大豆异黄酮通过抑制 Wnt/Ca2+信号通路减轻大鼠脑缺血再灌注引起的钙超载

摘要:目的 探讨大豆异黄酮(SI)减轻脑缺血再灌注(I/R)引起钙超载的作用机制。方法 将48 只SD大鼠采用随机数法分为4组:假手术组(Sham组)、脑缺血再灌注模型组(I/R组)、病毒空载组(NC 组)、Frizzled-2敲低组(Knock down组),12只/组。采用线栓法堵塞大脑中动脉2 h,再灌注24 h构建 I/R模型。采用Western blot验证病毒敲低效率并检测Wnt/Ca2+信号通路相关蛋白Wnt5a、Frizzled-2和P-CaMKⅡ的变化。采用钙含量显色法检测各组缺血半暗带(IP)区钙离子浓度变化,HE检测各组IP区组织结构变化。另将72只SD大鼠采用随机数法分为3组:Sham组、I/R组、大豆异黄酮预处理组(SI组),24只/组。采用多普勒血流仪检测局部脑血流变化,TTC染色检测脑梗死体积,HE和尼氏染色检测IP 区组织变化、免疫荧光检测ROS、Ca2+和细胞凋亡水平、流式检测细胞钙离子浓度,试剂盒检测血清MDA和SOD水平,Western blotting 和免疫组化检测IP区Wnt5a、Frizzled-2和P-CaMKⅡ蛋白表达。结果 与I/R 组比较,Knock down 组钙离子浓度(Plt;0.001)、Wnt5a(Plt;0.05)、Frizzled-2(Plt;0.05)和P-CaMKⅡ(Plt;0.001)表达水平均降低;与I/R组比较,SI 组钙离子浓度(Plt;0.05)、ROS 和MDA水平(Plt;0.001)、细胞凋亡程度(Plt;0.001)、脑梗死体积(Plt;0.001)、Wnt5a、Frizzled-2 和P-CaMKⅡ表达水平(Plt;0.05)均降低,SOD水平升高(Plt;0.001)。结论大豆异黄酮可能通过抑制Wnt/Ca2+信号通路减轻大鼠脑缺血再灌注引起的钙超载
关键词:大豆异黄酮;脑缺血再灌注;钙超载;Wnt/Ca2+
脑卒中可分为出血性脑卒中和缺血性脑卒中,其中缺血性脑卒中约占所有病例的80%[1]。血流阻塞或血供不足是缺血性脑卒中的根本原因,缺血性脑卒中导致大脑供氧和葡萄糖减少,进而引发兴奋毒性、炎症反应、氧化应激等一系列病理事件,最终导致不可逆的神经元损伤[2, 3]。脑卒中后脑血流的恢复可以挽救缺血神经元损伤,但也可引起脑缺血再灌注损伤(CIRI)[1, 4]。CIRI的形成机制复杂,钙超载是导致 CIRI 后神经元持续损伤的一个关键机制[5]。有研究认为在脑缺血的前期,短暂的葡萄糖和氧剥夺会触发对N-甲基-D-天冬氨酸受体的持续刺激,导致相关Ca2+通道的激活和Ca2+ 内流进入细胞,进而导致神经元损伤甚至死亡[6]。也有研究认为ROS会影响Ca2+进入细胞内和Ca2+的储存[7, 8]。但目前对于脑缺血再灌注过程中钙超载具体机制仍不明确。Wnt/Ca2+信号通路目前被认为在细胞内钙代谢中起关键作用[9],但其是否参与缺血再灌注钙超载尚未见报道。深入研究脑缺血再灌注引起的钙超载与Wnt/Ca2+通路的关系,对于研究CIRI的具体机制及寻求治疗的新靶点具有重要意义。
大豆异黄酮(SI)是从大豆中提取的一种带芳香A-环的三苯基异黄酮类化合物,在抗癌、防骨质疏松、防治心血管疾病等多方面都有其独特功效[10, 11]。既往研究表明SI可以通过调节钙离子和钙调素依赖性蛋白激酶Ⅱ(CaMKⅡ)减轻CIRI[12-14],CaMKⅡ活性检测可以作为Wnt/Ca2+信号通路的标志物[15]。SI 能否通过调控Wnt/Ca2+信号通路改善脑缺血再灌注导致的钙超载损伤尚未见报道。
本研究通过SI 预处理,采用线栓法构建大脑中动脉缺血再灌注模型,探讨SI 对脑缺血再灌注大鼠缺血半暗带内钙水平的影响及其可能的作用机制,为治疗CIRI提供新的策略。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
SPF级成年雄性SD大鼠(250~280 g),购自济南朋悦实验动物繁育有限公司,均在适当的密度下饲养,环境、温度、湿度适宜,光照/黑暗周期为12 h/12 h,自由饮水和进食。所有动物实验均经蚌埠医科大学动物研究伦理委员会批准(伦理编号:2021-206)。
1.1.2 主要试剂和仪器
腺相关病毒(上海汉恒生物有限公司); SI(Acmec,纯度40%,S64650);栓线(北京西浓科技公司);2,3,5- 三苯基氯化四氮唑(TTC,Solarbio);蛋白裂解液、BCA蛋白浓度测定试剂盒(碧云天);Wnt5a、β-actin 抗体(abcolne);P-CaMK Ⅱ、CaMKⅡ抗体(Abcam);Frizzled-2 抗体和山羊抗兔二抗(Affinity);HE染料(Biosharp);尼氏染料(源叶);钙含量显色试剂盒、超氧化物阴离子荧光检测探针DHE、钙离子试剂盒和一步TUNEL 染色试剂盒(碧云天);MDA 和SOD 试剂盒(南京建成有限公司);电泳仪(Servicebio);激光多普勒血流仪(Perimed);高端倒置荧光显微镜(Obsever); 流式细胞仪(贝克曼)。
1.2 方法
1.2.1 动物分组及给药
采用随机数法将48只SPF级雄性SD大鼠(250g~280 g)随机分为4组:假手术组(Sham组)、脑缺血再灌注模型组(I/R 组)、病毒空载组(NC组)、Frizzled-2敲低组(Knock down组),12只/组。其中NC组和Knock down组对大鼠进行侧脑室注射腺相关病毒,NC组为Knock down组的阴性对照组,注射21 d后再构建脑缺血再灌注模型。再采用随机数法将另外72 只SPF级雄性SD大鼠(250g~280 g)随机分为3 组:假手术组(Sham组)、脑缺血再灌注模型组(I/R组)、SI预处理组(SI组),24只/组。SI组给予SI(120 mg/kg)[13]灌胃21 d后构建脑缺血再灌注模型,Sham组和I/R组给予等体积生理盐水灌胃,I/R组21 d后构建脑缺血再灌注模型,Sham 组不插栓线其他步骤同I/R组。
1.2.2 脑缺血再灌注模型的建立
手术前将大鼠麻醉(1%戊巴比妥钠,腹腔注射,40 mg/kg)俯卧位置于手术平板上。剃除头部的毛发并用酒精消毒,剪开额顶部的皮肤并剔除皮下组织和骨膜,暴露中线、冠状缝和右顶骨,使用牙科钻在颅骨顶骨上横窦上方、上矢状窦外侧、冠状缝下方形成一骨窗[16],穿透颅骨至硬脑膜,将多普勒激光探头固定于此,实时检测局部脑血流(rCBF)变化。
采用改良的Longa's法建立大脑中动脉缺血再灌注模型[17]。沿颈部正中线切开,仔细剥离右侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA),结扎ECA和CCA 近心端,动脉夹短暂夹闭CCA,在动脉夹与CCA结扎处中间打一活结。于CCA结扎处远心端剪一斜口,将栓线经此斜口轻轻向前推进,拉紧活结固定住栓线,松开动脉夹从CCA经ICA入颅至大脑前动脉,阻断大脑中动脉形成缺血。缺血2 h后,拔出栓线以恢复脑血流灌流24 h,模拟急性脑缺血再灌注模型。
1.2.3 侧脑室注射敲低Frizzled-2 的腺相关病毒
采用1%戊巴比妥钠(40 mg/kg)对大鼠进行腹腔注射,根据大鼠脑立体定位图谱[18]中列出的坐标定位侧脑室(前囟后1 mm,正中线右侧1.5 mm,深度4 mm),并用牙科钻在此位置上钻1个直径2 mm的小孔,暴露硬脑膜。使用吸取5 μL腺相关病毒溶液的微量注射器缓慢(1 μL/min)注射到侧脑室。注射结束后静置5 min再取下针头,棉签按压以防出血,最后进行头皮缝合。
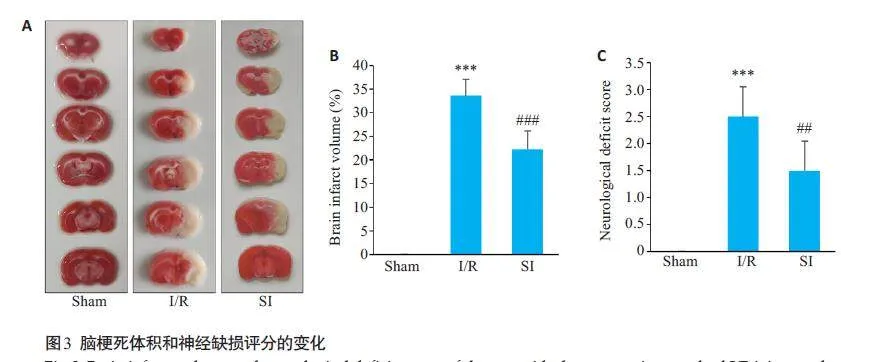
1.2.4 脑梗死体积检测和行为学评分
大鼠麻醉后立即处死,断头取脑,用预冷的PBS清洗后置于-80 ℃冰箱速冻1 h,取出后在冰上切成6片2 mm厚的冠状脑切片。将脑片置于2% TTC染液中37 ℃水浴孵育10 min,再将脑片翻面继续孵育10 min,随后置于4%多聚甲醛中固定,隔日拍照并利用Image J 进行脑梗死面积的分析。红色区域为未梗死区,白色区域为梗死区。脑梗死体积比=各脑切片梗死面积和/各脑切片面积和×100%。
再灌注24 h后,参照Longa's评价指标进行神经学评分[17]。无神经功能缺陷:0 分;对侧上肢不能完全伸展:1分;行走时向对侧转圈:2分;行走时向对侧倾倒:3分;不能自动行走,存在意识丧失现象:4分。选择评分在1~3的进行后续实验,并在各组大鼠中随机选择6只,进行统计学分析。
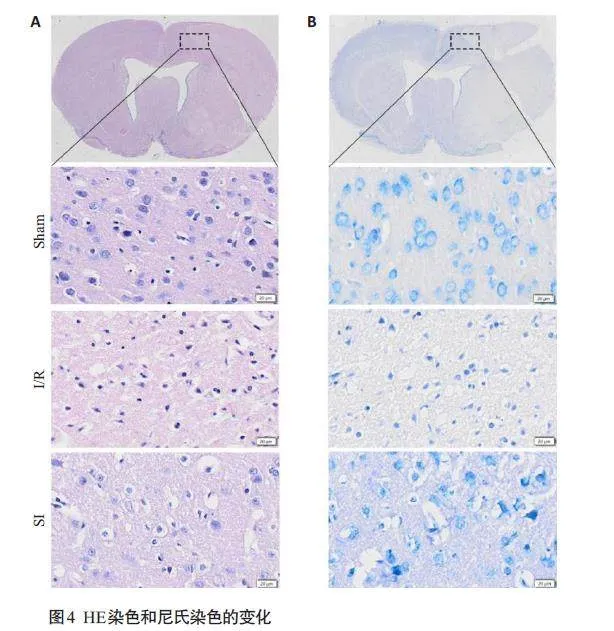
1.2.5 脑组织HE染色和尼氏染色
再灌注24 h后麻醉大鼠,先用0.9%生理盐水进行心脏灌注,再用4%多聚甲醛缓慢灌注直至肺变白,最后取脑置于4%多聚甲醛中4 ℃冰箱存放。隔日进行梯度酒精脱水、浸蜡、包埋和切片,分别进行HE和尼氏染色。
1.2.6 脑组织ROS、Ca2+免疫荧光染色
再灌注24 h 后麻醉大鼠,立即取脑置于-80 ℃速冻后直接包埋制成冰冻切片。用预冷的PBS清洗切片3遍于室温稍晾干,再用组化笔围组织画圈,后分别滴加DHE探针和Fluo-4探针,37 ℃水浴孵育30 min,随后用PBS清洗3遍,再用DAPI 染液室温孵育5 min,PBS清洗5 遍,滴加抗荧光淬灭剂封片,置于荧光显微镜采集图像并利用 Image J进行分析。
1.2.7 脑组织TUNEL免疫荧光染色
再灌注24 h后麻醉大鼠,进行心脏灌注后取脑置于4%多聚甲醛中固定24 h,后置于20%~30%蔗糖中脱水,OCT包埋制备冰冻切片。根据TUNEL染色试剂盒说明书染色,PBS洗3 遍后用DAPI 染色液染色,再用PBS清洗3 遍后封片。采用荧光显微镜观察TUNEL阳性细胞,Image J计数TUNEL阳性细胞数,随机选取3张图片计算细胞凋亡率。TUNEL细胞阳性率(%)=TUNEL细胞阳性数/DAPI细胞数×100%。
1.2.8 流式细胞术检测钙离子浓度
再灌注24 h后取各组大鼠缺血半暗带区域脑皮质组织并制备成单细胞悬液,用Fluo-4探针37 ℃孵育30 min,PBS清洗2遍,后用缓冲液重悬上机检测。
1.2.9 分光光度法检测血清中MDA和SOD水平
再灌注24 h后麻醉大鼠,开腹腔通过腹主动脉采血离心收集血清,按试剂盒说明书加入待测样品和相应试剂后置于酶标仪中检测各组吸光度值,带入相应公式计算各项指标含量。
1.2.10 Western blot 和免疫组织化学检测Wnt5a、Frizzled-2 和P-CaMKⅡ的表达水平
再灌注24 h 后取脑组织缺血半暗带区域匀浆并裂解,取蛋白上清BCA测定蛋白浓度、变性、上样(30 μg)、电泳、转膜、5%脱脂牛奶或5%BSA 封闭2 h,Wnt5a(1∶1000)、Frizzled-2(1∶1000)、P-CaMKⅡ(1∶4000)和CaMKⅡ(1∶25 000)抗体,4 ℃摇床孵育过夜;TBST洗膜,山羊抗兔二抗室温孵育2 h;TBST洗膜,滴加曝光液显影并拍照。取各组脑组织石蜡切片脱蜡至水、抗原修复、血清封闭,一抗4 ℃过夜、二抗避光孵育15 min;用DAB液显色后行细胞核复染、脱水封片置于显微镜下观察。
1.2.11 钙含量显色法测定脑组织钙离子浓度
再灌注24 h将大鼠处死后取脑组织,将IP区脑组织剪切成细小的碎片,按试剂盒说明书加入待测样品和相应试剂后置于酶标仪中检测各组吸光度值,带入相应公式计算各项指标含量。
1.3 统计学分析
采用GraphPad Prism 8 软件对实验结果进行数据分析,所有计量资料以均数±标准差表示,采用单因素方差分析比较多组间差异,采用T多重比较法比较两组间差异。以Plt;0.05为差异有统计学意义。
2 结果
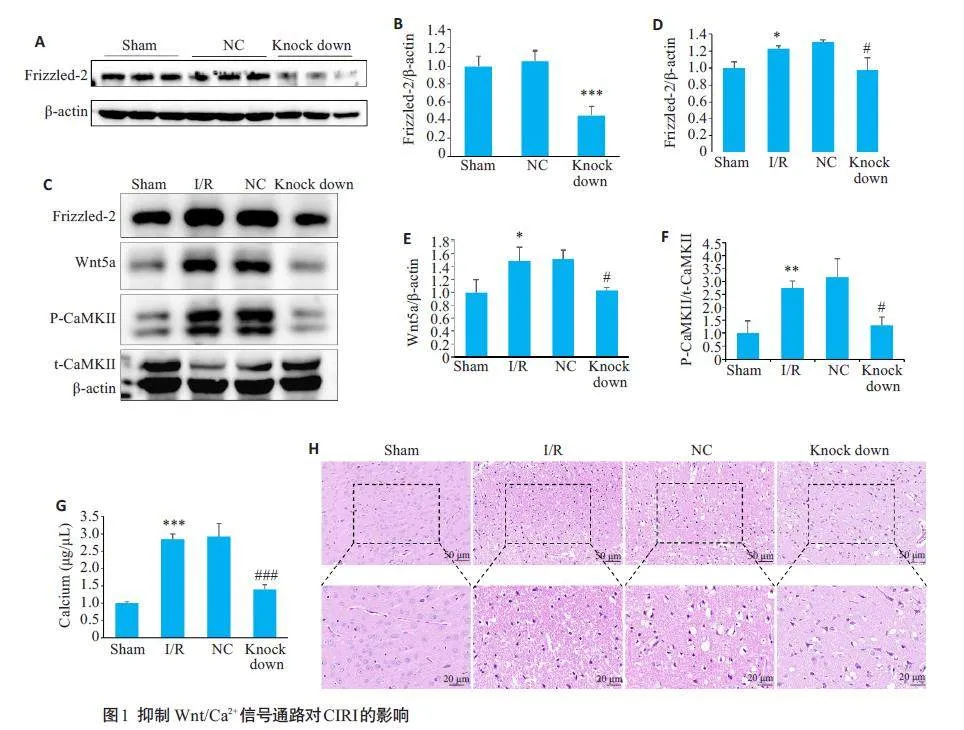
2.1 Wnt/Ca2+ 信号通路介导脑缺血再灌注引起的钙超载
Western blotting 检测Frizzled-2 敲低效果和Wnt/Ca2+信号通路相关蛋白的表达结果显示,与Sham组相比,NC组的差异无统计学意义(Pgt;0.05),Knock down组Frizzled-2蛋白表达降低约50%(Plt;0.001,图1A、B);I/R组Wnt5a、P-CaMKⅡ和Frizzled-2的表达增高。与I/R 组相比,Knock down 组Wnt5a、P-CaMK Ⅱ 和Frizzled-2 的表达均降低(图1C~F)。钙含量显色法检测各组脑组织钙离子浓度的结果显示,与 Sham 组相比,I/R组钙离子浓度明显增高;与 I/R 组相比,NC 组的差异无统计学意义(Pgt;0.05),Knock down 组钙离子浓度降低(图1G)。HE结果显示,与Sham组相比,I/R组组织结构分布紊乱,可见大量空泡,染色不均,胞核深染。与I/R组相比,NC 组无明显变化,Knock down组病理损伤可见明显改善(图1H)。
2.2 脑缺血再灌注模型建立过程中局部脑血流的变化
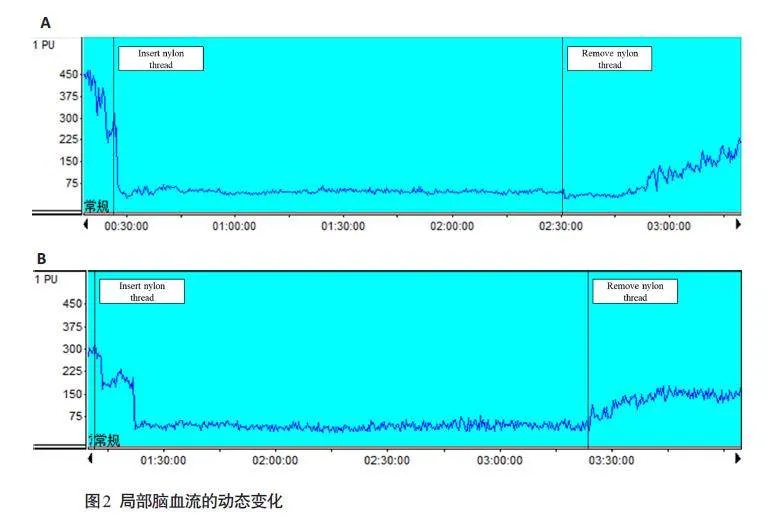
I/R组(图2A)和SI组(图2B)大鼠局部脑血流检测结果显示,插线后两组rCBF均迅速降至初始值的10%~20%,2 h 后拔出栓线血流恢复至初始值的50%~60%。在缺血的2 h内血流保持相对稳定的状态,但 I/R 组血流恢复速度慢于SI组。
2.3 SI对脑缺血再灌注大鼠脑梗死面积和神经缺损评分的影响
采用TTC 染色检测大鼠脑梗死体积,结果显示Sham组未见明显梗死区域,I/R组出现明显的梗死区(Plt;0.001),而SI组梗死体积较I/R组明显减小(Plt;0.001,图3A、B)。Sham组未出现神经功能障碍症状,神经功能评分为0。而I/R组大鼠神经功能缺失评分明显高于Sham 组(Plt;0.001),SI组症状明显轻于I/R组(Plt;0.01,图3C)。
2.4 SI对脑缺血再灌注大鼠脑组织病理学形态
HE染色和尼氏染色结果显示,Sham组大鼠脑组织结构正常,细胞排列整齐,细胞轮廓清晰,未见坏死细胞,尼氏小体、细胞核及核仁清晰可见。I/R组大鼠脑组织排列不规则,染色不均匀,细胞间隙增大,细胞数量明显减少,尼氏小体缩小,分布紊乱,细胞核较小甚至消失。而SI组病理损伤有所改善(图4)。
2.5 SI对脑缺血再灌注大鼠脑组织胞内钙离子的影响
免疫荧光结果显示,与Sham组相比,I/R组钙离子荧光强度明显增强,SI组钙离子荧光强度介于Sham组和I/R组之间(Plt;0.001,图5A、B)。流式细胞术呈现相同趋势(Plt;0.05,图5C、D)。
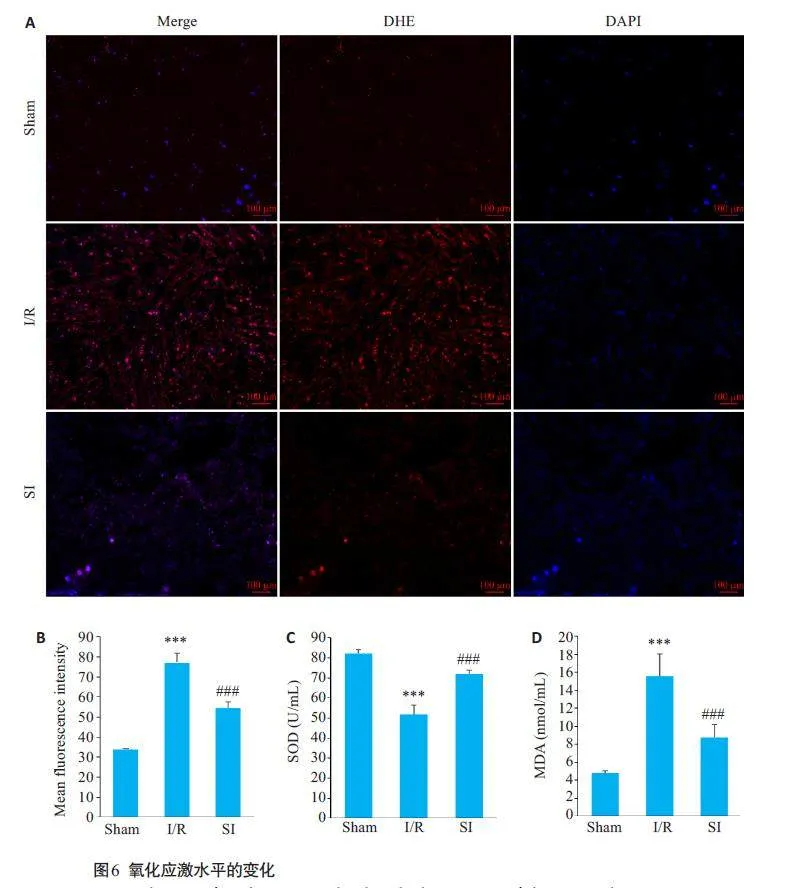
2.6 SI对脑缺血再灌注大鼠脑组织氧化应激的影响
与Sham组相比,I/R组ROS荧光强度、MDA水平增加,SOD水平下调(Plt;0.001)。与I/R组相比,SI组ROS荧光强度、MDA水平降低,SOD上调(Plt;0.001,图6)。
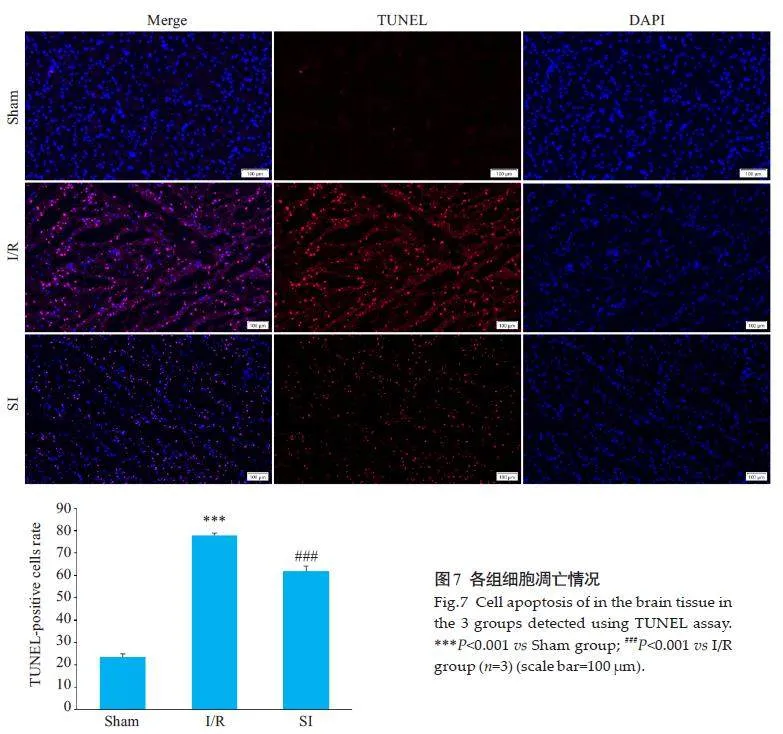
2.7 SI对细胞凋亡的影响
免疫荧光结果显示,与Sham组相比,I/R组凋亡细胞阳性率明显增高,与I/R组相比,SI组凋亡细胞阳性率降低(Plt;0.001,图7)。
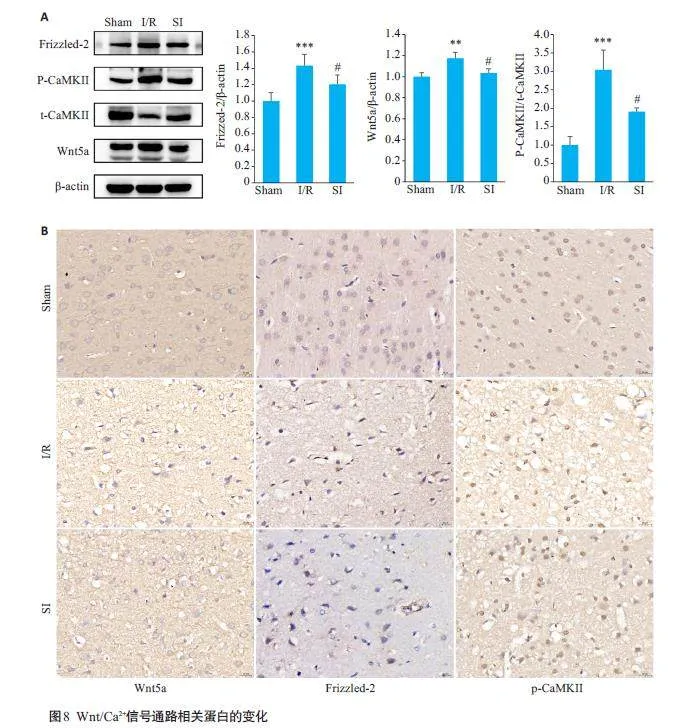
2.8 SI 对大鼠局灶性脑缺血再灌注后Wnt/Ca2+信号通路相关蛋白的影响
Western blotting结果显示,与Sham组相比,I/R组Wnt/Ca2+ 信号通路相关蛋白Wnt5a、Frizzled-2 和PCaMKⅡ表达明显升高(Plt;0.001);与I/R组相比,SI 组Wnt5a、Frizzled-2、P-CaMKⅡ蛋白的表达量均降低(Plt;0.05,图8A)。免疫组化结果也显示,与Sham组相比,I/R组Wnt5a、Frizzled-2 和P-CaMKⅡ蛋白表达水平明显升高;与I/R组相比,SI组Wnt5a、Frizzled-2和P-CaMKⅡ蛋白的表达量均降低(图8B)。
3 讨论
CIRI的病理生理机制复杂,尚未完全清晰,目前认为涉及以下多种可能的机制:氧化应激、炎症反应、线粒体损伤、细胞内钙超载及血脑屏障破坏等[19-23]。这些发病机制互为因果、共同作用,推动CIRI的发生发展。既往研究表明细胞内钙超载在CIRI的发生和发展中起关键作用[24, 25],也是多数情况下细胞死亡的最后共同通路[26],但目前对于探讨钙超载在脑缺血再灌注中的具体机制及通过改善钙超载来治疗CIRI的研究甚少。本研究首次证实了Wnt/Ca2+信号介导脑缺血再灌注钙超载损伤,并发现SI 可能通过减轻Wnt/Ca2+信号通路减轻CIRI。
SI主要分为游离型的苷元和结合型的糖苷两种形式,其中糖苷不具有活性,需要在肠道菌群的作用下转变为活性苷元发挥疗效[27, 28]。课题组前期研究发现,SI以120 mg·kg-1·d-1的剂量治疗脑缺血再灌注大鼠表现出较好的疗效[13]。因此,本研究沿用此剂量以灌胃的给药方式对大鼠进行术前干预,采用改良版线栓法大脑中动脉堵塞模型诱导大鼠CIRI模型,在模型构建过程中采用 LDF 实时监测大鼠rCBF的动态变化。LDF可以准确地体现脑内的微循环灌注情况[29],也可作为判断MCAO模型构建成功的依据[30]。本研究监测结果可见,I/R 组插线后rCBF骤降,拔线后rCBF恢复缓慢且恢复速度明显慢于SI组,提示MCAO模型构建成功且SI预处理可改善再灌注初期血流的低灌注情况。
SI 是大豆中的异黄酮类化合物的总称,因其抗氧化、抗炎作用目前多被用于抗癌研究[31-33]。研究表明,SI 在减轻CIRI 中也发挥一定的作用[34],但对于SI 在CIRI钙超载层面的研究较少。为探讨SI是否能够减轻脑缺血再灌注诱导的钙超载,本研究采用免疫荧光和流式细胞术检测细胞内钙离子的浓度,结果显示I/R组胞内钙离子浓度明显升高,SI 组钙离子降低,提示 SI 可改善脑缺血再灌注诱导的钙超载。
Wnt/Ca2+ 信号通路一种非典型 Wnt 通路,在早期胚胎发育、癌症进展、神经间通讯、炎症反应等过程中发挥着重要作用[35-38]。Wnt/Ca2+ 通路激活可诱使细胞内Ca2+ 浓度升高并可活化Ca2+ 敏感信号成分,在介导细胞Ca2+ 超载、氧化应激和凋亡等病理过程中扮演重要角色。既往研究探讨缺血再灌注损伤诱导的钙超载机制主要集中在再灌注后钠-钙交换体的功能失调、内源性儿茶酚胺的增多导致的钙通道开放增加和生物膜损伤通透性增加[19,39,40],而较少关注Wnt/Ca2+信号通路在细胞内钙代谢中起的作用。既往关于Wnt/Ca2+ 信号通路在缺血再灌注损伤的研究发现,大鼠心肌缺血再灌注损伤后心肌细胞中Wnt5a和Frizzled-2表达增加,细胞中的钙离子含量增多,抑制细胞中Frizzled-2表达后,缺血再灌注损伤后心肌细胞中钙离子含量显著下降[41];也有研究发现肝组织缺血再灌注损伤后Wnt5a和Frizzled-2表达上调,靶向抑制肝细胞Frizzled-2表达能减轻缺血再灌注诱导的细胞毒性、细胞凋亡和细胞内钙离子水平[42]。这提示我们在缺血再灌注损伤中,Wnt/Ca2+ 信号通路会被激活,而靶向抑制Frizzled-2可以减轻缺血再灌注损伤。另有学者发现脑创伤可通过 Wnt5a/Frizzled-2信号通路导致神经细胞内钙超载,靶向抑制Frizzled-2能抑制脑创伤诱导的神经细胞内钙离子浓度过度增加[43]。这提示脑组织也存在 Wnt/Ca2+ 通路,而靶向抑制 Frizzled-2 可以减轻神经细胞损伤。因此本研究为验证 Wnt/Ca2+ 信号通路在大鼠脑缺血再灌注后是否被激活,同样选择靶向抑制 Frizzled-2以达到抑制Wnt/Ca2+ 信号通路的作用。Wnt/Ca2+ 信号主要由Wnt5a 和 Frizzled-2 启动,且CaMKⅡ是Wnt/Ca2+信号通路的标志物[44],故本研究采用 Western blotting 检测Wnt5a、Frizzled-2和 P-CaMKⅡ的蛋白表达水平,结果显示成功敲低了Frizzled-2,且与 Sham 组相比,I/R组这些蛋白的表达均增高,说明在CIRI中 Wnt/Ca2+ 信号通路被上调,而敲低Frizzled-2后,这些蛋白的表达水平又有所降低,敲低Frizzled-2可以有效地抑制 Wnt/Ca2+信号通路。HE结果显示,与I/R组相比,Knock down 组的病理损伤明显减轻,再次说明了 Wnt/Ca2+ 信号通路确实参与脑缺血再灌注这一病理过程且抑制 Wnt/Ca2+信号通路可以减轻脑缺血再灌注病理损伤。采用钙含量显色法检测 IP 区钙离子浓度结果显示与 I/R 组相比,Knock down 组的钙离子浓度降低,表明Wnt/Ca2+信号通路介导脑缺血再灌注钙超载损伤。我们猜测SI改善脑缺血再灌注诱导的钙超载与调控Wnt/Ca2+ 信号通路有关。为验证该想法,本实验采用Western blotting检测了SI 组Wnt5a、Frizzled-2 和P-CaMKⅡ的蛋白表达水平,结果显示,与I/R组相比,SI组这些蛋白表达水平降低,说明SI 可以抑制Wnt/Ca2+信号通路,SI 可能通过抑制Wnt/Ca2+信号通路减轻脑缺血再灌注引起的钙超载。
胞内钙超载可引起自由基堆积、线粒体功能障碍及稳态失衡,激活神经元一氧化氮合酶以形成一氧化氮,激活磷脂酶和蛋白酶降解细胞脂质及相关结构蛋白,还可激活核酸酶引起DNA损伤[45],并导致羟基自由基等生成增加,进一步加重氧化应激,最终引起神经元凋亡或坏死[46]。超氧化物阴离子具有浓度水平极低、活性较高、寿命短、易转化等特点,且是机体最先产生的ROS,可直接反应脑组织氧化应激水平。MDA可间接反应氧化应激损伤程度,而SOD是机体抗氧化的关键酶。为探讨SI 是否能够影响机体的氧化应激水平,本研究采用免疫荧光和分光光度法分别检测脑组织中超氧化物阴离子和血清中MDA和SOD的含量,结果显示I/R组超氧化物阴离子和MDA水平明显升高,SI组相应指标均降低,SOD水平呈现相反趋势,提示SI可改善脑缺血再灌注诱导的氧化应激。进一步采用免疫荧光检测各组的细胞凋亡情况,结果显示SI组细胞凋亡数量较 I/R组明显减少,提示SI 可减少脑缺血再灌注诱导的细胞凋亡。以上结果表明,SI对脑缺血再灌注后细胞凋亡、氧化应激水平变化的影响趋势与钙离子水平变化一致。为探讨SI是否会减轻脑缺血再灌注后的梗死体积和病理损伤,本研究采用TTC、HE和Nissl染色分别检测各组的脑梗死体积和病理损伤程度,结果也显示 SI 可减少脑缺血再灌注导致的脑梗死体积和病理损伤程度,提示 SI 可减轻CIRI。然而,本研究的结果大部分都局限于表型实验,后续仍需进一步探讨 SI 抑制 Wnt/Ca2+ 信号通路减轻CIRI的具体分子机制。
综上所述,脑缺血再灌注会激活 Wnt/Ca2+ 信号通路并介导缺血再灌注后的钙超载,SI 可能通过抑制Wnt/Ca2+ 信号通路减轻脑缺血再灌注诱导的钙超载减轻CIRI。
参考文献:
[1] Zhang XX, Wang XB, Xue ZW, et al. Prevention properties oncerebral ischemia reperfusion of medicine food homologousDioscorea yam-derived diosgenin based on mediation of potentialtargets[J]. Food Chem, 2021, 345: 128672.
[2] Poh L, Kang SW, Baik SH, et al. Evidence that NLRC4inflammasome mediates apoptotic and pyroptotic microglial deathfollowing ischemic stroke[J]. Brain Behav Immun, 2019, 75: 34-47.
[3] Lou Z, Wang AP, Duan XM, et al. Upregulation of NOX2 and NOX4mediated by TGF‑β signaling pathway exacerbates cerebralischemia/reperfusion oxidative stress injury[J]. Cell PhysiolBiochem, 2018, 46(5): 2103-13.
[4] Stegner D, Klaus V, Nieswandt B. Platelets as modulators of cerebralischemia/reperfusion injury[J]. Front Immunol, 2019, 10: 2505.[5] Lipton P. Ischemic cell death in brain neurons[J]. Physiol Rev,1999, 79(4): 1431-568.
[6] Martin HGS, Wang YT. Blocking the deadly effects of the NMDAreceptor in stroke[J]. Cell, 2010, 140(2): 174-6.
[7] Han YL, Li XW, Yang L, et al. Ginsenoside Rg1 attenuates cerebralischemia-reperfusion injury due to inhibition of NOX2-mediatedcalcium homeostasis dysregulation in mice[J]. J Ginseng Res, 2022,46(4): 515-25.
[8] Xu ZX, Xu BY, Xia T, et al. Relationship between intracellular Ca²⁺and ROS during fluoride-induced injury in SH-SY5Y cells[J].Environ Toxicol, 2013, 28(6): 307-12.
[9] Mäkitie RE, Haanpää M, Valta H, et al. Skeletal characteristics ofWNT1 osteoporosis in children and young adults[J]. J Bone MinerRes, 2016, 31(9): 1734-42.
[10]Li N, Wu XT, Zhuang W, et al. Soy and isoflavone consumption andmultiple health outcomes: umbrella review of systematic reviewsand meta-analyses of observational studies and randomized trials inhumans[J]. Mol Nutr Food Res, 2020, 64(4): e1900751.
[11]Applegate CC, Rowles JL, Ranard KM, et al. Soy consumption andthe risk of prostate cancer: an updated systematic review and metaanalysis[J]. Nutrients, 2018, 10(1): 40.
[12]赵士弟, 陈 耀, 姜丽娜, 等. 大豆异黄酮对脑缺血/再灌注诱导的线粒体损伤和脑细胞凋亡的影响[J]. 中国病理生理杂志, 2014, 30(12):2172-8.
[13]赵士弟, 陈 耀, 董银凤, 等. 大豆异黄酮对全脑缺血/再灌注大鼠海马神经细胞凋亡的影响[J]. 上海交通大学学报: 医学版, 2015, 35(4):521-9.
[14]李 晒, 李 丽, 闵思敏, 等. 大豆异黄酮可减轻大鼠脑缺血/再灌注损伤: 基于抑制铁死亡及炎症级联反应[J]. 南方医科大学学报, 2023,43(2): 323-31.
[15]Kühl M, Sheldahl LC, Malbon CC, et al. Ca(2+ )/calmodulindependentprotein kinase II is stimulated by Wnt and Frizzledhomologs and promotes ventral cell fates in Xenopus[J]. J BiolChem, 2000, 275(17): 12701-11.
[16]Brossia-Root LJ, Cotroneo TM, Hish G. Anesthesia and Analgesiafor Research Animals[M]. Cham: Springer International Publishing,2019: 13-34.
[17]Longa EZ, Weinstein PR, Carlson S, et al. Reversible middlecerebral artery occlusion without craniectomy in rats[J]. Stroke,1989, 20(1): 84-91.
[18]Paxinos G.《大鼠脑立体定位图谱》[M]. 北京: 人民卫生出版社,2005.
[19]Kristián T, Siesjö BK. Calcium in ischemic cell death[J]. Stroke,1998, 29(3): 705-18.
[20]Al-Mufti F, Amuluru K, Roth W, et al. Cerebral ischemic reperfusioninjury following recanalization of large vessel occlusions[J].Neurosurgery, 2018, 82(6): 781-9.
[21]Soares ROS, Losada DM, Jordani MC, et al. Ischemia/reperfusioninjury revisited: an overview of the latest pharmacological strategies[J]. Int J Mol Sci, 2019, 20(20): 5034.
[22]Mao R, Zong NN, Hu YJ, et al. Neuronal death mechanisms andtherapeutic strategy in ischemic stroke[J]. Neurosci Bull, 2022, 38(10): 1229-47.
[23]Manzanero S, Santro T, Arumugam TV. Neuronal oxidative stress inacute ischemic stroke: sources and contribution to cell injury[J].Neurochem Int, 2013, 62(5): 712-8.
[24]Wang YL, Tian YX, Zhao JX, et al. Effect of electroacupuncture ongene expression in calcium signaling pathway in hippocampal cellsin mice with cerebral ischemia reperfusion[J]. J Tradit Chin Med,2017, 37(2): 252-60.
[25]Hu Y, Deng H, Xu SX, et al. MicroRNAs regulate mitochondrialfunction in cerebral ischemia-reperfusion injury[J]. Int J Mol Sci,2015, 16(10): 24895-917.
[26]Schanne FA, ane AB, Young EE, et al. Calcium dependence oftoxic cell death: a final common pathway[J]. Science, 1979, 206(4419): 700-2.
[27]Uddin MS, Kabir MT. Emerging signal regulating potential ofgenistein against Alzheimer's disease: a promising molecule ofinterest[J]. Front Cell Dev Biol, 2019, 7: 197.
[28]Chen LR, Chen KH. Utilization of isoflavones in soybeans forwomen with menopausal syndrome: an overview[J]. Int J Mol Sci,2021, 22(6): 3212.
[29]Basak K, Manjunatha M, Dutta PK. Review of laser speckle-basedanalysis in medical imaging[J]. Med Biol Eng Comput, 2012, 50(6): 547-58.
[30]刘 宇, 孟 然, 闫 峰, 等. 激光多普勒血流仪评价活体大鼠大脑中动脉栓塞模型成功的可行性分析[J]. 中国病理生理杂志, 2011, 27(3):620-4.
[31]Shin S, Fu JL, Shin WK, et al. Association of food groups anddietary pattern with breast cancer risk: a systematic review and metaanalysis[J]. Clin Nutr, 2023, 42(3): 282-97.
[32] Uifălean A, Schneider S, Ionescu C, et al. Soy isoflavones and breastcancer cell lines: molecular mechanisms and future perspectives[J].Molecules, 2015, 21(1): E13.
[33]Sahin I, Bilir B, Ali S, et al. Soy isoflavones in integrative oncology:increased efficacy and decreased toxicity of cancer therapy[J].Integr Cancer Ther, 2019, 18: 1534735419835310.
[34]Castelló -Ruiz M, Torregrosa G, Burguete MC, et al. Soy-derivedphytoestrogens as preventive and acute neuroprotectors inexperimental ischemic stroke: influence of rat strain[J].Phytomedicine, 2011, 18(6): 513-5.
[35]Zins K, Schäfer R, Paulus P, et al. Frizzled2 signaling regulatesgrowth of high-risk neuroblastomas by interfering with β‑catenindependentand β‑catenin-independent signaling pathways[J].Oncotarget, 2016, 7(29): 46187-202.
[36]Zhao CH, Bu XM, Wang W, et al. GEC-derived SFRP5 inhibitsWnt5a-induced macrophage chemotaxis and activation[J]. PLoSOne, 2014, 9(1): e85058.
[37]Maeda K, Takahashi N, Kobayashi Y. Roles of Wnt signals in boneresorption during physiological and pathological states[J]. J MolMed, 2013, 91(1): 15-23.
[38]刘 丽, 龙鼎新. Wnt 信号通路在神经系统发育中的作用研究进展[J]. 中南医学科学杂志, 2017, 45(3): 303-6.
[39]Wang RY, Wang M, He SB, et al. Targeting calcium homeostasis inmyocardial ischemia/reperfusion injury: an overview of regulatorymechanisms and therapeutic reagents[J]. Front Pharmacol, 2020,11: 872.
[40]Pittas K, Vrachatis DA, Angelidis C, et al. The role of calciumhandling mechanisms in reperfusion injury[J]. Curr Pharm Des,2018, 24(34): 4077-89.
[41]Zhou SS, He F, Chen AH, et al. Suppression of rat Frizzled-2attenuates hypoxia/reoxygenation-induced Ca2+ accumulation in ratH9c2 cells[J]. Exp Cell Res, 2012, 318(13): 1480-91.
[42]Hu X, Zhou CJ, He GL, et al. Inhibition of Frizzled-2 by smallinterfering RNA protects rat hepatic BRL-3A cells againstcytotoxicity and apoptosis induced by Hypoxia/Reoxygenation[J].Gastroenterol Hepatol, 2020, 43(3): 107-16.
[43]Niu LJ, Xu RX, Zhang P, et al. Suppression of Frizzled-2-mediatedWnt/Ca² ⁺ signaling significantly attenuates intracellular calciumaccumulation in vitro and in a rat model of traumatic brain injury[J].Neuroscience, 2012, 213: 19-28.
[44]Xu XF, Zhang MF, Xu FY, et al. Wnt signaling in breast cancer:biological mechanisms, challenges and opportunities[J]. MolCancer, 2020, 19(1): 165.
[45]Wu QJ, Tymianski M. Targeting NMDA receptors in stroke: newhope in neuroprotection[J]. Mol Brain, 2018, 11(1): 15.
[46]Lai TW, Zhang S, Wang YT. Excitotoxicity and stroke: identifyingnovel targets for neuroprotection[J]. Prog Neurobiol, 2014, 115:157-88.
(编辑:郎 朗)
基金项目:安徽省教育厅自然科学重大研究项目(KJ2021ZD0091);安徽省大学生创新项目(S202210367110);蚌埠医科大学“512 人才培育计划”(by51202204);安徽省大学生创新项目(S202310367066)

