地五养肝方对非酒精性脂肪肝小鼠循环外泌体溶血甘油磷脂的调控作用
摘要:目的 研究地五养肝方对非酒精性脂肪肝(NAFLD)小鼠循环外泌体溶血甘油磷脂(Lyso-GPLs)的调控作用。方法 采用尺寸排阻色谱法分离血液中循环外泌体,运用透射电镜观察外泌体的外观、粒径仪检测外泌体直径分布、Western blotting法检测外泌体表面特异性蛋白CD9,CD63及TSG101的表达;将24只雄性KM小鼠随机分为正常组、模型组和复方给药组,8只/组,正常组给予标准饲料,模型组和复方给药组饲喂高脂饲料,喂养1周后,各给药组小鼠按剂量给予地五养肝胶囊内容物,正常组和模型组给予等量生理盐水,灌胃给药4周。末次给药后,各小鼠麻醉后取血分离血清,检测总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST),观察其对NAFLD的改善作用并提取血清中循环外泌体;同时,结合多元统计分析,筛选NAFLD小鼠循环外泌体中Lyso-GPLs类成分生物标志物,观察地五养肝方对标志物的调控作用。结果 透射电镜结果显示外泌体大小在100 nm左右,形状为典型的具有清晰双层膜的茶托样结构;粒径结果显示循环外泌体粒径分布均匀,平均粒径为137.5 nm;Western blotting检测结果表明外泌体表面特异性蛋白CD9, CD63及TSG101 的存在;模型组小鼠血清中TC、HDL-C、LDL-C和AST水平显著高于正常组(Plt;0.01),经地五养肝方治疗后,TC、LDL-C、AST、ALT水平显著回调(Plt;0.01),并筛选出43个经地五养肝方治疗后呈现显著回调趋势(Plt;0.01)的Lyso-GPLs标志物成分。结论 地五养肝方防治NAFLD的作用机制涉及对循坏外泌体溶血甘油磷脂的改善和调控作用,为其防治慢性肝病的作用机制研究提供了新的科学视角。
关键词:地五养肝方;循环外泌体;液质联用;溶血甘油磷脂;非酒精性脂肪肝
湖北省中医院李瀚旻教授在中医经典理论“肝肾同源”基础上创新提出“补肾生髓成肝”理论,认为通过补肾可以促进生精髓、骨髓和脑髓进而调控转化生成肝,并将其理论应用到地五养肝方中。地五养方临床上主要用于慢性肝炎患者,具有抗炎保肝、解毒通络、清热利湿、补肾养肝以及调控肝再生的功效[1]。现代药理学实验表明,地五养肝方对HBeAg阴性慢性乙型肝炎、肝纤维化和肝癌等肝病均有较好的治疗作用[1,2]。目前对于地五养肝方的研究多集中于临床应用,因此,应用现代医学理论和技术去扩展与创新“肝肾同源”这一传统的中医理论,从而更好指导临床诊疗具有重要意义。
外泌体是生物体内最小的细胞外囊泡,直径30~150 nm,其内包含大量蛋白质、脂质和miRNA等来源于母体细胞的遗传信息[3,4]。在正常或病理条件下,大部分细胞均能产生外泌体[5],且广泛存在于血液、尿液等体液中[6]。循环外泌体作为各类疾病生物标志物的筛选载体,一直是外泌体研究领域的热点[7]。虽然外泌体能够实时动态反映其来源母细胞的生理病理状态,但在复杂的循环血液中,众多不同组织和细胞分泌的外泌体经各种途径进入血液循环,现今的外泌体纯化技术仍不足以支持循环血液中不同来源外泌体的分离制备。因此,从循环外泌体中筛选出能与非酒精性脂肪肝(NAFLD)疾病发生发展的标志物极其重要。
近年来,众多肝细胞损伤相关疾病研究中,基于外泌体生物标志物的研究已经取得了一定的成果和进展[8]。但外泌体标志物的研究不应仅仅局限于RNA和蛋白质,脂质标志物的筛选同样具有潜力[9]。小分子脂质作为外泌体重要组成部分,在其合成、释放至与受体细胞相结合等进程中具有重要的生物活性[10]。溶血甘油磷脂(Lyso-GPLs)作为脂质的一种,在生物体内发挥着重要的作用,作为重要作用的信号分子参与多种疾病的发展过程,如炎症、高脂血症和动脉粥样硬化等[11]。然而目前在NAFLD研究领域,循环外泌体中Lyso-GPLs生物标志物的研究仍相对较少。
因此,本文基于地五养肝方对NAFLD小鼠的治疗作用,研究地五养肝方对NAFLD小鼠血液循环外泌体中Lyso-GPLs 类成分的调控作用,从循环外泌体中Lyso-GPLs分子的分布和含量角度切入,初步阐明地五养肝方防治NAFLD的作用机制,对系统探索循环外泌体中早期预警NAFLD的生物标志物的研究具有重要意义,为进一步诠释“补肾生髓成肝”中医治则治法的科学内涵提供新的科学视角。
1 材料和方法
1.1 主要实验仪器
qEVsingle色谱柱(Izon Science)、AT-201电子分析天平(d=0.01 mg, Mettler-Toledo)、RWD410 多通道微量注射泵(深圳瑞沃德生命科技有限公司)、电泳仪电源(北京六一仪器厂)、酶标仪(Thermo)、纳米粒度仪(Nano ZS90, Malvern)、透射电子显微镜(JEM-1400,Jeol)、Waters Xevo G2-XS QTOF 飞行时间质谱仪、ACQUITY UPLC M-Class 液相色谱系统;WatersACQUITY REH C18色谱柱(1.7 μm, 2.1×100 mm)、恒温加样台(武汉莫纳生物科技有限公司)。
1.2 实验动物与试剂
24只正常6周龄雄性KM小鼠(20~25 g)武汉生物制品研究所有限责任公司[许可证:SCXK(鄂)2017-001]、磷钨酸(上海源叶生物科技有限公司)、PBS缓冲液(北京索莱宝科技有限公司)、BCA 蛋白浓度测定试剂盒(上海碧云天生物技术有限公司)、蛋白marker(20 000~120 000)(GenScript)、蛋白marker(10 000~250 000)(北京海利克思科技有限公司)、多抗CD63(47 000, 稀释比例1∶1000,Affinity)、多抗CD9(25 000,稀释比例1∶1000,Affinity)、多抗TSG101(44 000, 稀释比例1∶1500, Affinity)、ECL底物液(北京普利莱基因技术有限公司)、显影定影试剂盒(天津市汉中摄影材料厂)、乙腈(HPLC级,Fisher Scientific)、甲醇(HPLC级,FisherScientific)、甲酸(HPLC级,Sigma)。
1.3 血液循环外泌体的分离与鉴定
取正常小鼠血清150 μL加入至经室温无菌PBS溶液平衡30 min 后的qEVsingle 色谱柱中,以室温无菌PBS溶液洗脱,计算色谱柱下方液滴数目,前19滴为色谱柱死体积部位,第20~30滴流出液为外泌体部位,用1.5 mL EP管收集外泌体样品冻存备用。取上述外泌体样品,纳米颗粒跟踪分析法测量外泌体混悬液的大小分布;透射电镜观察外泌体形态;Western blotting 法检测特异性外泌体表面标志物CD63、CD9和TSG101表达情况。
1.4 循环外泌体中Lyso-GPL分析方法的构建
1.4.1 样品制备
取100 μL外泌体溶液于EP管中,加入500 μL乙腈,涡旋2 min;冰浴超声15 min;12 000 r/min离心15 min;移取500 μL上清液置于EP管中;氮吹仪浓缩;100 μL 90%甲醇复溶,涡旋,冰浴超声15 min,12 000 r/min离心15 min,取上清液用于液质联用分析。
1.4.2 UPLC-MS/MS检测条件
色谱条件:柱温40 ℃;流动相A:10 mmol/L甲酸铵水溶液,含0.1%甲酸;流动相B:乙腈;梯度洗脱程序:0 min,10% B;7 min,55% B;26 min,55% B;35 min,75% B;46 min,95% B;54 min,95% B;55 min,10% B;60 min,10% B;流速0.3 mL/min;进样量2 μL。
质谱条件:ESI离子源,MSE模式采集数据;质量范围:m/z 50~1500 Da;锥孔电压60 V;负离子模式电喷雾电压-4500 V,正离子模式电喷雾电压5500 V;ESI离子源温度:100 ℃;去溶剂化温度:500 ℃;气帘气流速为50 L/h;脱溶剂气(N2)流速为600 L/h;一级碰撞能量:10 eV,二级碰撞能量:35 eV;碰撞能量波动±10 eV,以脑啡肽(m/z 556.2771)调谐液作为实时校正溶液;Lyso-PC、Lyso-PE、Lyso-PS 在正离子模式下分析,Lyso-PA、Lyso-PI、Lyso-PG在负离子模式下分析。
1.5 地五养肝方对NAFLD小鼠循环外泌体Lyso-GPL的调控作用
小鼠放置于恒温恒湿动物房中,以12 h:12 h 的昼夜周期圈养在隔离笼中。适应性饲养3 d后,将所有小鼠随机分为正常组、模型组和复方给药组共3 组,8 只/组。正常组给予标准饲料,模型组和复方给药组饲喂高脂饲料。本研究项目由湖北中医药大学实验动物伦理委员会批准(审批号:202203004)。
根据参照文献[12]计算本实验小鼠给药剂量:设置地五养肝方给药剂量为150 mg/(kg·d)(以地五养肝胶囊内容物计算)。高脂饲料(含78.8%基础饲料(江苏美迪森生物医药有限公司)、10%蛋黄粉、10%猪油、1%胆固醇及0.2%猪胆盐[13])造模喂养1周后,经灌胃给药,其中正常组和模型组小鼠给予0.4 mL生理盐水,复方给药组给予地五养肝胶囊内容物水溶液。连续给药28 d,实验期间,3 d/次称取各组小鼠体质量,观察并记录各组小鼠饮食量,饮水量及健康状况。最后1 次给药后,于2 h内麻醉处死所有小鼠,经眼球取血置于不含抗凝剂的无菌EP 管中,4 ℃下静置30 min,以3000 r/min离心15 min分离小鼠血清,保存至-80 ℃冰箱备用。
按1.3 方法提取分离外泌体;血清TC,HDL-C,LDL-C,AST和ALT水平通过酶比色法按试剂盒说明书通过酶标仪测定;动脉粥样化指数(AI)按AI=(TCHDL-C)/HDL-C 公式进行计算。按1.4 方法下鉴定Lyso-GPL类成分并根据与姜黄素内标物的峰面积比值计算相对峰面积,对Lyso-GPL类成分进行相对定量分析,将相对峰面积导入SIMCA-P 14.1软件进行主成分分析(PCA)和正交偏最小二乘判别分析(OPLS-DA)。
1.6 统计学分析
实验数据采用IBM SPSS Statistics 23.0 软件进行分析处理。各项数据用均数±标准差表示,组间比较采用非参数检验分析,Plt;0.05 表示差异具有统计学意义。
2 结果
2.1 血液循环外泌体的提取与鉴定
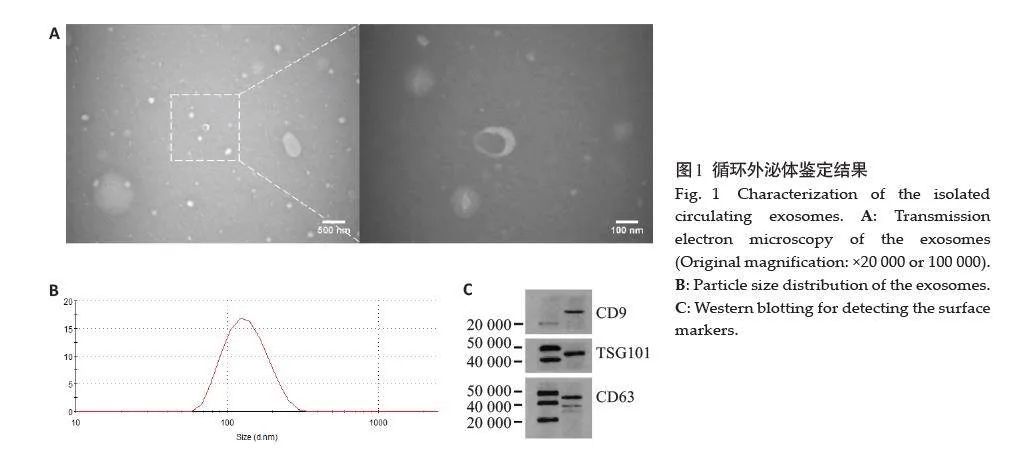
透射电镜下观察结果显示,外泌体呈有清晰双层膜的茶托样结构(图1A);NTA测量结果显示样品中外泌体粒径分布均匀,平均粒径为137.5 nm(图1B);通过Western blotting 检测外泌体特异性表面蛋白CD9(25 000)、CD63(47 000)及TSG101(44 000),经过qEV色谱柱分离出的溶液中富含外泌体(图1C)。
2.2 循环外泌体Lyso-GPL类分析方法的构建
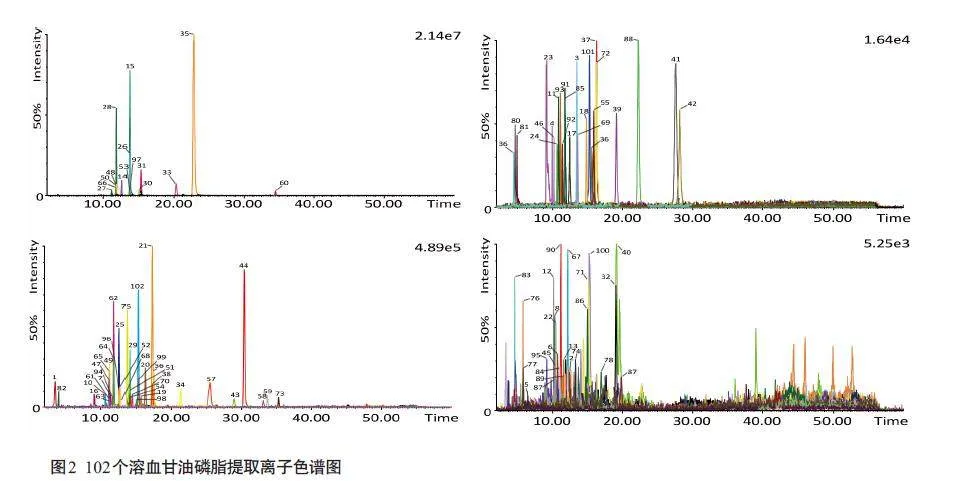
Lyso-PC 在正离子模式下最特征的产物离子是m/z 184.0733 和104.1070;Lyso-PE在正离子模式下会产生两个主要的碎片离子,分别是[M+H-61]+和[M+H-141]+;Lyso-PS的[M+H]+母离子在正离子模式下有两个特征中性丢失,分别为185.0089 和105.0426。在负离子模式下,m/z 171.0064和152.9958处的特征碎片离子指示了Lyso-PA类成分;Lyso-PI 负离子模式下的主要碎片产物是其结构上前体离子中性丢失的180.0634Da 和316.0559 Da。[M-H]-母离子的228.0399 Da 的中性丢失表征了Lyso-PG的极性头基,在m/z 277.0326处的产物离子容易因脂肪酰基的中性丢失而产生。按照上述裂解规律进行靶标性定性分析,本研究共检测出102 种Lyso-GPL,其中包括84 种Lyso-PC、14 种Lyso-PE和4 种Lyso-PS,而负离子模式下的Lyso-PA、Lyso-PI和Lyso-PG在外泌体样本中未检测到(图2)。
2.3 地五养肝方对NAFLD循环外泌体Lyso-GPLs的调控作用
2.3.1 理化指标
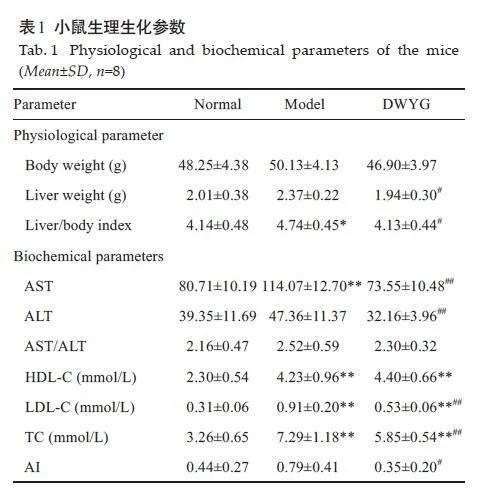
实验期间,各组小鼠均处于健康状态,无异常行为;各组小鼠之间的饮食及饮水量均无显著差异,给药4 周后,3 组小鼠间体质量无明显变化(表1)。与模型组相比,小鼠经复方给药后,其肝脏质量和肝脏指数显著性降低(Plt;0.05)。与模型组相比,正常组和复方给药组的血清AST水平均显著降低(Plt;0.01),复方组的血清ALT水平为32.16,显著低于模型组(Plt;0.01),而正常组和复方给药组的血清AST/ALT水平与模型组相比差异没有无统计学意义。正常组、复方组小鼠的血清TC水平分别为3.26和5.85,均显著低于模型组。与模型组小鼠相比,复方给药组的血清HDL-C水平无显著性变化,而血清LDL-C水平显著降低(Plt;0.01)。正常组和复方给药组的AI 值分别为0.44 和0.35,分别比NAFLD模型组小鼠低44.30%和55.70%,复方给药组的AI值与模型组相比具有显著性差异(Plt;0.05)。
2.3.2 地五养肝方对循环外泌体Lyso-GPLs 的调控作用
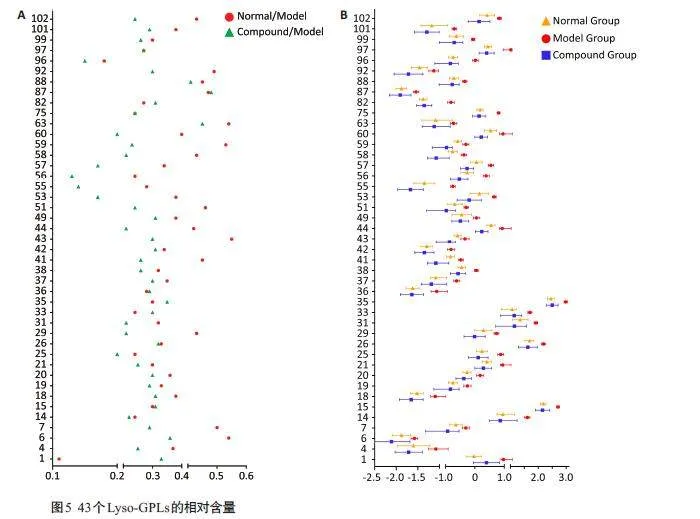
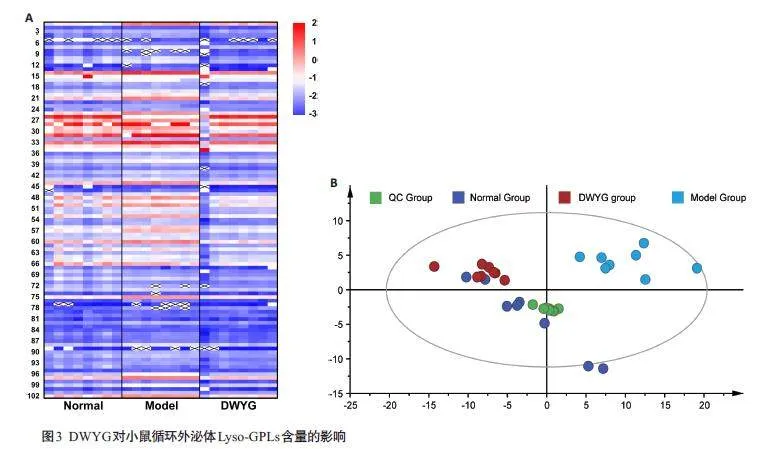
与正常组相比,模型组小鼠外泌体Lyso-GPLs的轮廓已出现整体差异,个别Lyso-GPLs类化合物含量有较显著的改变;经复方给药治疗后,小鼠外泌体Lyso-GPLs的轮廓相对于模型组,更加接近于正常组,且各Lyso-GPLs 类化合物的含量水平与正常组相比差异较小(图3A)。PCA分析结果显示正常组、模型组和复方组可以实现明显的分离,且复方给药组有向正常组靠近的趋势(图3B)。
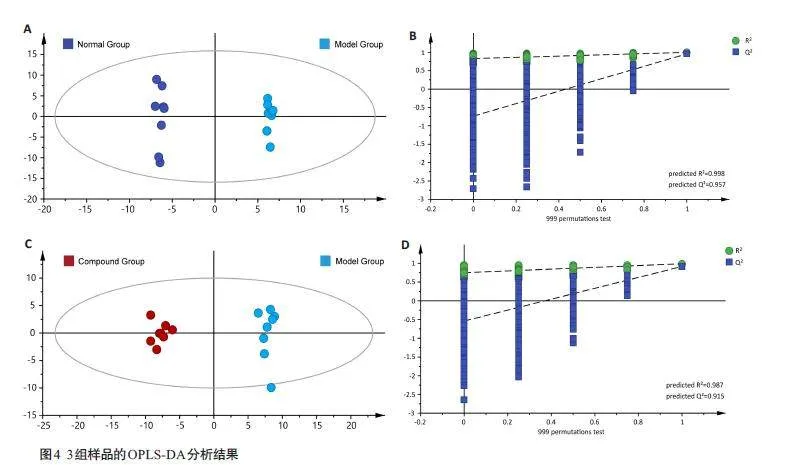
OPLS-DA分析结果(图4)清楚的显示出了正常组和模型组、模型组和复方给药组之间脂质的区别,两组分均能很好地聚集。基于此OPLS-DA模型,计算正常组/模型组样品的变量投影重要性(VIP);利用非参数检验分析正常组与模型组之间102个Lyso-GPL的相对峰面积;结合VIP值大于1 和非参数检验结果Plt;0.05,共筛选出46个差异性化合物;按上述相同操作,从模型组/复方组中共筛选出68个差异性化合物,其中46个为两者中共有成分。与模型组相比,根据正常组和复方给药组的各个Lyso-GPLs相对峰面积的含量,选择具有回调作用的Lyso-GPL,最后共筛选出43个标志物成分。其中,36 个为Lyso-PC类化合物,5 个为Lyso-PE 类化合物,2个Lyso-PS类化合物(图5)。
3 讨论
地五养肝方是基于李瀚旻教授创新“肝肾同源”理论提出的“补肾生髓成肝”治疗法则的基础上,研发的新型复方制剂。其中熟地黄、五味子的补肾作用已是广为人知[14, 15]。在本研究中,建造了NAFLD小鼠模型,经过4周地五养肝胶囊灌胃治疗后,分析小鼠常规血清生化指标,血清TC,HDL-C,LDL-C以及肝功能指标AST和ALT水平变化均呈现造模后升高趋势,而经地五养肝方给药治疗后,均被显著回调,证实了地五养肝方对NAFLD小鼠肝脏功能的治疗和改善作用,同时在本研究中,模型组小鼠循环外泌体中Lyso-GPLs的总含量相较于正常组有显著增加的趋势,经地五养肝方给药后被显著回调,并筛选出了43 个经地五养肝方治疗后呈现显著回调趋势(Plt;0.01)的Lyso-GPLs类生物标志物。
经细胞膜内吞过程产生的外泌体,其双层膜上的磷脂水平可以在一定程度上反应源细胞的变化[16],而Lyso-GPLs作为对应的磷脂类成分衍生物,其含量变化又可间接反映外泌体的变化。
血液和肝脏中脂质的堆积是NAFLD病症的主要特点,从而导致分泌的外泌体中脂质类成分的富集[17]。Hirsova等[ 18]的研究发现经高脂饲料诱导的非酒精性脂肪性肝炎小鼠肝脏中,随着脂质的增多可诱导肝细胞分泌外泌体,在Zhang等[ 19]的研究中也得出相似的结论。因此,循环外泌体中所含脂质类成分的富集和外泌体数量的增多是导致本研究中模型组Lyso-GPLs类成分高于正常组与给药组的主要原因。
血液中的外泌体被认为是微创的分子生物标志物来源,可用于早期发现和预后各种疾病,其中包括肝脏疾病[20]。有文献表明,肝脏是循环外泌体的重要来源器官,肝脏中各类细胞分泌的外泌体可通过细胞外液进入血液循环[21],肝脏分泌的外泌体可以体现“肝主疏泄”的功能,能够反映一身气机的通畅程度[22]。在非酒精性脂肪肝炎患者血液中可以检测到大量相应的脂毒性脂质分子[23, 24]。受损的肝细胞在毒性脂质分子的刺激下释放大量外泌体,通过血管生成、纤维化和炎症路径参与NAFLD的发病机制[25, 26]。
同时,肝脏也是循环外泌体摄取的主要位点,通过血液循环,接受自身分泌的或者其它细胞来源的外泌体[27]。有研究表明PKH26标记的黑色素瘤细胞来源外泌体,在静脉滴注处理小鼠的肝脏中被巨噬细胞捕获[28];活体实时动态示踪成像技术显示,由斑马鱼卵黄合胞体层释放的外泌体经血液循被肝脏中巨噬细胞识别捕获,摄取过程主要由清道夫受体介导[29]。在本研究中,给药组小鼠循环外泌体中Lyso-GPLs的总含量呈现回调趋势,证实了地五养肝方对循坏外泌体Lyso-GPLs类成分的调控作用,从而间接证明了地五养肝方在防治NAFLD发挥疗效的过程中对循坏外泌体的调控作用,为地五养肝方防治肝病的作用机制研究提供了新的科学视角。
然而,本研究仅探讨了地五养肝方对NAFLD小鼠血液循环外泌体中Lyso-GPLs类成分的调控作用。其他种类的脂质分子,如鞘磷脂、甘油磷脂等在与糖脂代谢相关的疾病中也具有重要的生理作用,后续还有待进一步研究。此外,本研究仅针对小鼠血液中总外泌体,而血液中的外泌体来源广泛,几乎所有的细胞产生的外泌体都会进入血液循环[30],且目前的技术手段难以从循环外泌体中准确分离出来源于特定组织的外泌体。因此,在循环外泌体中筛选与NAFLD病程密切相关的肝源性生物标志物,仍需更加深入的探索和研究。
参考文献:
[1] 李 瑶, 周 昕, 谢瑞芳. 地五养肝胶囊治疗肝病的理论依据[J]. 河南中医, 2018, 38(2): 257-61.
[2] 宋红丽“. 地五养肝胶囊” 抗大鼠肝纤维化及调节EMT/MET失衡的机制研究[D]. 武汉: 湖北中医药大学, 2013.
[3] Zhou JY, Tan XH, Tan YH, et al. Mesenchymal stem cell derivedexosomes in cancer progression, metastasis and drug delivery: acomprehensive review[J]. J Cancer, 2018, 9(17): 3129-37.
[4] Farooqi AA, Desai NN, Qureshi MZ, et al. Exosome biogenesis,bioactivities and functions as new delivery systems of naturalcompounds[J]. Biotechnol Adv, 2018, 36(1): 328-34.
[5] Zhang JC, Cui XL, Guo JC, et al. Small but significant: insights andnew perspectives of exosomes in cardiovascular disease[J]. J CellMol Med, 2020, 24(15): 8291-303.
[6] Shen MY, Shen Y, Fan XL, et al. Roles of macrophages andexosomes in liver diseases[J]. Front Med, 2020, 7: 583691.
[7] Boriachek K, Islam MN, Möller A, et al. Biological functions andcurrent advances in isolation and detection strategies for exosomenanovesicles[J]. Small, 2018, 14(6): 1702153.
[8] Devhare PB, Ray RB. Extracellular vesicles: novel mediator for cellto cell communications in liver pathogenesis[J]. Mol Aspects Med,2018, 60: 115-22.
[9] Nojima H, Freeman CM, Schuster RM, et al. Hepatocyte exosomesmediate liver repair and regeneration via sphingosine-1-phosphate[J]. J Hepatol, 2016, 64(1): 60-8.
[10]Skotland T, Sandvig K, Llorente A. Lipids in exosomes: currentknowledge and the way forward[J]. Prog Lipid Res, 2017, 66:30-41.
[11] Liu-Wu Y, Hurt-Camejo E, Wiklund O. Lysophosphatidylcholineinduces the production of IL-1beta by human monocytes[J].Atherosclerosis, 1998, 137(2): 351-7.
[12]Xu JL, Zou F, Lin YQ, et al. Integrated serum metabolomics andnetwork pharmacology approach to reveal the potential mechanismsof diwuyanggan prescription in the prevention of acute liver injury[J].Natural Product Communications, 2023, 18(6). 1934578X2311800.
[13]Shi QX, Jin SN, Xiang XL, et al. The metabolic change in serumlysoglycerophospholipids intervened by triterpenoid saponins fromKuding tea on hyperlipidemic mice[J]. Food Funct, 2019, 10(12):7782-92.
[14]陈思琦, 李佳欣, 吴鑫宇, 等. 熟地黄的药理学研究进展[J]. 化学工程师, 2019, 33(11): 46-50.
[15]任海风, 王世华. 五味子药理作用研究进展[J]. 中国医院用药评价与分析, 2018, 18(8): 1151-2.
[16] de la Torre Gomez C, Goreham RV, Bech Serra JJ, et al. \"exosomics\"-a review of biophysics, biology and biochemistry of exosomes witha focus on human breast milk[J]. Front Genet, 2018, 9: 92.
[17]Gitto S, Schepis F, Andreone P, et al. Study of the serummetabolomic profile in nonalcoholic fatty liver disease: research andclinical perspectives[J]. Metabolites, 2018, 8(1): 17.
[18]Hirsova P, Ibrahim SH, Krishnan A, et al. Lipid-induced signalingcauses release of inflammatory extracellular vesicles fromhepatocytes[J]. Gastroenterology, 2016, 150(4): 956-67.
[19]Zhang J, Tan J, Wang MK, et al. Lipid-induced DRAM recruitsSTOM to lysosomes and induces LMP to promote exosome releasefrom hepatocytes in NAFLD[J]. Sci Adv, 2021, 7(45): eabh1541.
[20]Vlassov AV, Magdaleno S, Setterquist R, et al. Exosomes: currentknowledge of their composition, biological functions, and diagnosticand therapeutic potentials[J]. Biochim Biophys Acta, 2012, 1820(7): 940-8.
[21]Sung S, Kim J, Jung Y. Liver-derived exosomes and their implicationsin liver pathobiology[J]. Int J Mol Sci, 2018, 19(12): 3715.
[22]高忠林, 白程菲, 张晓凤, 等. 外泌体在中医药研究中的应用进展[J]. 中国医药导报, 2021, 18(24): 36-9.
[23]Cheung O, Kapoor A, Puri P, et al. The impact of fat distribution onthe severity of nonalcoholic fatty liver disease and metabolicsyndrome[J]. Hepatology, 2007, 46(4): 1091-100.
[24]Puri P, Baillie RA, Wiest MM, et al. A lipidomic analysis of nonalcoholicfatty liver disease[J]. Hepatology, 2007, 46(4): 1081-90.
[25]Liu XL, Pan Q, Cao HX, et al. Lipotoxic hepatocyte-derivedexosomal miR-192-5p activates macrophages via rictor/akt/FoxO1signaling in NAFLD[J]. Hepatology, 2020, 72(2): 454-69
[26]Povero D, Panera N, Eguchi A, et al. Lipid-induced hepatocytederivedextracellular vesicles regulate hepatic stellate cell viamicroRNAs targeting PPAR-Γ[J]. Cell Mol Gastroenterol Hepatol,2015, 1(6): 646-63.e4.
[27]Masyuk AI, Masyuk TV, Larusso NF. Exosomes in the pathogenesis,diagnostics and therapeutics of liver diseases[J]. J Hepatol, 2013, 59(3): 621-5.
[28] Imai T, Takahashi Y, Nishikawa M, et al. Macrophage-dependentclearance of systemically administered B16BL6-derived exosomesfrom the blood circulation in mice[J]. J Extracell Vesicles, 2015, 4:26238.
[29]Verweij FJ, Revenu C, Arras G, et al. Live tracking of inter-organcommunication by endogenous exosomes In Vivo[J]. Dev Cell,2019, 48(4): 573-89.e4.
[30]Tan SHS, Wong JRY, Sim SJY, et al. Mesenchymal stem cellexosomes in bone regenerative strategies-a systematic review ofpreclinical studies[J]. Mater Today Bio, 2020, 7: 100067.
(编辑:经 媛)
基金项目:湖北省中医药管理局中医药青年人才项目(ZY2023Q040)

