鬼箭羽通过调节EGFR酪氨酸激酶抑制剂耐药信号通路延缓糖尿病肾病的进展


摘要:目的 结合GEO数据库利用网络药理学、分子对接技术及动物实验探究鬼箭羽治疗糖尿病肾病(DKD)的潜在作用机制。方法 通过TCMSP、PubChem及Swiss Target Prediction 数据库获取鬼箭羽的活性成分和作用靶点。利用GEO数据库找出与DKD相关基因芯片,使用R语言分析筛选出差异表达基因,结合GeneCards、DisGeNet、OMIM以及TTD疾病数据库整合获取DKD的治疗靶点。利用Venny2.1.0平台将药物与DKD相关的靶基因取交,利用STRING平台构建蛋白-蛋白互作网络图,并利用Cytoscape3.8.2 软件进行核心靶点的拓扑属性分析以及“药物-成分-靶点-疾病”网络图构建;利用David 平台进行KEGG与GO分析。利用Autodock vina V1.2.0 软件对核心靶点及主要药效成分进行分子对接,并通过db 小鼠动物实验进一步加以验证。结果 符合条件的基因芯片为GSE96804、GSE30528和GSE30529 ,共包含60例患病和45例正常样本数据,R语言分析得到111 个差异基因。网络药理学分析显示鬼箭羽相关靶基因共226 种,DKD相关靶基因共4252 种,二者取交得到鬼箭羽治疗DKD的潜在靶基因共161种;PPI网络图中筛选出关键核心靶基因为SRC、EGFR、AKT1等,“药物-成分-靶点-疾病“网络图得到鬼箭羽的主要核心活性成分为槲皮素、山奈酚、香叶木素、柚皮素。GO和KEGG富集分析显示,鬼箭羽治疗DKD的生物过程与外源刺激的反应、蛋白质磷酸化等有关,可能主要通过调节EGFR酪氨酸激酶抑制剂耐药通路发挥作用。分子对接结果显示鬼箭羽的主要核心活性成分与关键核心靶点具有良好的结合活性。体内动物实验结果证明鬼箭羽能够改善肾脏组织的病理学变化,且显著抑制了SRC、EGFR、AKT1的表达(Plt;0.05),延缓DKD的进一步恶化。结论 鬼箭羽可能是通过槲皮素、山奈酚、香叶木素、柚皮素等多种活性成分调控SRC、EGFR、AKT1等基因表达,从而影响EGFR酪氨酸激酶抑制剂耐药信号通路治疗DKD。
关键词:鬼箭羽;糖尿病肾病;GEO数据库;网络药理学;分子对接;信号通路;动物实验
糖尿病肾脏疾病(DKD)是糖尿病并发症中常见的微血管病变之一,也是临床上导致终末期肾脏病的主要诱导因素[1, 2],近年来DKD明显增加了患者发病和死亡的几率[3, 4]。DKD的发病机制复杂,与各种代谢紊乱、血流动力学异常改变、氧化应激、炎症反应及遗传因素等密切相关[5]。中医学认为,DKD属于“虚劳”、“消渴”、“水肿”等范畴,病变位置在于肾脏,可涉及五脏六腑,DKD病因大多数是肾气不足、气阴亏虚、精关不固、失于封藏[6, 7]。目前,西医主要治疗DKD的原则是控制人体内血压、血糖、血脂等的含量,但是仍然不能阻止DKD的病情进一步发生恶化[8]。
鬼箭羽最初记载于《神农本草经》,被列为中品,属于卫矛科植物卫矛的具有翅状枝条或者翅状附属物,性味苦寒,归肝经,功可破血痛经、解毒消肿、杀虫[9,10]。鬼箭羽的成分复杂,含有黄酮苷、生物碱类、挥发油等多种成分,具有降低血糖含量与改善胰岛素的抵抗、调节血脂代谢紊乱、抗氧化应激反应、抗炎症反应、抗肿瘤、抗肾小球硬化等方面的重要作用[11, 12]。研究显示,在使用中药对DKD进行治疗时,鬼箭羽可以通过单味药或者复方药的形式来改善肾小球损伤所导致的淤血症状,从而改善DKD的病情[13]。
既往相关研究中,对于鬼箭羽治疗DKD的生物信息学分析过程存在缺乏真实临床患者的基因数据以及相关中药中活性小分子数据不足的问题[14, 15]。GEO数据库是由美国国立生物技术信息中心创建的一个关于基因表达的数据库,该数据库包含了全球研究机构提供的大量高通量测序结果和微阵列数据集[16,17],通过对临床病例的差异基因(DEGs)分析能够使得出的结论更加可靠、准确。本研究深入挖掘GEO数据库中真实病例基因数据与DKD相关的传统疾病数据集,通过R语言进行DEGs分析,同时利用网络药理学结合分子对接预测作为切入点,在寻找鬼箭羽治疗DKD的潜在靶点时使用Swiss Target Prediction数据库进行靶点预测,该数据库收录了大量的蛋白质序列和药物分子信息,数据来源广泛,能够提高预测的准确性,为后续数据整合提供了坚实的数据基础,并通过动物实验验证相关作用机制,为临床上制定有效的诊治措施提供新的理论基础和研究思路。
1 材料和方法
1.1 实验动物
SPF 级9 周龄BKS-db/db 雄性小鼠27 只,体质量46~48 g同源BKS-db/m雄性小鼠9只,体质量23~25 g,[江苏集萃药康生物科技股份有限公司,SCXK(苏)2023-0009],饲养于河南中医药大学动物实验中心[SYXK(豫)2021-0015],室温19~25 ℃,相对湿度40%~55%;饮食、饮水自由。本研究经河南中医药大学动物伦理委员会批准(批准编号:202302012)。
1.2 主要实验仪器
三维冷冻研磨仪、研磨珠、涡旋混匀仪、离心机、移液器、封膜仪、PCR反应板、PCR封板膜、PCR反应管、离心管、研磨管(武汉塞维尔生物科技有限公司);荧光定量PCR仪(Bio-rad);酶标仪(Rayto);金属浴、磁力搅拌器、电泳仪、脱色摇床、化学发光成像系统、WB分析软件(Servicebio)。
1.3 主要实验药品与试剂
鬼箭羽水煎液(湖北道地药材科技有限公司);厄贝沙坦悬溶液(江苏恒瑞医药股份有限公司);4%多聚甲醛、RNA提取液、氯仿替代物(武汉塞维尔生物科技有限公司);异丙醇、无水乙醇、Water Nuclease-Free、RNA溶解液、SweScript All-in-One RT SuperMix for qPCR、2×Universal Blue SYBR Green qPCR Master Mix、引物(国药集团化学试剂有限公司);RIPA裂解液、PMSF(100 mmol/L)、磷酸化蛋白定量检测试剂盒、BCA蛋白定量检测试剂盒、5×蛋白上样缓冲液、10%PAGE彩色凝胶超快速配制试剂盒、Prestained Protein Market、PVDF膜(0.45 μm)、脱脂奶粉、ECL发光液组合装、玻璃板套装、无蛋白快速封闭液、PBS 缓冲液、抗体洗脱液、抗体孵育盒、丽春红染色液(Servicebio)。
1.4 网络药理学方法
1.4.1 鬼箭羽化学成分及靶点筛选
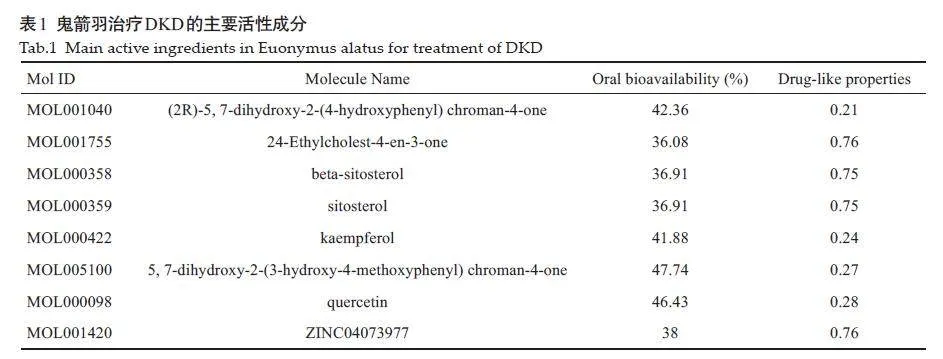
利用中药系统药理学数据库和分析平台(TCMSP,https://tcmsp-e. com/tcmsp.php)以口服生物利用度≥30%、类药性≥0.18为条件,筛选鬼箭羽的活性成分。将从TCMSP所筛选出的主要活性成分通过PubChem数据库(https://pubchem.ncbi. nlm. nih. gov/)获取SMILE name,将其导入到Swiss Target Prediciton 数据库(http://www.swisstargetprediction.ch/)中,获取单个主要成分基因名,把其中Probabilitylt;0的部分进行剔除,并对所筛选出的潜在靶点进行去重,最终得到鬼箭羽的潜在靶点。
1.4.2 基于GEO数据库筛选DKD的基因芯片
从GEO公共数据库(https://www.ncbi.nlm.nih.gov/gds)中以“diabetic kidney disease”作为关键词进行检索,选择“Homo sapiens”为研究对象,条目类型为“Series”,研究类型为“Expression profiling by array”,根据研究目的最终筛选得到GSE96804、GSE30528 和GSE30529 三个基因表达数据集。
1.4.3 DKD DEGs的差异分析
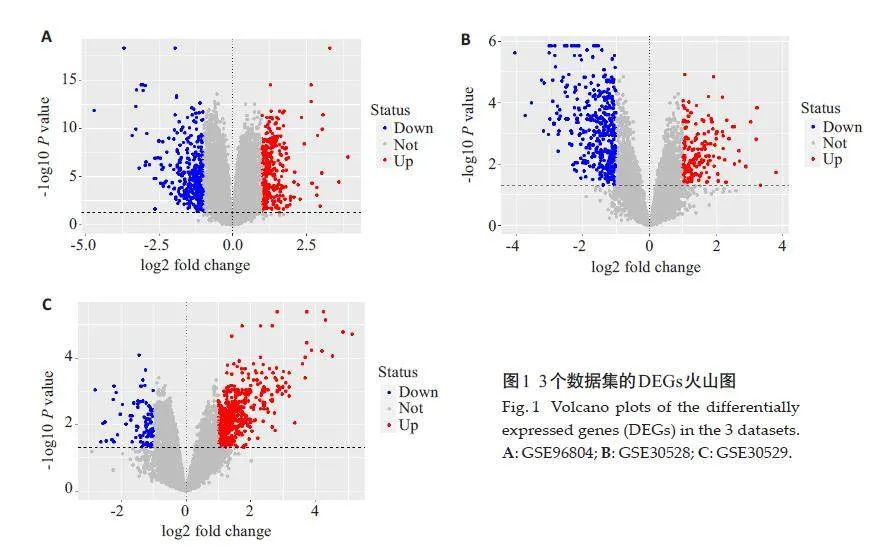
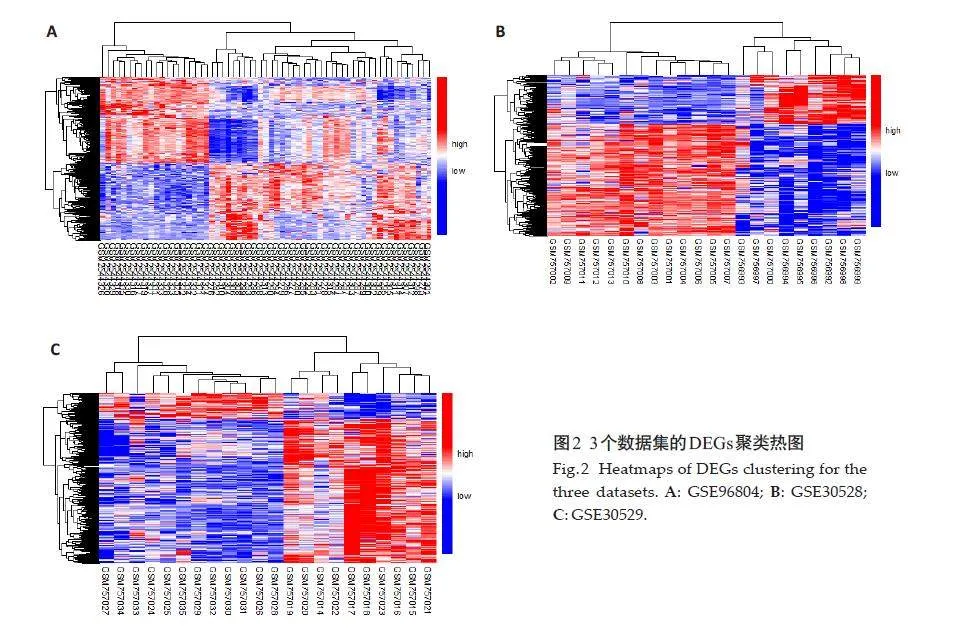
应用R语言合并3个数据集并用sva包去除批次效应,通过limma包识别合并后的数据集中DKD组和正常对照组之间的DGEs,设定筛选条件为调整后的Plt;0.05,|logFC|gt;1,当Plt;0.05,logFCgt;1为上调基因,用红色表示;当Plt;0.05,logFClt;-1下调基因,用蓝色表示,分别应用R语言的ggplot2 和pheatmap 包对3 个数据集的DEGs 绘制火山图及聚类热图。
1.4.4 DKD相关靶点的获取
利用人类基因GeneCards数据库(https://www.genecards.org/)、DisGeNet数据库(https://www. disgenet. org/home/)、OMIM 数据库(https://omim. org/)以及TTD 数据库(https://db.idrblab. net/ttd/)分别以“diabetic kidney disease”和“diabetic nephropathy”为关键词搜索与DKD的相关靶基因。GeneCards数据库检索时,设定relevance score≥10为筛选条件,保留所筛选出的靶基因。各数据库检索结果与GEO数据库分析出的DEGs 进行整合,删除重复值,即为DKD预测的靶基因。
1.4.5 鬼箭羽治疗DKD 的靶点搜集
将“1.4.1”和“1.4.4”小节中所检索到的药物相关的靶基因与DKD相关的靶基因利用Venny 2.1.0平台(http://liuxiaoyuyuan.cn/)的方式获取二者的交集靶点,即为鬼箭羽治疗DKD的潜在靶点。
1.4.6 鬼箭羽治疗DKD靶点的蛋白-蛋白相互作用网络(PPI)构建
利用STRING平台(https://stringdb.org/)把物种设定为“Homo sapiens”,相互作用阈值设定高置信度“highest confidence”gt;0.9为条件,隐藏网络中无联系的节点,其余参数设置保持不变,构建PPI网络。
1.4.7“ 药物-成分-靶点-疾病”的网络构建
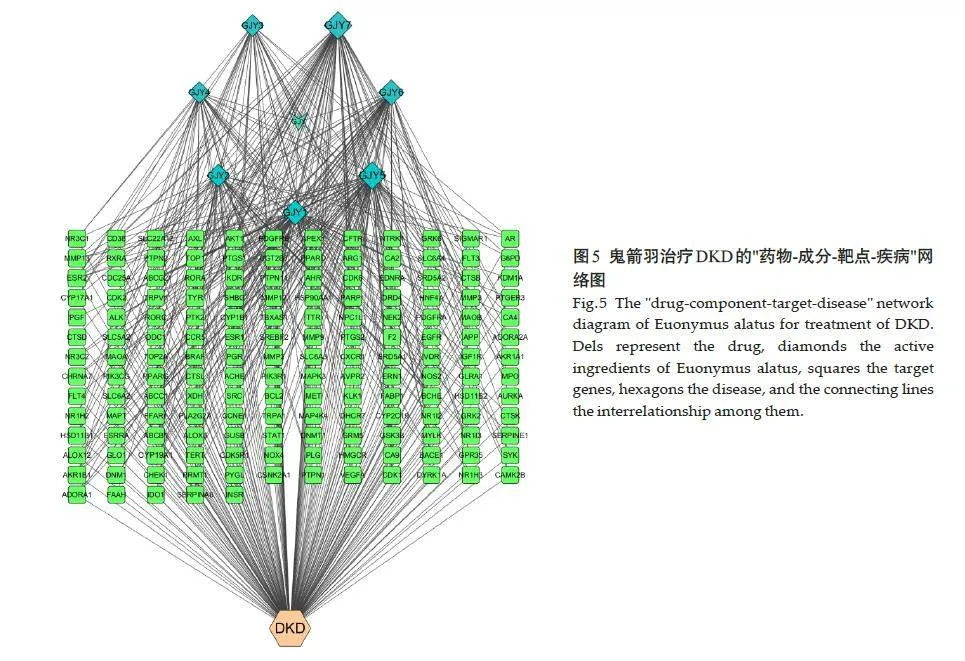
为筛选出关键核心靶点对应的活性成分,将鬼箭羽主要的7种活性成分、作用靶点和DKD相关靶点导入Cytoscape3.8.2软件中,构建“药物-成分-靶点-疾病”网络图。
1.4.8 鬼箭羽治疗DKD的功能与通路的富集分析
对筛选后的靶基因进行GO和KEGG通路富集分析。GO即基因本体论,是分析基因的常用方法,能通过分析靶基因参与的生物过程、细胞组分及分子功能对靶基因进行分类与注释。KEGG通路富集分析能分析基因在生物体内所参与的代谢过程。本研究使用DAVID数据库(https://david. ncifcrf. gov/)以及微生信平台(https://www.bioinformatics.com.cn/login/)的在线分析工具对靶基因进行富集分析。GO功能富集分析及KEGG通路富集分析的筛选条件均为Plt;0.05,并运用FDR的方法对P值进行矫正。
1.4.9 鬼箭羽治疗DKD 关键靶基因的确定
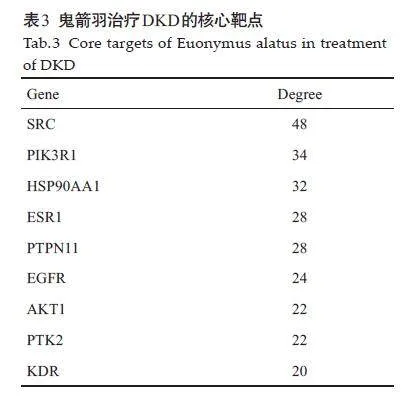
将STRING平台输出的蛋白-蛋白相互作用文件下载后导入Cytoscape3.8.2 软件中,对该网络进行可视化分析,使用“CytoNCA”进行拓扑分析,根据节点连接度(degree)、节点介度(betweenness)、节点紧密度(closeness)均大于等于三者中位数以及KEGG通路富集分析结果作为筛选标准,并利用KEGG 数据库(https://www.kegg.jp/)得到符合条件的节点作为关键核心靶点。
1.4.10 分子对接
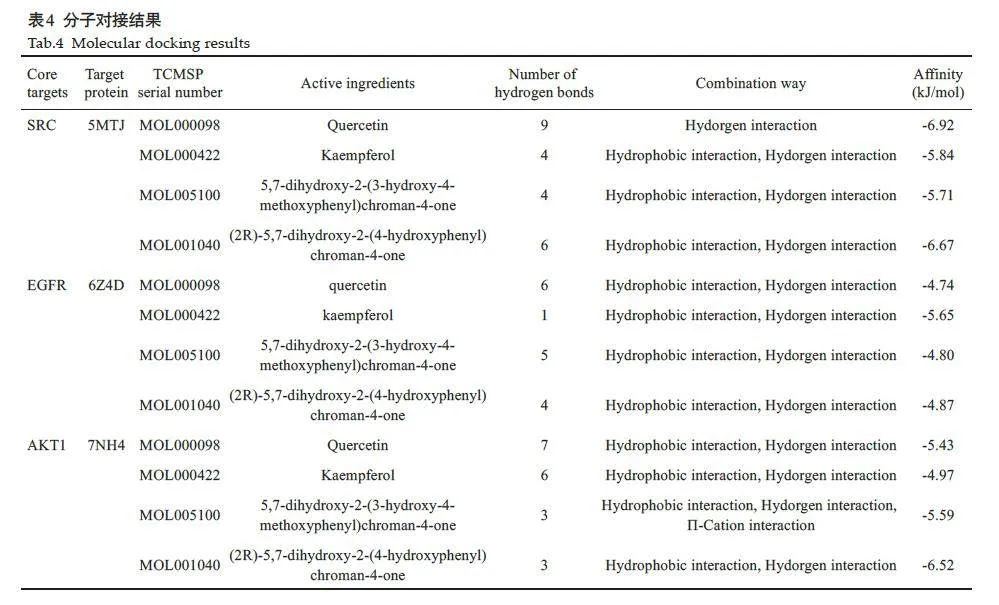
将“1.4.9”中的关键靶点导入至PDB数据平台(https://www. rcsb. org/)中,选择物种为“Home sapiens”,筛选条件为“Refinement Resolution(Å)lt;2 Å”,根据“1.4.1”的数据文件中找到关键靶点对应的活性成分,在TCMSP和PDB平台获取核心成分的小分子mol2 结构文件以及受体蛋白的pdb 文件,在Pymol 软件中对其进行去水、去配体操作,在AutoDock Tools1.5.7中打开配体和受体,确定配体和受体的结合位点grid box的位置和大小,并以“pdbqt”格式导出后用Open Babel3.1.1软件转换成“pdb”格式,最后使用Pymol软件调整透明度后显示结果位点以及运用PLIP网站(https://plip-tool. biotec. tu-dresden. de/plip-web/plip/index)进行对接结果的可视化分析。其中分子对接的得分Affinity≥-5.00 kJ/mol且lt;-4.25 kJ/mol表示配体和受体之间具有结合活性,Affinity≥-7.00 kJ/mol 且lt;-5.00 kJ/mol表示配体和受体之间具有良好的结合活性,Affinitylt;-7.00 kJ/mol 表示配体和受体之间具有强烈的对接活性。
1.5 实验验证
1.5.1 DKD小鼠模型的构建与分组
对db小鼠适应性饲养1 周后,对其进行尾静脉采血,连续3 次测定空腹血糖水平,当空腹血糖≥16.7 mmol/L、尿微量白蛋白高于空白对照组且尿量大于db/m小鼠的150%时,则认为DKD造模成功。将27只造模成功的db小鼠按照分层随机化方法分成模型组、中药组(鬼箭羽)、阳性对照组(厄贝沙坦)3 组,9 只/组,9 只db/m小鼠作为空白对照组。
1.5.2 给药
造模成功的小鼠按照与人体表面积系数进行换算,开始灌胃给药。鬼箭羽按照3 g/(kg·d)给药。给药依据为:鬼箭羽成人每日剂量23.33 g生药/70 kg体质量计算,按照体表面积折算的等效计量比值,小鼠给药剂量为人体的9.1 倍。因此,小鼠等效生药量为:23.33/70×9.1≈3.03 g(/ kg·d),故鬼箭羽剂量为3 g(/ kg·d)。阳性对照组按照人类临床中用药剂量的9.1 倍(22.75 mg/kg)及1 mL/100 g体质量系数的灌胃剂量给予厄贝沙坦悬溶液;空白对照组和模型组给予等体积的生理盐水溶液,以上4 组每天进行1 次灌胃,连续给药12周。
1.5.3 取材
给药12周后,使db小鼠禁食不禁水6 h,称其体质量,随后利用脱颈法将小鼠处死,充分暴露腹腔,摘取双侧肾脏,剥离筋膜,用生理盐水进行清洗,滤纸吸干水分,称量双肾的总质量,取部分肾脏在4%多聚甲醛溶液中进行固定,其余的肾脏组织放置在-80 ℃的液氮中保存备用。
1.5.4 用PAS染色和Masson染色观察肾脏组织的病理学变化
小鼠的肾脏组织在4%多聚甲醛溶液中固定48 h后,乙醇脱水,二甲苯透明,石蜡包埋,切片,分别进行PAS染色、Masson 染色,脱水,透明,封片,最后在光镜下观察肾脏组织的病理学变化并拍照记录。
1.5.5 qRT-PCR及Western blotting
qRT-PCR法检测肾脏组织中SRC、EGFR、AKT1的mRNA表达:取小鼠的肾脏组织,提取总RNA,进行逆转录、扩增过程,检测空白对照组、中药组、模型组以及阳性对照组的肾脏组织中SRC、EGFR、AKT1的mRNA表达情况。
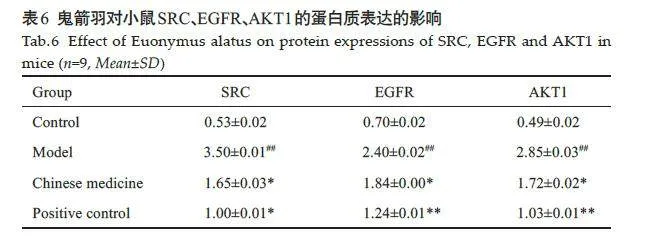
Western blotting 法检测肾脏组织中SRC、EGFR、AKT1 的蛋白表达:对小鼠的肾脏组织进行裂解、离心后提取组织的总蛋白,采用BCA的方法测定蛋白浓度,进行SDS-PAGE电泳、转膜、封闭、加入抗体、孵育、显色,利用凝胶成像仪观察空白对照组、中药组、模型组以及阳性对照组的肾脏组织中SRC、EGFR、AKT1蛋白表达情况,以条带灰度值与内参β-actin 灰度值的比值作为蛋白表达量指标。
1.6 统计学分析
采用SPSS27.0软件对实验数据进行分析。计量资料以均数±标准差表示,符合正态分布和方差齐性的,组间比较采用单因素方差分析;不符合正态分布,则采用非参数检验。以Plt;0.05为差异有统计学意义。
2 结果
2.1 网络药理学结果
2.1.1 鬼箭羽化学成分及靶点
经TCMSP平台筛选、去重及与疾病靶基因整合过后得出鬼箭羽的活性成分共有8种。纳入到鬼箭羽治疗DKD中的活性成分(表1)。
2.1.2 获取基因表达谱并筛选差异表达基因(DEGs)
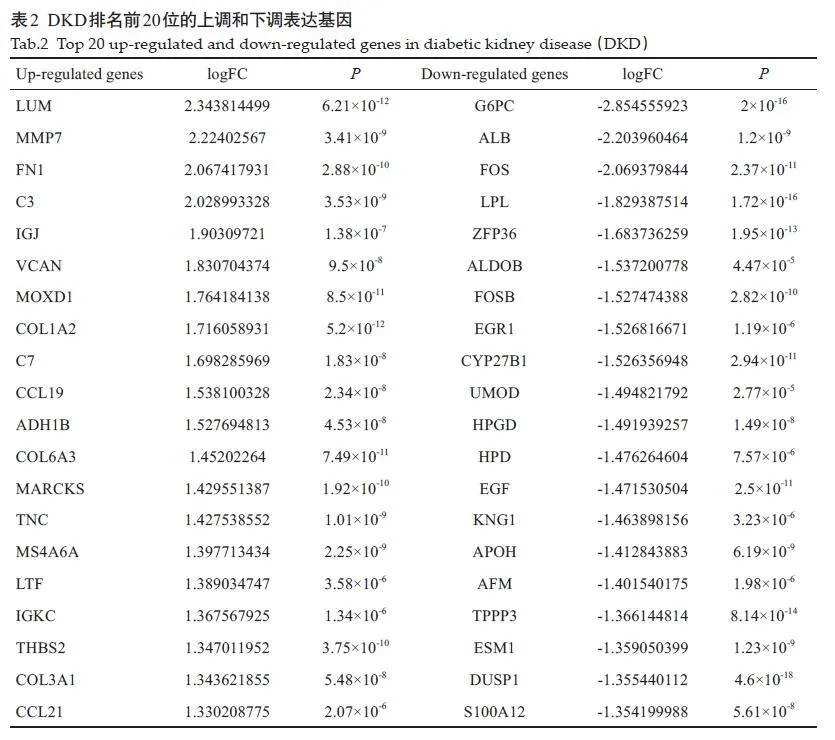
从GEO 数据库中根据研究目的最终筛选得到GSE96804、GSE30528和GSE30529三个基因表达数据集,其中GSE96804来自平台GPL17586-45144,包含41个DKD 样本和20 个正常组织样本;GSE30528 和GSE30529都来自平台GPL571-17391,GSE30528包含9 个DKD样本和13 个正常组织样本,GSE30529 包含10个DKD样本和12个正常组织样本。最终筛选出111个DEGs,其中满足Plt;0.05,logFCgt;1 的上调基因共有44个;满足P<0.05,logFClt;-1的下调基因共有67个,排名前20 的DEGs(表2),使用ggplot2 包构建火山图(图1),pheatmap包构建聚类热图(图2)。
2.1.3 鬼箭羽治疗DKD的潜在靶基因
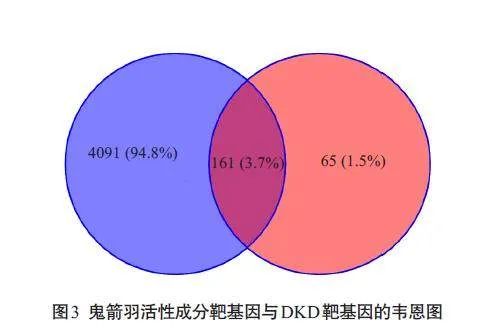
经TCMSP平台与Swiss Target Prediciton平台,预测所筛选出的药物候选潜在靶基因共226种;经各疾病相关数据库预测所筛选出的DKD相关靶基因共4252 种;二者求交集后,得到鬼箭羽治疗DKD的潜在靶基因共161种。韦恩图结果(图3)。
2.1.4 治疗DKD的PPI网络图
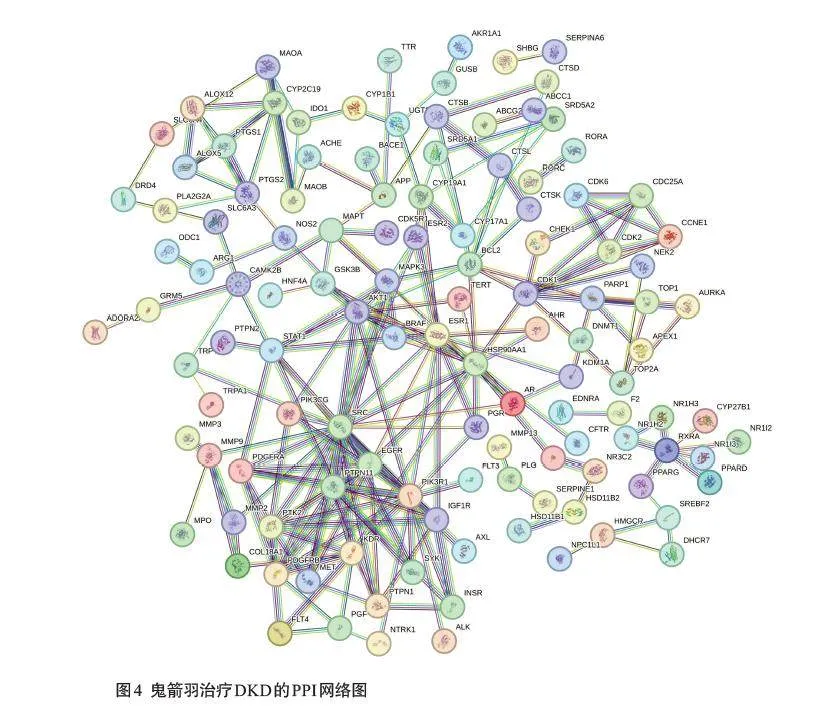
将鬼箭羽治疗DKD的潜在靶点共161个导入至STRING平台构建PPI网络,结果显示PPI网络中共有作用节点161个,节点之间代表蛋白互相作用关系的连线共228条,平均节点度值为2.83,平均局部聚类系数为0.45(图4)。
2.1.5 构建“药物-活性成分-靶点-疾病”网络图
可视化处理结果显示,槲皮素、山奈酚、香叶木素、柚皮素活性成分Degree值较大,可能是作为鬼箭羽治疗DKD的关键活性成分(图5)。
2.1.6 核心基因GO功能富集分析结果
利用David 数据库进行GO功能富集分析,其中生物过程共有508条,包括对外源刺激的反应、蛋白质磷酸化、蛋白质自身磷酸化等;细胞组分共有85 条,包括受体复杂、大分子复杂、等离子体膜等;分子功能共有161 条,包括RNA聚合酶ⅱ转录因子活性,配体激活的序列特异性DNA结合、蛋白质丝氨酸/苏氨酸/酪氨酸激酶活性、酶结合等。根据Plt;0.05筛选出具有代表性的前10条借助微生信平台进行富集分析(图6)。
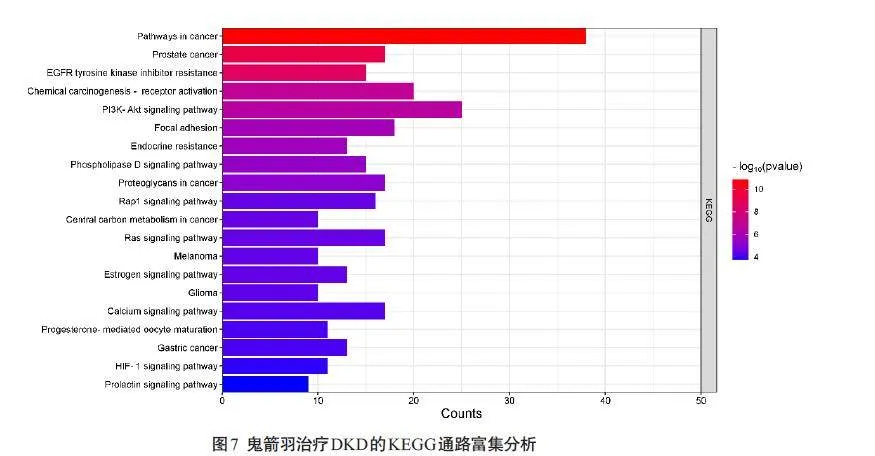
2.1.7 核心基因KEGG通路富集分析结果
通过David数据库进行KEGG通路富集分析,共得到128条通路,将P<0.05作为筛选条件选取前20条通路,利用微生信平台进行通路富集分析(图7),结果显示包括癌症通路、前列腺癌通路、EGFR酪氨酸激酶抑制剂耐药通路、化学致癌作用-受体活化通路、PI3K-Akt信号通路等,其中EGFR酪氨酸激酶抑制剂耐药通路可能发挥着重要的治疗作用。
2.1.8 确定鬼箭羽治疗DKD的关键靶基因
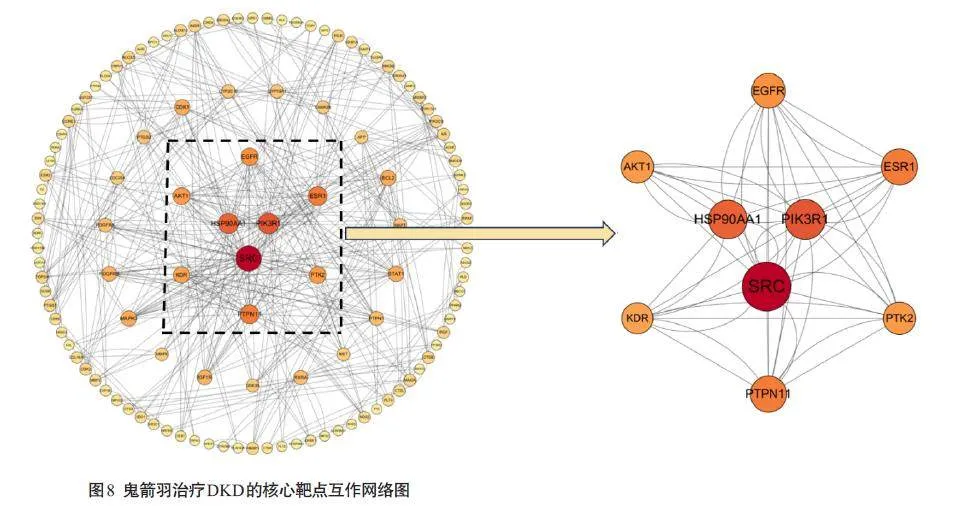
对网络的拓扑属性进行分析,最终选出鬼箭羽治疗DKD的核心靶点共9个,再根据EGFR酪氨酸激酶抑制剂耐药通路在KEGG数据库中的相关作用靶点,推测SRC、EGFR、AKT1 可能是鬼箭羽治疗DKD的关键核心作用靶点(表3、图8)。
2.1.9 药物成分-核心靶点分子对接验证分析
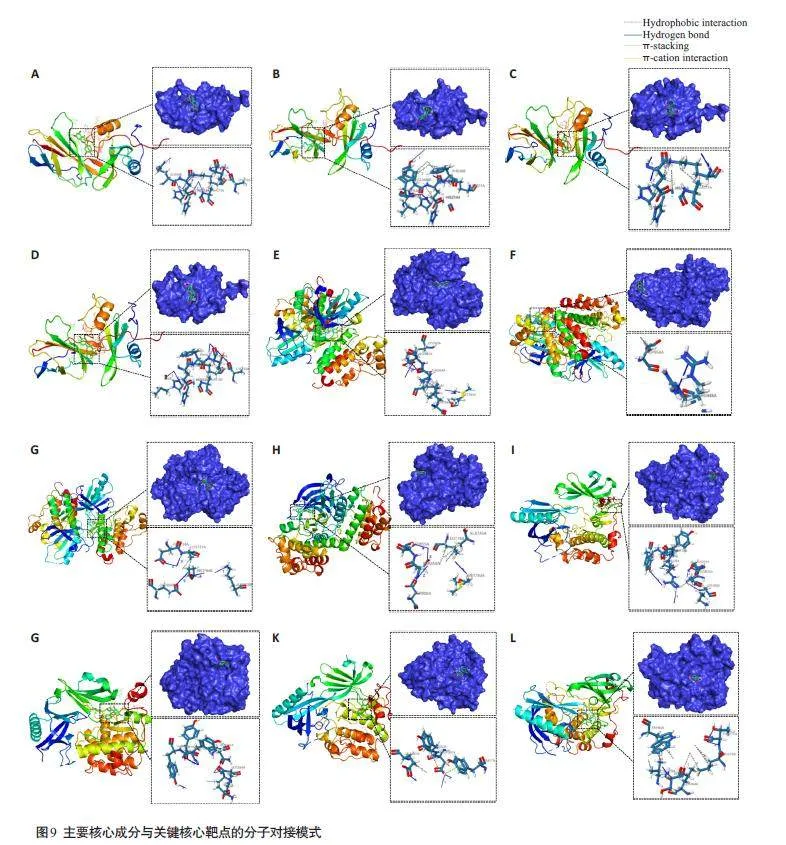
选取鬼箭羽治疗糖尿病肾病“药物-活性成分-靶点-疾病”互作网络图中连接度最高的前4 位作为核心活性成分即槲皮素、山奈酚、香叶木素、柚皮素;选取“2.1.8”小节中筛选得出的3 个关键核心靶点,分别是SRC、EGFR、AKT1,进行分子对接进行验证,对接结果及核心靶点与活性成分连接方式(表4)。槲皮素、山奈酚、香叶木素、柚皮素4 种核心活性成分与SRC、EGFR、AKT1 3 个关键核心靶点有较好的结合活性。核心蛋白与核心活性成分对接可视化情况(图9)。
2.2 在体实验验证结果
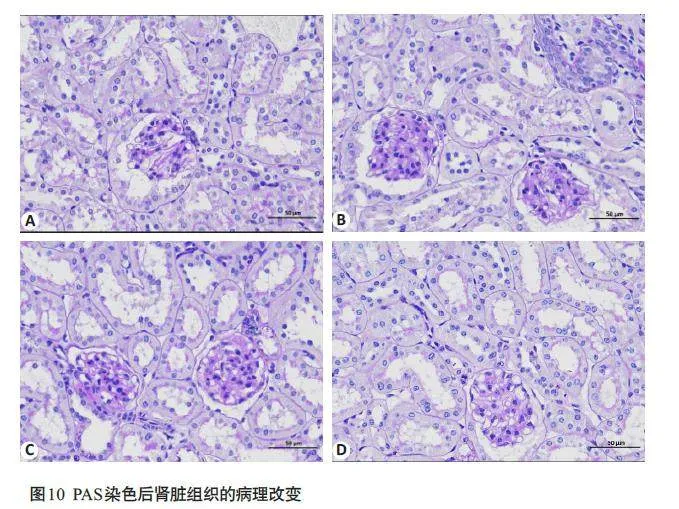
2.2.1 小鼠肾脏组织的病理变化
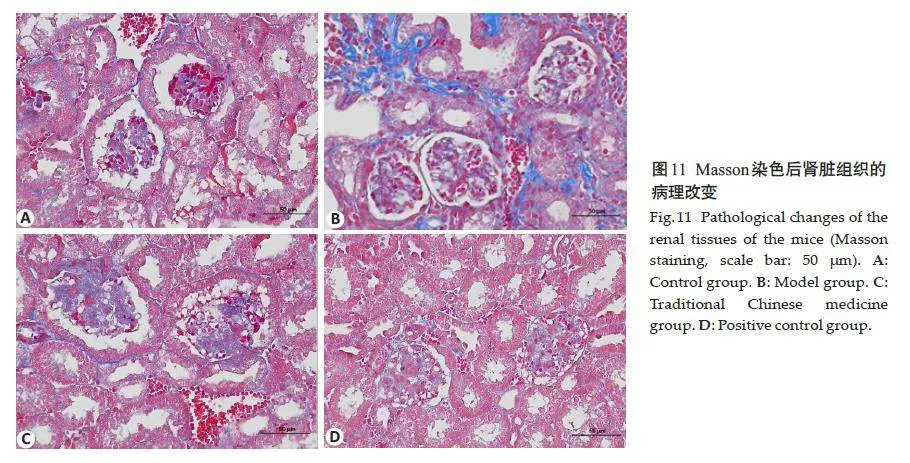
空白对照组小鼠的肾脏组织形态结构正常,系膜区基质均匀,未见明显紫红色糖原沉积,肾小球和肾小管中存在少量胶原纤维;与空白对照组相比,模型组小鼠肾小球体积增大,系膜基质增宽,肾组织内可见紫红色糖原明显沉积,胶原大量沉积;与模型组相比,中药组及阳性对照组小鼠的肾脏组织病变均有不同程度的改善缓解,肾小球体积减小,系膜基质增生、糖原沉积减少,胶原纤维沉积减轻(图10、11)。
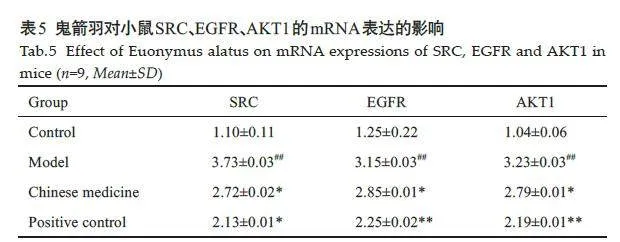
2.2.2 小鼠肾脏组织中SRC、EGFR、AKT1的mRNA表达情况
与空白对照组相比,模型组中SRC、EGFR、AKT1 的mRNA表达情况升高(Plt;0.01);与模型组相比,中药组及阳性对照组中SRC、EGFR、AKT1 的mRNA表达情况降低(Plt;0.05,表5)。
2.2.3 小鼠肾脏组织中SRC、EGFR、AKT1 的蛋白表达情况
与空白对照组相比,模型组SRC、EGFR、AKT1的蛋白表达水平均升高(Plt;0.01);与模型组相比,中药组及阳性对照组中SRC、EGFR、AKT1的蛋白表达水平均下降(Plt;0.05,表6、图12)。
3 讨论
《外台要诀》有描述消渴者,与DKD的表现很相似[18],随病情发展,日久亏损,逐渐导致脾肾亏虚,发展为晚期肾病。鬼箭羽性味苦寒,最初记载于《神农本草经》,可清热坚阴,解毒消肿,又可破血散瘀,对下焦之瘀血疗效显著,广泛用于肾脏、肿瘤、心血管等疾病治疗[19]。取其活血行血,有助于调节血糖、抗炎、治疗肾纤维化、抗心肌缺血[20]。临床研究显示,鬼箭羽可有效缓解DKD的临床症状[21],但并未从临床基因数据与生物信息技术融合的方向进行相关机制研究。本研究在传统网络药理学数据基础上新增临床真实DKD患者基因数据,使疾病数据更加真实有效,并通过“药物-成分-靶点-疾病”网络图可视化的基础上,从动物体内实验中阐述鬼箭羽治疗DKD的作用机制。
在鬼箭羽的核心活性成分中,槲皮素作为一种常见的天然黄酮类化合物,广泛存在于日常的各种膳食中,能够增强细胞对氧化应激的抵抗力,具有抗炎、抗病毒、免疫调节等作用[22]。多数文献认为DKD的病理特征之一是胞外基质的堆积,TGF-β通路的激活会导致系膜细胞增殖,进一步导致肾小球硬化,而槲皮素能够抑制这种表达,从而改善肾脏的损伤现象,其中有学者认为,虽然不同剂量的槲皮素都有抑制肾小球系膜增殖的作用,但中高剂量组之间差异不大[23-25]。本研究发现,槲皮素缓解DKD症状极有可能是通过调节EGFR酪氨酸激酶抑制剂耐药信号通路来发挥降低肾组织炎症、抗纤维化的作用。相关研究发现,山奈酚能够减少人肾小球内皮细胞中高糖诱导的ROS的产生,从而通过减轻氧化应激来缓解DKD病理特征[26]。香叶木素能抗氧化、抗癌、保护视网膜,其抗氧化功用与山奈酚不谋而合。但当前对香叶木素作用机制的研究众说纷纭,有学者认为其主要缓解糖尿病氧化应激作用,还可以改善脂代谢紊乱和肝功能受损[27];有研究显示香叶木素通过调节YAP通路保护高糖诱导的内皮细胞损伤,从而缓解糖尿病并发症[28]。当前有关柚皮素对DKD的作用的研究并不多,有研究从体外研究出发,认为其可能是通过调节RhoA/ROCK通路降低肾纤维化程度[29]。而本研究通过使用DKD小鼠模型进行实验,其病理切片结果显示,山奈酚、香叶木素和柚皮素可能是通过减少糖原沉积和胶原纤维沉积从而延缓肾脏组织纤维化进程。
PPI 网络图分析结果显示关键核心靶点为SRC、EGFR、AKT1。研究发现,SRC家族成员SRC3与DKD重要发病机制炎症反应、血脂异常及氧化应激等密切相关[29],且SRC3通过维持自噬来保护足细胞免受高糖损伤已被证实[30, 31]。SRC和ROS受细胞类型和刺激双向影响,在胰岛素样生长因子的刺激下,ROS衍生并激活SRC,SRC也能通过激活相关激酶使ROS 含量增加,ROS的产生和增加导致氧化应激,引起细胞损伤[32]。本研究动物实验结果表明,鬼箭羽可能也可以通过调控SRC 进一步缓解DKD肾脏生理功能的进一步恶化。EGFR在哺乳动物肾脏广泛表达,研究表明,在肾炎和DKD早期抑制其表达含量可有效减少尿蛋白尿的产生[33],目前研究表明其有望成为新型鉴定DKD 指标[34, 35]。AKT1属于AKT家族成员之一,丝氨酸/苏氨酸激酶,参与细胞增殖、生长、氧化应激等多种反应,与调节心血管功能,心脏舒张与收缩具有重要联系[36]。研究发现AKT1介导足细胞自噬、减轻足细胞损伤及肾小管上皮-间质转化中发挥重要作用[37, 38]。本研究发现AKT1 在中药组的表达含量相较于模型组而言有所减少,其肾脏组织恶化程度有所改善,表明AKTI 含量减少极有可能是阻止系膜基质增生,延缓肾脏纤维化进程的重要指标。
在KEGG富集所得通路中,EGFR酪氨酸激酶抑制剂耐药信号通路中的EGFR是一种受体酪氨酸激酶,是表皮生长因子受体家族成员之一,其为该条通路的上游靶点,可调节细胞的增殖、吸附、迁移等,下游通路中涉及靶点SRC与AKT1。本研究的分子对接结果显示,鬼箭羽中的主要活性成分山柰酚、槲皮素、香叶木素等与关键核心靶点SRC、EGFR、AKT1 的结合活性良好,提示其在治疗过程中起关键作用。
本研究在体实验验证结果显示,SRC、EGFR、AKT1 在模型组中呈高表达状态,经鬼箭羽药液治疗后,小鼠体内SRC、EGFR、AKT1的mRNA及相关蛋白的表达情况水平均降低。相关报道显示,SRC的表达会诱导肾纤维化,导致内质网应激,炎症发生,促进糖尿病肾病进展[31, 39]。EGFR为EGFR酪氨酸激酶抑制剂耐药信号通路的下游靶点。AKT1也多次被证明是在DKD发病过程的关键基因[40-42]。以上结果均表明鬼箭羽可通过降低SRC、EGFR、AKT1 血清水平及蛋白表达含量,改善DKD小鼠肾脏功能,提高临床疗效,具有保护肾脏的作用。
综上所述,本研究通过网络药理学、分子对接技术与动物在体实验验证,揭示了鬼箭羽可通过多个活性成分,调控多个靶点治疗DKD,初步揭示出鬼箭羽可能通过调节EGFR酪氨酸激酶抑制剂耐药信号通路对DKD进行治疗,改善肾脏损伤情况,为其后续鬼箭羽的用药治疗提供相关科研依据。本研究中鬼箭羽成分分析有待完善,其临床疗效还需从实际中药药液有效成分入手,如采取中药指纹图谱的方法,使其成分更加精确。后续也将对EGFR酪氨酸激酶抑制剂耐药信号通路进行深层次挖掘。
参考文献:
[1] 魏瑞贤, 杨丽霞, 崔阳阳, 等. 黄芪多糖对糖尿病肾病小鼠肾组织血管内皮损伤的影响[J]. 中国临床药理学杂志, 2023, 39(21): 3130-3.
[2] 姜晓雪, 金智生, 陈彦旭, 等. 基于NLRP3/Caspase-1信号通路探讨红芪多糖对糖尿病肾病db/db小鼠作用机制[J]. 中国临床药理学杂志, 2023, 39(21): 3125-9.
[3] Kaur P, Kotru S, Singh S, et al. miRNA signatures in diabeticretinopathy and nephropathy: delineating underlying mechanisms[J]. J Physiol Biochem, 2022, 78(1): 19-37.
[4] 朱 清, 韩佳瑞, 庞欣欣, 等. 基于AMPK信号通路探讨中医药防治糖尿病肾脏疾病的研究进展[J/OL]. 中药药理与临床, 2023: 1-13.doi: 10.13412/j.cnki.zyyl.20231109.001.
[5] 刘心雨, 郑伟英. 依帕司他联合贝那普利对老年糖尿病肾病患者ICAM-1、VCAM-1 和HMGB1 水平及炎症因子的影响[J]. 中国老年学杂志, 2023, 43(20): 4991-4.
[6] 张亚亨, 盛广宇, 宋 婷, 等. 玉蚕颗粒改善足细胞损伤治疗糖尿病肾病的机制研究[J]. 上海中医药杂志, 2023, 57(11): 77-84.
[7] 谢旦红, 徐 杰, 杨 鑫, 等. 益气养阴化瘀方联合达格列净治疗糖尿病肾病对肾功能及血液流变学与凝血功能的影响[J]. 中药材, 2022,45(8): 1990-2.
[8] 徐 洋, 王 敏, 张恒璐, 等. 达格列净通过Rffl抑制STAT1/TGF-β1信号通路改善糖尿病肾病肾小管上皮细胞EMT和纤维化[J]. 南京医科大学学报: 自然科学版, 2023, 43(9): 1201-7.
[9] 郭延秀, 席少阳, 马 毅, 等. 鬼箭羽化学成分及药理活性研究进展[J]. 中国现代应用药学, 2021, 38(18): 2305-16.
[10]洑晓哲, 张耀夫, 赵进喜, 等. 赵进喜应用鬼箭羽、牛蒡子对药治疗糖尿病肾脏病经验探析[J]. 中华中医药杂志, 2021, 36(8): 4742-4.
[11]文 辉, 黄思芸, 赖俊玉, 等. 鬼箭羽治疗糖尿病肾病探讨[J]. 实用中医药杂志, 2022, 38(10): 1812-4.
[12]杨 鑫, 刘春莹. 鬼箭羽治疗糖尿病肾病药理机制的研究进展[J]. 中华老年多器官疾病杂志, 2023, 22(7): 557-60.
[13]杜雨璇, 谢治深, 徐江雁, 等. 鬼箭羽化学成分和药理作用的研究进展及其质量标志物预测[J]. 天然产物研究与开发, 2024, 36(6):1064-81, 1044.
[14]孙瑞茜, 彭 静, 郭 健, 等. 鬼箭羽的现代药理作用研究成果[J]. 环球中医药, 2015, 8(2): 245-9.
[15]王 函, 文 辉, 赖俊玉, 等. 基于网络药理学结合体内实验揭示黄芪—鬼箭羽方治疗糖尿病肾病的核心靶点及分子机制[J]. 临床合理用药, 2023, 16(33): 150-5.
[16]张贵斌, 张闫斌, 许 涵, 等. 基于GEO数据库筛选多发性硬化症关键基因Kcnc1、Kcnc2的分析研究[J]. 中国免疫学杂志, 2023, 39(8):1600-4.
[17]Su WX, Zhao Y, Wei YQ, et al. Exploring the pathogenesis ofpsoriasis complicated with atherosclerosis via microarray dataanalysis[J]. Front Immunol, 2021, 27(12): 667690.
[18]李明侠, 李小会. 糖尿病肾病蛋白尿中医研究进展[J]. 现代中西医结合杂志, 2023, 32(18): 2623-8.
[19]卜祥辉, 安海燕, 安晓娜, 等. 基于网络药理学与分子对接探究鬼箭羽治疗糖尿病肾病的作用机制[J]. 湖南中医药大学学报, 2021, 41(10): 1564-73.
[20]周丽霞, 王继革, 张娜娜. 鬼箭羽药效学研究概况[J]. 中医临床研究, 2016, 8(12): 134-6.
[21]陈 慧, 赵进喜. 赵进喜治疗糖尿病肾病经验[J]. 中医杂志, 2011, 52(4): 344-5.
[22]王兴红, 孙 静, 马永超, 等. 槲皮素对糖尿病肾病小鼠肾脏P2X7R/NLRP3 信号通路和纤维化的影响[J]. 中药药理与临床, 2023, 39(6): 48-53.
[23]黄小翠, 于赵龙, 祝子健, 等. 槲皮素对糖尿病大鼠肾脏保护作用研究[J]. 赣南医学院学报, 2023, 43(3): 262-6.
[24]朱开梅, 唐丽霞, 赵文鹏, 等. 槲皮素脂质体对糖尿病肾病氧化应激和TGF-β1/Smad7通路的影响[J]. 安徽医科大学学报, 2017, 52(3):319-23.
[25]吴素珍, 李加林, 陈水亲. 槲皮素对高糖诱导肾小球系膜细胞增殖及TGF-β1/Smads信号通路的影响[J]. 中国中医基础医学杂志, 2016,22(2): 195-7, 215.
[26]段 斌, 高妍婷, 杜 鹏, 等. 山奈酚对高糖条件下人肾小球内皮细胞氧化应激及凋亡的影响[J]. 疑难病杂志, 2019, 18(4): 403-6.
[27]江一峰, 周雪雪, 黄盈盈, 等. 香叶木素对Ⅱ型糖尿病小鼠的降血糖作用[J]. 中国食品学报, 2022, 22(6): 177-89.
[28]雷静文, 郭小莉, 宋丽华, 等. 香叶木素对高糖诱导的血管内皮细胞损伤的保护作用[J]. 中国临床药理学杂志, 2022, 38(22): 2679-83.
[29]周鑫帝, 甘 淳, 陈婉冰, 等. 通过SRC3敲低改善糖尿病肾病肾功能紊乱的实验研究[J]. 中国生物工程杂志, 2023, 43(7): 23-35.
[30]Xie YR, Yuan Q, Cao XY, et al. Deficiency of nuclear receptorcoactivator 3 aggravates diabetic kidney disease by impairingpodocyte autophagy[J]. Adv Sci, 2024, 11(19): e2308378.
[31]Yu C, Li Z, Nie CL, et al. Targeting Src homology phosphatase 2ameliorates mouse diabetic nephropathy by attenuating ERK/NF-κBpathway-mediated renal inflammation[J]. Cell Commun Signal,2023, 21(1): 362.
[32]Hussain M, Ikram W, Ikram U. Role of c-Src and reactive oxygenspecies in cardiovascular diseases[J]. Mol Genet Genomics, 2023,298(2): 315-28.
[33]魏艳红. PKCα介导的EGFR降解在糖尿病肾病足细胞损伤中的作用及机制[D]. 武汉: 华中科技大学, 2015.
[34]Zhang SJ, Zhang YF, Bai XH, et al. Integrated networkpharmacology analysis and experimental validation to elucidate themechanism of acteoside in treating diabetic kidney disease[J]. DrugDes Devel Ther, 2024, 18: 1439-57.
[35]孙艳红. eGFR在2型糖尿病早期肾病中的临床意义[D]. 沈阳: 中国医科大学, 2012.
[36]朱 墨, 郭长彬. Akt 抑制剂的研究进展[J]. 中国药物化学杂志,2021, 31(11): 921-8.
[37]高 飞, 谢惠迪, 于博睿, 等. 芪地糖肾方调控Akt1/HIF-1α/Bcl-xl信号通路提高糖尿病肾病足细胞自噬的机制[J]. 中国实验方剂学杂志, 2024, 30(15): 90-7.
[38]尹德辉, 唐诗韵, 吴 珠, 等. 益智仁-乌药药对调控PI3K/Akt/mTOR通路介导细胞自噬保护肾小球足细胞的作用机制研究[J]. 中华中医药学刊, 2024, 42(1): 30-4, 262-4.
[39]Dorotea D, Jiang SL, Pak ES, et al. Pan-Src kinase inhibitortreatment attenuates diabetic kidney injury via inhibition of Fynkinase-mediated endoplasmic reticulum stress[J]. Exp Mol Med,2022, 54(8): 1086-97.
[40]Chen SN, Li B, Chen L, et al. Uncovering the mechanism ofresveratrol in the treatment of diabetic kidney disease based onnetwork pharmacology, molecular docking, and experimentalvalidation[J]. J Transl Med, 2023, 21(1): 380.
[41]Asmy VKSS, Natarajan J. Comparative co-expression analysis ofRNA-Seq transcriptome revealing key genes, miRNA andtranscription factor in distinct metabolic pathways in diabetic nerve,eye, and kidney disease[J]. Genomics Inform, 2022, 20(3): e26.
[42]Gao YY, Nan Z. Mechanistic insights into the use of rhubarb indiabetic kidney disease treatment using network pharmacology[J].Medicine, 2022, 101(1): e28465.
(编辑:郎 朗)
基金项目:国家自然科学基金(82104748);河南省科技攻关计划项目(242102311282)

