拟南芥中异源过表达CsLOX6和CsHPL2基因提高植株耐盐性和耐旱性

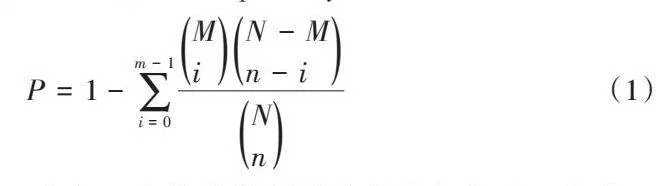











摘要:探究CsLOX6基因和CsHPL2基因对拟南芥(Arabidopsis thaliana)生长以及对干旱和盐胁迫抗性的影响,以野生型拟南芥(WT)、转基因型拟南芥(OE-CsLOX6、OE-CsHPL2)、突变体型拟南芥(TB-Atlox5)为材料,通过表型观察、转录组和代谢组学分析等方法评估4种拟南芥的耐旱性、耐盐性。结果表明,OE-CsLOX6的地上部鲜重和根长均显著高于其他基因型植株,地下部鲜重明显高于其他基因型植株;OE-CsHPL2的地上部鲜重、地下部鲜重和根长明显低于其他基因型植株。OE-CsLOX6、OE-CsHPL2和WT的代谢物含量存在较大差异,OE-CsLOX6和WT有64个差异代谢物,其中有6个上调,58个下调;OE-CsHPL2和WT有63个差异代谢物,其中有9个上调,54个下调。过表达CsLOX6基因和CsHPL2基因可以提高拟南芥对盐胁迫和干旱胁迫的抗性。在盐胁迫和干旱胁迫下,OE-CsLOX6、OE-CsHPL2的丙二醛含量要显著低于野生型植株,膜质过氧化程度低,SOD、POD和CAT活性要明显高于野生型,提高了植株的抗氧化能力,叶片长势明显优于野生型植株。
关键词:拟南芥(Arabidopsis thaliana);异源过表达;CsLOX6基因;CsHPL2基因;耐盐性;耐旱性;胁迫
中图分类号:S642.2 RF58snVPgIRUvMo8rYGR6Wb6UgLlQLpyvCKz6OzHkYY=文献标识码:A
文章编号:0439-8114(2024)10-0165-11
DOI:10.14088/j.cnki.issn0439-8114.2024.10.030 开放科学(资源服务)标识码(OSID):
Abstract: To explore the effects of CsLOX6 gene and CsHPL2 gene on the growth of Arabidopsis thaliana and its resistance to drought and salt stress, wild-type Arabidopsis thaliana (WT), transgenic Arabidopsis thaliana (OE-CsLOX6, OE-CsHPL2), and mutant Arabidopsis thaliana (TB-Atlox5) were used as materials, and the drought and salt tolerance of the four Arabidopsis thaliana species were evaluated through phenotype observation, transcriptome, and metabolomics analysis. The results showed that the aboveground fresh weight and root length of OE-CsLOX6 were significantly higher than those of other genotypes, and the underground fresh weight was significantly higher than that of other genotypes;the aboveground fresh weight, underground fresh weight, and root length of OE-CsHPL2 plants were significantly lower than those of other genotypes. There were significant differences in the metabolite content between OE-CsLOX6, OE-CsHPL2, and WT. OE-CsLOX6 and WT had 64 differential metabolites, of which 6 were upregulated and 58 were downregulated;OE-CsHPL2 and WT had 63 differential metabolites, of which 9 were upregulated and 54 were downregulated. Overexpression of CsLOX6 gene and CsHPL2 gene could enhance the resistance of Arabidopsis thaliana to salt stress and drought stress. Under salt stress and drought stress, compared with wild-type plants, the malondialdehyde content of OE-CsLOX6 and OE-CsHPL2 was significantly lower, and the degree of membrane peroxidation was lower,the activities of SOD, POD, and CAT enzymes were significantly higher than those of the wild type, which improved the antioxidant capacity of the plants and resulted in significantly better leaf growth compared to the wild type plants.
Key words: Arabidopsis thaliana; heterologous overexpression; CsLOX6 gene; CsHPL2 gene; salt tolerance; drought tolerance; stress
植物挥发性物质(Volatiles compounds,VOCs)来自一系列营养物质,包括氨基酸、脂肪酸、类胡萝卜素等,由初生代谢物和次生代谢物产生,通常是低分子的亲脂性化合物。氧脂素是脂肪酸氧化LOX-HPL途径的氧合衍生物,在许多情况下参与植物防御反应或作为基因表达的调节剂。有研究表明,青草味的C6醛类香气和花香味的C9醛类香气是构成黄瓜果实香气挥发物的主要成分[1],约占总挥发性物质的70%~95%。黄瓜中脂肪酸的氧化有两条途径,一条是生成茉莉酸的途径[2],另一条为体内仅存的短链醛类物质合成途径:LOX-HPL途径[3],即体内游离的α-亚麻酸和亚油酸在LOX酶的作用下加上分子氧转变成13-或9-氢过氧化物亚麻酸(HPOT)和氢过氧化物亚油酸(HPOD),然后通过脂氢过氧化物裂解酶(HPL)、烯醛异构酶转化成短链C6、C9醛类物质,从而形成令人倍感清新的芳香气味[4,5],如图1所示[6]。
拟南芥(Arabidopsis thaliana)中存在6个AtLOX基因,南瓜中存在18个CmLOX基因,黄瓜中存在23个CsLOX基因[7],表明在植物的生长发育过程中需要不同脂氧合酶基因的调控。利用拟南芥6个突变亚型的每种突变体系,发现LOX2参与植物挥发性物质的合成,与受伤的组织相比,在完好的组织中LOX2的活性被抑制,受伤时被激活[8]。拟南芥中4种13-LOXs都有助于受损叶片中茉莉酸盐的合成,其中LOX6对合成茉莉酸盐的相对贡献更高,合成的强度随离叶尖创口距离增加而增加,LOX6产物可能发挥着信号作用[9,10]。超表达番茄LOX基因可以提高番茄植株的茉莉酸含量,并且提高植株对病原菌、昆虫、高温和机械损伤的抵抗能力[11]。沉默番茄果实和叶片的LOXC基因,绿叶挥发性物质含量显著降低[12]。将柿子的DkLOX3基因转入番茄和拟南芥中,发现拟南芥转基因植株的耐干旱和耐盐能力有所增强[13]。
Matsui等[14]首先从辣椒中克隆得到HPL的cDNA全长序列后,人们相继从拟南芥、黄瓜、甜瓜、紫花苜蓿和马铃薯等多种植物中获得了HPL的cDNA,并且发现除黄瓜HPL基因和甜瓜HPL基因的编码产物同时具有9-HPL、13-HPL 催化功能外,其他已经克隆出HPL基因的编码产物只具有13-HPL功能[15]。刘苗苗等[16]发现13-CsHPL基因在受到非生物胁迫,如干旱、NaCl、甲基紫精、H2O2、损伤与外源激素MeJA、SA和灰霉侵染处理后其表达水平均显著升高。Halitschke等[17]发现HPL表达水平较低的转基因烟草在受到草食动物攻击后,相关防御基因的表达量降低。在缺少HPL基因的马铃薯植株中发现蚜虫的繁殖能力增加了2倍,表明HPL衍生物对蚜虫性能有负面影响[18]。
脂肪酸的氧化需要借助脂氧合酶(LOX)、脂氢过氧化物裂解酶(HPL)的活性,在遭受逆境时,植株体内脂肪酸衍生物含量会在短时间内迅速升高(如短链挥发物质醛醇等是主要的衍生物),相应的应激反应也不断发生来抵抗胁迫对自身的损害。外施LOX-HPL途径产物后,植物抵御逆境的能力得到提升,研究人员猜测这些组分可能直接参与逆境反应,也可能作为植株自身或相邻植株间传递信息的信号分子发生作用。根据前期试验结果在黄瓜的LOX-HPL氧化途径上筛选出CsLOX6基因和CsHPL2基因。在拟南芥上分别异源过表达这2个基因,同时对转基因植株和突变体植株进行表型观察和抗胁迫研究,探究这2个基因在抗逆过程及信号传导中的作用。
1 材料与方法
1.1 材料
野生型拟南芥材料为哥伦比亚Col-0(WT),转基因型拟南芥材料为实验室前期过表达所得的转基因植株(OE-CsLOX6、OE-CsHPL2),突变体型拟南芥材料(TB-Atlox5)购于Arashare(Non-profit Arabidopsis Share Center),检索网站为www. Ara share.cn。
1.2 方法
1.2.1 代谢组和转录组测定 代谢组和转录组材料为野生型哥伦比亚Col-0和过表达得到的转基因植株,保证相同的生长条件,待植株长至4周大小时,取叶片送至欧易生物科技有限公司进行代谢组和转录组测定。
1.2.2 生根分析 种植4种基因型(野生型1种、转基因型2种、突变体型1种)拟南芥,从中各选取长势、大小一致的植株,从穴盘中将拟南芥的根部取出(为减少对根部伤害可携带较多营养土),置于去离子水中轻柔洗净,重复多次,尽量避免对根部的损伤,洗净后统一置于吸水纸上吸除多余水分,留待后续的干、鲜重称量以及根长分析。
1.2.3 叶绿素含量的测定 取0.1 g拟南芥叶片,剪碎后放入50 mL离心管中,加入20 mL 95%的乙醇,避光放置40 h,充分提取叶绿素。用95%的乙醇调零,在波长655、649、470 nm下测定吸光度。
1.2.4 荧光实时定量PCR(qPCR)分析 用Trizol法提取总RNA后,利用反转录试剂盒合成cDNA的第一条链,作为qPCR的模板。qRT-PCR反应体系如表1所示,每个cDNA样品进行3次独立重复试验。体系配置好后加入96孔板中,采用iQ™5多重实时荧光定量PCR仪(Bio-Rad,美国)进行目的基因的扩增,反应程序:95 ℃预变性30 s,40个循环(95 ℃变性5 s,60 ℃退火30 s),71个循环(95 ℃变性5 s,60 ℃退火30 s)。以黄瓜的持家基因Actin作为内标,目的基因相对表达量的计算参照2-ΔΔCT法。
1.2.5 干旱和盐处理 采用生长箱培养拟南芥,待长到一定大小时定植到穴盘(规格为6 cm × 6 cm × 5.5 cm)。穴盘的每行种植不同的基因型(共4个),每个基因型取正常生长的拟南芥定植于穴盘中,每穴5株,保证相同的生长条件,待植株长至一定大小时,选取长势一致的植株进行处理,每个处理20株,3次重复。
干旱处理:对18 d苗龄的拟南芥进行处理,连续10 d不浇水,对照正常浇水,拍照留存并测定丙二醛含量。
盐处理:对8 d苗龄的拟南芥进行处理,每2 d浇1次400 mmol/L的NaCl,用水作为对照,持续18 d,拍照留存并测定丙二醛含量。
1.2.6 丙二醛含量的测定 丙二醛含量可反映植物脂类过氧化程度和遭受逆境伤害的程度,丙二醛含量的测定参照《植物生理学实验指导》[19]。
1.2.7 抗氧化酶活性的测定 采用苏州科铭生物技术有限公司的试剂盒测定SOD、POD、CAT活性,测定步骤参见说明书。
1.3 数据处理
采用 SPSS 16.0 软件进行数据处理及结果分析,采用Duncan氏新复极差法进行多重比较及差异显著性分析,采用Graphpad Prism 5.0软件作图。
2 结果与分析
2.1 不同基因型拟南芥生理指标的比较
为了比较不同基因型拟南芥的生理指标,将转基因型、野生型和突变体型拟南芥种子播种于培养基上,长至一定大小移栽入穴盘,每个穴盘为1个重复,植株间混合取样,至少设置3个重复。由图2可知,在拟南芥定植后的生长过程中OE-CsLOX6的长势明显优于其他基因型植株,生长旺盛,其他基因型长势无明显差别。进一步测定拟南芥的生理指标(图3、表2),OE-CsLOX6的地上部鲜重和根长均显著高于其他基因型植株,地下部鲜重明显高于其他基因型植株;TB-Atlox5的地上部鲜重和地下部鲜重均显著高于WT,但根长显著低于WT;OE-CsHPL2的地上部鲜重、地下部鲜重和根长明显低于其他基因型植株。叶片的叶绿素和类胡萝卜素含量在不同基因型植株间无显著差异。
2.2 拟南芥转基因植株的代谢组分析
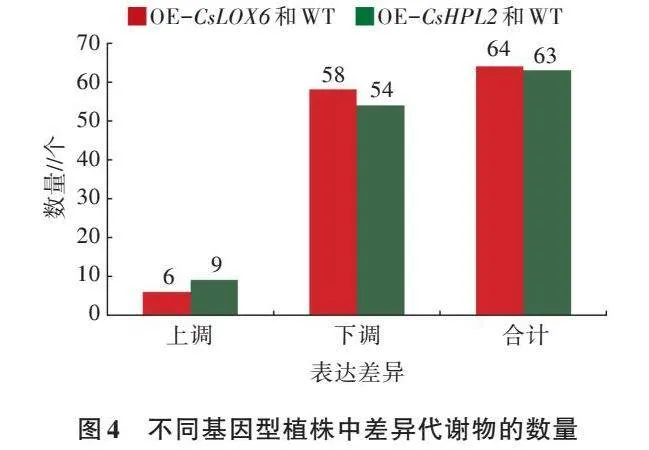
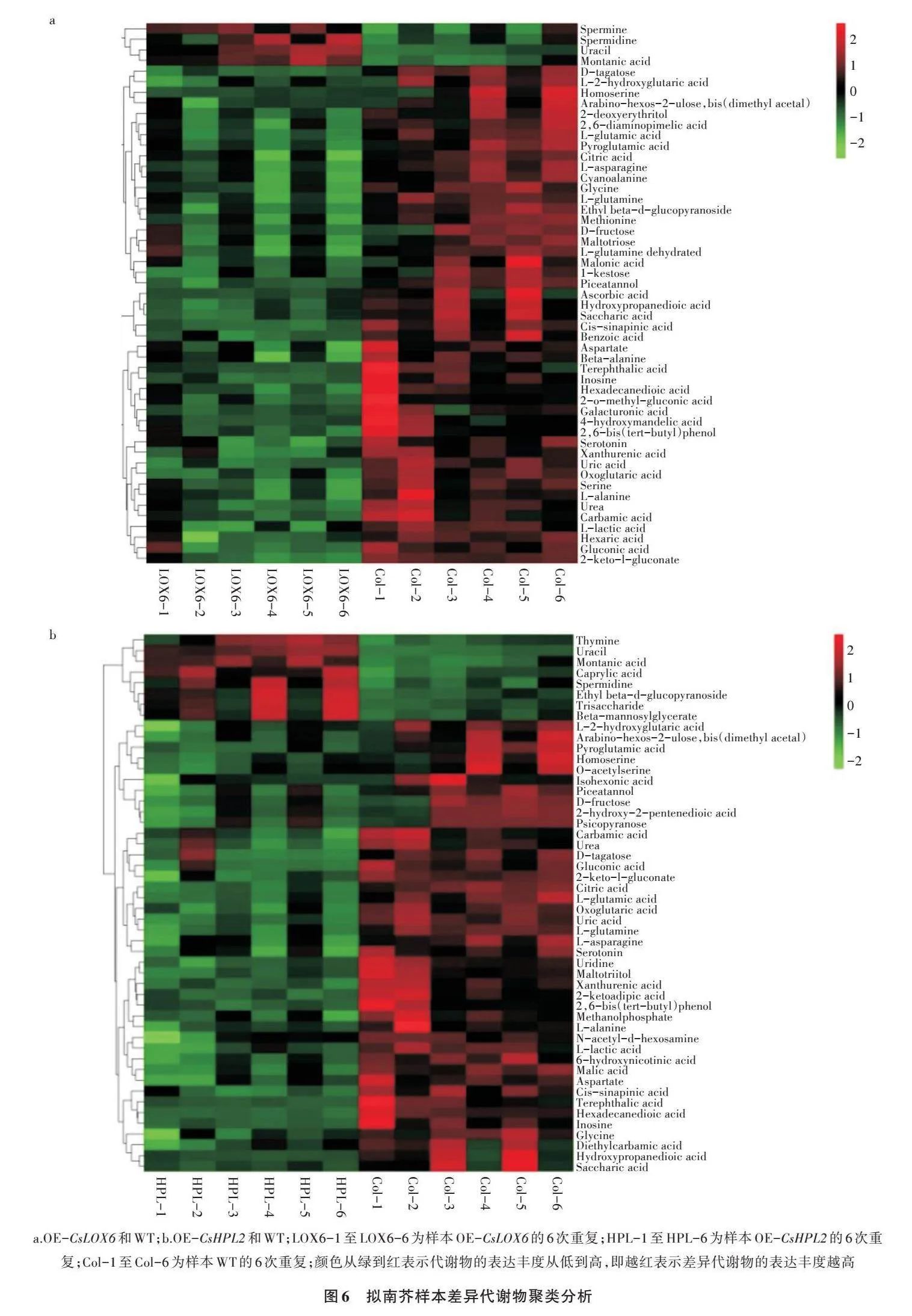
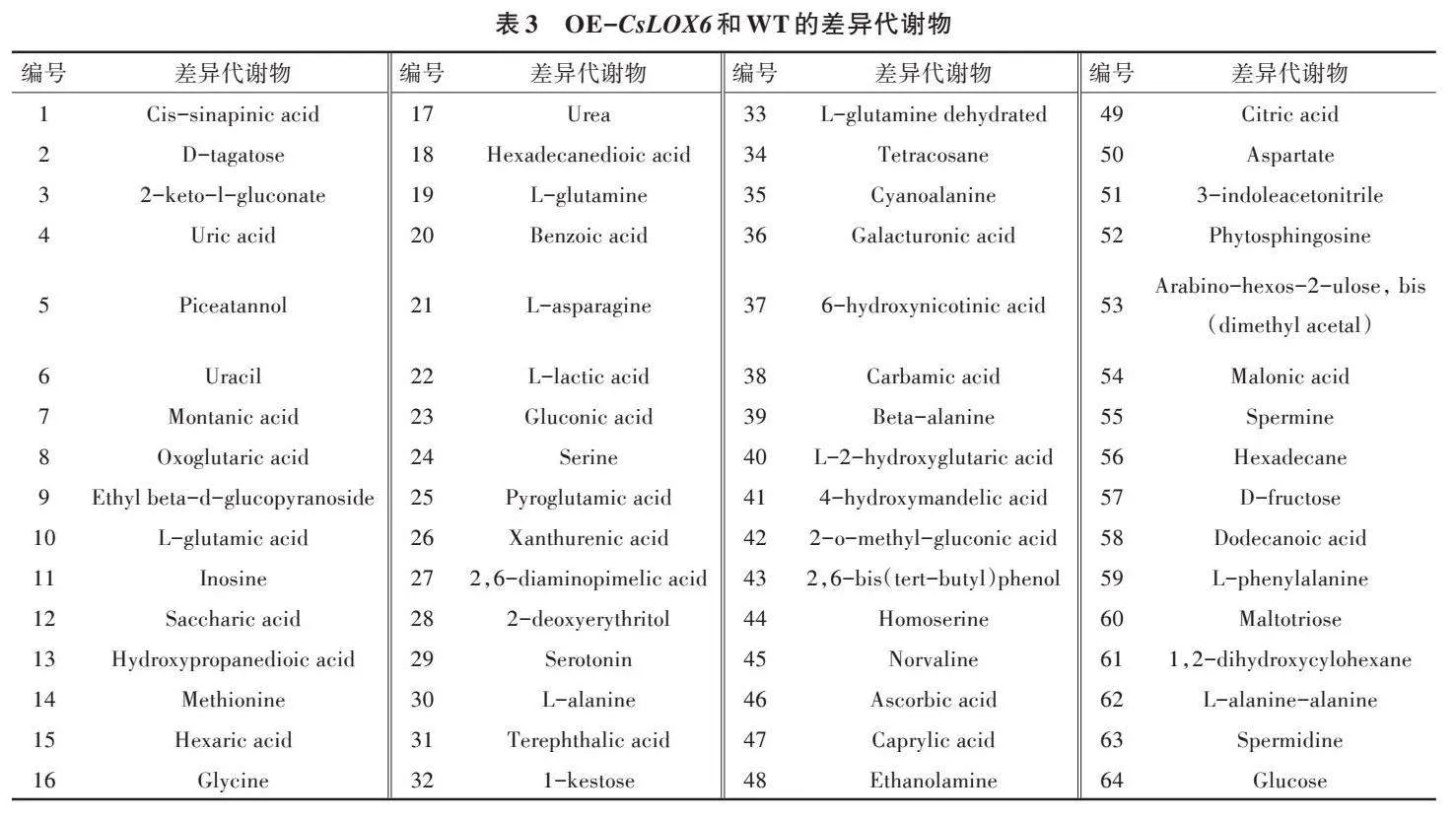
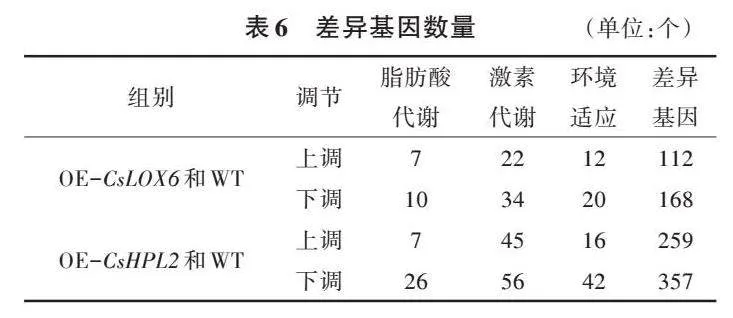
2.2.1 转基因植株代谢物变化 为了全面分析CsLOX6基因和CsHPL2基因对拟南芥叶片代谢水平的影响,选取WT、OE-CsLOX6、OE-CsHPL2,利用GC-MS对样品进行代谢组分析。采用多维分析和单维分析相结合的办法筛选组间差异代谢产物,筛选标准为OPLS-DA模型第一主成分的VIP>1,P<0.05。OE-CsLOX6、OE-CsHPL2与WT的代谢物含量存在较大差异(图4、表3、表4)。OE-CsLOX6和WT有64个差异代谢物,其中有6个上调,58个下调,6个上调的代谢物是辛酸、尿嘧啶、月桂酸、亚精胺、精胺、褐煤酸;58个下调的代谢物主要是氨基酸和碳水化合物,如L-丙氨酸、戊氨酸、甘氨酸、丝氨酸、天冬氨酸盐、β-丙氨酸、高丝氨酸、甲硫氨酸、焦谷氨酸、L-谷氨酸、L-苯丙氨酸、L-天冬酰胺、2,6-二氨基庚二酸、谷氨酰胺、糖二酸、葡糖酮、果糖、D-塔格糖、葡萄糖、半乳糖醛酸、乙基葡萄糖苷、麦芽三糖、葡糖酸、己糖二酸、蔗果三糖等。OE-CsHPL2和WT有63种差异代谢物,其中有9个上调,54个下调,9个上调的代谢物是辛酸、月桂酸、褐煤酸、尿嘧啶、胸腺嘧啶、喃葡萄糖、亚精胺、甘露糖基甘油酸、三糖;54个下调的代谢物主要是氨基酸和碳水化合物,如L-丙氨酸、戊氨酸、甘氨酸、乙酰丝氨酸、天冬氨酸盐、丙氨酸、高丝氨酸、焦谷氨酸、L-谷氨酸、L-苯丙氨酸、L-天冬酰胺、谷氨酰胺/葡萄糖-6-磷酸、糖二酸、葡糖酮、乙酰氨基己糖、乳糖醛酸、果糖、D-塔格糖、葡糖酸、己糖二酸等。
图5显示差异代谢物在野生型和转基因型植株中的大致变化。差异表达程度极显著的代谢物数量较少,在有显著差异的代谢物中,下调表达占大多数。为了更直观地展示不同样本之间的关系及代谢物在不同样本之间的表达差异,对所有显著差异的代谢物进行层次聚类(Hierarchical clustering),如图6所示,在未受胁迫处理时,与野生型植株相比,OE-CsLOX6和OE-CsHPL2中多数代谢物含量有所降低。
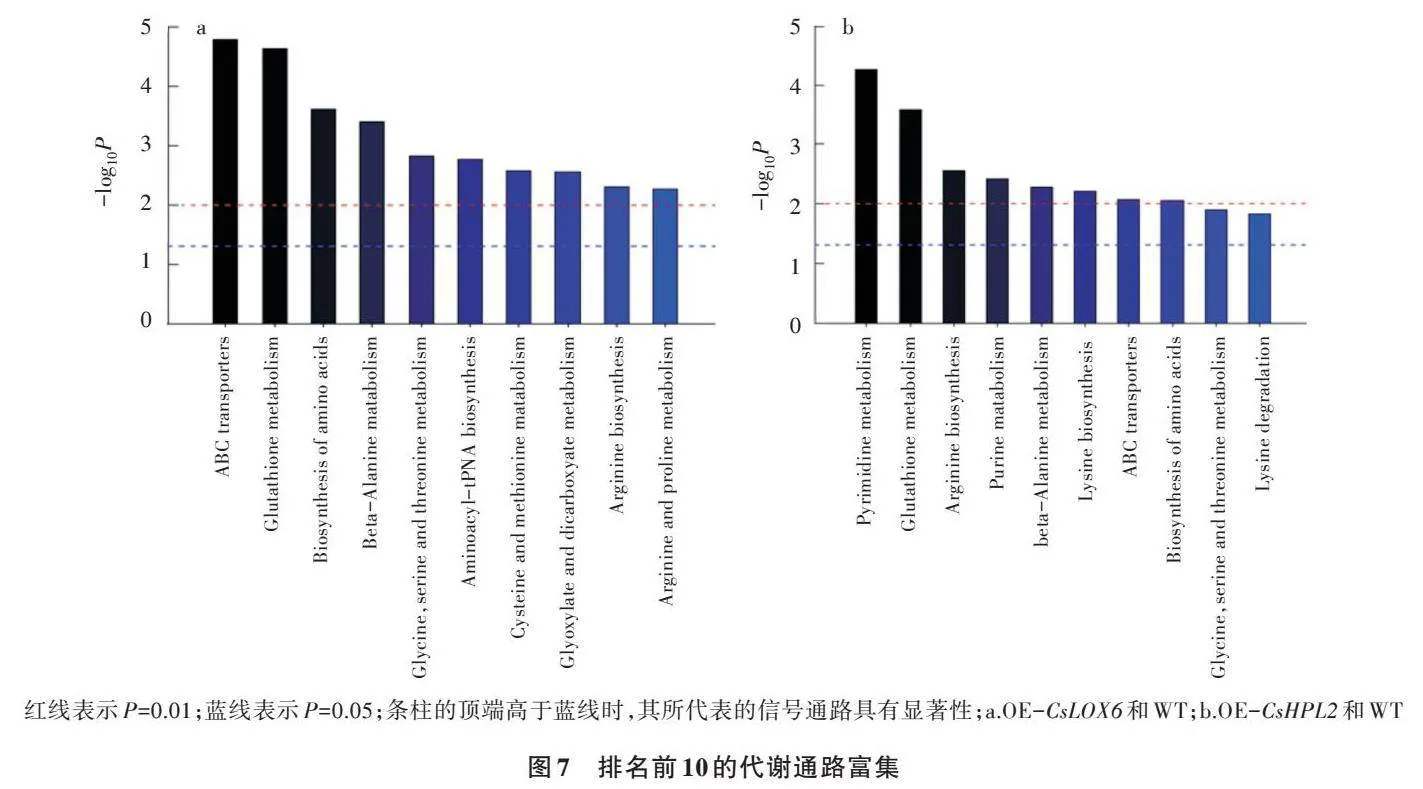
2.2.2 转基因植株代谢通路变化 通过对差异代谢物进行通路富集分析,有助于理解在差异样品中代谢途径变化机制。利用差异代谢物的KEGG ID进行通路富集分析,获得代谢通路富集结果。应用超几何检验,找出与整个背景相比在显著性差异表达代谢物中显著富集的pathway条目,其计算公式如下。
式中,P为该代谢通路的超几何检验;i为求和指标;N为代谢物总数;n为N中差异表达代谢物的数量;M为某特定pathway的代谢物数量;m为注释为某特定pathway的差异代谢物数量。以P≤0.05为阙值,满足此条件的pathway为在差异代谢物中显著富集的pathway。P越小,表示该代谢通路的差异性越显著。
由图7可知,CsLOX6基因过表达会使拟南芥体内代谢物发生显著变化,植株中ABC转运蛋白、谷胱甘肽代谢、氨基酸生物合成、β-丙氨酸代谢、甘氨酸丝氨酸和苏氨酸代谢、氨酰基−tRNA生物合成、半胱氨酸和蛋氨酸代谢、乙醛酸和二羧酸代谢、精氨酸生物合成、精氨酸和脯氨酸代谢等途径发生变化。而CsHPL2基因过表达会引起拟南芥植株中嘧啶代谢、谷胱甘肽代谢、精氨酸生物合成、嘌呤代谢、β-丙氨酸代谢、赖氨酸生物合成、ABC转运蛋白、氨基酸生物合成、甘氨酸丝氨酸和苏氨酸代谢、赖氨酸降解等途径发生变化。由此可见,过表达CsLOX6基因、CsHPL2基因的植株有相似的代谢通路,除影响一些转运蛋白外,主要与谷胱甘肽代谢和氨基酸的合成代谢等有关。
2.3 拟南芥转基因植株的转录组分析
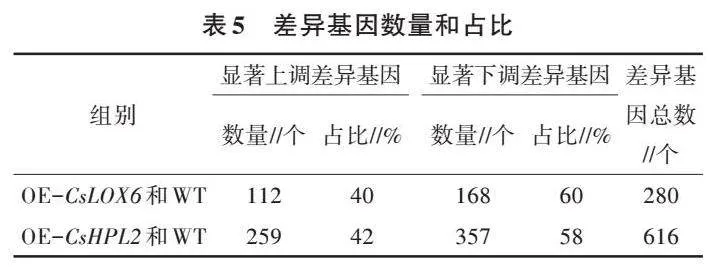
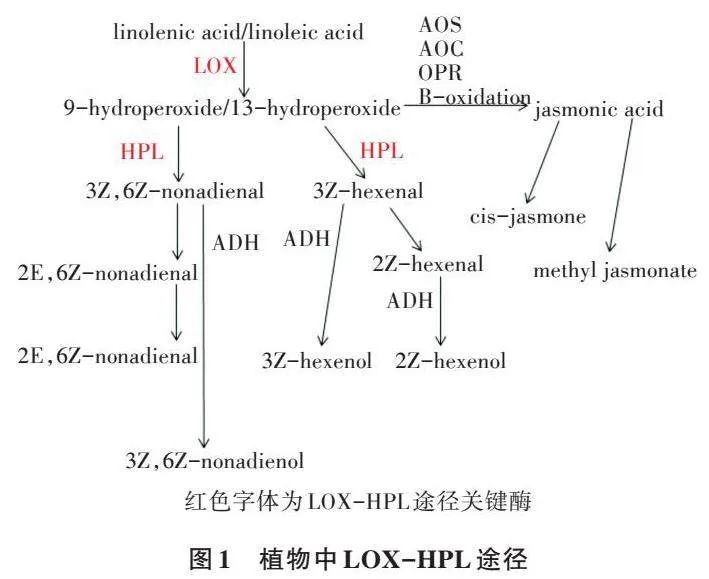
2.3.1 不同基因型植株差异基因表达分析 为了深入分析转基因型和野生型拟南芥在转录水平的差异,通过转录组比较野生型和转基因型植株叶片中的转录变化,利用DESeq软件,以Fold Change ≥ 2和P≤0.05为筛选标准,在野生型和转基因型植株中筛选差异基因。结果(表5、图8)表明,在OE-CsLOX6和WT中共发现280个差异基因,其中显著上调的差异基因有112个,显著下调的差异基因有168个。112个显著上调的差异基因中,有22个与植物激素信号转导途径相关,其中乙烯相关11个、生长素相关3个、脱落酸相关4个、茉莉酸相关4个,根据激素数量,受影响最显著的是乙烯,其次是脱落酸、茉莉酸、生长素;有7个基因与脂类代谢途径相关;14个基因与细胞壁生长相关;12个基因与非生物胁迫(干旱、盐)相关。
在OE-CsHPL2和WT中共发现616个差异基因,其中显著上调的差异基因有259个,显著下调的差异基因有357个。OE-CsLOX6和WT组、OE-CsHPL2和WT组之间的共有及特有的差异基因如图8所示,2组共有的差异基因有170个。259个显著上调的差异基因中,有45个与植物激素信号转导途径相关,其中乙烯相关16个,生长素相关8个,脱落酸相关12个,茉莉酸相关9个,根据激素数量,受影响最显著的是乙烯,其次是脱落酸、茉莉酸、生长素;有7个基因与脂类代谢途径相关;30个基因与细胞壁生长相关;16个基因与非生物胁迫(干旱、盐)相关。
2.3.2 不同基因型植株差异基因GO富集分析 为了进一步了解差异基因的功能,对得到的差异基因进行GO富集分析,对功能进行描述。在OE-CsLOX6和WT中发现280个差异基因,其功能主要与乙烯信号通路、茉莉酸响应、机械损伤、花粉发育、渗透响应、脂质分解、Karrikins信号通路、脱落酸信号通路、氨基酸代谢、细胞壁等有关(图9a)。在OE-CsHPL2和WT中有616个差异基因,其功能主要与机械损伤、茉莉酸响应、乙烯信号通路、Karrikins信号通路、胁迫应激反应(温度、渗透、盐胁迫)、脱落酸信号通路、氧化还原酶、细胞壁等有关(图9b)。
2.3.3 不同基因型对生长发育及环境适应相关基因的响应 LOX和HPL都是脂类氧化途径的关键酶,在芳香物质的合成消耗中扮演重要角色,乙烯、生长素在植株生长发育过程中发挥重要作用。由表6可知,2组的差异基因与脂肪酸代谢、激素代谢(激素合成、运输及信号转导)、环境适应有关,其中激素主要为乙烯,环境适应主要为盐和干旱。基因过表达会影响转基因型植株体内脂肪酸和激素的代谢过程,在正常生长时,有些与环境适应相关的基因就已经发生显著变化,这些基因可能在胁迫过程中发挥关键作用。
2.4 干旱和盐胁迫对过表达拟南芥的影响
为了验证不同基因型拟南芥对非生物胁迫的抵抗能力,本研究进行了干旱和盐胁迫处理,验证过表达CsLOX6和CsHPL2是否能促进拟南芥对干旱和盐胁迫的抗性,如图10所示。
拟南芥幼苗生长的影响
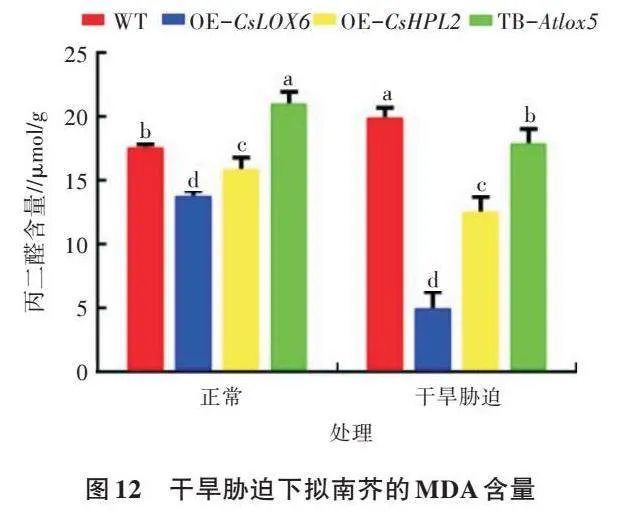
2.4.1 过表达CsLOX6和CsHPL2对拟南芥细胞膜损伤的影响 植物器官衰老或在逆境下遭受伤害,往往发生膜脂过氧化作用,丙二醛(MDA)是膜脂过氧化的最终产物,其含量可以反映植物遭受逆境伤害的程度。可通过MDA了解膜脂过氧化的程度,以间接测定膜系统受损程度以及植物的抗逆性。由图11、图12可知,在正常生长条件下,不同基因型植株的丙二醛含量表现出明显差异,TB-Atlox5的丙二醛含量最高,WT次之,OE-CsLOX6和OE-CsHPL2的含量较低。在盐胁迫下,拟南芥生长受到严重的抑制,TB-Atlox5的丙二醛含量明显高于其他基因型植株,受到的膜损伤最大,WT次之,OE-CsLOX6和OE-CsHPL2受到的膜损伤较小。在干旱胁迫下,WT的叶片受损严重,叶片卷曲且长势较弱,OE-CsLOX6的长势要优于其他基因型植株。
2.4.2 过表达CsLOX6和CsHPL2对拟南芥抗氧化酶活性的影响 SOD、POD、CAT在清除活性氧、缓解逆境胁迫方面发挥重要作用。不同基因型拟南芥抗氧化酶活性测定结果(图13)显示,在正常条件下,不同基因型拟南芥的SOD活性和POD活性均差异不显著,OE-CsLOX6、OE-CsHPL2的CAT活性差异不显著,但均显著高于野生型和突变体型。盐胁迫下,所有株系的抗氧化酶活性与对照相比均明显上升,OE-CsLOX6上升最明显;OE-CsHPL2的SOD活性和CAT活性均显著高于WT,OE-CsHPL2的POD活性与WT无显著差异;TB-Atlox5的SOD活性和CAT活性显著高于WT,TB-Atlox5的POD活性显著低于WT。干旱胁迫下,OE-CsLOX6、OE-CsHPL2和TB-Atlox5的酶活性均显著高于WT;OE-CsLOX6的酶活性最高,OE-CsLOX6的SOD活性和POD活性显著高于TB-Atlox5;OE-CsHPL2与TB-Atlox5的酶活性无显著差异。
3 讨论
对过表达转基因型植株、突变体型植株和野生型植株进行代谢组和转录组测序,通过比较分析,过表达CsLOX6基因、CsHPL2基因的植株有相似的代谢通路,与植物信号转导、脂肪酸合成和转运、氨基酸代谢、抵御逆境有着密切关系。有机酸和氨基酸的积累对植物有重要影响,可以提高植物对干旱胁迫的耐受性[20]。氨基酸通过一些代谢途径比如脱氨基、脱羧基可以转变为糖或酮等物质,如丙氨酸、苏氨酸、甘氨酸、丝氨酸是丙酮酸的中间产物,组氨酸、精氨酸、脯氨酸等是α-酮戊二酸的中间产物,苯丙氨酸、天冬氨酸、酪氨酸是延胡索酸的中间产物。氨基酸是三羧酸循环中多种物质的前体,转基因型拟南芥与野生型相比,多数代谢物含量有所降低。β氧化是脂肪酸在一系列酶的作用下,生成含有两个碳原子的乙酰辅酶A,是脂肪酸分解的主要方式,在此过程中游离出的乙酰CoA会经三羧酸循环而氧化[21]。Karrikins与植物激素独脚金内酯在结构、信号传导通路等方面具有非常高的相似性,除促进种子萌发外,还具有调控植物光形态建成、叶片发生过程等生物学功能[22]。很多基因响应了Karrikins信号通路,可能与转基因植株长势旺盛有关。过表达脂氧合酶基因和脂氢过氧化物酶基因与体内各代谢途径的关系还有待于进一步验证。
转基因植株在耐盐和耐旱方面表现出较好的耐受力,OE-CsLOX6的表现更好,而TB-Atlox5和WT表现较差。过表达13-脂氧合酶基因TomloxD的番茄植株中脂氧合酶活性和内源激素茉莉酸含量增加,提高了对病原菌和高温的耐受性[23]。陈璐等[24]对野生型、 AtLOX1的突变体型拟南芥施用0.3 mol/L的甘露醇模拟干旱,发现干旱胁迫能显著提高拟南芥AtLOX1基因的表达并促进种子的萌发。在拟南芥中过表达辣椒CaLOX1去探究CaLOX1在渗透、干旱和高盐度条件下的功能,干旱和高盐度处理辣椒叶片后,转基因植株表现出更强的耐受性,H2O2积累更少,ABA相关标记基因表达水平升高,同时,种子萌发和幼苗的发育对逆境的耐受性也更强,表明CaLOX1通过调控脂质氧化活性、过氧化氢含量、脱落酸含量等代谢途径来缓解胁迫对植株的伤害[25],转基因植株的丙二醛含量低,受到的胁迫损伤小,体内酶促清除系统被激活,表明过表达CsLOX6基因和CsHPL2基因能在一定程度上降低膜损伤,提高植株在逆境胁迫下的耐受力,而TB-Atlox5在干旱胁迫下表现出比野生型植株更强的耐受性,与OE-CsHPL2的表现相似,由于拟南芥含有多个脂氧合酶基因,因此推测Atlox5缺失后引起其他同源基因表达量的变化,发挥了Atlox5原有的功能。目前对于脂氧合酶基因的研究大多侧重在产生茉莉酸的LOX-AOS通路上,而脂氢过氧化物裂解酶基因的研究集中在增加植物的挥发性气体方面,如花卉类[26]、生菜[27]、瓜类[16]等对气味、品质要求较高的植物。
在拟南芥定植后的生长过程中OE-CsLOX6的长势明显优于其他基因型植株,生长旺盛,其他基因型长势无明显差别。进一步测定拟南芥的生理指标,OE-CsLOX6的地上部鲜重和根长均显著高于其他基因型植株,地下部鲜重明显高于其他基因型植株;TB-Atlox5的地上部鲜重和地下部鲜重均显著高于WT,但根长显著低于WT;OE-CsHPL2的地上部鲜重、地下部鲜重和根长明显低于其他基因型植株。叶片的叶绿素和类胡萝卜素含量在不同基因型植株间无显著差异。
4 小结
在拟南芥中异源过表达CsLOX6基因和CsHPL2基因对植株生长以及对干旱和盐胁迫抗性具有明显影响。OE-CsLOX6的地上部鲜重和根长均显著高于其他基因型植株,地下部鲜重明显高于其他基因型植株;OE-CsHPL2的地上部鲜重、地下部鲜重和根长明显低于其他基因型植株。OE-CsLOX6、OE-CsHPL2与WT的代谢物含量存在较大差异,OE-CsLOX6和WT有64个差异代谢物,其中有6个上调,58个下调;OE-CsHPL2和WT有63个差异代谢物,其中有9个上调,54个下调。过表达CsLOX6基因和CsHPL2基因可以提高拟南芥对盐胁迫和干旱胁迫的抗性。在盐胁迫和干旱胁迫下,OE-CsLOX6、OE-CsHPL2的丙二醛含量要显著低于野生型植株,膜质过氧化程度低,SOD、POD和CAT活性要明显高于野生型,提高了植株的抗氧化能力,叶片长势明显优于野生型植株。
参考文献:
[1] LIGOR T, BUSZEWSKI B. Single-drop microextraction and gas chromatography-mass spectrometry for the determination of volatile aldehydes in fresh cucumbers[J]. Analytical and bioanalytical chemistry, 2008, 391(6): 2283-2289.
[2] DUDAREVA N, MURFITT L M, MANN C J, et al. Developmental regulation of methyl benzoate biosynthesis and emission in snapdragon flowers[J]. Plant cell, 2000, 12(6): 949-961.
[3] SCALA A,ALLMANN S,MIRABELLA R,et al. Green leaf volatiles:A plant’s multifunctional weapon against herbivores and pathogens[J]. International journal of molecular sciences, 2013, 14(9): 17781-17811.
[4] THANH H T, VERGOIGNAN C, CACHON R, et al. Recombinant hydroperoxide lyase for the production of aroma compounds: Effect of substrate on the yeast yarrowia lipolytica[J]. Journal of molecular catalysis enzymatic, 2008, 52(3): 146-152.
[5] HADI MA, ZHANG F J, WU F F, et al. Advances in fruit aroma volatile research[J]. Molecules, 2013, 18:8200-8229.
[6] MATSUI K, MIYAHARA C, WILKINSON J, et al. Fatty acid hydroperoxide lyase in tomato fruits: Cloning and properties of a recombinant enzyme expressed in Escherichia coli[J]. Bioscience biotechnology and biochemistry, 2000, 64(6): 1189-1196.
[7] HUANG S W,ZHANG Z H,GU X F,et al.The genome of the cucumber, Cucumis sativus L[J]. Nature genetics,2009,41:1275-1281.
[8] YAMAUCHI Y, KUNISHIMA M, MIZUTANI M, et al. Reactive short-chain leaf volatiles act as powerful inducers of abiotic stress-related gene expression[J]. Scientific reports, 2015, 5(1):8030.
[9] CHAUVIN A, CALDELARI D, WOLFENDER J, et al. Four 13-lipoxygenases contribute to rapid jasmonate synthesis in wounded Arabidopsis thaliana leaves: A role for lipoxygenase 6 in responses to long-distance wound signals[J]. New phytologist,2013,197(2): 566-575.
[10] 丁 辉. 拟南芥At LOX3基因在非生物胁迫中的功能研究[D]. 广州:华南师范大学, 2014.
[11] FARAHANI A S,TAGHAVI S M. Profiling expression of lipoxygenase in cucumber during compatible and incompatible plant-pathogen interactions[J]. Physiology and molecular biology of plants, 2016, 22(1):175-177.
[12] CHEN G, HACKETT R, WALKER D, et al. Identification of a specific isoform of tomato lipoxygenase (TomloxC) involved in the generation of fatty acid-derived flavor compounds[J]. Plant physiology, 2004, 136(1): 2641-2651.
[13] HOU Y, MENG K, HAN Y, et al. The persimmon 9-lipoxygenase gene DkLOX3 plays positive roles in both promoting senescence and enhancing tolerance to abiotic stress[J]. Frontiers in plant science, 2015, 6:1073.
[14] MATSUI K, SHIBUTANI M, HASE T, et al. Bell pepper fruit fatty acid hydroperoxide lyase is a cytochrome P450 (CYP74B)[J]. Febs letters, 1996, 394(1):1-24.
[15] 赵 凌,沈文飚, 翟虎渠, 等. 植物的脂氢过氧化物裂解酶[J]. 植物生理学通报, 2004(2):135-140.
[16] 刘苗苗,张然然,魏文霞,等.黄瓜脂氢过氧化物裂解酶基因13-CsHPL的克隆及其表达分析[J]. 分子植物育种,2018, 16(2VBJs6Av2HJCT48/4DQ1ZKSwndYcWaaFHEVuOARJFXcw=1):6907-6914.
[17] HALITSCHKE R, ZIEGLER J, KEINANEN M, et al. Silencing of hydroperoxide lyase and allene oxide synthase reveals substrate and defense signaling crosstalk in Nicotiana attenuata[J]. Plant journal, 2004, 40: 35-46.
[18] VANCANNEYT G, SANZ C, FARMAKI T, et al. Hydroperoxide lyase depletion in transgenic potato plants leads to an increase in aphid performance[J]. Proceedings of the national academy of sciences, 2001, 98(14):8139-8144.
[19] 赵世杰, 苍 晶. 植物生理学实验指导[M]. 北京:中国农业出版社, 2016
[20] CATOLA S, MARINO G, EMILIANI G, et al. Physiological and metabolomic analysis of Punica granatum (L.) under drought stress[J]. Planta, 2016, 243(2): 441-449.
[21] 石如玲, 姜玲玲. 过氧化物酶体脂肪酸β氧化[J]. 中国生物化学与分子生物学报, 2009, 25(1):12-16.
[22] 罗晓峰, 戚 颖, 孟永杰, 等. Karrikins信号传导通路及功能研究进展[J]. 遗传, 2016, 38(1): 52-61.
[23] HU T, ZENG H, HU Z, et al. Overexpression of the tomato 13-lipoxygenase gene TomloxD increases generation of endogenous jasmonic acid and resistance to cladosporium fulvumand high temperature[J]. Plant molecular biology reporter,2013,31(5):1141-1149.
[24] 陈 璐, 刘 博, 安炎黄,等. 干旱胁迫下磷脂酶Dδ和9-脂氧合酶对拟南芥茉莉酸合成及种子萌发的影响[J]. 生态学杂志, 2018, 37(9):2627-2636.
[25] WOO L C,SANG WOOK H,SUN H I,et al. The pepper lipoxygenase CaLOX1 plays a role in osmotic,drought and high salinity stress response[J]. Plant and cell physiology,2015,56(5):930-942.
[26] 郭凤芝,许颖妍,熊 青,等. 玳玳花瓣脂氢过氧化物裂解酶基因cDNA的克隆及原核表达[J]. 热带作物学报, 2017,38(4):673-681.
[27] 谢鑫鑫,吴卫东,林碧英,等. 脂氢过氧化物裂解酶基因对生菜遗传转化的研究[J]. 热带作物学报, 2016, 37(5):856-861.
收稿日期:2023-11-05
基金项目:国家大宗蔬菜产业技术体系项目(CARS-23-B07);国家自然科学基金项目(31672203);国家重点研发计划支持项目(2023YFD2300703);现代农业产业技术体系北京市创新团队项目(BAIC-2024)
作者简介:王 聪(1995-),女,河北石家庄人,硕士,主要从事蔬菜栽培与生理研究,(电话)18803219590(电子信箱)wangcong333333@163.com;通信作者,蒋卫杰(1965-),男,北京人,研究员,主要从事蔬菜栽培生理和无土栽培研究,(电子信箱)jiangweijie@caas.cn。

