饲料添加牡丹籽壳对黄颡鱼肝脏组织学、抗氧化酶活性和非特异性免疫的影响



摘要:为探究饲料中添加牡丹籽壳对黄颡鱼(Pelteobagrus fulvidraco)抗氧化能力和非特异性免疫的影响,以饲喂商品饲料的黄颡鱼为空白对照组,以饲喂含有1%和5%牡丹籽油的再制商品饲料的黄颡鱼为阳性对照组,以饲喂含有1%和5%牡丹籽壳的再制商品饲料的黄颡鱼为试验组,养殖时间21 d。测定黄颡鱼血清和肝脏抗氧化酶活性、血清溶菌酶活性及补体C3含量,并在光学显微镜下观察黄颡鱼肝脏组织形态学结构。结果表明,与对照组相比,饲料添加1%牡丹籽壳显著提高黄颡鱼血清中超氧化物歧化酶活性(P<0.001)和补体C3(P<0.05)含量,黄颡鱼肝脏中超氧化物歧化酶和过氧化氢酶活性显著升高(P<0.001),指示肝脏氧化损伤程度的丙二醛含量显著降低(P<0.001),黄颡鱼肝脏形态结构完好,与对照组无明显差异。牡丹籽壳提高黄颡鱼抗氧化能力和非特异性免疫的效果在5%剂量添加组更加显著,与空白对照组相比,血清超氧化物歧化酶、肝脏超氧化物歧化酶和过氧化氢酶活性分别提高了100%(P<0.001)、245%(P<0.001)和176%(P<0.001),血清溶菌酶活性和补体C3含量分别提高了36%(P<0.001)和33%(P<0.01)。与牡丹籽油相比,饲料添加牡丹籽壳能达到与其相同的保健效果。饲料添加牡丹籽壳能有效提高黄颡鱼抗氧化能力和非特异性免疫,适宜添加量为1%~5%。
关键词:牡丹籽壳;牡丹籽油;饲料添加剂;抗氧化;非特异性免疫;黄颡鱼(Pelteobagrus fulvidraco)
中图分类号:S963.73 文献标识码:A
文章编号:0439-8114(2024)10-0124-07
DOI:10.14088/j.cnki.issn0439-8114.2024.10.023 开放科学(资源服务)标识码(OSID):
Abstract: To investigate the effects of dietary peony seed shell on fish oxidation resistance and nonspecific immunity, yellow catfish were fed with 1% or 5% peony seed shell (commercial feed containing 1% or 5% peony seed shell) for 3 weeks. Meanwhile, fish fed with commercial feed only were used as the blank control group, and fish fed with 1% or 5% peony seed oil were used as positive control group. The results showed that, compared with blank control group, the activity of superoxide dismutase (P<0.001) and the content of complement C3 (P<0.05) in serum of fish fed with 1% peony seed shell increased significantly. Liver superoxide dismutase and catalase activities were higher than those of the blank control group (P<0.001), and liver malondialdehyde content decreased significantly (P<0.001). Liver histomorphology of yellow catfish was normal and intact in both the blank control group and 1% peony seed shell group, and there was no obvious difference between the two groups. Peony seed shell had a dose-dependent positive effect on promoting the antioxidant capacity and nonspecific immunity in yellow catfish, all the test indexes in the 5% peony seed shell group showed a remarkably better change. Compared with blank control group, serum superoxide dismutase, liver superoxide dismutase and catalase activities in 5% peony seed shell group increased by 100% (P<0.001), 245% (P<0.001) and 176% (P<0.001), respectively. Serum lysozyme activity and complement C3 content increased by 36% (P<0.001) and 33% (P<0.01), respectively. In both dose groups, peony seed shell showed similar positive effects on yellow catfish compared to peony seed oil, the suitable addition amount was 1%~5%.
Key words: peony seed shell; peony seed oil; feed additive; antioxidation; nonspecific immunity; Pelteobagrus fulvidraco
油用牡丹是一种新兴的木本油料作物。牡丹籽油含有丰富的不饱和脂肪酸[1-3],具有抗氧化[4-7]、保护肝脏[8,9]和增强免疫力[10-15]等功效。牡丹籽壳是牡丹籽榨油前脱壳过程产生的副产物。随着牡丹籽油产量增加,数以万吨计的牡丹籽壳缺乏合理开发和利用,造成环境污染,牡丹籽壳的资源化利用刻不容缓。研究表明,牡丹籽壳含有丰富的低聚芪类化合物——白藜芦醇[16,17],是一种高生物活性的植物抗毒素,具有抗氧化、抗炎性、防止神经退化、抗癌及预防衰老等多种保健功效[18]。在药物引起动物疾病模型中,白藜芦醇能显著提高受试动物抗氧化酶基因mRNA水平,提高抗氧化酶活性和谷胱甘肽含量,降低活性氧、丙二醛和促炎性细胞因子水平[19,20]。与哺乳动物类似,白藜芦醇能提高鱼类抗氧化能力,抑制促炎性基因表达,同时促进鱼类生长,提高鱼类天然和适应性免疫力[21-23]。以富含白藜芦醇的牡丹籽壳作为饲料添加剂具有广阔的市场前景,是提高油用牡丹资源利用率的有效途径。
黄颡鱼(Pelteobagrus fulvidraco)属于鲇形目鲿科,是中国重要的淡水经济鱼类。据《2023中国渔业统计年鉴》统计,2022年全国黄颡鱼养殖产量达60.0万t[24]。随着黄颡鱼养殖规模日益扩大,细菌性疾病频繁暴发,传统的抗生素治疗存在残留和耐药风险,而疫苗预防存在操作复杂和特异性强的缺点。2020年中国推出饲料中全面禁止添加抗生素政策,“绿色无抗养殖”已成为行业大趋势,研究和使用有效的“替抗”饲料添加剂是养殖行业关注的焦点和热点。采用营养调控方式,在饲料中添加有利于黄颡鱼免疫力的成分,提高鱼体抗氧化能力,增强抗病力,是预防黄颡鱼病害发生的有效措施。例如,饲料添加乌拉尔甘草提取物[25]或其他复方中药[26],可以有效提高柱状黄杆菌和嗜水气单胞菌感染后黄颡鱼的存活率,增加血清抗氧化酶和溶菌酶活性、IgM含量,抑制促炎因子的表达。饲料添加维生素D3能提高黄颡鱼对鲶爱德华氏菌的抵抗力,改善细菌感染引起的肾脏损伤,抑制NF-κB激活和促炎性基因的表达[27,28]。饲料中同时添加虾青素和大黄素时,黄颡鱼的抗氧化能力和抗逆性显著增强,在奇异变形杆菌感染后死亡率也明显降低[29]。随着牡丹籽油产业兴起,牡丹籽壳的产量不断增加,又因其含有丰富的生物活性物质白藜芦醇,牡丹籽壳作为经济、绿色、高效的饲料添加剂具有巨大的市场潜力。
黄颡f04c685b3973ec02c34afa577d458ffb鱼肉质细嫩、味道鲜美,是中国重要的淡水名特优经济鱼类。在养殖过程中,黄颡鱼易受多种水产病原细菌感染,发病快、死亡率高,给养殖业带来巨大经济损失,寻找提高黄颡鱼免疫力和抗病力的有效方法迫在眉睫。本研究以黄颡鱼为对象,在饲料中添加不同比例的牡丹籽壳超微粉,研究牡丹籽壳对黄颡鱼肝脏组织结构,血清、肝脏抗氧化酶活性和非特异性免疫的影响,以期为牡丹籽壳作为“替抗”添加剂在水产饲料中的应用提供理论依据。同时,牡丹籽油富含不饱和脂肪酸,营养价值极高,但牡丹籽油提取和纯化步骤复杂,价格昂贵,限制了其作为饲料添加剂的可能性。同时以添加牡丹籽油作为对照,比较牡丹籽油和牡丹籽壳对黄颡鱼影响的差异,为评估牡丹籽壳作为饲料添加剂提供依据。
1 材料与方法
1.1 试验材料
黄颡鱼商品饲料购自武汉大北农饲料科技有限公司。超氧化物歧化酶、过氧化氢酶、溶菌酶、补体C3和丙二醛(MDA)测定试剂盒均购自南京建成生物工程研究所。
黄颡鱼商品饲料经粉碎机(DF-35,温岭市林大机械有限公司)粉碎后,过20目筛网,选取颗粒均匀、无结块的粒质饲料与不同添加剂逐级混合,利用双螺杆制粒机(SLR-45,中国水产科学院渔业机械研究所)挤压成粒径2.0 mm的颗粒饲料,60 ℃烘干2 h,冷却后置于-20 ℃保存备用。
牡丹籽油和牡丹籽壳均由武汉市农业科学院林业果树研究所王湛昌高级工程师提供。牡丹籽壳由武汉中博水产生物技术有限公司粉碎为200目超微粉。牡丹籽油和牡丹籽壳超微粉室温储存于阴凉、干燥、通风处。
1.2 试验鱼
黄颡鱼来自湖北黄优源渔业发展有限公司,试验前将鱼在1×103 L塑料鱼缸里驯养两周,每日用商品饲料投喂两次(9:00和17:00定时投喂),使鱼适应养殖环境和饲料。试验开始时将试验鱼饥饿处理24 h。随机选取100尾规格均匀、健康活泼的鱼,放入各个鱼缸(体积1×102 L),共计5组,分别为对照组、1%牡丹籽油组、1%牡丹籽壳组、5%牡丹籽油组和5%牡丹籽壳组,每组20尾鱼。
1.3 试验设计
试验在武汉市农业科学院水产研究所中心实验室养殖系统内进行。周期设置为21 d,每7 d换水1次,采取自然光照,水温14~16 ℃。每日投喂两次饲料(9:00和17:00),采用饱食投喂策略。试验结束后,试验鱼禁食12 h后采样。
1.4 血清抗氧化和非特异性免疫指标测定
每组随机选取3尾黄颡鱼,采用1 mL注射器进行尾静脉取血。血液在室温静置2 h后,4 ℃静置过夜。第二天,4 ℃下3 500 r/min离心10 min,收集上清作为血清样品,样品冻存于-80 ℃。采用黄嘌呤氧化酶法测定血清总超氧化物酶活性,采用比浊法测定血清溶菌酶活性,采用免疫浊度法测定血清补体C3含量。
1.5 肝脏组织结构观察
每组随机选取5尾黄颡鱼,从体侧线处解剖鱼体,取小块肝脏组织立即置入1.5 mL 4%多聚甲醛溶液,室温固定24 h以上。在通风橱内将固定好的组织修切平整,放于脱水盒内。组织块经梯度乙醇-二甲苯脱水、石蜡包埋,切成4 μm薄片,60 ℃烘箱烘干。切片经二甲苯-梯度乙醇-水洗涤后,苏木素染细胞核、伊红染细胞质,最后将切片经梯度乙醇-二甲苯脱水和透明,中性树胶封片。使用Pannoramic midi型全自动数字切片扫描系统拍摄肝脏组织。
1.6 肝脏抗氧化指标测定
肝脏切片样品取样结束后,剩余肝脏组织立即置于1.5 mL离心管液氮中速冻,2 h后转入-80 ℃保存。采用黄嘌呤氧化酶法测定肝脏总超氧化物酶活性,采用钼酸铵法测定肝脏过氧化氢酶活性,采用TBA(硫代巴比妥酸)法测定肝脏MDA含量。
1.7 数据分析
采用SPSS 20.0统计软件处理数据。所有数值均以“平均值±标准差”表示,组间比较采用独立样本t检验,P<0.05代表具有显著性差异,P<0.01代表具有极显著差异。
2 结果与分析
2.1 饲料添加牡丹籽壳对黄颡鱼血清抗氧化和非特异性免疫指标的影响
含有牡丹籽油或牡丹籽壳的饲料饲喂黄颡鱼21 d后,采用尾静脉取血并收集血清,检测血清超氧化物歧化酶和溶菌酶活性及补体C3含量。结果表明,当添加量为1%时,牡丹籽油组和牡丹籽壳组超氧化物歧化酶活性分别为对照组的1.83倍和1.46倍(图1A,P<0.001)。牡丹籽油和牡丹籽壳以剂量依赖方式促进超氧化物歧化酶活性(图1A,P<0.01),当添加量为5%时,牡丹籽油组和牡丹籽壳组黄颡鱼血清超氧化物歧化酶活性分别为对照组的2.70倍和2.02倍(图1A,P<0.001)。在1%和5%添加剂量下,牡丹籽油提高血清超氧化物歧化酶活性的效果优于牡丹籽壳(图1A,P<0.01)。
图1B展示了饲喂含有牡丹籽油或牡丹籽壳饲料后黄颡鱼血清溶菌酶活性的变化趋势。1%剂量添加组,牡丹籽油和牡丹籽壳略微提高了溶菌酶活性,但差异不具有统计学意义(P>0.05)。当添加剂量为5%时,与对照组相比,牡丹籽油组和牡丹籽壳组的黄颡鱼血清溶菌酶活性显著增加,分别为对照组的1.24倍(P<0.01)和1.36倍(P<0.001),牡丹籽壳促进溶菌酶活性的效果优于牡丹籽油(P<0.05)。
饲料中添加牡丹籽油或牡丹籽壳也能有效提高黄颡鱼血清补体C3的含量。如图1C所示,当添加比例为1%时,牡丹籽油组和牡丹籽壳组黄颡鱼血清补体C3含量分别为对照组的1.11倍和1.15倍(P<0.05);当添加比例为5%时,牡丹籽油组和牡丹籽壳组补体C3含量分别为对照组的1.27倍和1.33倍(P<0.01)。牡丹籽油和牡丹籽壳显著提高血清补体C3含量的效果与添加量呈正比,当添加量一致时,两者提高补体C3含量的效果没有显著性差异(P>0.05)。
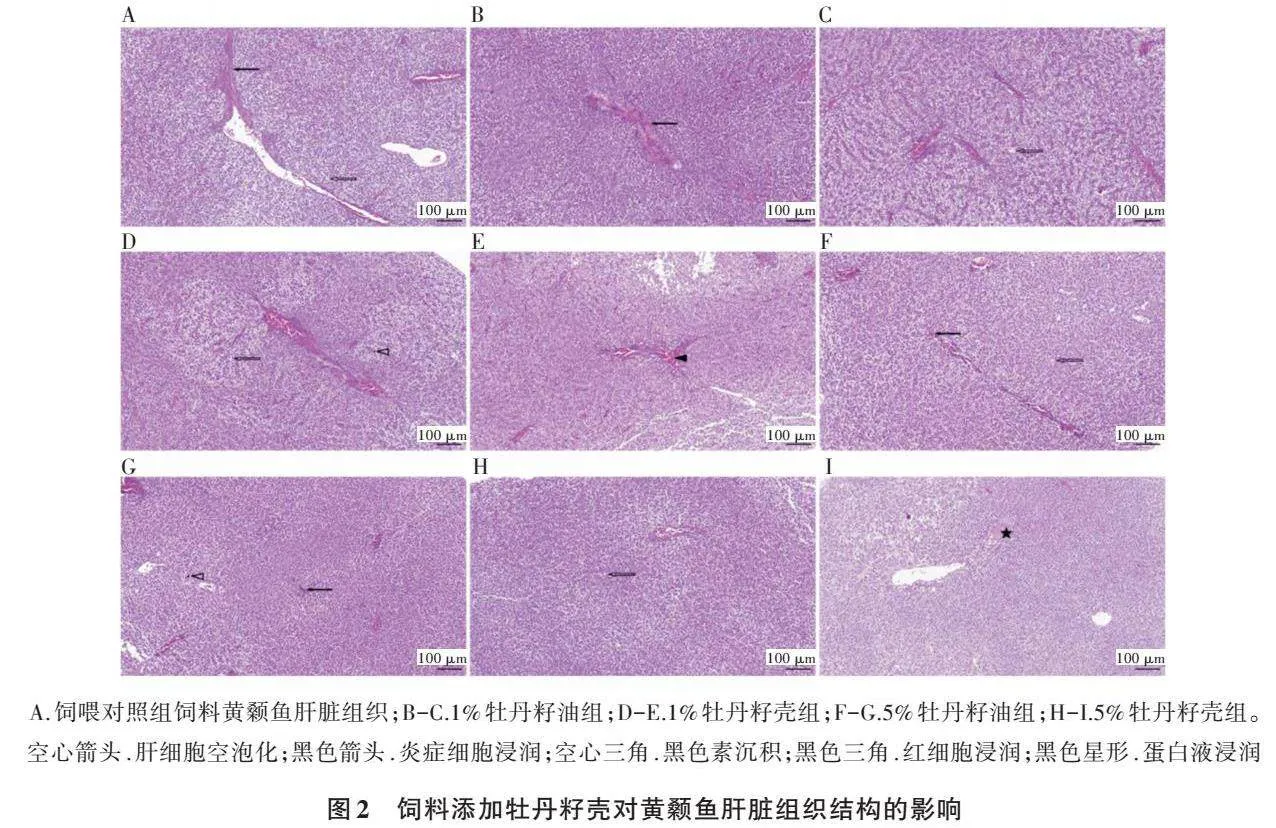
2.2 饲料添加牡丹籽壳对黄颡鱼肝脏组织结构的影响
饲喂对照组饲料21 d后,光学显微镜下观察黄颡鱼肝脏组织致密紧实,肝细胞沿肝索排列整齐、结构清晰,偶见肝细胞空泡化(图2A,空心箭头所示)和少量炎症细胞浸润(图2A,黑色箭头所示)。
与对照组相比,饲喂各组添加剂的黄颡鱼肝脏组织整体情况良好,偶见个别鱼体肝脏的异常变化。1%牡丹籽油组黄颡鱼也出现了炎性细胞浸润(图2B)和肝细胞空泡化(图2C)现象。1%牡丹籽壳组黄颡鱼肝脏出现黑色素沉积(图2D,空心三角所示)和空泡化现象(图2D,空心箭头所示),偶见红细胞浸润(图2E,黑色三角所示)。5%牡丹籽油组黄颡鱼肝脏组织整体情况与对照组和1%牡丹籽油组类似,肝细胞轻度空泡化(图2F,空心箭头所示),偶见炎症细胞浸润(图2F和2G,黑色箭头所示)和黑色素沉积(图2G,空心三角所示)。5%牡丹籽壳组黄颡鱼肝脏组织结构良好,肝细胞有少量空泡化(图2H)和蛋白液浸润(图2I,黑色星形所示)现象。
本研究中黄颡鱼摄食含有1%和5%牡丹籽壳或牡丹籽油的饲料21 d后,其肝脏组织结构完好,未见明显的异常变化,表明在该范围内牡丹籽壳和牡丹籽油具有安全的可食用性。
2.3 饲料添加牡丹籽壳对黄颡鱼肝脏抗氧化指标的影响
由图3A可知,饲喂含有1%和5%牡丹籽油或牡丹籽壳的饲料21 d,黄颡鱼肝脏超氧化物歧化酶活性显著升高。当添加比例为1%时,牡丹籽油组和牡丹籽壳组超氧化物歧化酶活性分别为对照组的1.86倍和1.77倍(P<0.001),此时两者提高酶活的效果相当(P>0.05)。当添加比例为5%时,牡丹籽油组和牡丹籽壳组超氧化物歧化酶活性分别为对照组的2.91倍和3.45倍(P<0.001),牡丹籽壳提高超氧化物歧化酶活性的效果显著优于牡丹籽油(P<0.05)。
与超氧化物歧化酶类似,饲料中添加不同浓度的牡丹籽油或牡丹籽壳亦能显著提高黄颡鱼肝脏过氧化氢酶活性(图3B,P<0.001),提高效果在高剂量组更加显著(图3B,P<0.001)。与对照组相比,1%牡丹籽油组和1%牡丹籽壳组的过氧化氢酶活性分别提高了96%和85%。5%牡丹籽油组和5%牡丹籽壳组过氧化氢酶活性分别为对照组的2.96倍和2.76倍。牡丹籽油促进溶菌酶活性的效果略优于牡丹籽壳。
超氧化物歧化酶和过氧化氢酶活性增加,指示肝脏细胞氧化损伤程度的丙二醛含量在牡丹籽油组和牡丹籽壳组显著降低,表明牡丹籽油和牡丹籽壳能有效增强黄颡鱼肝脏抗氧化能力。当添加量为1%时,牡丹籽油组和牡丹籽壳组肝脏MDA含量都为对照组的68%(图3C,P<0.001),MDA含量在两个添加剂组之间没有差异(图3C,P>0.05)。当添加量为5%时,黄颡鱼肝脏MDA含量在两个添加剂组进一步降低,分别为对照组的60%和50%,牡丹籽壳改善肝脏氧化水平的效果显著优于牡丹籽油(图3C,P<0.05)。
3 讨论
3.1 饲料添加牡丹籽壳显著提高黄颡鱼血清超氧化物歧化酶和溶菌酶活性及补体C3含量
血清超氧化物歧化酶和过氧化氢酶在机体抵御活性氧引起的氧化损伤过程中发挥重要作用[30,31],是衡量机体健康的重要指标之一。溶菌酶和补体系统在鱼类识别病原细菌和抵抗感染过程中具有重要作用[32,33],其中C3是补体系统的关键核心分子[33]。本研究表明饲料添加1%或5%的牡丹籽壳能有效提高黄颡鱼血清超氧化物酶和溶菌酶活性,提高血清补体C3含量,表明牡丹籽壳能增强黄颡鱼清除氧自由基和抵抗病原细菌的能力,维持黄颡鱼机体健康。牡丹籽壳富含白藜芦醇,研究表明白藜芦醇能显著提高大菱鲆超氧化物歧化酶mRNA水平[22],这可能是饲喂牡丹籽壳黄颡鱼超氧化物歧化酶活性增加的原因之一。摄食含有螺旋藻的饲料可提高虹鳟溶菌酶和补体C3的转录水平[34],铜藻提取物[35]和岩藻多糖[36]可增加黄颡鱼血清溶酶体活性和补体C3含量。饲料添加牡丹籽壳可同时增强黄颡鱼血清抗氧化能力和非特异性免疫,具有免疫增强剂的功效。牡丹籽油含有丰富的不饱和脂肪酸,能显著提高齐口裂腹鱼血清超氧化物酶和溶菌酶活性,增加血清补体C3含量[11]。
3.2 饲料添加牡丹籽壳不影响黄颡鱼肝脏组织结构
肝脏是营养物质代谢的重要器官,肝脏的组织学变化是评估动物营养状态的可靠指标之一[37]。已有研究证实牡丹籽油不影响大鼠脏器质量及脏体比,各脏器未见明显的病理损害改变[38,39],表明牡丹籽油具有较高的食用安全性。本研究中饲喂含有牡丹籽油或牡丹籽壳的饲料不影响黄颡鱼的存活率和行为能力,也未造成黄颡鱼肝脏结构明显的变化,表明牡丹籽油和牡丹籽壳安全、无毒,可作为饲料添加剂的备选物质。研究表明,合理使用添加剂有助于改善受试动物肝脏组织形态结构,例如摄食含有蒲公英[40,41]、银杏叶[42]或枸杞[43]提取物饲料的杂交石斑鱼肝血窦和肝细胞形态完好,边界清晰,油红染色表明肝脏脂质化程度明显低于对照组。牡丹籽壳能否改善黄颡鱼肝脏组织形态进而促进肝脏代谢解毒功能有待进一步探索。
3.3 饲料添加牡丹籽壳显著提高黄颡鱼肝脏抗氧化能力
肝脏是动物体内重要的代谢和解毒器官,肝脏的氧化损伤直接影响机体的健康[44]。研究表明,牡丹籽油能干预四氯化碳[8]和环磷酰胺[9]诱导的小鼠肝损伤,显著提高肝脏超氧化物酶水平,降低丙二醛含量和肝损伤程度,与本研究中牡丹籽油促进黄颡鱼肝脏抗氧化酶活性是一致的。牡丹籽壳含有丰富的白藜芦醇,是一种高效的天然抗氧化剂[45],其作为饲料添加剂能显著提高摄食动物抵抗氧化损伤的能力[19-23]。此外,牡丹籽壳还含有黄酮[46,47]、黑色素[48]和多酚化合物[49,50],天然产物也具有清除自由基和抗氧化的功效[51]。本研究中牡丹籽壳饲喂组的黄颡鱼肝脏超氧化物歧化酶和过氧化氢酶活性显著增加,肝脏丙二醛含量显著降低,表明牡丹籽壳能调节黄颡鱼肝脏抗氧化状态,降低脂质过氧化反应对肝细胞的毒害作用,具有促进肝脏健康的保健功效。
4 结论
饲料添加1%和5%牡丹籽壳能显著提高黄颡鱼抗氧化酶活性,增强黄颡鱼非特异性免疫,对黄颡鱼肝脏组织结构没有损伤作用。本研究中牡丹籽壳的保健功效与牡丹籽油相当,具有经济、安全、高效的优点,其作为饲料添加剂亦可解决粗犷堆放造成的环境污染问题,达到变废为宝的环保效果。牡丹籽壳可作为黄颡鱼饲料添加剂使用。
参考文献:
[1] 戚军超,周海梅,马锦琦,等.牡丹籽油化学成分GC-MS分析[J].粮食与油脂, 2005(11): 23-24.
[2] 王昌涛, 张 萍, 董银卯. 超临界CO2提取牡丹籽油的工艺以及成分分析[J]. 中国粮油学报, 2009, 24(8): 96-99,107.
[3] 邓瑞雪, 刘 振, 秦琳琳, 等. 超临界CO2流体提取洛阳牡丹籽油工艺研究[J]. 食品科学, 2010, 31(10): 142-145.
[4] 刘丛彬, 宣自华, 董振兴, 等. 牡丹籽油体外及对脂代谢紊乱大鼠体内抗氧化作用的研究[J]. 中国粮油学报, 2014, 29(6): 53-56.
[5] 杨晓君, 商雪珂, 买迪娜木·阿布力米提, 等. 不同植物油脂对D-半乳糖衰老模型小鼠的抗氧化作用[J]. 新疆农业大学学报, 2020, 43(6): 453-459.
[6] 史国安, 郭香凤, 金宝磊, 等. 牡丹籽油超临界CO2萃取工艺优化及抗氧化活性的研究[J]. 中国粮油学报, 2013, 28(4): 47-50,107.
[7] 翟文婷, 朱献标, 李艳丽, 等. 牡丹籽油成分分析及其抗氧化活性研究[J]. 烟台大学学报(自然科学与工程版), 2013, 26(2): 147-150.
[8] 翟文婷, 朱献标, 李艳丽, 等. 牡丹籽油对小鼠急性肝损伤的保护作用[J]. 中国油脂, 2013, 38(11): 43-45.
[9] 彭安芳,郭慧鹏,冯秀宽,等. 牡丹籽油对环磷酰胺致小鼠遗传毒性和肝损伤的保护作用[J]. 中国油脂, 2018, 43(10): 74-76,81.
[10] 郭 婷. 牡丹籽油抗炎作用的分子机理研究[D]. 长沙:中南林业科技大学,2019.
[11] 冯莉梅. 牡丹籽油对齐口裂腹鱼免疫及免疫相关基因表达的影响[D]. 四川雅安:四川农业大学,2018.
[12] 孙 燕,李成忠,左伟勇. 牡丹籽油对小鼠免疫功能的影响[J]. 上海农业学报, 2018, 34(6): 65-68.
[13] 张梦兰, 杨 琴, 张冰洁, 等. 牡丹籽油复方软胶囊增强免疫力的功能研究[J]. 中国油脂, 2019, 44(11): 121-126.
[14] 李成忠, 张焕新, 李若敏, 等. 牡丹籽油复方研制及其降血糖和增强免疫活性研究[J]. 扬州大学学报(农业与生命科学版), 2020, 41(6): 84-89.
[15] 朱宗磊. 牡丹籽油软胶囊稳定性及功能研究[D]. 济南:山东大学.2014.
[16] ZHANG L N, LIU P, GAO J Y, et al. Profiling and simultaneous quantitative determination of oligostilbenes in Paeonia ostii seed shell from different geographical areas in China and their comparative evaluation[J]. Phytochemical analysis, 2019, 30(4): 464-473.
[17] 张红玉, 王成章, 原姣姣, 等. 牡丹籽壳中白藜芦醇的分离及结构表征[J]. 中国油脂, 2017, 42(2): 116-119.
[18] GALINIAK S,AEBISHER D, BARTUSIK-AEBISHER D. Health benefits of resveratrol administration[J]. The journal of the polish biochemical society and of the polish academy of sciences, 2019, 66(1): 13-21.
[19] CONG L, LEI M Y, LIU Z Q, et al. Resveratrol attenuates manganese-induced oxidative stress and neuroinflammation through SIRT1 signaling in mice[J]. Food and chemical toxicology, 2021, 153: 112283.
[20] XUN W J, FU Q Y, SHI L G, et al. Resveratrol protects intestinal integrity, alleviates intestinal inflammation and oxidative stress by modulating AhR/Nrf2 pathways in weaned piglets challenged with diquat[J]. International immunopharmacology,2021,99: 107989.
[21] ROHMAH M K, SALAHDIN O D, GUPTA R, et al. Modulatory role of dietary curcumin and resveratrol on growth performance, serum immunity responses, mucus enzymes activity, antioxidant capacity and serum and mucus biochemicals in the common carp, Cyprinus carpio exposed to abamectin[J]. Fish & shellfish immunology, 2022, 129: 221-230.
[22] TAN C, ZHOU H H, WANG X, et al. Resveratrol attenuates oxidative stress and inflammatory response in turbot fed with soybean meal based diet[J]. Fish & shellfish immunology, 2019, 91: 130-135.
[23] ZHENG Y, ZHAO Z X, WU W, et al. Effects of dietary resveratrol supplementation on hepatic and serum pro-/anti-inflammatory activity in juvenile GIFT tilapia, Oreochromis niloticus[J]. Developmental & comparative immunology, 2017, 73: 220-228.
[24] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 中国渔业统计年鉴[M]. 北京:中国农业出版社, 2023.31.
[25] WANG Q, SHEN J Y, YAN Z T, et al. Dietary Glycyrrhiza uralensis extracts supplementation elevated growth performance, immune responses and disease resistance against Flavobacterium columnare in yellow catfish (Pelteobagrus fulvidraco)[J]. Fish & shellfish immunology, 2020, 97: 153-164.
[26] HOU T L, LIU H R, LI C T. Traditional Chinese herb formulas in diet enhance the non-specific immune responses of yellow catfish (Pelteobagrus fulvidraco) and resistance against Aeromonas hydrophila[J]. Fish & shellfish immunology, 2022, 131: 631-636.
[27] CHENG K, TANG Q, HUANG Y Q, et al. Effect of vitamin D3 on the immunomodulation of head kidney after Edwardsiella ictaluri challenge in yellow catfish (Pelteobagrus fulvidraco)[J]. Fish & shellfish immunology, 2020, 99: 353-361.
[28] CHENG K, TANG Q, GUO X, et al. High dose of dietary vitamin D3 modulated the yellow catfish (Pelteobagrus fulvidraco) splenic innate immune response after Edwardsiella ictaluri infection[J]. Fish & shellfish immunology, 2020, 100: 41-48.
[29] LIU F, SHI H Z, GUO Q S, et al. Effects of astaxanthin and emodin on the growth, stress resistance and disease resistance of yellow catfish (Pelteobagrus fulvidraco)[J]. Fish & shellfish immunology, 2016, 51: 125-135.
[30] FRIDOVICH I. Superoxide radical and superoxide dismutases[J]. Annual review of biochemistry, 1995, 64: 97-112.
[31] SEIFRIED H E,ANDERSON D E,FISHER E I, et al. A review of the interaction among dietary antioxidants and reactive oxygen species[J]. The journal of nutritional biochemistry, 2007,18(9): 567-579.
[32] ELLIS A E. Innate host defense mechanisms of fish against viruses and bacteria[J]. Developmental & comparative immunology, 2001, 25(8-9): 827-839.
[33] MAGNADOTTIR B, LANGE S, GUDMUNDSDOTTIR S, et al. Ontogeny of humoral immune parameters in fish[J]. Fish & shellfish imm1ftYX/iZXwdZU99ZJlkn7g==unology, 2005, 19(5): 429-439.
[34] SHEIKHZADEH N, MOUSAVI S, HAMIDIAN G, et al. Role of dietary Spirulina platensis in improving mucosal immune responses and disease resistance of rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2019, 510: 1-8.
[35] SHI Q C, WANG J, QIN C J, et al. Growth performance, serum biochemical parameters, immune parameters and hepatic antioxidant status of yellow catfish Pelteobagrus fulvidraco supplemented with Sargassum horneri hot-water extract[J]. Aquaculture reports, 2021, 21: 100839.
[36] YANG Q, YANG R, LI M, et al. Effects of dietary fucoidan on the blood constituents, anti-oxidation and innate immunity of juvenile yellow catfish (Pelteobagrus fulvidraco)[J]. Fish & shellfish immunology, 2014, 41(2): 264-270.
[37] NAJDEGERAMI E H, BAKHSHI F, LAKANI F B. Effects of biofloc on growth performance, digestive enzyme activities and liver histology of common carp (Cyprinus carpio L.) fingerlings in zero-water exchange system[J]. Fish physiology and biochemistry, 2016, 42(2): 457-465.
[38] 朱文学, 李 欣, 刘少阳, 等. 牡丹籽油的毒理学研究[J]. 食品科学, 2010, 31(11): 248-251.
[39] 周海梅,马锦琦,杨志勇,等. 牡丹籽油对大、小鼠的毒性试验[J]. 毒理学杂志, 2009, 23(3): 256-257.
[40] SUN Z Z, TAN X H, XU M L, et al. Effects of dietary dandelion extracts on growth performance, liver histology, immune-related gene expression and CCl4 resistance of hybrid grouper (Epinephelus lanceolatusmale♂×Epinephelus fuscoguttatusfemale♀)[J]. Fish & shellfish immunology, 2019, 88: 126-134.
[41] SUN Z Z, TAN X H, WEI Z L, et al. Effects of dietary dandelion extract on the growth performance, serum biochemical parameters, liver histology, and immune and apoptosis-related genes expression of hybrid grouper (Epinephelus lanceolatusmale♂×Epinephelus fuscoguttatusfemale♀ at different feeding period[J]. Fish & shellfish immunology, 2022, 120: 280-286.
[42] TAN X H, SUN Z Z, LIU Q Y, et al. Effects of dietary ginkgo biloba leaf extract on growth performance, plasma biochemical parameters, fish composition, immune responses, liver histology, and immune and apoptosis-related genes expression of hybrid grouper (Epinephelus lanceolatusmale♂×Epinephelus fuscoguttatusfemale♀) fed high lipid diets[J]. Fish & shellfish immunology, 2018, 72: 399-409.
[43] TAN X H, SUN Z Z, YE C X, et al. The effects of dietary Lycium barbarum extract on growth performance, liver health and immune related genes expression in hybrid grouper (Epinephelus lanceolatusmale♂×E. fuscoguttatusfemale♀) fed high lipid diets[J]. Fish & shellfish immunology, 2019, 87: 847-852.
[44] LI S, TAN H Y, WANG N, et al. The role of oxidative stress09ce2e22b24be8342cabd6a08e870a34 and antioxidants in liver diseases[J]. International journal of molecular sciences, 2015, 16(11): 26087-26124.
[45] 刘 普, 许艺凡, 李小方, 等. 油用牡丹籽壳低聚茋类化合物富集及对牡丹籽油抗氧化作用研究[J]. 中国粮油学报, 2017, 32(6): 84-90.
[46] 李婉仪, 吉文丽, 李 蕊, 等. 响应面优化牡丹籽壳总黄酮超声波提取工艺及抗氧化活性研究[J]. 中国油脂, 2018, 43(4): 114-118.
[47] 孟庆焕, 王 化, 王洪政, 等. 牡丹种皮黄酮提取及对ABTS自由基清除作用[J]. 植物研究, 2013, 33(4): 504-507.
[48] 丁永霞. 牡丹籽壳中黑色素的提取及化学成分测定的方法研究[J]. 现代食品, 2018(24): 159-164.
[49] 张红玉, 王成章, 张宇思, 等. 超声波提取牡丹籽壳多酚工艺响应面法优化及抗氧化性研究[J]. 中国油脂, 2015, 40(6): 90-94.
[50] 张红玉, 王成章, 原姣姣, 等. 牡丹籽壳提取物及不同极性部位的抗氧化活性研究[J]. 中国油脂, 2016, 41(7): 64-67.
[51] HABOTTA O A, DAWOOD M A O, KARI Z A, et al. Antioxidative and immunostimulant potential of fruit derived biomolecules in aquaculture[J]. Fish & shellfish immunology,2022,130: 317-322.
收稿日期:2023-04-18
基金项目:武汉知识创新专项-基础研究项目(2022020801010414); 武汉市农业科学院创新项目(XTCX202204)
作者简介:刘鹿忆(1987-),女,黑龙江鸡西人,农艺师,博士,主要从事水产动物细菌病与免疫防控工作,(电话)13657274094(电子信箱)luyi_1009@126.com;通信作者,张立强(1979-),男,江西金溪人,高级工程师,博士,主要从事水产病害防控工作,(电话)15926219392(电子信箱)zhangliqiang@wuhanagri.com。

