HIPVs介导的植物与害虫互作机理研究进展

摘要:对虫害诱导植物挥发物(HIPVs)的种类及其释放特性、生态功能及应用进行了详细综述,并从利用HIPVs防治害虫、探索HIPVs在植物-害虫-天敌三者营养关系中的调控作用和应用基因工程技术进行改造3个方面对未来的研究重点进行了展望,以期让人们更好地了解虫害诱导植物挥发物的研究现状和应用前景,开发出更多的害虫防治手段。
关键词:植物挥发物; 虫害诱导植物挥发物(HIPVs); 释放特点; 生态功能; 应用; 互作机理
中图分类号:S433.1;Q965 文献标识码:A
文章编号:0439-8114(2024)10-0053-06
DOI:10.14088/j.cnki.issn0439-8114.2024.10.009 开放科学(资源服务)标识码(OSID):
Abstract: The species, release characteristics, ecological functions and applications of herbivore induced plant volatiles(HIPVs) were reviewed in detail, and the future research focus was prospected from three aspects: The use of HIPVs for pest control, the exploration of the regulatory role of HIPVs in the nutritive relationship among plants, pests and natural enemies, and the application of genetic engineering technology for modification, to make people better understand the research status and application prospect of pest induced volatiles, and develop more pest control methods.
Key words: plant volatiles; herbivore induced plant volatiles(HIPVs); release characteristics; ecological function; application; interaction mechanism
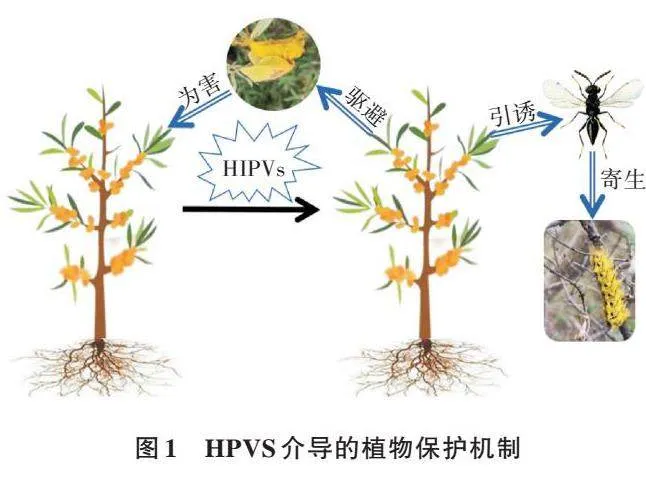
植物挥发物属于植物的次生化学物质,可产生于植物的叶、花和果实等不同部位,在促进植物与昆虫之间的信息交流,调节昆虫的产卵、取食以及生长发育等方面起着关键作用,通常分为植物自然释放的挥发物和虫害诱导产生的挥发物[1,2]。植物自然释放的挥发物一般是萜、醛、醇、酯、酮等[3,4]。当植物受到昆虫的危害后,植物会向外界释放挥发性次生代谢物(图1),称为虫害诱导植物挥发物(Herbivore induced plant volatiles,HIPVs),一般是氮、硫、萜类化合物、绿叶类物质等[5]。HIPVs的化学成分和浓度会随植物的种类、为害植物的昆虫种类、为害部位、龄期、为害时间长短等产生不同的变化[6,7],对植食性昆虫的取食、求偶、交配等行为都会造成影响。国内外对HIPVs在植物与植物之间、植物与昆虫之间、植物与昆虫以及天敌之间相互作用的研究越来越广泛和深入。本研究对HIPVs的类别、释放特性、三者营养级之间的关系、生态学功能及其应用研究展开系统的综述。
1 虫害诱导植物挥发物的类别及释放特性
1.1 虫害诱导植物挥发物的类别
当植物受到昆虫为害时,植物会及时响应,从而形成一系列的防御机制,其中释放挥发性化学物质是减轻自身伤害的重要手段,这些挥发性化学物质包括萜类化合物、绿叶类物质、含氮化合物、含硫化合物以及其他化学物质等[8,9]。
萜类化合物在植物界分布广泛,其结构多样且丰富,据不完全统计,包含超过22 000 多种化合物[10]。这类衍生物来自2种常见的五碳(C5)前体,异戊烯基二磷酸酯(IPP)及其二甲基烯丙基焦磷酸盐(DMAPP)[11],合成2种前体的甲羟戊酸(MVA)途径和2-甲基赤藓醇磷酸(MEP)途径虽然是分隔的,但它们通过代谢串扰连接[12],使得MEP途径通常具有比较高的碳通量,以支持胞质形成的萜类化合物的生物合成[13,14]。
萜类化合物通过直接或间接的作用提高植物抵御害虫的能力,在植物生命中发挥多种生理生化功能以及生态功能[15]。当玉米(Zea mays L.)受到甜菜夜蛾(Spodoptera exigua)幼虫侵害时,会释放含萜类成分的物质,这种物质不仅可以显著提升周围邻近植株的抗虫能力,也能提高其他植株的防御水平[16]。茶树(Camellia sinensis)萜类化合物在合成MVA路径中的1个3-羟基-3-甲基戊二酸单酰辅酶A还原酶(HMGR)能被茶尺蠖(Ectropis obliqua)和小绿叶蝉(Empoasca flavescens)显著诱导上调表达,能够进一步证明虫害能诱导萜类生物合成途径中的关键酶基因的上调表达。当茶树叶芽受到虫害侵害时,细胞破裂导致糖苷和糖苷水解酶与其充分接触并在其作用下水解,释放出萜类化合物,从而减轻危害[17,18]。
绿叶挥发物(GLVs)可以直接阻止害虫,也可以通过吸引害虫的捕食者间接保护植物[19]。当植物组织受损时,GLVs 生物合成途径被迅速激活,可以在数秒至数分钟内大量形成,它们主要是由不饱和脂肪酸形成的脂肪酸衍生物,通常以游离与脂质结合的形式存在[20-22]。通过植物释放的GLVs,可以让昆虫通过GLVs找到寄主,完成取食、交配、产卵等一系列的生理活动。马铃薯(Solanum tuberosum L.)叶片释放的GLVs可促使马铃薯甲虫(Leptinotarsa decemlineata)进行一系列定位行为[23]。杏(Prunus armeniaca L.)花部位所释放的GLVs也能吸引扁桃广肩小蜂(Eurytoma amygdali Enderlein)成虫聚集并取食[24]。
HIPVs中含氮化合物、含硫化合物和其他化学物质的占比较低,但也会显著影响害虫的种群数量。王让剑等[25]的研究发现当茶小绿叶蝉为害茶树时,会释放二甲基二硫醚(DMDS)、1,8-桉叶油和烯丙基甲基硫醚,当释放量较多时,会显著降低茶小绿叶蝉的数量,并且显著降低了邻近茶树中茶小绿叶蝉成虫的数量。
1.2 虫害诱导植物挥发物的释放特点
HIPVs的组成成分受到众多因素的影响,比如植物基因型[26]、害虫种类[27]以及一些非生物因子(阳光、空气、水分、土壤、温度、湿度)[28],导致HIPVs的释放特点多种多样,比如主动释放与被动释放相结合、系统性和群体性以及昼夜节律等[29,30]。
HIPVs呈现主动释放与被动释放相结合的释放特性,植食性昆虫对植物的伤害会促使植物释放萜类化合物、GLVs与其他挥发物质的成分增加。Loughrin等[31]通过连续3 d对田间甜菜夜蛾(Spodoptera exigua)幼虫取食的陆地棉植株(Gossypium hirsutum L.)挥发物的收集分析发现,非环萜烯类化合物具有明显的节律性。 Helsper等[32]的研究发现当暴露在12 h的光周期时,月季(Rosa hybrida)花的挥发物组分中的醛类挥发物、醇类挥发物、烯类挥发物均在光周期内释放量最大。
HIPVs还具有系统性和群体性的释放特点。系统性是指当植物的某个部位遭受害虫侵害时,植物会系统性地释放挥发物,群体性则表明植物个体之间存在信息交流。当植物受到植食性昆虫的侵袭时,植物会通过释放挥发物来通知周围的植物,并促使它们释放类似的挥发物[33]。例如,美洲棉铃虫(Helicoverpa zea)取食诱导棉花(Gossypium spp.)花蕾释放(E)-β-罗勒烯、芳樟醇、(E)-β-法尼烯、(E, E)-α-法尼烯、2,4-二甲基-5-硝基苯甲酸酯(DMNT)、四硫代四甲基秋兰姆(TMTT)、己烯基丁酸酯、2-丁酸甲酯、(Z)-3-乙酸叶醇酯和吲哚,而且还能诱导未被为害的营养器官系统性释放(Z)-3-乙酸叶醇酯、(E)-β-罗勒烯、芳樟醇、DMNT、(E)-β-法尼烯、(E,E)-α-法尼烯和吲哚等挥发物[34]。除此之外,当甘薯(Ipomoea batatas)遭到海灰翅夜蛾取食后迅速释放出DMNT,DMNT诱导邻近甘薯中蛋白酶抑制剂(Sporamin protease inhibitor,SPI)基因的表达上调,使叶片中胰蛋白酶抑制剂的含量升高,进而增强了邻近甘薯对海灰翅夜蛾的抗性[35]。
此外,HIPVs具有昼夜节律的释放特点,即HIPVs在晚上的释放量显著低于白天的释放量[36]。光照和温度是诸多植物种类中单萜合成速率的主要影响因素。如马尾松(Pinus massoniana)在光下释放的挥发物远大于暗处[37]。Shiojiri等[38]的研究表明在寄主植株存在的情况下,黏虫(Mythimna separata)幼虫在日间环境条件下比夜间环境条件下表现出更隐蔽的行为。此外,与光照条件相比,HIPVs更能有效地调控黏虫行为。
2 虫害诱导植物挥发物的生态功能
2.1 虫害诱导植物挥发物对植物的影响
2.1.1 虫害诱导植物挥发物对植物自身的影响 植物挥发物不仅体现出植物的生理特征,还能反映出植物在不同的周边环境下、植物自身生长发育的不同历期以及植物各部位的生理状态[39]。
当植物遭受昆虫侵害时,其受损部位会产生挥发物质,这些挥发物质可以作为系统性的损伤信号传递给健康部位。这种信号激发了植物的自我保护机制,使整个植株陷入防御状态,会进一步释放HIPVs。由于被昆虫攻击,植物所释放的挥发物使同一种植物的不同部位对昆虫的危害作出更快和更大的反应,从而减轻昆虫的侵害[40,41]。例如,受到昆虫为害的棉豆 (Phaseolus lunatus)释放HIPVs后,未受昆虫侵害的棉豆叶片中与抗虫能力有关的基因表达水平显著升高。这些基因不仅释放出能吸引捕食螨的HIPVs,而且进一步的试验表明,将虫害信息传递到未受害叶片的化学物质主要包括萜类化合物和绿叶气味[42,43]。
2.1.2 虫害诱导植物挥发物对邻近植物的影响 邻近植物可以通过受害植物所释放的挥发物信息,预先准备好防御来获得竞争优势。当植物遭受到昆虫的侵害时,其邻近植株可以更为迅速地采取相应防御机制且抵抗过程相对更为强烈。研究发现盲蝽(Miridae)在侵害番茄时,其HIPVs的释放使得这些挥发物诱导先前未暴露于盲蝽的邻近完整植株的防御起到了至关重要的作用[44-46]。当黄花叶甲虫(Trirhabda virgate)为害北美一枝黄花(Solidago altissma)时,其产生的HIPVs可激发邻近相同甚至不同基因型的植物提高对黄花叶甲虫的防御水平,但是利用未经黄花叶甲虫诱导的挥发物处理植物时,只有邻近相同基因型的植物会启动同等防御,不同基因型的植物没有表现同样的反应[47]。
2.2 虫害诱导植物挥发物对植食性昆虫的影响
2.2.1 虫害诱导植物挥发物对植食性昆虫的直接影响 HIPVs在植食性昆虫寄主定向、产卵、驱避和取食行为等方面发挥着至关重要的作用[48-50]。不同种类植物释放HIPVs的含量以及化学成分也不相同,对植食性昆虫整个生长发育历期中的生理学特性以及生活习性的影响有显著差异[51,52]。
对植食性昆虫而言,当被害植株存在HIPVs时,不仅表明存在同种竞争者,可能降低寄主植物的数量和质量,而且意味着遭遇天敌的风险更高。因此,当这种情况存在时,植食性昆虫往往都会选择其他健康植物,避免危险的发生,这样可以获得充足的食物和更安全的栖息地,增加它们的适应性。赵海燕等[53]发现虫害诱导阳桃(Averrhoa carambola)果实(1 d)释放的挥发物能显著引起蝇蛹金小蜂(Pachycrepoideus vindemmiae)的定向选择,蝇蛹金小蜂雌蜂对虫伤1 d的阳桃果实选择率为63.16%,显著高于对空白对照的46.84%。
植食性昆虫受到植物所散发HIPVs的影响,选择有利于提高后代生存率的植物部位产卵[54]。研究发现烟草青虫(Heliothis virescens)倾向于产卵在未侵染的烟草(Nicotiana tabacum)植株上,而不是被同种幼虫侵染的烟草植株上,表明烟草青虫可以识别HIPVs,使其能在未感染的地区产卵,在那里它们的后代可能有更好的适应性[55]。虫害诱导马尾松(Pinus massoniana)挥发物中的α-蒎烯和柠檬烯在不同浓度范围内均对微红梢斑螟(Dioryctria rubella Hampson)有极显著的产卵引诱效果[56]。
HIPVs可以作为植物与昆虫之间的化学信息纽带,特别是有研究表明HIPVs对害虫本身具有驱避作用。罗勒(Ocimum basilicum)和万寿菊(Tagetes erecta)受温室白粉虱为害时,所释放的挥发物中含有0.1%(质量分数)的(Z)-β-桉油烯和1.0% (质量分数)的芳樟醇,可以有效地驱避白粉虱[57]。研究发现HIPVs的类别以及含量差异对害虫的趋避作用具有明显差异,杜仲(Eucommia ulmoides)叶与香椿(Toona sinensis)叶混合提取物对谷蠹(Rhyzopertha dominica)有较高的驱避活性,且有一定的毒杀作用,具有开发利用的潜力[58]。
2.2.2 虫害诱导植物挥发物对植食性昆虫的间接影响 HIPVs对植食性昆虫的间接影响主要体现在引诱植食性昆虫的天敌,反过来控制植食性昆虫的种群数量[59]。在植食性昆虫攻击植物时,植物组织内的吲哚、己烯醇、己烯醛以及萜类等挥发性成分将大规模释放[60]。这些挥发物不仅能引诱植食性昆虫的捕食性和寄生性天敌,从而准确无误地捕捉害虫,同时还能有效减轻植物本身的危害症状,控制害虫的数量和密度[61]。例如,当甜菜夜蛾(Spodoptera exigua)侵害植物时,植物会逐步释放吲哚、萜类化合物以及Glvs等挥发物,以促进其寄生性天敌小茧蜂(Cotesia marginiventris)的定向、产卵等行为,从而显著减轻玉米遭受的攻击程度[62]。
当灰茶尺蠖(Ectropis grisescens)危害影响到茶树时,茶树释放的挥发物中,苯甲醛、反-2-癸烯醛、4-庚烯醛和反-2-己烯醛含量均明显增加。研究表明,茶树释放的吲哚、反-癸烯醛和4-庚烯醛对茶尺蠖绒茧蜂(Apanteles sp.)具有显著的引诱效果,可以有效降低害虫对茶树造成的危害[63]。不同种类的天敌利用不同的策略来区分复杂的挥发性有机化合物(VOC)的混合物。蚜虫诱导植物的4种挥发物(α-蒎烯、癸醛、邻苯二甲酸和异佛尔酮)对寄生蜂产生了强烈的吸引力,在这些HIPVs中,浓度为100 ng/μL的α-蒎烯吸引的黄蜂明显更多[64]。Shi等[65]在研究水稻中的互益素时,发现芳樟醇对褐飞虱(Nilaparvata lugens)的卵期寄生蜂-稻虱缨小蜂(Anagrus nilaparvatae)有显著的引诱作用。
3 虫害诱导植物挥发物的应用
3.1 虫害诱导植物挥发物作为引诱剂
植物可借助HIPVs吸引天敌,阻止植食性昆虫对其取食,从而降低对寄主植物的伤害,此外HIPVs可以直接对害虫产生引诱作用。在实际应用中,单一种类的挥发性化合物往往很难达到理想的杀虫效果,而通过将多种种类的挥发性化合物按照特定的配比进行混合能有效地增强对害虫的诱捕能力。
Rasmann等[66]鉴定出倍半萜(E)-β-丁香烯,这类挥发物引诱昆虫病原线虫,对玉米根萤叶甲(Diabrotica virgifera)这类地下害虫起到一定程度的侵染作用,为防治地下害虫提供了新方法。研究发现,向马铃薯块茎蛾性信息素诱芯中添加一定比例的虫害诱导植物挥发物能显著提高诱捕量,这为马铃薯块茎蛾性信息素应用开拓了新方法[67]。在生产上,利用朱红毛斑蛾为害榕树后释放的HIPVs,可以诱集花胸姬蜂(Gotra octocinctus),充分发挥其天敌作用,也可以诱集朱红毛斑蛾成虫,进行集中诱杀,从而减轻对榕树的危害[68]。Wang等[69]的研究发现绿豆象成虫在交配后对HIPVs中的苯甲醛和2-己烯醛表现出寄主选择性偏好,当300 μg/μL 2-已烯醛和180 μg/μL苯甲醛混合后,可作为有效的诱捕剂,用于田间监测和控制绿豆象数量,有效减轻其危害。
3.2 虫害诱导植物挥发物作为驱避剂
HIPVs作为驱避剂备受关注,不仅可以通过干扰害虫的嗅觉和触觉来减少害虫对植物的危害,而且也能通过控制害虫的行为,如阻止其寻找卵床、缩短寿命等方式来控制害虫的数量。Gaffke等[70]的研究发现,当红柳粗角萤叶甲(Diorhabda carinulata)取食寄主植物时,该植物会产生4-氧-(E)-2-己烯醛化合物,对繁殖产卵期的成虫具有显著的驱避作用。此外,柠檬烯驱避剂能成功地从被害植物上驱除温室白粉虱(Trialeurodes vaporariorum),并在危害情况严峻期间将果实产量与品质提高32%,由此可见,柠檬烯驱避剂可作为低经济成本和易于操作实施的粉虱防控策略应用推广[71]。邬亚红等[72]通过对芹菜(Apium graveolens)的茎叶部位进行挥发物提取分析,成功筛选出了α-蒎烯和柠檬烯2种挥发性物质。这2种物质具有明显的抵御烟粉虱侵害的效果,能够有效减轻田间辣椒(Capsicum annuum)遭受烟粉虱侵害的情况。
4 展望
随着环境的变化和人类活动干扰的不断加剧,植物面临日益严重的虫害威胁,对人类的生活、产业的发展以及生态环境造成了很大的影响。植物通过挥发性化学物质的释放来诱导或威慑害虫,从而实现植物自身或者对邻近植株的保护。HIPVs作为植物与害虫之间联系的信息纽带,可以直接或者间接地影响害虫的生长发育和行为习性,在开发害虫防治新技术方面具有巨大的潜力,已经引起了国内外学者广泛的关注。深入研究HIPVs的类别、释放特点和生态功能,可以更好地了解植物与害虫之间的关系,及时采取有效措施,保护植物及生态系统的动态平衡。
HIPVs已成为植物保护领域的研究热点,未来的研究重点应集中在以下几个方面。
首先,研究如何更好地利用HIPVs来防治害虫。通过深入研究HIPVs对害虫所具有的引诱作用和趋避作用,开发出更加有效的植物保护方法。由于害虫在一定距离外,通过视觉、嗅觉和触觉来实现对植物的定向或趋性。因此,如何通过HIPVs来实现对昆虫的直接或间接诱捕,或者为捕食者提供便利条件,从而增强对害虫的捕食能力,增加害虫天敌的搜索成功率,从而减少害虫对植物的取食伤害,也是未来研究的重点领域。
其次,研究植物-害虫-天敌的三者营养层关系,并探索HIPVs在这一关系中的调控作用。这三者之间的相互作用关系到植物本身的营养物质输送、害虫捕食的选择、植物的抵御反应、吸引天敌昆虫到植物周边从而控制害虫等方面,可为优化植物保护策略提供理论基础。同时,结合现代生物技术手段,掌握HIPVs的释放特性,对参与的挥发性物质合成与释放的基因加以重组,探索HIPVs对植物的调控机制,揭示HIPVs与植物免疫系统之间的关系,为培育抗虫、抗病植物品种提供技术支持。
最后,HIPVs不仅是植物次生代谢产物中的一种,还有很大的潜力,能通过基因工程技术进行改造,并合成类似HIPVs的物质。HIPVs类似物不仅具有更强的引诱作用,而且其效果更加稳定。深入研究HIPVs的合成和释放机制,并进行基因改造以提高植物释放 HIPVs的能力,从而增强其对抗害虫的抵抗力。
此外,研究人员应加强与产业界和政府部门的合作,加速HIPVs在实际生产中的推广和应用。
参考文献:
[1] 贾志飞,仇延鑫,赵永超,等.植物挥发物对昆虫的驱避和引诱作用研究进展[J].山东农业科学,2022,54(7):164-172.
[2] 袁格格,黄国华,陈 功.虫害诱导蔬菜作物挥发物的研究进展[J].环境昆虫学报,2021,43(3):567-575.
[3] ABBAS F,KE Y G,YU R C,et al. Volatile terpenoids: Multiple functions, biosynthesis, modulation and manipulation by genetic engineering[J].Planta,2017,246(5):803-816.
[4] HANKS L M,MONGOID-DIERS J A,ATKINSON T H,et al. Blends of pheromones, with and without host plant volatiles, can attract multiple species of cerambycid beetles simultaneously[J].Journal of economic entomology,2018,111(2):716-724.
[5] 蔡晓明,李兆群,潘洪生,等.植食性害虫食诱剂的研究与应用[J].中国生物防治学报,2018, 34(1):8-35.
[6] HELMS A M,DE M C M,MESCHER M C,et al. The volatile emission of Eurosta solidaginis primes herbivore-induced volatile production in Solidago altissima and does not directly deter insect feeding[J].BMC plant biology,2014,14(1):173.
[7] MITRA P,DAS S,DEBNATH R,et al. Identification of Lathyrus sativus plant volatiles causing behavioral preference of Aphis craccivora[J].Pest management science,2020,77(1):285-299.
[8] 娄永根,程家安.虫害诱导的植物挥发物: 基本特性、生态学功能及释放机制[J].生态学报, 2000,20(6):1097-1106.
[9] FINCHEIRA P,QUIROZ A,TORTELLA G,et al. Current advances in plant-microbe communication via volatile organic compounds as an innovative strategy to improve plant growth[J].Microbiological research,2021,247(1):126726.
[10] ZENG T,CHEN Y,JIAN Y,et al. Chemotaxonomic investigation of plant terpenoids with an established database (TeroMOL)[J].The new phytologist,2022,235(2):662-673.
[11] MCGARVEY D J,CROTEAU R. Terpenoid metabolism[J].Plant cell,1995,7(7):1015-1026.
[12] LAULE O,FURHOLZ A,CHANG H S,et al. Crosstalk between cytosolic and plastidial pathways of isoprenoid biosynthesis in Arabidopsis thaliana[J].Proceedings of the national academy of sciences,2003,100 (11):6866-6871.
[13] WARD J L,BAKER J M,LLEWELLYN A M,et al. Metabolomic analysis of Arabidopsis reveals hemiterpenoid glycosides as products of a nitrate ion-regulated, carbon flux overflow[J].Proceedings of the national academy of sciences of the United States of Americ,2011,108(26):10762-10767.
[14] BERGMAN M E,PHILLIPS M A. Structural diversity and biosynthesis of plant derived p-menthane monoterpenes[J].Phytochemistry reviews,2021,20:433-459.
[15] BRUCE T J A,ARADOTTIR G I,SMART L E,et al. The first crop plant genetically engineered to release an insect pheromone for defence[J].Scientific reports,2015,5(1):11183.
[16] TON J,D'ALESSANDRO M,JOURDIE V,et al. Priming by airborne signals boosts direct and indirect resistance in maize:Protective mechanisms of VOC-induced priming[J].The plant journal,2006,49(1):16-26.
[17] 付建玉.茶树倍半萜类物质代谢及其对虫害胁迫响应[D].北京:中国农业科学院,2017.
[18] 雷子寅,蔺松波,张 瑾,等.茶树害虫挥发性化学信息物质的研究进展[J].应用昆虫学报,2023,60(2):449-462.
[19] D'AURIA J C,PICHERSKY E,SCHAUB A,et al. Characterization of a BAHD acyltransferase responsible for producing the green leaf volatile (Z)-3-hexen-1-yl acetate in Arabidopsis thaliana: Arabidopsis CHAT acyltransferase[J].The plant journal,2007, 49(2):194-207.
[20] NAKASHIMA A,VON R S H,TASAKA H,et al. Traumatin- and dinortraumatin-containing galactolipids in Arabidopsis: Their formation in tissue-disrupted leaves as counterparts of green leaf volatiles[J].The journal of biological chemistry,2013,288(36):26078-26088.
[21] TANAKA T,IKEDA A,SHIOJIRI K,et al. Identification of a hexenal reductase that modulates the composition of green leaf volatiles[J].Plant physiology,2018,178(2):552-564.
[22] OHGAMI S J,ONO E,HORIKAWA M,et al. Volatile glycosylation in tea plants: Sequential glycosylations for the biosynthesis of aroma β-primeverosides are catalyzed by two Camellia sinensis glycosyltransferases[J].Plant physiology,2015,168(2):464-477.
[23] 赵冬香,高景林.植食性昆虫对寄主植物的定向行为研究进展[J].热带农业科学,2004,24(2):62-68.
[24] KRASNOFF S B,DUSSOURD D E. Dihydropyrrolizine attractants for arctiid moths that visit plants containing pyrrolizidine alkaloids[J].Journal of chemical ecology,1989,15(1):47-60.
[25] 王让剑,杨 军,孔祥瑞.茶树挥发性萜类物质研究进展[J].茶叶学报,2018,59(3):149-154.
[26] STAUDT M,JACKSON B,EL-AOUNI H,et al. Volatile organic compound emissions induced by the aphid Myzus persicae differ among resistant and susceptible peach cultivars and a wild relative[J].Tree physiology,2010,30(10):1320-1334.
[27] DICKE M. Induced plant volatiles: Plant body odours structuring ecological networks[J].The New Phytol,2016,210(1):10-12.
[28] LORETO F,SCHNITZLER J P. Abiotic stresses and induced BVOCs[J].Trends in plant science,2010,15(3):154-166.
[29] 张 凡.二化螟为害诱导水稻关键挥发物的释放节律及其功能分析[D].北京:中国农业科学院,2021.
[30] 刘明杨,李静静,卢少华,等.虫害诱导植物挥发物研究进展[J].华中昆虫研究,2015(11):43-49.
[31] LOUGHRIN J H,MANUKIAN A,HEATH R R,et al. Diurnal cycle of emission of induced volatile terpenoids by herbivore-injured cotton plant[J].Proceedings of the national academy of sciences,1994,91(25):11836-11840.
[32] HELSPER J P F G,DAVIES J A,BOUWMEESTER H J,et al. Circadian rhythmicity in emission of volatile compounds by flowers of Rosa hybrida L. cv. Honesty[J].Planta,1998,207(1):88-95.
[33] JOO Y S,SCHUMAN M C,GOLDBERG J K,et al. Herbivore-induced volatile blends with both “fast” and “slow” components provide robust indirect defence in nature[J].Functional ecology,2018,32(1):136-149.
[34] RÖSE U R,TUMLINSON J. Volatiles released from cotton plants in response to Helicoverpa zea feeding damage on cotton flower buds[J].Planta,2004,218(5):824-832.
[35] MEENTS A K,CHEN S P,REICHELT M,et al. Volatile DMNT systemically induces jasmonate-independent direct anti-herbivore defense in leaves of sweet potato (Ipomoea batatas) plants[J].Scientific reports,2019,9(1):17431.
[36] PICAZO A J,TERRAB A,BALAO F. Plant volatile organic compounds evolution: Transcriptional regulation, epigenetics and polyploidy[J].International journal of molecular sciences,2020, 21(23):1-18.
[37] 任 琴.马尾松快速诱导抗性及化学信号物质的研究[D].北京:北京林业大学,2006.
[38] SHIOJIRI K,OZAWA R,TAKABAYASHI J. Plant volatiles, rather than light,determine the nocturnal behavior of a caterpillar[J].PLos biology,2006,4(6):1044-1047.
[39] 孙仲享,宋圆圆,曾任森.植物挥发物介导的种内与种间关系研究进展[J].华南农业大学学报,2019,40(5):166-174.
[40] SHIVARAMU S,JAYANTHI P D K,KEMPRAJ V,et al. What signals do herbivore-induced plant volatiles provide conspecific herbivores?[J].Arthropod-plant interactions,2017,11(6):815-823.
[41] FROST C J,MESCHER M C,DERVINIS C,et al. Priming defense genes and metabolites in hybrid poplar by the green leaf volatile cis-3-hexenyl acetate[J].The new phytologist,2008,180 (3):722-734.
[42] ARIMURA G,TASHIRO K,KUHARA S,et al. Gene responses in bean leaves induced by herbivory and by herbivore-induced volatiles[J].Biochemical and biophysical research communications,2000,277(2):305-310.
[43] TAKABAYASHI J,SABELIS M W,JANSSEN A,et al. Can plants betray the presence of multiple herbivore species to predators and parasitoids?The role of learning in phytochemical information networks[J].Ecological research,2006,21(1):3-8.
[44] NASELLI M,URBANEJA A,SISCARO G,et al. Stage-related defense response induction in tomato plants by Nesidiocoris tenuis[J].IJMS,2016,17(8):1210.
[45] BOUAGGA S,URBANEJA A,RAMBLA J L,et al. Zoophytophagous mirids provide pest control by inducing direct defences, antixenosis and attraction to parasitoids in sweet pepper plants[J].Pest management science,2018,74(6):1286-1296.
[46] PÉREZ-HEDO M,URBANEJA-BERNAT P,JAQUES J A,et al. Defensive plant responses induced by Nesidiocoris tenuis(Hemiptera: Miridae) on tomato plants[J].Journal of pest science,2015,88(3):543-554.
[47] KALSKE A,SHIOJIRI K,UESUGI A,et al. Insect herbivory selects for volatile-mediated plant-plant communication[J].Current biology,2019,29(18):3128-3133.
[48] SJÖDIN K,PERSSON M,BORG-KARLSON A K,et al. Enantiomeric compositions of monoterpene hydrocarbons in different tissues of four individuals of Pinus sylvestris[J]. Phytochemistry,1996,41(2):439-445.
[49] CHAPMAN R F. Contact chemoreception in feeding by phytophagous insects[J].Annual review of entomology,2003,48(1):455-484.
[50] ROLAND M,MONIKA H. The significance of background odour for an egg parasitoid to detect plants with host eggs[J].Chemical senses,2005,30(4):337-343.
[51] 姚诚诚,杜立啸,李云河.虫害诱导植物信息化合物介导的植物间交流及机制[J].植物保护, 2021,47(6):1-10.
[52] 顾亚欣,王向向,母泽祺,等.植物挥发物影响植食性昆虫的定向行为研究概述[J].广西农学报,2022,37(2):84-89.
[53] 赵海燕,梁广文,陆永跃.虫害诱导果实挥发物对蝇蛹金小蜂趋性行为的影响及其成分初步鉴定[J].植物保护,2016,42(4):83-88.
[54] RIGSBY C M,MUILENBURG V,TARPEY T,et al. Oviposition preferences of Agrilus planipennis (Coleoptera: Buprestidae) for different ash species support the mother knows best hypothesis[J].Annals of the entomological society of America,2014,107(4):773-781.
[55] DE M C M,MESCHER M C,TUMLINSON J H. Caterpillar-induced nocturnal plant volatiles repel conspecific females[J].Nature,2001,410(6828):577-580.
[56] 谢云忠.虫害诱导马尾松挥发物对微红梢斑螟的产卵选择影响[D].贵阳:贵州大学,2022.
[57] MATU F K,MURUNGI L K,MOHAMED S,et al. Behavioral response of the greenhouse whitefly (Trialeurodes vaporariorum) to plant volatiles of Ocimum basilicum and Tagetes minuta [J].Chemoecology,2020,31(1):47-62.
[58] 姜宗庆.杜仲叶与香椿叶混合提取物对谷蠹的驱避和毒杀作用研究[J].现代园艺,2021,44(21):35-36.
[59] DICKE M,BALDWIN I T. The evolutionary context for herbivore-induced plant volatiles: Beyond the “cry for help”[J].Trends in plant science,2010,15(3):167-175.
[60] PARÉ P W,TUMLINSON J H,LEWIS W J. Plant production of volatile semiochemicals in response to insect-derived elicitors[J].Novartis foundation symposium,1999,223:95-105.
[61] 禹海鑫,叶文丰,孙民琴,等.植物与植食性昆虫防御与反防御的三个层次[J].生态学杂志,2015,34(1):256-262.
[62] TURLINGS T C J,TUMLINSON J H,LEWIS W J. Exploitation of herbivore-induced plant odors by host-seeking parasitic wasps[J].Science,1990,250(4985):1251-1253.
[63] 范培珍,韩善捷,韩宝瑜.灰茶尺蠖为害诱导茶树释放的互利素的鉴定[J].中国生物防治学报,2020,36(1):65-71.
[64] ALI M Y,NASEEM T,ZHANG J P,et al. Plant volatiles and herbivore induced plant volatiles from chili pepper act as attractant of the aphid parasitoid Aphelinus varipes (Hymenoptera: Aphelinidae)[J].Plants,2022,11(10):1350.
[65] SHI J,MA C Y,QI D D,et al. Transcriptional responses and flavor volatiles biosynthesis iX6Jf5jVXYBYQcRGH2GsKDw==n methyl jasmonate-treated tea leaves[J].BMC plant biology,2015,15:233.
[66] RASMANN S,KÖLLNER T G,DEGENHARDT J,et al. Recruitment of entomopathogenic nematodes by insect-damaged maize roots[J].Nature,2005,434(7034):732-737.
[67] 闫俊杰.马铃薯块茎蛾性信息素及其添加物生物活性研究[D].呼和浩特:内蒙古农业大学,2021.
[68] 管维康,王小云,陆 温,等.朱红毛斑蛾和花胸姬蜂对虫害诱导榕树挥发物的触角电位及行为反应[J].植物保护,2022, 48(3):81-89.
[69] WANG H M,BAI P H,ZHANG J,et al. Attraction of bruchid beetles Callosobruchus chinensis (L.) (Coleoptera: Bruchidae) to host plant volatiles[J].Journal of integrative agriculture,2020, 19(12):3035-3044.
[70] GAFFKE A M,SING S E,MILLAR J G,et al. An herbivore-induced plant volatile from saltcedar (Tamarix spp.) is repellent to Diorhabda carinulata (Coleoptera: Chrysomelidae)[J].Environmental entomology,2020,49(5):1063-1070.
[71] CONBOY N J A,MCDANIEL T,GEORGE D,et al. Volatile organic compounds as insect repellents and Plant elicitors: An integrated pest management (IPM) strategy for glasshouse whitefly (Trialeurodes vaporariorum)[J].Journal of chemical ecology,2020, 46 (11/12):1090-1104.
[72] 邬亚红,衡 森,周福才,等.芹菜植株挥发物对蔬菜烟粉虱的驱避作用[J].环境昆虫学报, 2019,41(4):900-907.
收稿日期:2023-10-31
基金项目:国家自然科学基金项目(31760209;32260398);榆林学院研究生创新基金一般项目(2023YLYCX16)
作者简介:冯江帅(1998-),男,陕西榆林人,在读硕士研究生,研究方向为作物有害生物控制,(电话)15291234967(电子信箱)fengjiangs8@163.com;通信作者,刘永华(1978-),男,山西阳泉人,教授,博士,主要从事作物有害生物控制研究,(电话)13571216403(电子信箱)liuyonghuaa@126.com。

