阿耶波多氏芽孢杆菌对盐胁迫下绿豆的促生效果





摘要:测定了从红树林分离出来的耐盐内生细菌阿耶波多氏芽孢杆菌(Bacillus aryabhattai)对植物的促生特性,研究了盐胁迫下其定殖前后对绿豆[Vigna radiata (Linn.) Wilczek]生长的影响。结果表明,阿耶波多氏芽孢杆菌对NaCl的最高耐受浓度为110 g/L,最高耐受pH为10.0,产IAA能力为(154.474±1.526)μg/mL、ACC脱氨酶活性为(0.125 6±0.051 2) U/mg、溶有机磷和无机磷能力分别为1.89±0.03和2.27±0.01;基因组DNA里扩增出appA和phoD两个基因,这是该菌具溶磷能力的分子机理。阿耶波多氏芽孢杆菌在绿豆根、茎、叶3个部位的定殖率分别为68.27 %、63.48%、50.00%,定殖组的绿豆幼苗叶绿素含量和SOD活性高于对照组,说明阿耶波多氏芽孢杆菌的定殖有助于绿豆幼苗抗氧化能力的提高,从而提高绿豆的耐盐性。
关键词:阿耶波多氏芽孢杆菌(Bacillus aryabhattai);植物促生菌;绿豆[Vigna radiata (Linn.) Wilczek];耐盐性
中图分类号:S551+.9;S182 文献标识码:A
文章编号:0439-8114(2024)10-0008-06
DOI:10.14088/j.cnki.issn0439-8114.2024.10.002 开放科学(资源服务)标识码(OSID):
Abstract: The characteristics of promoting plant growth of salt-tolerant endophytic bacterium Bacillus aryabhattai isolated from mangrove were determined, and the effects of its colonization into mung bean [Vigna radiata (Linn.) Wilczek] under salt stress were studied. The results showed that the highest NaCl tolerant concentration of B. aryabhattai was 110 g/L, the highest pH tolerant value was 10.0, the IAA production capacity was (154.474±1.526) μg/mL, the ACC deaminase activity was (0.125 6±0.051 2) U/mg, and the capacities of dissolving organic phosphorus and inorganic phosphorus were 1.89±0.03 and 2.27±0.01, respectively. Two genes, appA and phoD, were amplified in the genomic DNA, which was the molecular mechanism of the phosphorus-solubilizing ability of the bacteria. The colonization rates of B. aryabhattai in roots, stems and leaves were 68.27%, 63.48% and 50.00%, respectively. The chlorophyll content and superoxide dismutase (SOD) activity of mung bean seedlings in the colonization group were higher than those in the control group, indicating that the colonization of B. aryabhattai contributed to the improvement of the antioxidant capacity of mung bean seedlings, thus effectively increasing the salt tolerance of mung bean.
Key words: Bacillus aryabhattai; plant growth-promoting bacteria; mung bean [Vigna radiata (Linn.) Wilczek]; salt tolerance
盐胁迫是农业生产中对植物有害的胁迫。当植物暴露在极端盐水条件下时,其新陈代谢会受损,对植物生长和农业生产均产生不利影响[1]。全球大约有50%的耕地受到盐胁迫的影响[2]。盐胁迫以多种方式影响植物,如水分胁迫、离子毒性、营养破坏、膜破坏、代谢循环改变、氧化应激、细胞分裂和遗传毒性[3]。在不改变土壤特性的情况下,微生物(生物增强)是一种环境可持续的土壤去污解决方案。许多微生物可以吸收和沉淀土壤中的NaCl,对水体净化有一定作用,但在实际应用中存在缺少高抗盐性的微生物菌种和含盐土壤营养物质缺乏不利于微生物生长这两个关键问题,虽然营养物质的短缺可以通过添加营养物质和改善生长环境来解决,但选育高耐盐性微生物才是真正解决提高盐碱地利用的关键所在[4]。
内生细菌是一种独特的微生物,可以潜伏或主动定殖在植物内部组织中,而不会对宿主造成实质性伤害。某些内生细菌可以在正常或不利条件下促进植物生长和健康,被认为是植物促生菌(Plant growth-promoting bacteria,PGPB),这些有益微生物在农业实践中的应用是不可或缺的组成部分,可以通过处理作物种子或喷洒在植物叶面来提高作物在各种非生物胁迫下的生产力[5],也可以通过几种协同机制提高植物耐盐力[6]。第一种是通过引起渗透物质积累和植物生长调节剂信号,如吲哚-3-乙酸(IAA)和赤霉素(GA3),或通过提高1-氨基环丙烷-1-羧酸(ACC)脱氨酶的活性和形成生物膜等缓解渗透胁迫[7-10]。第二种是通过实现离子稳态和改善养分的吸收减少离子胁迫和营养缺乏[11],如磷增溶、铁固定。第三种是通过增加光合作用的潜力减少氧化应激[12]。植物促生菌可以通过维持兼容活性氧(Reactive oxygen species,ROS)水平的细胞功能改善植物在非生物胁迫情况下的性能。正因为植物生长促进菌对寄主植物生长和健康的有益作用,所以多种内生细菌作为生物接种剂应用于促进植物在盐碱、重金属污染地的生长发育。
本研究从红树林的秋茄(Kandelia obovata)和木榄(Bruguiera gymnorhiza)中共同分离出了耐盐内生细菌阿耶波多氏芽孢杆菌(Bacillus aryabhattai),并对其促进植物生长性能进行体外试验,评价其对绿豆[Vigna radiata (Linn.) Wilczek]在盐胁迫下生长的影响,以期开发一些有价值的内生细菌作为生物接种剂提高农作物的生物量产量,还可为提高盐碱地的利用率提供潜在的机会。
1 材料与方法
1.1 材料
供试菌株为从红树林的秋茄和木榄中分离出的内生细菌阿耶波多氏芽孢杆菌。供试植物为从超市购买的普通绿豆。
1.2 方法
1.2.1 阿耶波多氏芽孢杆菌的耐盐碱能力分析 挑取活化的阿耶波多氏芽孢杆菌的单菌落,在LB液体培养基培养16 h,菌液按1%(OD500 nm约为1.2)的浓度分别转接到不同盐碱浓度的液体LB培养基,设置NaCl浓度为0、10、30、50、70、90、110、120、130 g/L;碱的处理为pH从7.0开始,处理以0.5等差值递增,直至pH为10.5。所有处理的培养条件都为30 ℃、150 r/min培养48 h,3次重复。
1.2.2 阿耶波多氏芽孢杆菌促生生理分析 采用比色法[13]测定IAA活性,分析菌株阿耶波多氏芽孢杆菌产IAA的能力;参考王玉琴等[14]的方法测定阿耶波多氏芽孢杆菌溶有机磷和无机磷的能力,计算式为SI=D/d,其中,SI为溶磷能力,D为溶磷圈直径,d为菌落直径;采用双抗体一步夹心法酶联免疫吸附试验(ELISA)(Microorganism ACCD ELISA KIT YJ009852,上海源桔生物科技中心)方法测定阿耶波多氏芽孢杆菌ACC脱氨酶活性;采用CAS检测平板法[15]分析阿耶波多氏芽孢杆菌分泌铁载体的能力。
1.2.3 阿耶波多氏芽孢杆菌溶磷能力相关基因扩增 以阿耶波多氏芽孢杆菌基因组DNA为模板,扩增与溶磷能力有关的基因appA和phoD[16,17]。引物序列见表1,扩增产物经1%琼脂糖凝胶电泳检测,送往北京擎科生物科技股份有限公司福州分公司进行测序。
1.2.4 盐胁迫下阿耶波多氏芽孢杆菌定殖前后绿豆促生生理分析 绿豆分为试验组和对照组2组,试验组用液体LB培养基培养16 h的阿耶波多氏芽孢杆菌菌液浸泡,对照组用无菌去离子水浸泡,均浸泡24 h,浸泡好后的绿豆种植于无菌沙土花盆中,每盆保证10株生长一致的绿豆幼苗。等绿豆发芽后,地上部分长到5 cm长度后,配制0、3、5、7、9、11 g/L的NaCl溶液,每天浇入花盆中50 mL,连续10 d,10 d后正常浇水处理。所有处理3次重复。
采用95 %乙醇法[18]测定绿豆幼苗叶绿素含量;采用硫代巴比妥酸法19]测定绿豆幼苗丙二醛含量;采用NBT光还原法[20]测定绿豆幼苗超氧化物歧化酶(SOD)活性。
1.2.5 阿耶波多氏芽孢杆菌定殖绿豆规律分析 参考陈惠静等[19]的方法,分别分离试验组和对照组的绿豆幼苗内生细菌,提取内生细菌的基因组DNA,扩增16S rDNA序列,选用Hinf Ⅰ、Hae Ⅲ、Pst Ⅰ和Taq Ⅰ这4种限制性内切酶消化16S rDNA扩增产物,经2%琼脂糖凝胶电泳检测并比对阿耶波多氏芽孢杆菌16S rDNA序列,统计绿豆幼苗不同组织菌株数。
2 结果与分析
2.1 阿耶波多氏芽孢杆菌最高耐盐碱度分析
由图1可知,经过48 h的培养,在NaCl浓度高于120 g/L和pH高于10.5的LB液体培养基中未见混浊,推断阿耶波多氏芽孢杆菌对NaCl的最高耐受浓度为110 g/L,对pH的最高耐受值为10.0。
2.2 阿耶波多氏芽孢杆菌促生特性分析
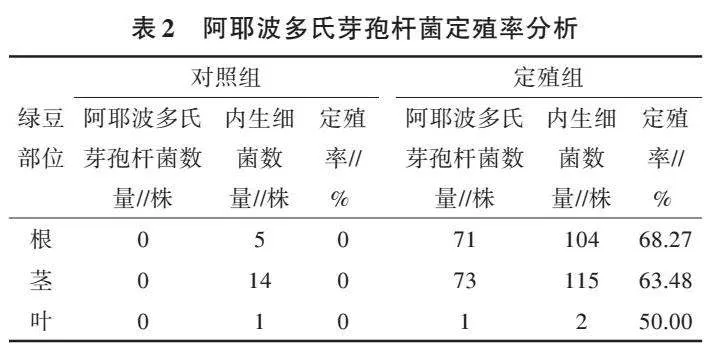
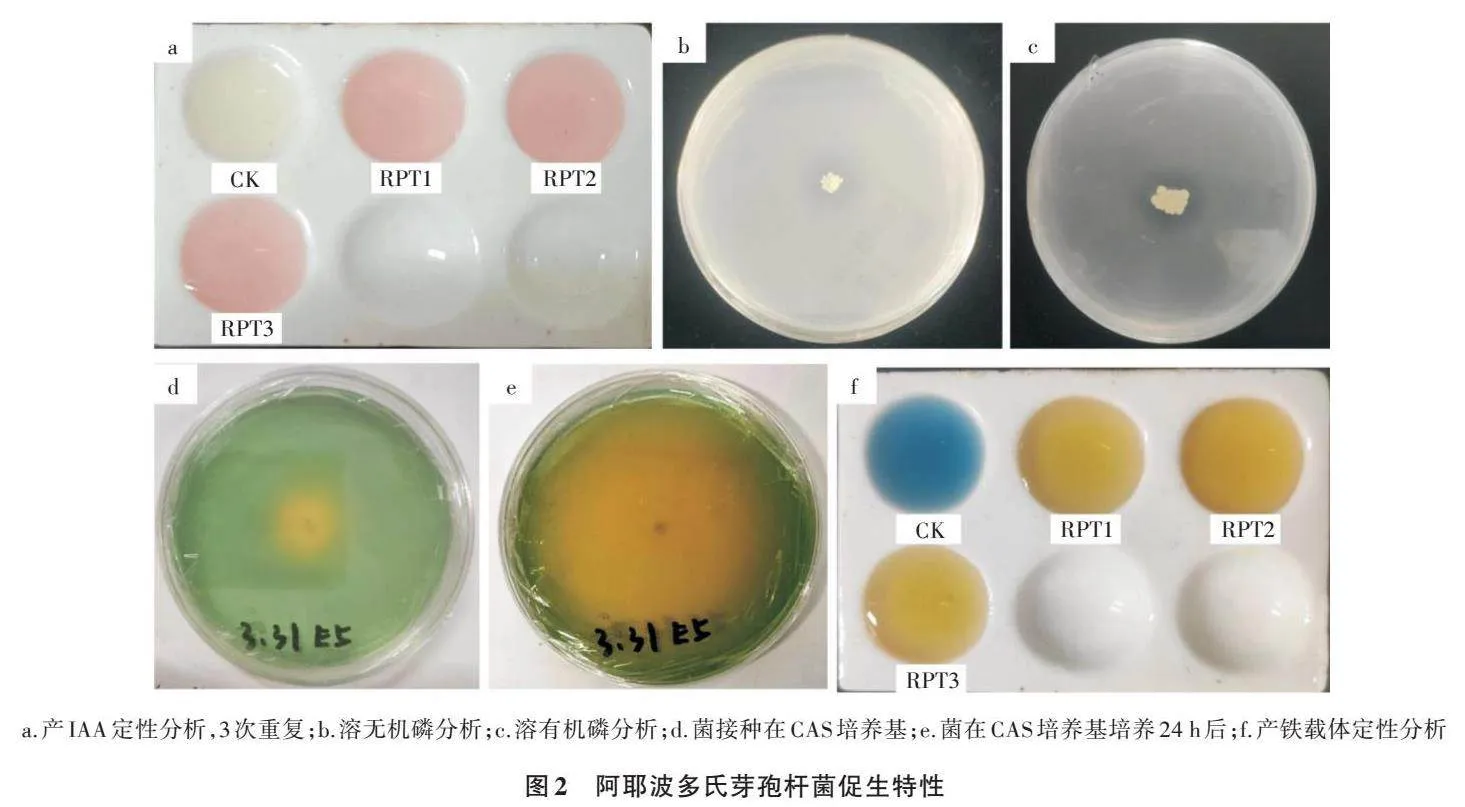
阿耶波多氏芽孢杆菌产IAA定性分析如图2a所示,白瓷板上液体呈现粉色,表明菌株具有分泌IAA能力。对产IAA能力的定量分析表明,IAA产量为(154.474±1.526)μg/mL,说明该菌具有较强的产IAA能力。阿耶波多氏芽孢杆菌溶有机磷和溶无机磷现象见图2b和图2c,观察到培养基上菌株周围均出现明显的透明圈,表明菌株具有溶有机磷和无机磷的能力,通过测量与计算得出,溶无机磷能力为2.27±0.01,溶有机磷能力为1.89±0.03。双抗体一步夹心法酶联免疫吸附试验(ELISA)测定结果显示阿耶波多氏芽孢杆菌ACC脱氨酶活性为(0.125 6±0.051 2)U/mg。阿耶波多氏芽孢杆菌在培养基培养24 h后,培养基发生明显变色(图2d、图2e和图2f),说明该菌具有产铁载体的能力,通过定量分析可知,该菌产铁载体单位为81.430%±0.814%。综上所述可知,该菌具有所测试的所有植物促生特性,从而最大限度地发挥内生细菌对植物生长的促进作用。
2.3 阿耶波多氏芽孢杆菌溶磷能力相关基因扩增
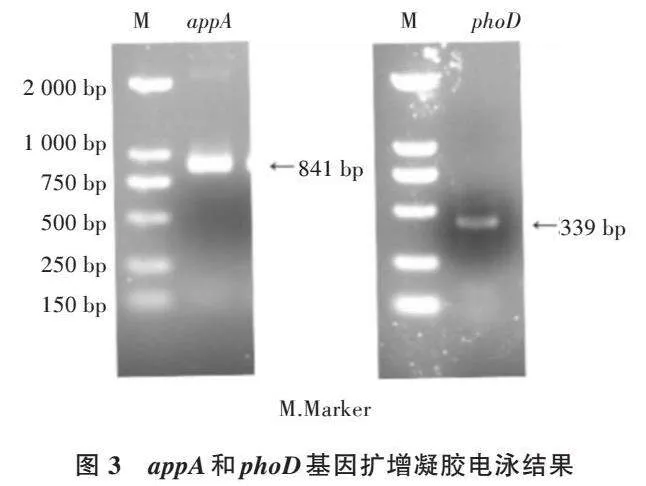
根据文献[17,18]设计了碱性磷酸酶和植酸酶基因的PCR引物,提取阿耶波多氏芽孢杆菌基因组DNA 进行PCR扩增,PCR产物进行1%琼脂糖凝胶电泳,结果如图3所示。其中,appA基因的扩增长度为841 bp,phoD基因的扩增长度为339 bp,推断阿耶波多氏芽孢杆菌具有溶磷能力的原因可能与这两个基因相关。
2.4 盐胁迫下阿耶波多氏芽孢杆菌定殖前后绿豆促生生理分析
通过检测阿耶波多氏芽孢杆菌定殖前后绿豆幼苗叶片的叶绿素含量、丙二醛含量和SOD活性3个生长生理指标(图4)可知,对照组和试验组叶绿素含量均随NaCl浓度的增加先上升后降低,且均在NaCl浓度为5 g/L时叶绿素含量最高,试验组的叶绿素含量均高于对照组;菌定殖前后绿豆幼苗叶片丙二醛含量整体呈随NaCl浓度升高而降低的趋势,除5 g/L和11 g/L的NaCl两个处理的丙二醛含量定殖组与对照组差异显著外,其他处理组二者间差异均不显著;SOD活性随NaCl浓度升高而升高,但除5 g/L和7 g/L的NaCl两个处理组菌定殖前后差异显著外,其他处理组二者间差异均不显著。
2.5 阿耶波多氏芽孢杆菌定殖绿豆规律分析
分离绿豆幼苗的不同组织内生细菌,通过酶切分型图谱(图5)分析其在绿豆中的定殖率。结果(表2)表明,定殖组的内生细菌数量明显高于对照组,阿耶波多氏芽孢杆菌在绿豆根、茎、叶3个部位的定殖率分别达68.27%、63.48%和50.00%,且定殖率表现为根>茎>叶,推测内生细菌对绿豆植株提高耐盐能力起到至关重要的作用。当定殖率大于50%时,说明该内生菌为优势菌种。
3 讨论
研究证实,植物促生菌能够在寄主植物内部组织定殖,并与寄主植物进一步建立有益的共生关系,从而提高寄主植物的生长和抗逆性[21-23]。这一功能确实有助于以更可持续的方式提高盐碱地农作物的生物量和产量,提高盐碱地利用率[24]。细菌感染并在寄主植物组织中的定殖促进了寄主植物的生长[25]。内生细菌的定殖能力可使内生细菌在各种生物和非生物胁迫下获得更有利的环境,与根际细菌相比,内生细菌具有天然土壤细菌的竞争优势[26]。因此,有学者认为内生细菌能够在寄主植物的内部组织中定殖,是一种高效的促进植物生长的接种剂[27]。内生细菌对植物具有促生特性,包括IAA生产能力、铁载体生产能力、固氮能力、氨生产能力、无机磷酸盐增溶能力或ACC脱氨酶活性,从而促进植物在正常或者逆境下的生长。本研究中的阿耶波多氏芽孢杆菌能够产生IAA和铁载体,溶解无机和有机磷酸盐,促进植物生长和耐盐性,这与早期研究报道一致[28-30];从阿耶波多氏芽孢杆菌基因组中扩增出appA和phoD基因,appA是微生物的酸性植酸酶编码基因,phoD是微生物编码碱性磷酸酶的关键基因,植酸酶和酸性植酸酶是土壤中有机磷矿化的重要酶类[31-33]。提高ACC脱氨酶活性是植物生长促进菌的共同特征,ACC脱氨酶通过将ACC(乙烯的前体)降解为氨和α-酮丁酸盐来降低乙烯水平,从而促进植物生长,缓解不良环境对植物的胁迫[30,34,35]。
研究表明,每种内生细菌都至少具有两种或两种以上促生特性,不同内生细菌组合的接种剂可能具有不同的植物促生特性,这些特性可以相互补充,从而在寄主植物生命周期的不同时期利用各种机制增强其促进植物生长的能力[28-30]。本研究中绿豆幼苗叶片丙二醛含量在菌定殖前后没有出现随NaCl浓度升高而相应提高或降低的规律,推断其原因是只有一种内生细菌的侵染,在未来的研究中,应更关注两种或者两种以上内生细菌的共同侵染。
4 小结
本研究从红树林(秋茄和木榄)分离出内生细菌的耐盐阿耶波多氏芽孢杆菌,将其定殖在绿豆体内,并对其促生特性、定殖规律和促生效果进行了系统的研究。在促生特性方面,阿耶波多氏芽孢杆菌具有一系列的相关特性,包括IAA的产生、铁载体的产生、磷酸盐的溶解和ACC脱氨酶的活性,也证实了阿耶波多氏芽孢杆菌可以成功地在宿主体内定殖。综上所述,阿耶波多氏芽孢杆菌在绿豆的组织中具有生存潜力,可以作为内生生物接种剂的合适菌种,以提高农作物的抗逆性,促进农作物在贫瘠和盐碱地上的生长和生物量产量。
参考文献:
[1] EL-BELTAGI H, MOHAMED H. Reactive oxygen species, lipid peroxidation and antioxidative defense mechanism[J]. Notulae botanicae horti agrobotanici cluj-napoca, 2013,41: 44-57.
[2] CAO C, LI X, YU L, et al. Foliar 2,3-dihydroporphyrin iron (III) spray confers ameliorative antioxidation, ion redistribution and seed traits of salt-stressed soybean plants[J]. Journal of soil science and plant nutrition, 2018,18(4):1048-1064.
[3] GHONAIM M M, MOHAMED H I, OMRAN A A A. Evaluation of wheat (Triticum aestivum L.) salt stress tolerance using physiological parameters and retrotransposon-based markers[J]. Genetic resources and crop evolution, 2021,68(1): 227-242.
[4] WANG T, SUN H, MAO H, et al. The immobilization of heavy metals in soil by bioaugmentation of a UV-mutant Bacillus subtilis 38 assisted by NovoGro biostimulation and changes of soil microbial community[J]. Journal of hazardous materials, 2014,278: 483-490.
[5] HAITAO Y, MO W, LI C, et al. The salt stress relief and growth promotion effect of Rs-5 on cotton[J]. Plant and soil, 2007,297: 139-145.
[6] ETESAMI H, BEATTIE G A. Mining halophytes for plant growth-promoting halotolerant bacteria to enhance the salinity tolerance of non-halophytic crops[J]. Front Microbiol, 2018,9: 148.
[7] ZHAO L, XU Y, LAI X. Antagonistic endophytic bacteria associated with nodules of soybean (Glycine max L.) and plant growth-promoting properties[J]. Brazilian journal of microbiology,2018,49(2):269-278.
[8] 黄 臣, 梁银萍, 韩玲娟, 等.一株达乌里胡枝子耐盐碱内生细菌的鉴定和促生特性[J].微生物学通报, 2023,50(1): 218-234.
[9] 苗阳阳, 张艳蕊, 宋 标, 等.碱蓬根际和内生细菌菌株对盐碱胁迫下苜蓿生长的影响[J].草业学报, 2022,31(9): 107-117.
[10] 钮旭光, 梅 韩, 宋立超, 等.翅碱蓬内生细菌鉴定及耐盐促生作用研究[J].沈阳农业大学学报, 2011,42(6): 698-702.
[11] KUMAR ARORA N, FATIMA T, MISHRA J, et al. Halo-tolerant plant growth promoting rhizobacteria for improving productivity and remediation of saline soils[J]. Journal of advanced research, 2020,26: 69-82.
[12] BHARTI N, PANDEY S S, BARNAWAL D, et al. Plant growth promoting rhizobacteria Dietzia natronolimnaea modulates the expression of stress responsive genes providing protection of wheat from salinity stress[J]. Scientific reports, 2016,6: 34768.
[13] 闵 勇,刘晓艳, 陈 凌, 等.一株产吲哚乙酸巴基斯坦赖氨酸芽胞杆菌的快速筛选与鉴定[J].湖北农业科学,2021,60(23):68-70.
[14] 王玉琴, 杨成德, 王 颖, 等.针茅内生细菌菌株265ZY4的鉴定及其生物学功能[J].微生物学通报, 2015,42(1):101-109.
[15] 焦诗雨, 李旭东, 张婷婷, 等.一株羽毛针禾内生细菌的鉴定、功能及促生特性[J].微生物学通报, 2022,49(8): 3179-3191.
[16] 熊梦霞, 廖华媛, 郑 金, 等.一株产高酶活性碱性磷酸酶解淀粉芽孢杆菌的分离及其phoD碱性磷酸酶基因的克隆与表达[J].微生物学通报, 2022,49(2): 505-513.
[17] 陈中伟, 郑 璞, 陈 鹏, 等.耐热植酸酶突变体的筛选及性质研究[J].中国生物工程杂志, 2021,41(S1): 30-37.
[18] 王学奎.植物生理生化实验原理和技术[M].北京: 高等教育出版社, 2006.
[19] 陈惠静, 赖安萍, 范铭丰, 等.秋茄和木榄耐盐内生细菌筛选及鉴定[J].西昌学院学报, 2022,36(2): 8-12.
[20] 高俊凤.植物生理学实验指导[M].北京: 高等教育出版社, 2006.61-64.
[21] SARAVANAKUMAR D, SAMIYAPPAN R. ACC deaminase from Pseudomonas fluorescens mediated saline resistance in groundnut (Arachis hypogea) plants[J]. Journal of applied microbiology, 2007,102(5): 1283-1292.
[22] MAYAK S,TIROSH T,GLICK B R. Plant growth-promoting bacteria that confer resistance to water stress in tomatoes and peppers[J]. Plant science, 2004,166(2): 525-530.
[23] 朱梦卓, 孙洋洋, 赵晓妍, 等.野大豆内生假单胞菌YDX26的鉴定及促生抗逆特性[J].微生物学通报, 2021,48(11): 4100-4110.
[24] AHEMAD M, KIBRET M. Mechanisms and applications of plant growth promoting rhizobacteria: Current perspective[J]. Journal of king saud university - Science, 2013,26(1):1-20.
[25] MEI C, LARA-CHAVEZ A, LOWMAN S, et al. The use of endophytes and mycorrhizae in switchgrass biomass production[M].Boca Raton,FL,USA:CRC press, 2014. 67-108.
[26] REINHOLD-HUREK B, HUREK T. Life in grasses: diazotrophic endophytes[J]. Trends in microbiology, 1998,6(4): 139-144.
[27] SHENG X F, XIA J J, JIANG C Y, et al. Characterization of heavy metal-resistant endophytic bacteria from rape (Brassica napus) roots and their potential in promoting the growth and lead accumulation of rape[J]. Environmental pollution, 2008,3: 156.
[28] JHA P, KUMAR A. Characterization of novel plant growth promoting endophytic bacterium Achromobacter xylosoxidans from wheat plant[J]. Microbial ecology, 2009,58(1): 179-188.
[29] JHA B, GONTIA I, HARTMANN A. The roots of the halophyte Salicornia brachiata are a source of new halotolerant diazotrophic bacteria with plant growth-promoting potential[J]. Anglais, 2012,356(1): 265-277.
[30] GLICK B R. The enhancement of plant growth by free-living bacteria[J]. Canadian journal of microbiology,1995,41(2): 109-117.
[31] CHEN X, JIANG N, CONDRON L M, et al. Impact of long-term phosphorus fertilizer inputs on bacterial phoD gene community in a maize field, Northeast China[J]. Science of the total environment, 2019,669: 1011-1018.
[32] DASSA J,MARCK C,BOQUET P. The complete nucleotide sequence of the Escherichia coli gene appA reveals significant homology between pH 2.5 acid phosphatase and glucose-1-phosphatase[J]. Journal of bacteriology, 1990,172: 5497-5500.
[33] 张美珍,王丽娜,刘 权,等.耐盐碱溶磷菌的筛选鉴定及其在大豆生长中的功能验证[J].河南农业科学,2022,51(5): 34-44.
[34] PENROSE D M, MOFFATT B A, GLICK B R. Determination of 1-aminocycopropane-1-carboxylic acid (ACC) to assess the effects of ACC deaminase-containing bacteria on roots of canola seedlings[J]. Canadian journal of microbiology,2001,47(1):77-80.
[35] CHEN L, LUO S, XIAO X, et al. Application of plant growth-promoting endophytes (PGPE) isolated from Solanum nigrum L. for phytoextraction of Cd-polluted soils[J]. Applied soil ecology, 2010,46(3): 383-389.
收稿日期:2024-05-20
基金项目:福建省自然基金面上项目(2020J01375);国家级大学生创新创业项目(202311311002);福建省大学生创新创业项目(S202311311071)
作者简介:刘彩婷(2002-),女,福建福清人,在读本科生,专业方向为生物技术与生物育种,(电子信箱)1597324463@qq.com;通信作者,刘希华(1978-),男,福建闽清人,教授,主要从事抗逆境植物选育,(电子信箱)xihua7808@163.com。

