静电纺丝纳米纤维在药物输送领域的应用


摘 要:药物输送系统能够最大限度地提高递送药物的治疗效果,并减少副作用,引起了研究者的广泛关注。随着患者治疗需求的不断增加,传统药物输送方法无法充分适应患者体内的需求。而基于静电纺丝纳米纤维的给药系统具有高比表面积、可调节孔隙率、良好的机械耐久性、药物包封性、生物相容性和高缓释性能,为药物载量和可定制释放特性提供了兼容的环境。通过对静电纺丝原理以及药物封装方法的阐述,体现了静电纺丝纳米纤维膜作为新兴药物输送载体的独特优势,同时探究了不同种类的载药纳米纤维膜在未来应用中的可能性。分析结果表明,通过静电纺丝法可以制备出不同形貌结构的纳米纤维,并通过合理结构设计可以调控药物在体内的释放行为和效率。因此,将载药纳米纤维功能化,可以得到具有药物缓释、抗菌、消炎等性能的药物输送系统,可为解决某些药物应用困难、收效甚微的难题提供新的途径。
关键词:静电纺丝;药物输送;抗癌症;抗感染;非甾体类抗炎药;组织工程
中图分类号:TS199
文献标志码:A
文章编号:1009-265X(2024)10-0056-12
药物输送系统是在空间、时间和计量上全面调控药物在生物体内分布的技术体系,是药物能否有效作用于患者体内的关键。传统的药物主要以片剂、注射液、软胶囊等形式进行输送,工艺成熟,产量可观,疗效稳定[1]。但随着药物的研发,更多难溶性药物的出现,使得某些药物因子难以通过传统的口服或注射手段充分发挥疗效,影响患者康复[2-3];同时人体内部细胞膜对某些化学物质具有良好的阻断作用,在一定程度上也会影响药物因子的疗效。
随着时代的进步和科技的发展,医学技术、医疗设备日新月异,多种新型药物输送技术百花齐放,为解决医学药物的临床瓶颈提供了强有力的指导,为众多新型药物的临床转化提供了强大动力。静电纺丝技术作为目前制备纳米纤维的主要方法之一,由于所制备的纤维具有独特的结构和纳米尺寸效应,在药物输送领域展现出诸多优势。其高孔隙率和高比表面积增加了药物的吸附面积,极大地提高了载药量。纳米纤维的制备过程不会对药物产生化学修饰,保持了药物的生物活性,为药物的良好输送奠定了基础[4]。静电纺丝选材的灵活性,纺丝过程的多样性也使得纳米纤维产品功能丰富多样,更能满足对不同药物进行包覆输送释放的要求,来保证药效在患者体内的高效利用[5-7]。总之,采用纳米纤维对药物进行包覆,可实现“载药剂量高”“运药损量少”“释药精准”“控药可调”等多种作用,是目前医学释药领域极具前景的方法之一,对实现药物研发最后一公里的跨越至关重要[8]。但随着研究的深入,也发现了一些问题亟待解决,如载药纳米纤维在人体内是否会引发免疫反应,以及纤维结构如何影响药物释放等。
本文综述基于静电纺丝纳米纤维的药物输送系统的研究进展,探讨使用不同的合成聚合物和天然聚合物纳米纤维制备药物输送系统的差异,并对未来的发展前景进行展望。
1 静电纺丝
静电纺丝是一种利用静电原理大规模制备均匀、连续纳米纤维的方法,所制备的纳米纤维形貌规整、表面光滑。通过化学修饰(如引入分子或功能性聚合物)、物理沉积(在纳米纤维表面沉积金属或非金属元素)、材料复合(将不同性能的聚合物进行混纺)等方法可对纤维进行改性,使该技术广泛应用于医疗、环保、能源和传感器等领域。静电纺丝的基本原理是将聚合物溶液或熔体置于高压静电场中,静电场中的电压在聚合物液体中引起电荷运动,并拉伸下垂液滴的形状(通常是由表面张力形成的球体)。一旦带电聚合物液体的静电斥力高于表面张力,就会形成被称为泰勒锥的圆锥形[9-10],并且射流从锥尖开始。如果聚合物液体中存在足够的内聚力,就会从泰勒锥喷出稳定的射流,使聚合物链相互拉伸,形成均匀的细丝。随着溶剂的蒸发,细丝剧烈摆动沉积在收集装置上形成纳米纤维[11-13]。图1显示了收集装置的种类,主要有静态板、旋转滚筒、旋转圆盘和网格等[8]。
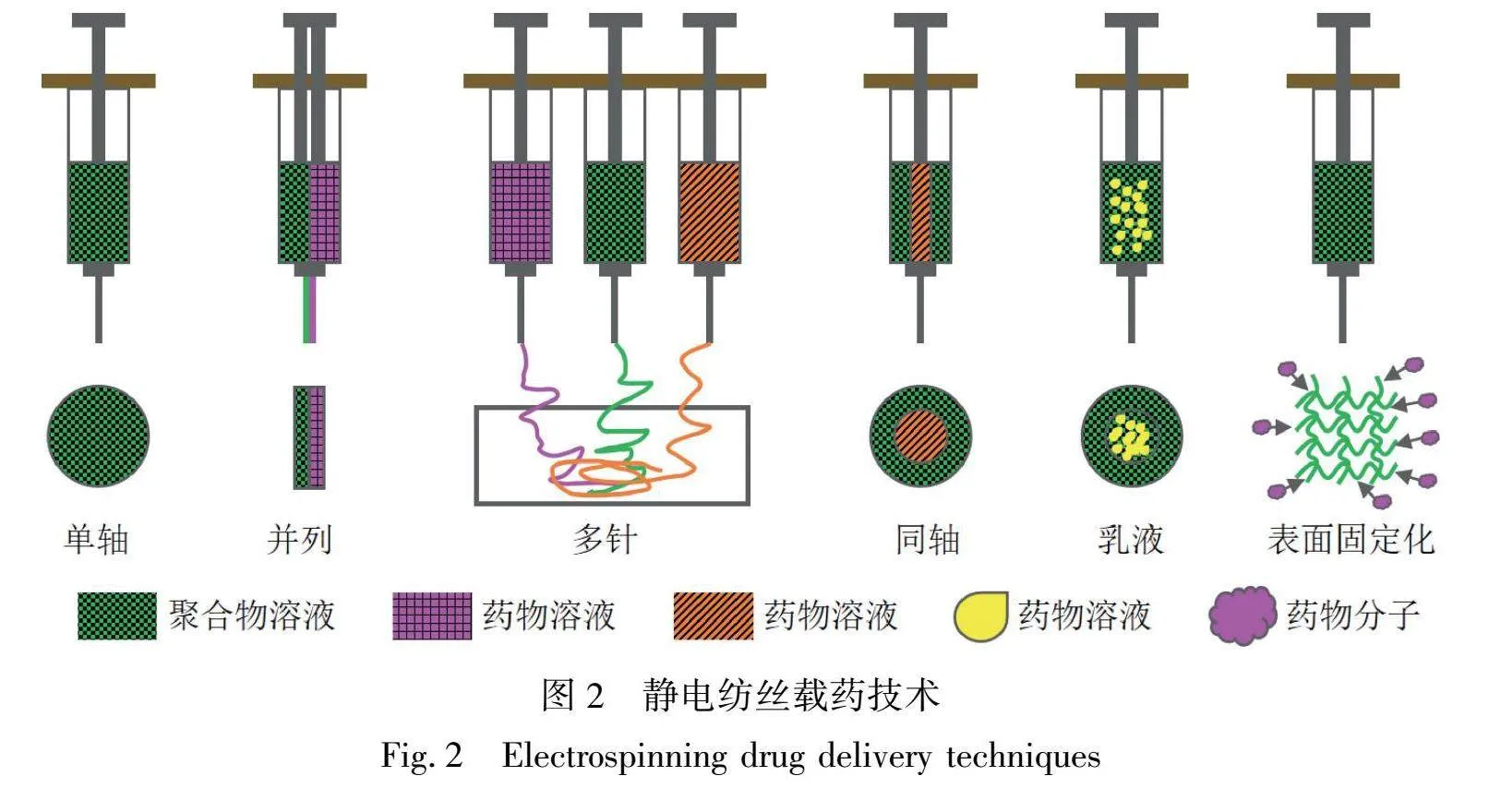
静电纺丝纳米纤维具有比表面积高、直径和结构可调、连接孔隙率高、机械柔韧性好、易于加工,以及对各种表面活性剂具有良好的包封能力等优点[14]。然而,静电纺丝过程中的各种参数严重影响表面活性剂的形成、包封和释放。这些参数可分为溶液性质(浓度、粘度、电导率、表面张力和介电常数)、工艺条件(流速、施加电压、接收距离和针头直径)和环境条件(湿度和温度)。通过采用最佳参数,可以实现最大的药物封装和释放,为药物输送系统提供了可行性[15-16],这已广泛应用于生物医学抗菌、组织工程、抗氧化剂、生物传感器、伤口愈合和药物递送等领域。图2展示了几种静电纺丝和封装方法[8]。静电纺丝纳米纤维药物递送系统通过调节纳米纤维的形状、直径、孔隙率以及聚合物和包封药物之间的比例,对释放动力学提供特殊控制[17-18]。通过与单轴静电纺丝溶液直接共混来封装各种活性
药物是功能化的主要方法,这在封装不同的亲水和疏水药物方面具有良好的优势,特别是在制造“快速溶解”药物传递系统方面[19]。并列和多针静电纺丝是将两种或多种药物封装在纳米纤维中的理想方法,可用于潜在的治疗,基于静电纺丝纳米纤维的“快速溶解”系统在这方面也不例外[20]。同轴静电纺丝利用多种溶液通过同轴毛细管同时流动,通过物理分离形成核/壳纳米纤维。通过使用不同的聚合物来调节不同的物理和化学制剂,利用高包封性和最大的释放效率来包封亲水性和疏水性药物,为开发具有缓释性的药物递送系统提供了广泛的适用性[21-22]。乳液静电纺丝相较于同轴静电纺丝可控性更好,可实现药物高封装效率及多种药物共封装,实现药物的协同治疗,提升治疗效果[23]。静电自组装技术是一种通过静电相互作用,将带相反电荷的粒子层层自组装成纳米结构的方法。在药物输送领域,这项技术被广泛应用于药物纳米颗粒的制备。通过精确控制组装条件和选择适当的带电材料,可以制备出尺寸均一、稳定性好的药物纳米颗粒[24]。
2 静电纺丝在药物输送系统中的应用
2.1 抗癌症和肿瘤方面
目前,通过将抗癌药物包裹在纳米纤维中,可以实现对肿瘤部位的精确递送。而肿瘤部位的精确递送主要依靠局部和植入式药物递送系统,即将药物直接扩散到肿瘤中——以持续或控制的方式进行靶向局部给药。而且通过实现药物的控释和局部递送,可以减少药物在全身的分布,从而降低对其他器官的副作用。此外,静电纺丝纳米纤维是一种优异的药物载体,具有独特的优势。未来,相信通过材料选择和工艺优化,可以实现药物的精确递送、控释和稳定性提高等功能,为癌症治疗提供更方便有效的手段[25]。
氟他胺作为抗肿瘤药物,如何优化递送方法、提高给药效率、减少副作用是研究的关键,为此,Tajik等[26]通过静电纺丝法制备了生物活性玻璃/羧甲基纤维素/β-环糊精(BAG/CMC/β-CD)纳米纤维。研究发现,BAG/CMC/β-CD纳米纤维具有不规则平面和堆叠层状结构、孔隙率和大量平面内孔,纤维直径为10 nm,其高比表面积、体积和孔隙率提供了较大的药物载体接触面积,增强了对药物分子的亲和力,可用于模拟肠道环境中的氟他胺药物递送。此外,负载氟他胺的BAG/CMC/β-CD纳米纤维具有高达99.65%的载药效率以及持续的药物释放能力。Yan等[27]通过静电纺丝制备了聚乙烯醇/聚己内酯(PVA/PCL)核壳纳米纤维,并将其用作抗癌剂阿霉素(DOX)的载体。药物释放结果表明,负载DOX的PVA/PCL核壳纳米纤维显示出药物的持续和pH响应性释放。随着壳层厚度的变化,DOX的释放速率也不同。此外,负载DOX的纤维对抑制宫颈癌症Hela细胞表现出优异的性能。目前,使用植入式药物递送系统局部递送化疗药物是治疗恶性脑肿瘤的一种有前景的策略,因此,Shamsipour等[28]通过同轴静电纺丝制备了核/壳壳聚糖-聚环氧乙烷-碳量子点/羧甲基纤维素-聚乙烯醇(CS-PEO-CQD/CMC-PVA)纳米纤维,作为可生物降解的聚合物植入物,来代替莫唑胺(TMZ)的局部递送,具有富含羧基的表面的荧光碳点被用作局部癌症治疗的可追踪药物递送剂。在CS/PEO比为80∶20、CMC/PVA比为20∶80、电压为25 V的条件下获得了表面光滑和无珠结构的纳米纤维,其中核直径分别为159 nm和125 nm,壳直径分别为109 nm和111 nm,核壳结构的设计使掺入的TMZ随着壳层材料的降解而逐渐释放,提高了药物释放效率。差示扫描量热法(Differential Scanning Calorimetry, DSC)结果表明,纳米纤维中捕获的TMZ以无定形或无序结晶状态存在,爆裂后持续药物释放长达28 d,当TMZ与CQD结合时,TMZ对U251癌症细胞的细胞毒性增强,在恶性脑肿瘤的治疗方面有极大的应用潜力。
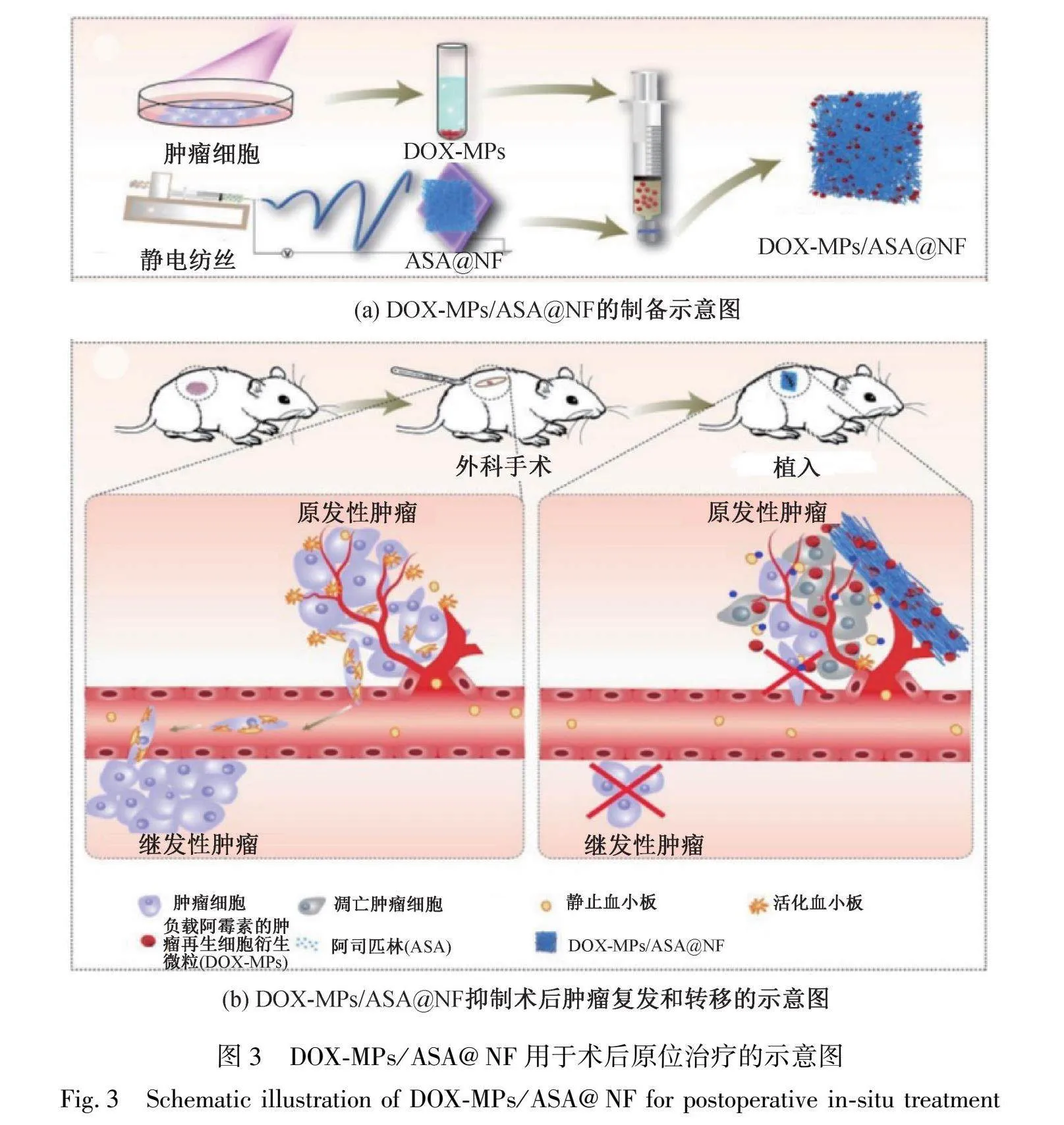
癌症是全球死亡的主要原因之一,手术、化疗和放疗是目前的基础治疗方法,但仍存在手术并发症、化疗系统副作用和癌症复发等一些问题。药物递送系统可以减少副作用,通过对靶向肿瘤细胞的控制释放来提高治疗的有效性。Mitxelena-Iribarren等[29]采用同轴静电纺丝法制备了包封甲氨蝶呤(MTX)或5-氟尿嘧啶(5F)的聚己内酯(PCL)共混纳米纤维。结果表明,药物的加入导致纳米纤维直径减小,且纤维表面没有药物晶体残留,这表明合适的表面积与体积比可以改善药物暴露,增强药物的稳定性。此外,聚合物溶液可用于封装和释放治疗癌症的不同药物,同轴静电纺丝增加了纳米纤维对药物释放曲线的控制,可提供复杂化疗,包括多种药物用于癌症治疗,如FOLFIRINOX等。创伤与血小板募集和活化密切相关,对肿瘤的复发和转移影响重大,因此,Li等[30]制备了聚乳酸-羟基乙酸共聚物(PLGA)纳米纤维膜,将阿霉素负载的肿瘤再生细胞衍生微粒(DOX-MPs)和阿司匹林(ASA)共同作为植入材料(DOX-MPs)/ASA@NF)用于术后原位治疗,如图3(a)所示。研究发现,纤维直径约为833 nm,PLGA纳米纤维膜能促进DOX-MPs的增强分布,使DOX-MPs和ASA能够程序性释放。如图3(b)所示,释放的DOX-MPs可以有效杀死残留肿瘤细胞,而ASA降低了血小板活化,抑制了血小板促进的肿瘤细胞增殖、迁移和转移。总之,DOX-MP/ASA@NF可通过杀死残留的肿瘤细胞并抑制血小板活化,显著降低肿瘤的复发和转移风险,具有广阔的临床应用前景。
2.2 抗感染方面
目前,静电纺丝纳米纤维在抗感染药物传输和释放方面也表现出良好的性能。比如,各种皮肤伤口的愈合是一个漫长的过程,常伴有细菌感染和疤痕形成。而仿生电纺纳米纤维创口敷料具有抗菌和组织修复双重功能,在伤口修复方面具备独特优势。因此,Liu等[31]制备了一种含有姜黄素(Cur)和银纳米颗粒(AgNPs)的Cur@β-环糊精(β-CD)/AgNPs的壳聚糖复合纳米纤维,该纳米纤维的直径约为(65.35 ± 23.14) nm。研究表明,AgNPs与Cur的组合对抗菌活性具有协同作用,对细菌生长具有强抑制作用,抑制作用呈剂量依赖性。伤口愈合实验表明,Cur@β-CD/AgNPs壳聚糖敷料可以通过调节血管生成和促进周围组织的增殖来促进伤口修复再生,提高组织再生的生物活性。与商业AgNPs相比,该敷料具有更高的伤口闭合率,且伤口愈合后皮肤更光滑,疤痕更少,是一种优异的伤口敷料。Sequeira等[32]通过静电纺丝法制备了由聚乙烯醇(PVA)和赖氨酸(Lys)组成的纳米纤维膜,并通过共混电纺和表面物理吸附法将抗炎剂(布洛芬(IBP))和抗菌剂(薰衣草油(LO))掺入电纺膜中。结果表明,IBP或LO的PVA_Lys的加入使电纺膜表现出更好的形貌、力学性能和生物特性,可增强伤口愈合过程。IBP的可控和持续释放特性适用于伤口愈合炎症阶段,LO的初始突然释放可防止伤口细菌污染。PVA_Lys_LO电纺膜可介导对金黄色葡萄球菌和铜绿假单胞菌的强大抗菌活性,且不会损害人类成纤维细胞的活力,表明PVA_Lys电纺膜药物递送系统用作伤口敷料的潜力。
伤口感染是患者治愈过程的主要并发症,为了预防和治疗伤口感染,Bandeira等[33]以聚丙烯酸(PAA)和聚烯丙胺(PAH)为原料,将绿色合成的氧化锌纳米颗粒(ZnONPs)掺入聚合物纤维中,成功制备了PAA/PAH/ZnONPs复合纳米纤维物。红外光谱证实PAA羧基与多环芳烃分子胺的相互作用;ZnONPs对金黄色葡萄球菌的抑菌活性高于大肠杆菌,但PAA/PAH/ZnONPs复合物抑制了这两种细菌的生长。所开发的PAA/PAH/ZnONPs复合材料具有抗菌活性,并可以模拟皮肤组织的细胞外基质形态,显示出伤口愈合治疗的潜力。Almukainzi等[34]通过静电纺丝法制备了龙胆苦苷(GPS)和胸腺醌(TQ)负载于由聚乙烯吡咯烷(PVP)和甲基醚聚乙二醇(m-PEG)组成的复合纳米纤维垫,并使用高效液相色谱法(HPLC)对样品进行了体外释放研究。结果表明,选择优化的配方(F3)在60 min时实现了最高的累积释放(GPS)累积释放率为(99.79 ± 6.47)%,TQ累积释放率为(96.89 ± 6.87)%,较小的直径(200 nm)显示出显著的抗菌效果,组织良好的皮肤结构显示出良好的愈合迹象,表明负载GPS和TQ的m-PEG/PVP纳米纤维垫是一种理想的伤口护理敷料,有望作为一种药物递送方式应用于临床医学。
2.3 在非甾体类抗炎药(NSAIDs)方面
目前,传统输送非甾体抗炎药的方式可能无法满足患者体内高效的药物分配需求,且大部分非甾体抗炎药存在较大的副作用,如胃肠不适、恶心、呕吐和器官损害等。而通过静电纺丝法可以制备出具有药物缓释功能的复合纳米纤维进行载药,从而减少药物剂量、降低副作用,在减少身体损害的同时完成高效治疗的目标,具有极大地应用前景。
吡罗昔康是一种水溶性差、首过代谢率高的药物,可通过将其配制成载药纳米纤维来改善其溶解度。Chandira等[35]通过静电纺丝法与逐层组装法制备乙基纤维素/聚乙烯吡咯烷酮(PVP)纳米纤维作为输送载体,以降低吡罗昔康的毒性。结果显示,逐层组装的纳米纤维表现出较高的药物捕获效率和释放效率,药物膜在可控透皮给药系统中发挥了重要作用,并对贴片的治疗效果产生了直接影响。通过静电纺丝制成的载药纤维贴片可能是一种可行的方式,这种贴片具有增强扩散、降低给药频率、提高患者依从性以及局部给药时有效的控释效果。Celebioglu等[36]采用无聚合物静电纺丝的方法制备了一种具备自立性和柔性的环糊精(HPβCyD)/布洛芬IC包合物纳米纤维,该纤维具有作为快速溶解口服给药系统的潜力。布洛芬的水溶性通过与环糊精的包叠络合而显著提高。在纺丝过程中,布洛芬被完全保留,通过保留1∶1和2∶1的初始摩尔比(HPβCyD/布洛芬IC),制备出没有布洛芬损失的电纺HPβCyD/布洛芬IC纳米纤维。当与水接触或用人造唾液润湿时,HPβCyD/布洛芬IC(1∶1和2∶1)纳米纤维网都显示出非常快速的溶解特性,表明电纺HPβCyD/布洛芬IC纳米纤维网具有作为快速溶解口服给药系统的潜力。
为解决布洛芬(IBU)在给药系统中溶解度有限、与聚合物生物分布差的问题,Sun等[37]使用毒性较低的二元溶剂二氯甲烷/乙醇(DCM/EtOH,v/v=8/2),制备了性能优异的聚乳酸(PLA)/布洛芬(IBU)电纺垫。结果表明,IBU在PLA均匀地分布在纤维的内部与表面。与纯PLA垫相比,IBU的加入显著提高了电纺垫的结晶度和力学性能。同时,体外药物释放行为表明,随着IBU含量的增加,IBU的释放率提升,表明PLA/IBU垫在伤口敷料和药物递送领域具有一定的应用潜力。Riaz等[38]通过单针静电纺丝法制备了负载布洛芬(IBU)的聚己内酯(PCL)和聚己内酯/聚乙二醇(PCL/PEG)纳米纤维。PEG的加入减小了PCL纳米纤维的直径,并提高了PCL纳米纤维的孔隙率、结晶率和润湿性。IBU的掺入导致了大直径的纳米纤维,但对其结晶度没有实质性影响。药物释放动力学显示,IBU在最初几个小时内突然释放,随后在24 h内逐渐释放,最大IBU释放效率高达IBU掺入总量的85%。这些掺入药物的纳米纤维网可以释放IBU以减轻疼痛和炎症,并吸收伤口渗出物以确保伤口快速愈合,同时保护其免受外部环境的影响。
2.4 在组织工程方面
2.4.1 骨组织工程
在骨组织修复方面,静电纺丝复合纳米纤维可以模拟血管和骨组织的多层、多孔结构,具有良好的仿生学特点。而这种仿生结构和良好的生物活性能够促进骨组织的再生和修复,更有利于药物释放,在提升药物的有效性方面具有独特优势。
共混静电纺丝技术可以将各种聚合物结合在一起来提高纳米纤维的力学性能和生物活性。Al-Baadani等[39]采用共混静电纺丝法制备了聚己内酯/明胶(PCL/Gel)复合纳米纤维膜,并对其生物相容性和药物释放能力进行了评估。结果表明,Gel的加入显著增强了成骨细胞的粘附和分化,PCL的加入显著改善了成骨细胞的力学性能。体外降解和药物释放结果表明,通过调节PCL的含量,可以控制Gel的降解和亲水性药物/蛋白质的释放特性。当PCL含量低时,Gel纳米纤维迅速溶解,导致1周内爆炸释放;但随着PCL含量的增加,药物释放速度逐渐降低,总释放期可延长至2周以上。因此,通过PCL和Gel的共混静电纺丝可以制备出具有良好生物活性的可控药物递送系统,为骨再生提供了一种新方法。瑞舒伐他汀(RSV)对人间充质干细胞(MSCs)成骨和新骨再生具有积极作用,因此,为了开发新型载体实现对RSV的可控释放,Ghasemvand等[40]采用同轴静电纺丝法制备壳聚糖(CS)/聚环氧乙烷(PEO)/聚己内酯(PCL)纳米纤维垫,并采用等离子体处理对其进行了改性,其中RSV被掺入纳米纤维的芯内。研究发现,该纤维垫呈圆形、光滑和无珠的状态,核直径约为370 nm、壳厚度约为70 nm,等离子体处理可以增强纳米纤维垫的润湿性和药物释放行为。此外,纳米纤维的核壳结构可以在体外和体内指导干细胞的靶向分化,并促进组织工程支架的血管化,实现精确控制药物的释放时间和速率。因此,该纤维结构可以作为RSV的缓释平台长期使用,使其成为引导骨再生的有前途的候选者。
多年来,复杂形状和临界大小的骨缺损一直是临床上的挑战,亟需具有机械强度的细胞外基质(ECM)模拟支架。Miszuk等[41]使用基于静电纺丝的热诱导自团聚(TISA)技术,开发了一种用于骨组织再生的复合双相聚己内酯(PCL)/羟基磷灰石(HA)三维纳米纤维支架。该支架能适应复杂形状的临界尺寸缺陷,提供持续释放的多种生长因子,具有高弹性和多孔性,以适应不同缺陷形状。此外,仿生矿物沉积技术可在生理温和条件下将不同类型的药物封装在支架上并持续释放,从而改善体外细胞的成骨分化。这种创新型压贴合3D纳米纤维复合支架作为药物载体,在骨组织修复方面具有广阔的前景。Birhanu等[42]开发了电纺多层载药聚左旋乳酸(PLLA)/pluronic P123(PLLA-P123)复合支架。药物位于中间层的多层支架以及具有覆盖层的PLLA-plasma和PLLA-P123显示出比其他组支架更好的成骨增殖和分化效果。支架的多层载药结构具既能提供更好的成骨作用,又能在植入部位控制药物和生物活性分子的释放,应用潜力巨大。Rezk等[43]采用聚ε-己内酯(PCL)和聚癸二酸甘油酯(PGS)的复合纳米纤维,负载羟基磷灰石纳米颗粒(HANPs)和辛伐他汀(SIM),制备了药物洗脱支架。该支架模仿了天然细胞外基质(ECM)的结构,有利于在生物医学中的应用,同时PGS的添加增大了纤维直径。体外药物释放表明,SIM从复合纳米纤维中的持续释放符合Korsemeyer-Peppas和Kpocha模型,揭示了非Fickian扩散机制,释放机制遵循扩散而非聚合物侵蚀。体外研究表明,与对照样品比,PCL-PGS-HA表现出更好的细胞增殖和粘附,从而改善了再生过程。这表明PCL-PGS-HA在控制药物递送和骨组织再生方面具有广阔的应用前景。
2.4.2 皮肤组织工程
皮肤是一个复杂的层系统,是环境和生物体之间最重要的屏障。随着静电纺丝技术的研究深入,其在皮肤修复方面的应用吸引诸多关注。静电纺丝纳米纤维可以作为药物载体,将药物直接输送至皮肤受损部位,提高药物的局部浓度,从而促进皮肤细胞的增殖和分化。这有助于加速皮肤修复过程,减少疤痕的形成。
由于电纺纤维可提供高比表面积、可控和持续的药物释放,并模拟细胞外基质,将其用于药物递送应用的研究备受关注。Turan等[44]制备了负载盐酸四环素(TCH)抗生素的聚(ω-五癸内酯-ε-己内酯)/明胶(GEL)/壳聚糖(CS)纳米纤维膜,其中,聚合物、蛋白质和多糖之间表现出协同效应。体外药物释放表明,TCH在1 h内开始释放,然后持续释放了14 d,其中负载1% TCH的样品表现出最优异的释放效率,总释药率为96.5%,初始释放率为11.8%。同时负载TCH的样品对革兰氏阳性细菌也表现出良好的抗菌活性。因此,TCH质量浓度大于3%可能是获得广谱有效性的首选,该药物递送系统可以应用于皮肤损伤修复。Dodero等[45]通过静电纺丝制备了由一层聚己内酯(PCL)和一层物理交联的藻酸盐(Alg)包埋ZnO纳米颗粒组成的多层纳米纤维膜,作为具有药物递送能力的潜在伤口愈合贴片。研究发现,纤维显示出适当的电阻、可调控性和良好的热稳定性(即降解温度高于250 ℃)。PCL外层具有良好的拒液性能,藻酸盐层则可以促进细胞活力、允许渗出物去除和气体交换,从而促进组织再生。药物释放研究表明,纳米纤维垫具有良好的药物递送能力,且根据性质和染料负载浓度可以调节释放速度。因此,所提出的藻酸盐-聚己内酯膜代表了一类有前途的创新、简单且具有成本效益的伤口愈合贴片,适用于大规模生产。
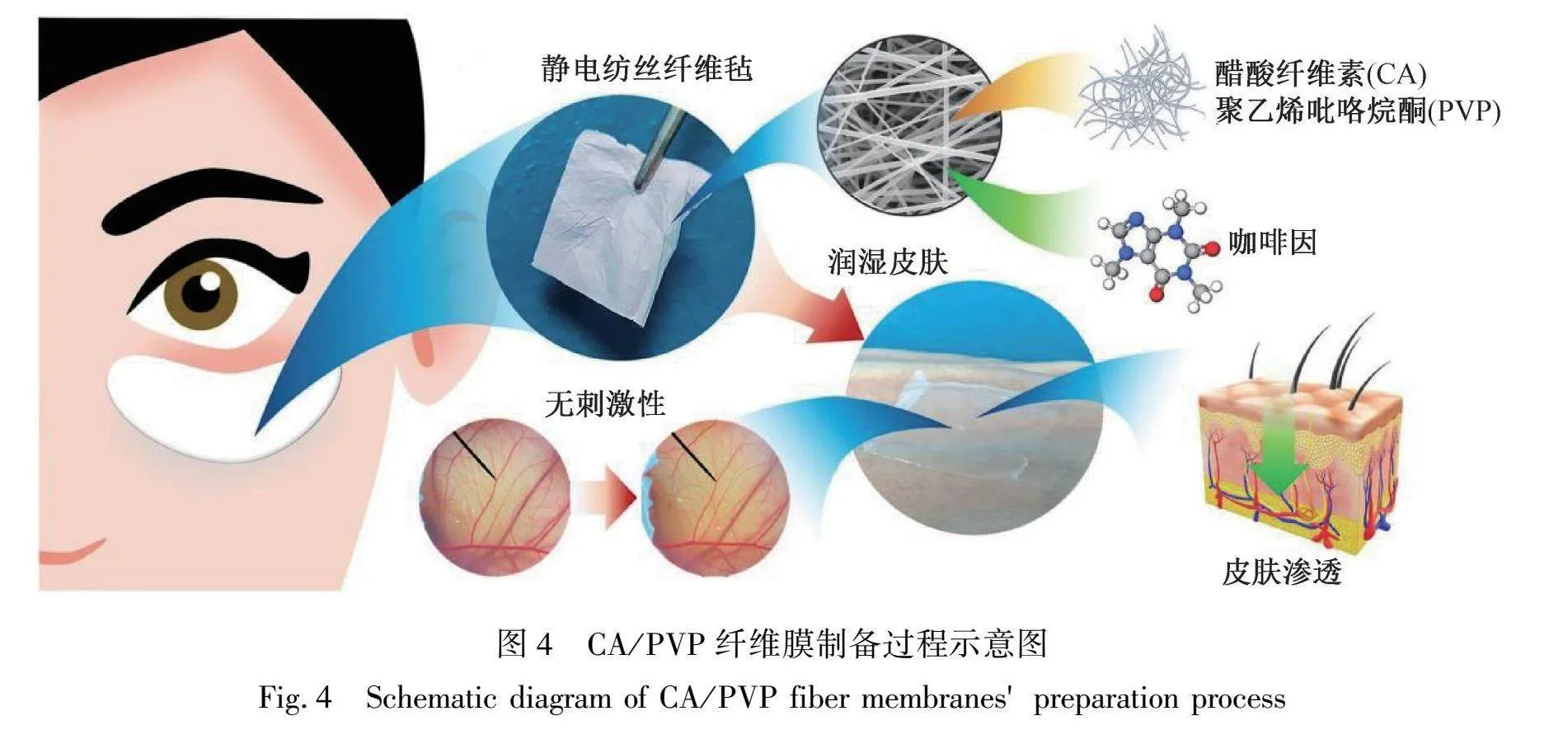
将咖啡因掺入美容面膜中有利于解决眶下皮肤黑眼圈,但通过这种配方局部输送咖啡因的方法仍然不足。Tipduangta等[46]制备了醋酸纤维素(CA)/聚乙烯吡咯烷酮(PVP)电纺纤维毡,作为眼罩向皮肤输送咖啡因。研究发现,咖啡因的加入减少了纤维直径,增强了其机械强度和柔韧性。药物释放结果表明,较小的纤维直径和较短的扩散路径长度有助于药物释放,在24 h达到约85%。鸡胚绒毛尿囊膜(HET-CAM)试验表明,CA/PVP纳米纤维毡没有刺激性,如图4所示,表明CA/PVP纳米纤维毡是一种优异的化妆品,可用于防止皮肤老化。Parn等[47]以聚乙烯醇(PVA)、聚乙烯醇-明胶(PVA-Gel)和聚乙烯醇-海藻酸盐(PVA-Alg)为基材,将叶酸(FA)颗粒分散在纳米纤维表面,通过静电纺丝和静电喷雾工艺制备了亲水性生物活性纳米纤维。体外释放结果表明,在人工汗液溶液(pH为5.44)中,负载FA的纳米纤维在8 h内可以快速释放维生素,可用于透皮贴剂应用。
2.4.3 神经组织工程
静电纺丝制备的纳米纤维可以模拟天然细胞外的基质结构,提供一个有利于神经细胞生长和迁移的仿生环境,其携带的药物可以进一步促进神经细胞的再生和修复,在不引发明显炎症的情况下在体内自然降解,使其成为神经修复的理想材料。
石墨烯掺杂的静电纺丝支架在组织工程和药物递送等生物医学领域备受关注,Heidari等[48]研究了石墨烯对PCL/明胶纳米纤维生物性能的影响,发现PCL/明胶/石墨烯纳米纤维对革兰氏阳性菌和革兰氏阴性菌具有99%的抗菌性能。与PCL/明胶纳米纤维比,盐酸四环素(TCH)和石墨烯之间的π-π堆叠作用使PCL/明胶/石墨烯对TCH的释放控制得更好。在施旺细胞、神经元细胞以及永生化和原代星形胶质细胞的氧化、渗透和热诱导的细胞应激的体外细胞模型中,PCL/明胶/石墨烯纳米纤维能够显著减少细胞死亡,表明该纳米纤维支架在神经组织工程和药物递送领域具有极大的应用潜力。
尼莫地平常用于控制血压和降低动脉瘤性蛛网膜下腔出血后继发性缺血的风险。但由于全身副作用,在全身给药后往往无法实现所需局部作用的全部潜力。Zech等[49]通过静电纺丝制备了含有1%和10%药物的聚乳酸聚乙醇酸共聚物(PLGA)纳米纤维。研究表明,尼莫地平以无定形状态掺入聚合物基体中,药物没有重结晶,纳米纤维也没有细胞毒性,表明该纤维能够降低人体细胞死亡率。Dolci等[50]采用同轴静电纺丝法,将抗炎和再髓鞘的两种药物布洛芬(IBU)和甲状腺激素三碘甲状腺原氨酸(T3)整合到单个聚合物支架中作为递送系统,以在体外释放适量的抗炎和髓鞘形成药物。体外释放结果表明,IBU/T3 PLLA系统将两种药物的释放延长了14 d,提供了靶向持续释放。在细胞培养物(RAW巨噬细胞和神经干细胞衍生的少突胶质细胞前体细胞-OPC)中的研究证明了双载药递送平台的抗炎和脱髓鞘功效,表明IBU/T3 PLLA系统是一种治疗中枢神经系统急性损伤的有效方法。为了系统对比,表1总结了基于静电纺丝纳米纤维的药物输送系统的研究进展,该系统包括所使用纳米纤维的基质类型、封装的药物类别及其治疗应用等。
3 结论与展望
将药物包封于静电纺丝纳米纤维内部作为新型药物递送系统,可以提供更精确的药物释放、更高的载药量,提升药物治疗效果并减少副作用,在药物递送领域受到广泛关注。本文对目前静电纺丝的原理及多种药物封装方法进行了介绍,总结了单针、多针、同轴等静电纺丝技术的优点和不足,阐述了静电纺丝纳米纤维作为新型药物输送载体在抗癌症和肿瘤、抗感染、非甾体抗炎药、骨组织工程、皮肤组织工程、神经组织工程领域的研究进展。结果发现,虽然通过静电纺丝法可制备出不同结构、不同药物释放效果的纤维来满足不同药物递送的实际应用需求,但仍存在一些问题亟须解决,如纳米纤维的生物相容性不高,可能会引起免疫反应或组织损伤;纤维直径分布不均,可能会影响药物递送效果;生产效率较低、成本较高,部分纳米纤维材料的安全性尚需进一步验证;纳米纤维药物的质量和稳定性需要严格控制,以及跨学科合作和研究深度仍需加强等。
未来的研究可以从以下几个方面进行研究和完善:
a)通过材料复合设计将不同材料进行共混或交联等处理,制备具有优异生物相容性和生物活性的新型纳米纤维药物载体材料,以避免在药物输送时对自身免疫系统造成损伤。
b)完善实验研究,增加体内外实验研究与对比。在解决体内外可能存在的药物释放差异的同时,对静电纺丝过程中的参数进行优化,以获得最佳的纤维直径分布,提高给药的稳定性和效果。
c)深入研究载药纳米纤维在体内的分布、吸收和排泄行为,阐明其治疗机制,并优化静电纺丝药物负载方法,提升药物的输送、释放效率与治疗效果。
d)研发针对特定疾病的新型纳米纤维药物制剂,提高疾病的治疗效果。
参考文献:
[1]MANZARI M T, SHAMAY Y, KIGUCHI H, et al. Targeted drug delivery strategies for precision medicines[J]. Nature Reviews Materials, 202 6(4): 351-370.
[2]LURAGHI A, PERI F, MORONI L. Electrospinning for drug delivery applications: A review[J]. Journal of Controlled Release, 202 334: 463-484.
[3]JEONG W Y, KWON M, CHOI H E, et al. Recent advances in transdermal drug delivery systems: A review[J]. Biomaterials Research, 202 25(1): 24.
[4]苏芳芳, 经渊, 宋立新, 等. 我国静电纺丝领域研究现状及其热点:基于CNKI数据库的可视化文献计量分析[J]. 东华大学学报(自然科学版), 2024, 50(1): 45-54.
SU Fangfang, JING Yuan, SONG Lixin, et al. Present situation and hotspot of electrospinning in China: Visual bibliometric analysis based on CNKI database[J]. Journal of Donghua University (Natural Science), 2024, 50(1): 45-54.
[5]于超群, 龙云泽, 刘现峰, 等. 载药静电纺丝纤维研究及应用进展[J]. 青岛大学学报(医学版), 2023, 59(1): 147-150.
YU Chaoqun, LONG Yunze, LIU Xianfeng, et al. Advances in the research and application of drug-loaded electrospinning nanofibers[J]. Journal of Qingdao Uni-versity(Medical Sciences), 2023, 59(1): 147-150.
[6]KIANFAR E. Magnetic nanoparticles in targeted drug delivery: A review[J]. Journal of Superconductivity and Novel Magnetism, 202 34(7): 1709-1735.
[7]MITCHELL M J, BILLINGSLEY M M, HALEY R M, et al. Engineering precision nanoparticles for drug delivery[J]. Nature Reviews Drug Discovery, 202 20(2): 101-124.
[8]BALUSAMY B, CELEBIOGLU A, SENTHAMIZHAN A, et al. Progress in the design and development of "fast-dissolving" electrospun nanofibers based drug delivery systems-A systematic review[J]. Journal of Controlled Release, 2020, 326: 482-509.
[9]何玲霞, 樊之瑀, 杜雨佳, 等. 静电纺丝技术在软骨修复中的应用[J]. 华西医学, 2023, 38(10): 1559-1563.
HE Lingxia, FAN Zhiyu, DU Yujia, et al. Application of electrospinning for cartilage repair[J]. West China Medical Journal, 2023, 38(10): 1559-1563.
[10]GUO Y, WANG X, SHEN Y, et al. Research progress, models and simulation of electrospinning technology: A review[J]. Journal of Materials Science, 202 57(1): 58-104.
[11]NADAF A, GUPTA A, HASAN N, et al. Recent update on electrospinning and electrospun nanofibers: Current trends and their applications[J]. RSC Advances, 202 12(37): 23808-23828.
[12]屈展, 夏广波, 方剑. 静电纺P(VDF-TrFE)纳米纤维在柔性压电传感与能量收集领域的研究进展[J]. 复合材料学报, 2024, 41(03): 1141-1152.
QU Zhan, XIA Guangbo, FNAG Jian. Research progress of electrospun P(VDF-TrFE) nanofibers in the field of flexible piezoelectric sensing and energy harvesting[J]. Acta Materiae Compositae Sinica, 2024, 41(03): 1141-1152.
[13]CHEN J, YU Z, LI C, et al. Review of the principles, devices, parameters, and applications for centrifugal elec-trospinning[J]. Macromolecular Materials and Engineering, 202 307(8): 2200057.
[14]SONG J, LIN X, EE L Y, et al. A review on elec-trospinning as versatile supports for diverse nanofibers and their applications in environmental sensing[J]. Advanced Fiber Materials, 2023, 5(2): 429-460.
[15]付征, 穆齐锋, 张青松, 等. 胶体静电纺微纳米纤维的研究进展[J]. 纺织学报, 2023, 44(10): 196-204.
FU Zheng, MU Qifeng, ZHANG Qingsong, et al. Research progress in colloidal electrospun micro/nano fibers[J]. Journal of Textile Research, 2023, 44(10): 196-204.
[16]ODULARU A T. Basic principles of electrospinning, mechanisms, nanofibre production, and anticancer drug delivery[J]. Journal of Chemistry, 202 2022: 9283325.
[17]张树智, 曲鹏飞, 韩俊泉, 等. 静电纺丝构建中药控释系统的研究及应用[J]. 中国组织工程研究, 2024, 28(17): 2759-2765.
ZHANG Shuzhi, QU Pengfei, HAN Junquan, et al. Research and application of electrospinning drug delivery systems containing traditional Chinese medicine[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(17): 2759-2765.
[18]MIRANDA-CALDERON L, YUS C, LANDA G, et al. Pharmacokinetic control on the release of antimicrobial drugs from pH-responsive electrospun wound dressings[J]. International Journal of Pharmaceutics, 202 624: 122003.
[19]DING Y, LI W, ZHANG F, et al. Electrospun fibrous architectures for drug delivery, tissue engineering and cancer therapy[J]. Advanced Functional Materials, 2019, 29(2): 1802852.
[20]张子浩, 陈威亚. 静电纺丝喷丝装置研究进展[J]. 纺织科技进展, 2023 (8): 1-3.
ZHANG Zihao, CHEN Weiya. Research progress of electrospinning apparatus[J]. Progress in Textile Science & Technology, 2023(8): 1-3.
[21]WU J, ZHANG Z, GU J, et al. Mechanism of a long-term controlled drug release system based on simple blended electrospun fibers[J]. Journal of Controlled Release, 2020, 320: 337-346.
[22]HAI T, WAN X, YU D G, et al. Electrospun lipid-coated medicated nanocomposites for an improved drug sustained-release profile[J]. Materials & Design, 2019, 162: 70-79.
[23]KRYSIAK Z J, STACHEWICZ U. Electrospun fibers as carriers for topical drug delivery and release in skin bandages and patches for atopic dermatitis treatment[J]. Wiley Interdisciplinary Reviews: Nanomedicine and Nano-biotechnology, 2023, 15(1): 1829.
[24]WANG Z, KANG Y, ZHAO S, et al. Self-limiting assembly approaches for nanoadditive manufacturing of electronic thin films and devices[J]. Advanced Materials, 2020, 32(3): 1806480.
[25]张卓然, 周虎, 朱雅琳, 等. 静电纺丝的癌症治疗研究进展[J]. 海峡药学, 202 33(8): 87-90.
ZHANG Zhuoran, ZHOU Hu, ZHU Yalin, et al. Re-search progress of cancer treatment by electrospinning[J]. Strait Pharmaceutical Journal, 202 33(8): 87-90.
[26]TAJIK M, SEYED-SADJADI M, ZARE K, et al. Preparation, characterization, and application of electrospun BAG/CMC/β-CD nanofibers for flutamide drug delivery[J]. Korean Journal of Chemical Engineering, 2024, 41(3): 853-868.
[27]YAN E, JIANG J, YANG X, et al. pH-sensitive core-shell electrospun nanofibers based on polyvinyl alcohol/polycaprolactone as a potential drug delivery system for the chemotherapy against cervical cancer[J]. Journal of Drug Delivery Science and Technology, 2020, 55: 101455.
[28]SHAMSIPOUR M, MANSOURI A M, MORADIPOUR P. Temozolomide conjugated carbon quantum dots embedded in core/shell nanofibers prepared by coaxial electros-pinning as an implantable delivery system for cell imaging and sustained drug release[J]. AAPS PharmSciTech, 2019, 20(7): 259.
[29]MITXELENA-IRIBARREN O, RIERA-PONS M, PEREIRA S, et al. Drug-loaded PCL electrospun nanofibers as anti-pancreatic cancer drug delivery systems[J]. Polymer Bulletin, 2023, 80(7): 7763-7778.
[30]LI J, LI J, YAO Y, et al. Biodegradable electrospun nanofibrous platform integrating antiplatelet therapy-che-motherapy for preventing postoperative tumor recurrence and metastasis[J]. Theranostics, 202 12(7): 3503-3517.
[31]LIU C, ZHU Y, LUN X, et al. Effects of wound dressing based on the combination of silver@curcumin nanopar-ticles and electrospun chitosan nanofibers on wound healing[J]. Bioengineered, 202 13(2): 4328-4339.
[32]SEQUEIRA R S, MIGUEL S P, CABRAL C S D, et al. Development of a poly(vinyl alcohol)/lysine electrospun membrane-based drug delivery system for improved skin regeneration[J]. International Journal of Pharmaceutics, 2019, 570: 118640.
[33]BANDEIRA M, CHEE B S, FRASSINI R, et al. Antimicrobial PAA/PAH electrospun fiber containing green synthesized zinc oxide nanoparticles for wound healing[J]. Materials, 202 14(11): 2889.
[34]ALMUKAINZI M, EL-MASRY T A, NEGM W A, et al. Co-delivery of gentiopicroside and thymoquinone using electrospun m-PEG/PVP nanofibers: In-vitro and In vivo studies for antibacterial wound dressing in diabetic rats[J]. International Journal of Pharmaceutics, 202 625: 122106.
[35]CHANDIRA R M, PETHAPPACHETTY P, NARAYANAN G R, et al. Design, optimization and evaluation of nanofibers containing NSAID for controlled drug delivery system[J]. Asian Journal of Biological and Life Sciences, 202 11(2): 389-396.
[36]CELEBIOGLU A, UYAR T. Fast dissolving oral drug delivery system based on electrospun nanofibrous webs of cyclodextrin/ibuprofen inclusion complex nanofibers[J]. Molecular pharmaceutics, 2019, 16(10): 4387-4398.
[37]SUN C, ZOU L, XU Y, et al. Ibuprofen-loaded poly(lactic acid) electrospun mats: The morphology, physico-chemical performance, and in vitro drug release behavior[J]. Macromolecular Materials and Engineering, 2020, 305(12): 2000457.
[38]RIAZ T, KHENOUSSI N, RATA D M, et al. Blend electrospinning of poly(ε-caprolactone) and poly (ethy-lene glycol-400) nanofibers loaded with ibuprofen as a potential drug delivery system for wound dressings[J]. AUTEX Research Journal, 2023, 23(1): 66-76.
[39]AL-BAADANI M A, HII RU YIE K, AL-BISHARI A M, et al. Co-electrospinning polycaprolactone/gelatin membrane as a tunable drug delivery system for bone tissue regenera-tion[J]. Materials & Design, 202 209: 109962.
[40]GHASEMVAND F, KABIRI M, HASSAN-ZADEH V, et al. Chitosan, polyethylene oxide/polycaprolactone elec-trospun core/shell nanofibrous mat containing rosuvastatin as a novel drug delivery system for enhancing human mesenchymal stem cell osteogenesis[J]. Frontiers in Molecular Biosciences, 2023, 10: 1220357.
[41]MISZUK J, LIANG Z, HU J, et al. An elastic mineralized 3D electrospun PCL nanofibrous scaffold for drug release and bone tissue engineering[J]. ACS Applied Bio Materials, 202 4(4): 3639-3648.
[42]BIRHANU G, TANHA S, AKBARI JAVAR H, et al. Dexamethasone loaded multi-layer poly-l-lactic acid/pluronic P123 composite electrospun nanofiber scaffolds for bone tissue engineering and drug delivery[J]. Pharmaceutical Development and Technology, 2019, 24(3): 338-347.
[43]REZK A I, KIM K S, KIM C S. Poly(ε-caprolactone)/poly(glycerol sebacate) composite nanofibers incor-porating hydroxyapatite nanoparticles and simvastatin for bone tissue regeneration and drug delivery applications[J]. Polymers, 2020, 12(11): 2667.
[44]TURAN C U, GUVENILIR Y. Electrospun poly(ω-pentadecalactone-co-ε-caprolactone)/gelatin/chitosan ter-nary nanofibers with antibacterial activity for treatment of skin infections[J]. European Journal of Pharmaceutical Sciences, 202 170: 106113.
[45]DODERO A, ALLOISIO M, CASTELLANO M, et al. Multilayer alginate-polycaprolactone electrospun membr-anes as skin wound patches with drug delivery abilities[J]. ACS Applied Materials & Interfaces, 2020, 12(28): 31162-31171.
[46]TIPDUANGTA P, WATCHARATHIRAWONGS W, WARITDECHA P, et al. Electrospun cellulose acetate/polyvinylpyrrolidone fiber mats as potential cosmetic under-eye masks for caffeine delivery[J]. Journal of Drug Delivery Science and Technology, 2023, 86: 104732.
[47]PARN F N, AYDEMIR I N, TANER G, et al. Co-electrospun-electrosprayed PVA/folic acid nanofibers for transdermal drug delivery: Preparation, characterization, and in vitro cytocompatibility[J]. Journal of Industrial Textiles, 202 51: 1323S-1347S.
[48]HEIDARi M, BAHRAMI S H, RANJBAR-MOHAMMADI M, et al. Smart electrospun nanofibers containing PCL/gelatin/graphene oxide for application in nerve tissue engineering[J]. Materials Science and Engineering: C, 2019, 103: 109768.
[49]ZECH J, LEISZ S, GOETTEL B, et al. Electroea9183fded5dbee191bacb17ae34a32cspun Nimodipine-loaded fibers for nerve regeneration: Develop-ment and in vitro performance[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2020, 151: 116-126.
[50]DOLCI L S, PERONE R C, DI GESU R, et al. Design and in vitro study of a dual drug-loaded delivery system produced by electrospinning for the treatment of acute injuries of the central nervous system[J]. Pharmaceutics, 202 13(6): 848.
Research on the application of electrospinning nanofibers in the field of drug delivery
YANG Haizhen, WEI Sujie, MA Chuang, ZHOU Zelin, HU Yawen
(College of Textiles, Zhongyuan University of Technology, Zhengzhou 450007, China)
Abstract:
Electrospun nanofibers have the characteristics of extremely fine diameter, high specific surface area, and good pore structure. They are easy to operate, low costing, and mass-producible. Their unique structure and performance have received widespread attention in the field of drug delivery. In recent years, the application of electrospun nanofibers in the field of drug delivery has made further research breakthroughs. By controlling the diameter and shape of the fibers, efficient drug loading and sustained release can be achieved, and drug bioavailability and reducing toxic side effects can be enhanced. These properties expedite the application prospects of electrospun nanofibers in drug delivery.In recent years, electrospun nanofibers have been widely used in the field of drug delivery. Their nanoscale diameter and porous structure make electrospun nanofibers an ideal drug carrier material. Biodegradable polymer nanofiber membranes can not only stably carry various types of drugs, but also achieve slow drug release, thereby improving drug efficacy and reducing side effects. Compared to traditional drug delivery systems, electrospun nanofibers have many advantages. Firstly, their nanoscale diameter and porous structure are beneficial for improving the solubility and bioavailability of drugs, enhancing their stability and bioavailability efficiency. Secondly, electrospun nanofibers can simulate the natural extracellular matrix structure, provide a scaffold for cell adhesion, and help promote tissue regeneration and healing. In addition, electrospun nanofibers can also achieve controlled drug release, further improving the therapeutic effect of drugs.Research and development based on pharmaceutical technology is the foundation for enhancing the development of drug delivery. Research has confirmed that electrospun nanofibers, as drug carriers, have become a hot research topic in the field of drug delivery for local drug delivery and slow release drug systems in the treatment of diseases. By encapsulating drugs within electrospun nanofibers, not only can the solubility and stability of drugs be improved, but the duration of sustained drug release can also be extended, local drug concentration can be increased, and treatment effectiveness can be improved. This technology has shown great potential for application in multiple drug delivery fields such as anti-infection, wound healing, and anti-cancer.
The development trend of electrospun nanofibers in the field of drug delivery mainly includes multifunctionality, intelligence capabilities and precision. With the continuous development of nanotechnology and materials science, electrospun nanofibers will be more widely used in drug delivery systems and can achieve more diverse functions. In the future, with the continuous progress of medical technology and the development of interdisciplinary fields, electrospun nanofibers as carriers of drug delivery systems are expected to achieve more precise drug treatment, bringing revolutionary changes to the medical field. Electrospun nanofibers, as a cutting-edge technology in the field of drug delivery, will continue to bring new hope and possibilities to the medical and pharmaceutical fields.
Keywords:
electrospinning; drug delivery; anti-cancer; anti-infection; non-steroidal anti-inflammatory drugs; tissue engineering

