负载聚集诱导发光光敏剂纳米纤维膜的制备及其抗菌性能


摘 要:为解决光动力抗菌纤维活性氧(ROS)产率低、光敏剂易泄露等问题,以聚集诱导发光(AIE)分子(TPE-TCF)为光敏剂,与聚丙烯腈(PAN)、聚乙烯吡咯烷酮(PVP)共混,通过静电纺丝制备TPE-TCF@PAN/PVP纳米纤维膜,表征其化学结构、微观形貌和表面亲水性,并探究其ROS产率和抗菌效果。结果表明:TPE-TCF@PAN/PVP膜(TPE-TCF质量分数为0.4%)具有高亲水性、优异的光敏剂负载稳定性和高ROS产率,超低功率白光照射20 min后,可实现对金黄色葡萄球菌(抑菌率大于96.2%)和大肠杆菌(抑菌率大于99.9%)的高效灭菌。该研究结果可为高效广谱抗菌的医用防护材料的制备和应用提供参考。
关键词:聚集诱导发光光敏剂;活性氧;静电纺丝;纳米纤维膜;光动力抗菌
中图分类号:TS101.4
文献标志码:A
文章编号:1009-265X(2024)10-0031-09
近年来,由病原菌感染引发的人类生命安全问题受到了研究者们的广泛关注。研究表明,医用纺织品可在一定程度上预防病原菌的传播[1],但由于它们自身缺乏抗菌性能,病原菌仍可在材料表面存活,增加了交叉污染和多次传播的风险。因此,迫切需要开发一类具有杀灭微生物能力的医用防护材料。目前,制备该类材料的主要方法是在纤维中掺杂抗菌剂[2],如季铵盐化合物、金属氧化物和光敏剂(Photosensitizer,PS)等。其中,PS因其高效、低毒性、低耐药性等优点备受瞩目。
PS在光照下能产生活性氧(Reactive oxygen species,ROS),实现对革兰氏阳性和阴性细菌、真菌以及病毒等微生物的杀灭,达到广谱高效的抗菌效果[3]。根据化学组成,PS可分为有机PS和无机PS两类,其中,有机PS易于加工成柔性材料,更适用于医用防护材料领域。但是,传统的有机PS,如孟加拉玫瑰红、亚甲蓝等存在聚集导致淬灭、ROS产生效率低等缺陷,影响了其光动力抗菌效果[4]。相比之下,具有供体-受体(Donor-acceptor,D-A)结构的新型聚集诱导发光(Aggregation-induced emission,AIE)PS,可实现对可见光的吸收,且具有独特的聚集诱导ROS增强作用[5],成为光动力抗菌领域最有前景的研究方向之一。
目前,对AIE PS的研究主要集中在对其溶液体系的光动力杀菌性能的优化[6-7]。利用静电纺丝技术[8],将AIE PS与纤维复合而制备薄膜材料的报道还不多。Li等[9]将AIE PS分子三苯胺-乙烯基噻吩-3-乙基苯并[d]噻唑-3-鎓(TTVB)与共聚物聚偏氟乙烯-六氟丙烯(PVDF-HFP)共混,通过静电纺丝制得了纳米纤维膜。纳米纤维膜虽可在阳光照射下产生ROS,实现对金黄色葡萄球菌(S.aureus)、大肠杆菌(E.coli)、白色念珠菌和M13噬菌体的杀灭,但由于它的基底为疏水聚合物,与水相菌液的接触程度有限,影响了纤维膜中AIE PS产生的ROS对细菌的杀灭效果。
为提高负载AIE PS的纳米纤维膜的抗菌效果,本文拟采用具有D-A结构的AIE分子(3-氰基-5,5-二甲基-4-(4-( 2-三苯基乙烯基)苯乙烯基)呋喃-2(5H)亚基)丙二腈(TPE-TCF)为光敏剂,将其与具有一定亲水性的聚合物聚丙烯腈(Polyacrylonitrile,PAN)和聚乙烯吡咯烷酮(Polyvinyl pyrrolidone,PVP)共混,通过静电纺丝技术制备亲水性良好的TPE-TCF@PAN/PVP纳米纤维膜,通过提高纳米纤维膜与水相菌液的接触程度,改善其ROS产率及对细菌的杀灭效果。本文研究TPE-TCF的掺杂量对纳米纤维膜的润湿性、ROS产率和抗菌性能的影响,并探究其在超低功率白光照射下对金黄色葡萄球菌(S.aureus)和大肠杆菌(E.coli)的灭菌效果,旨在解决医用防护材料因病原体吸附导致的交叉感染问题。
1 实验
1.1 材料及试剂
4-( 2-三苯基乙烯基)苯甲醛(TPE-CHO),泰坦(上海)有限公司;丙二腈(99%)、乙氧基镁(98%)、3-羟基-3-甲基-2-丁酮(97%),百灵威(上海)科技有限公司;氢氧化钠(NaOH,AR),国药集团化学试剂有限公司;乙醇(AR),上海凌峰化学试剂有限公司;四氢呋喃(THF,AR),杭州高晶精细化工;无水硫酸镁(MgSO4,99%)、聚丙烯腈(PAN,Mw=15000)、二氯甲烷(DCM,AR),麦克林试剂(上海)有限公司;聚乙烯吡咯烷酮(PVP,Mw=58000)、N,N-二甲基乙酰胺(DMCA,99.0%)、9,10-蒽二基-双(亚甲基)二丙二酸(ABDA)、2',7'-二氯二氢荧光素二乙酸酯(DCFH),阿拉丁试剂(上海)有限公司;S.aureus(ATCC6538)、E.coli(ATCC5922),鲁微(上海)科技有限公司。
1.2 实验方法
1.2.1 TPE-TCF分子的合成
TPE-TCF分子根据文献[10]报道合成,分为两个步骤。步骤一:在氮气环境下,向100 mL双口烧瓶中放入丙二腈(5.9 g,90 mmol)、乙氧基镁(3.9 g,34 mmol)、3-羟基-3-甲基-2-丁酮(3.2 mL,30 mmol)和30 mL经无水硫酸镁干燥过的乙醇,60 ℃反应8 h后冷却至室温,过滤,将滤液萃取、干燥后以二氯甲烷为淋洗液,用层析柱进行分离,所得粗产物重结晶后,得到7.5 g黄色针状固体化合物TCF,产率为63.1%。步骤二:将4-( 2-三苯基乙烯基)苯甲醛(TPE-CHO,0.74 g,2.0 mmol)、TCF(0.50 g,2.5 mmol)、乙醇(25 mL)和NaOH(4.2 mg)混合在100 mL双颈圆底烧瓶中回流过夜。混合溶液用二氯甲烷萃取,留下有机层。有机层用盐水洗涤,无水硫酸镁干燥,硅胶柱层析纯化,得到鲜红色固体产物TPE-TCF。
1.2.2 PAN/PVP纳米纤维膜的制备
将1.6 g PAN和0.8 g PVP聚合物溶解在13.6 g DMAC中,制备成PAN/PVP混合溶液,在99 ℃中完全溶解12 h,配置成PAN/PVP静电纺丝溶液。然后将溶液引入装有21号针头的5 mL塑料注射器中。在进料速率为0.7 mL/h、电压为12 kV、针头与接收器距离为14 cm的条件下进行静电纺丝,纺丝时间为3 h。最后,将制备的PAN/PVP纳米纤维膜在40 ℃下真空干燥12 h,去除残留溶剂,在暗处保存样品。
1.2.3 TPE-TCF@PAN/PVP 纳米纤维膜的制备
将不同质量分数的TPE-TCF分子溶于PAN/PVP混合液中,分别配置成TPE-TCF质量分数为0.07%、0.1%、0.4%、0.7%和1.0%的混合溶液,在99 ℃中完全溶解12 h,制备成静电纺丝溶液。分别将纺丝液引入装有21号针头的5 mL塑料注射器中。在进料速率为0.7 mL/h、电压为11.5 kV、针头与接收器距离为14 cm的条件下进行静电纺丝,纺丝时间均为3 h。分别获得TPE-TCF质量分数为0.07%、0.1%、0.4%、0.7%和1.0%的TPE-TCF@PAN/PVP纳米纤维膜。最后,将制备的纳米纤维膜在40 ℃下真空干燥12 h,去除残留溶剂,在暗处保存样品。
1.2.4 纳米纤维膜稳定性测试
将2 cm×2 cm尺寸的纳米纤维膜浸入含有30 mL去离子水的培养皿中,间隔不同的时间取培养皿中1 mL去离子水溶液与2 mL THF溶液混合,然后使用紫外可见光光度计(UV-2600)记录混合溶液在300~500 nm处的吸收峰。
1.2.5 活性氧(ROS)产生速率测试
使用DCFH作为总ROS的指示剂。将市售DCFH-DA指示剂溶于乙醇中制备成浓度为10 μmol/L的储备液。测试前,将500 μL DCFH-DA储备液与2 mL NaOH水溶液(10 mmol/L)混合并在室温下搅拌30 min,使其转化为DCFH。然后将上述溶液用10 mL pH为7.4的PBS溶液稀释,制备成最终浓度为0.4 μmol/L的测试液。测试时,对于TPE-TCF分子的检测,将250 μL DCFH测试液和10 μL TPE-TCF储备液(0.625 mg/mL,DMSO)溶于1740 μL PBS(pH=7.4)或者1740 μL DMSO中;对于纳米纤维膜的检测,将1 cm×1 cm大小的纳米纤维膜浸入含有250 μL DCFH测试液和1750 μL PBS(pH=7.4)的孔板中。记录白灯(400~830 nm,50 mW/cm2)照射不同时间后的混合溶液在525 nm(激发波长为485 nm)处的荧光强度。
使用ABDA作为1O2产率指示剂。将市售ABDA探针溶于DMSO溶液中,制备成浓度为25 μmol/L的储备液。在测试时,对于TPE-TCF分子的检测,将12 μL ABDA储备液和12 μL TPE-TCF储备液(0.625 mg/mL,DMSO)溶于2976 μL去离子水或DMSO中;对于纳米纤维膜的检测,将1 cm×1 cm大小的纳米纤维膜浸入含有12 μL ABDA测试液和2988 μL去离子水的孔板中。记录白光(400~830 nm,50 mW/cm2)照射不同时间后混合溶液在340~600 nm处的吸收光谱。
1.2.6 抗菌实验测试
按照标准程序评估纳米纤维膜对S.aureus和E.coli的抑菌活性。两株细菌在37 ℃、150 r/min下振荡培养过夜,直到达到它们的对数生长期。将1 mL细菌悬液(菌液浓度为107 CFU/mL)与一块样品膜(1 cm×1 cm)在12孔板中共孵育4 h,然后分别在白光(400~830 nm, 50 mW/cm 照射距离1 cm)照射下或黑暗条件下再孵育20 min。不加样品膜共孵育的细菌作为对照组。然后用无菌PBS稀释细菌悬液,将100 μL稀释后的细菌悬液均匀涂抹在LB琼脂板上,37 ℃孵育24 h。最后,对LB琼脂板上的细菌进行拍照,用Image J软件进行计数定量分析。所有实验均重复进行验证。由式(1)计算抑菌率[11]。
S/%=Na-NiNa×100(1)
式中:S为抑菌率,%;Na为对照组细菌菌落数,CFU;Ni为实验组细菌菌落数,CFU。
1.3 测试方法
1.3.1 化学结构测试
采用傅里叶变换红外光谱仪(5700,Nicolet)对薄膜样品的化学基团结构进行分析。
1.3.2 形貌测试
采用高分辨场发射扫描电镜(500 Gemini)和激光共聚焦(Nikon C2+)对制备样品的形貌进行测试分析。
2 结果与讨论
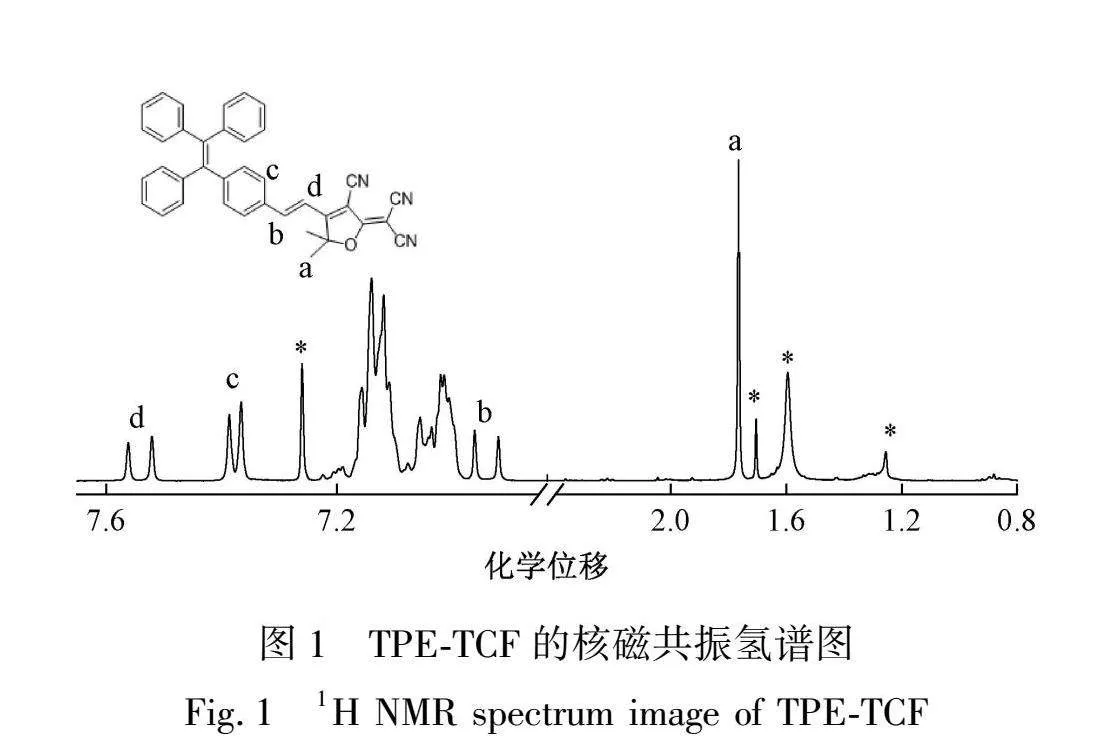
2.1 TPE-TCF的结构表征
为了表征TPE-TCF的化学结构,测试了它在氘代氯仿中的核磁共振氢谱(1H NMR),结果如图1所示。其中,化学位移位于1.78~1.74、6.97~6.89、7.39~7.35和7.54~7.38的信号峰对应于分子结构中的氢原子Ha、Hb、Hc和Hd,其余信号峰对应于苯环上的氢原子。以上信号峰的积分面积的比例与TPE-TCF分子结构中氢原子个数的比例相同,证明了TPE-TCF分子的成功合成。
2.2 TPE-TCF的光动力性能
负载光敏剂的ROS生成效率是纳米纤维膜实现抗菌效果的关键因素。从分子结构角度,TPE-TCF具有典型的供体-受体(D-A)结构,可以通过充分的系统间交叉作用(Inter system crossing,ISC)过程提高ROS生成效率[12]。从分子发光性能角度,TPE-TCF在纳米纤维膜中以聚集状态均匀分布,可以通过分子自身的聚集诱导发光性能实现ROS增强,进一步提升其ROS生成效率[10]。
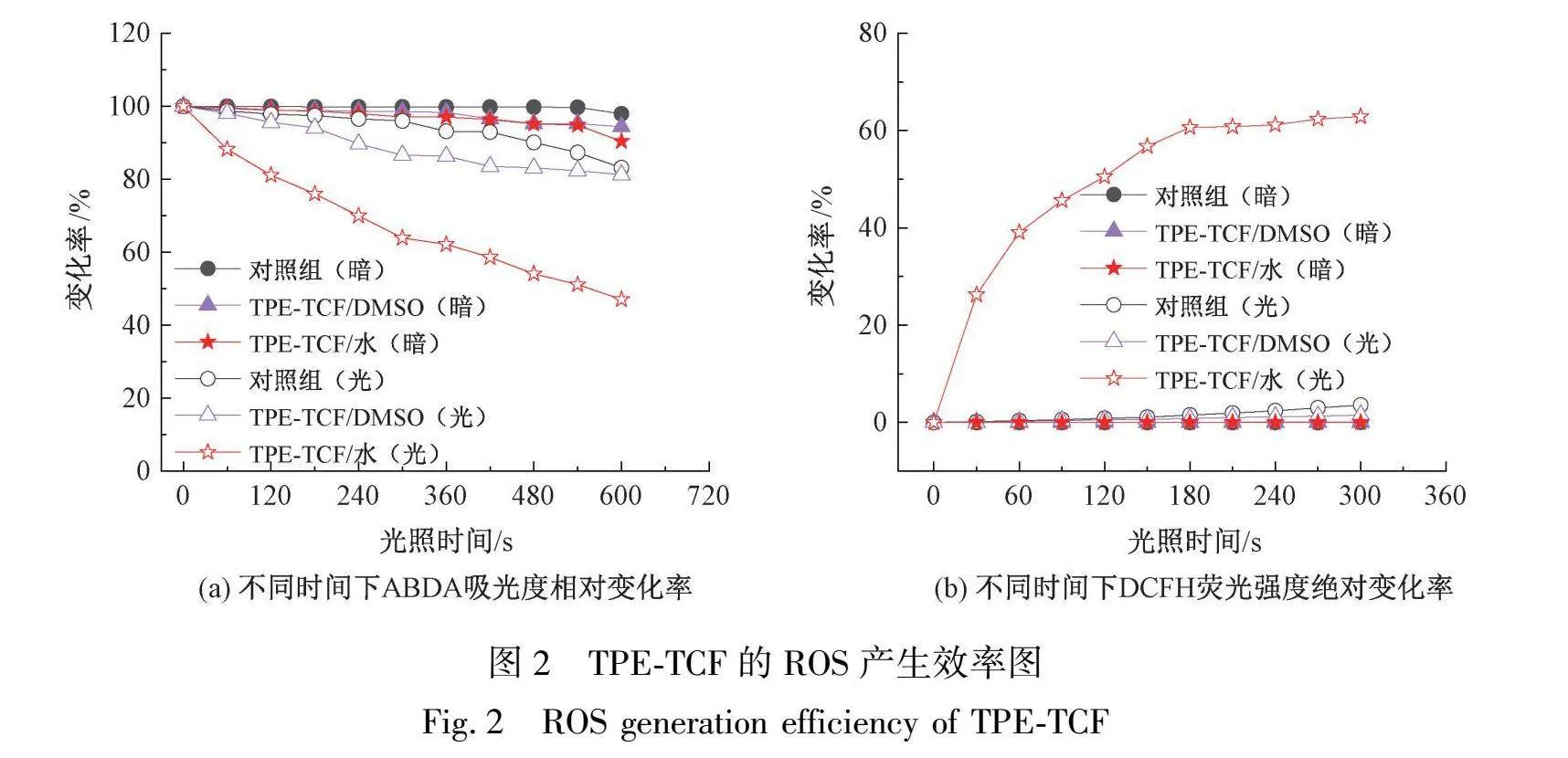
ABDA和DCFH是两种常用的ROS指示剂。其中,ABDA可被单线态氧(Singlet oxygen,1O2)选择性降解,生成相应的内过氧化物,使其位于378 nm处的紫外吸光度降低,因此,ABDA在378 nm处吸光度的变化用于反映1O2的产生[13];非荧光DCFH则可被ROS氧化为强荧光DCF,使其位于525 nm处的荧光发射强度增强,因此,DCFH溶液在525 nm处的荧光强度的变化可用于反映ROS的生成[14]。在模拟太阳光的白色光源照射下,可使用ABDA评估TPE-TCF的1O2产生效率,使用DCFH评估TPE-TCF分子的总ROS产生量。不同时间下,不同组分中ABDA溶液在378 nm处吸光度的相对变化率如图2(a)所示。从图2(a)中观察到,黑暗条件下,对照组、TPE-TCF/水(聚集体状态)和TPE-TCF/DMSO(溶解状态)的样品中,ABDA的吸光度均未发生明显下降,说明上述样品均未有明显的1O2生成。而在光照条件下,3组样品中ABDA的吸光度均随时间的延长出现了一定程度的下降,且TPE-TCF/水和TPE-TCF/DMSO对ABDA呈现出不同的降解效率。TPE-TCF/DMSO中ABDA的降解率保持在20%以下,而TPE-TCF/水中ABDA的降解率提升至52.04%,说明TPE-TCF分子的聚集有利于1O2的产生。DCFH测试也表现出相似结果。不同时间下,不同组分中DCFH溶液在525 nm处荧光强度的相对变化率如图2(b)所示,在光照条件下,加入TPE-TCF/水后,DCFH溶液发射荧光强度绝对变化率显著高于其余样品,说明TPE-TCF分子的聚集同样有利于总ROS的产生。以上测试结果证明,在白光照射下,TPE-TCF聚集体具有较高1O2和ROS产率,可在日光驱动下高效灭活病原菌。
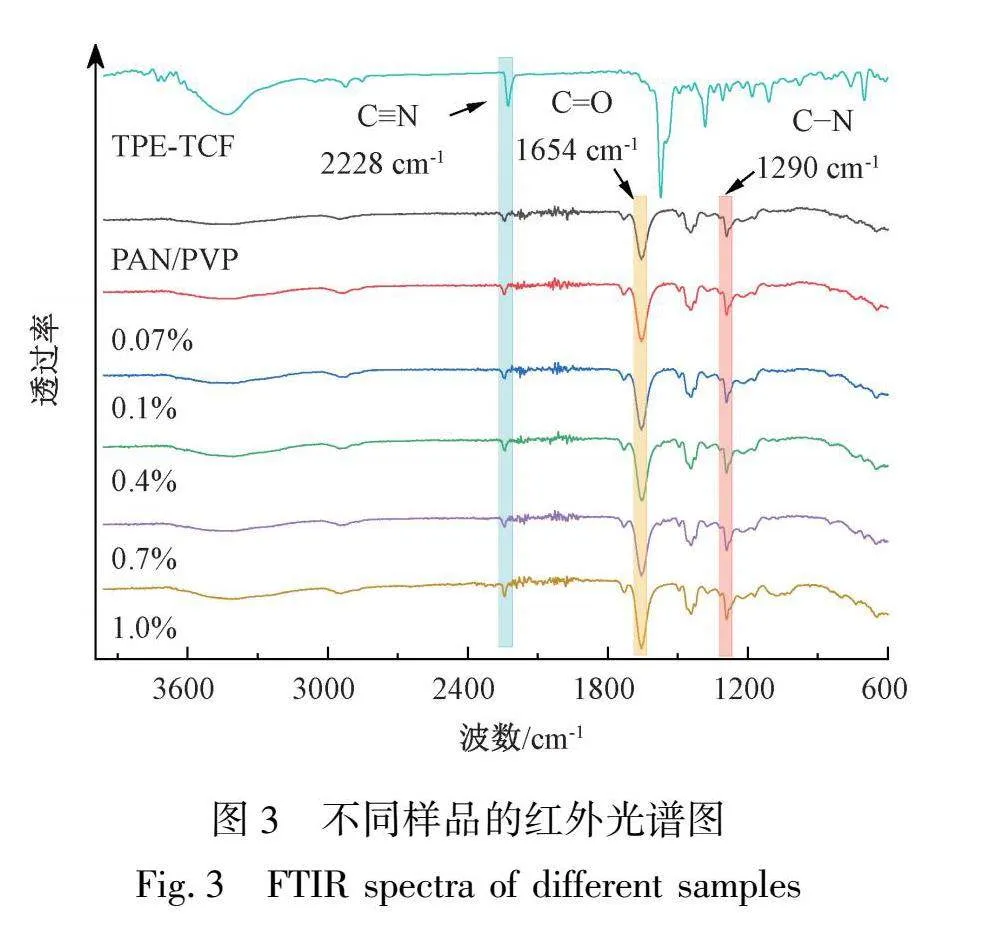
2.3 TPE-TCF@PAN/PVP纳米纤维膜的结构表征
采用红外光谱分别对TPE-TCF、纯PAN/PVP膜和TPE-TCF质量分数分别为0.07%、0.1%、0.4%、0.7%、1.0%的TPE-TCF@PAN/PVP膜进行测试。如图3所示,TPE-TCF在2228 cm-1处的特征峰对应于C≡N键的拉伸振动,PVP在1654 cm-1处的特征峰对应于中吡咯环内C=O基团的拉伸振动,在1290 cm-1处的特征峰对应于CN的拉伸振动。这些特征吸收峰都出现在不同TPE-TCF质量分数的TPE-TCF@PAN/PVP纳米纤维膜的红外谱图中,证明了TPE-TCF@PAN/PVP纳米纤维膜的成功制备。
2.4 TPE-TCF@PAN/PVP纳米纤维膜的微观形貌
利用扫描电子显微镜(SEM)和激光共聚焦显微镜(CLSM)分析了纳米纤维膜的形貌。如图4(a)所示,纯PAN/PVP膜和TPE-TCF质量分数分别为0.07%、0.1%、0.4%、0.7%、1.0%的TPE-TCF@PAN/PVP膜均呈现直径均一的纳米纤维形态,且在TPE-TCF分子掺杂前后,纳米纤维的直径没有发生明显变化,说明TPE-TCF分子的加入并未明显影响纳米纤维膜的物理形貌。CLSM图像显示(见图4(b)),PAN/PVP纳米纤维本身不发射荧光,随着具有AIE性能的TPE-TCF分子掺杂量的增加,TPE-TCF@PAN/PVP纳米纤维的荧光发射强度逐渐增强。此外,具有不同TPE-TCF掺杂量的纳米纤维的发光非常均匀,说明TPE-TCF分子在纳米纤维膜中分布也是十分均一的。最后,测试了纳米纤维膜的厚度,PAN/PVP膜为39 μm,而不同TPE-TCF掺杂量的TPE-TCF@PAN/PVP膜厚度在59~70 μm之间。
2.5 TPE-TCF在纳米纤维膜中的负载稳定性
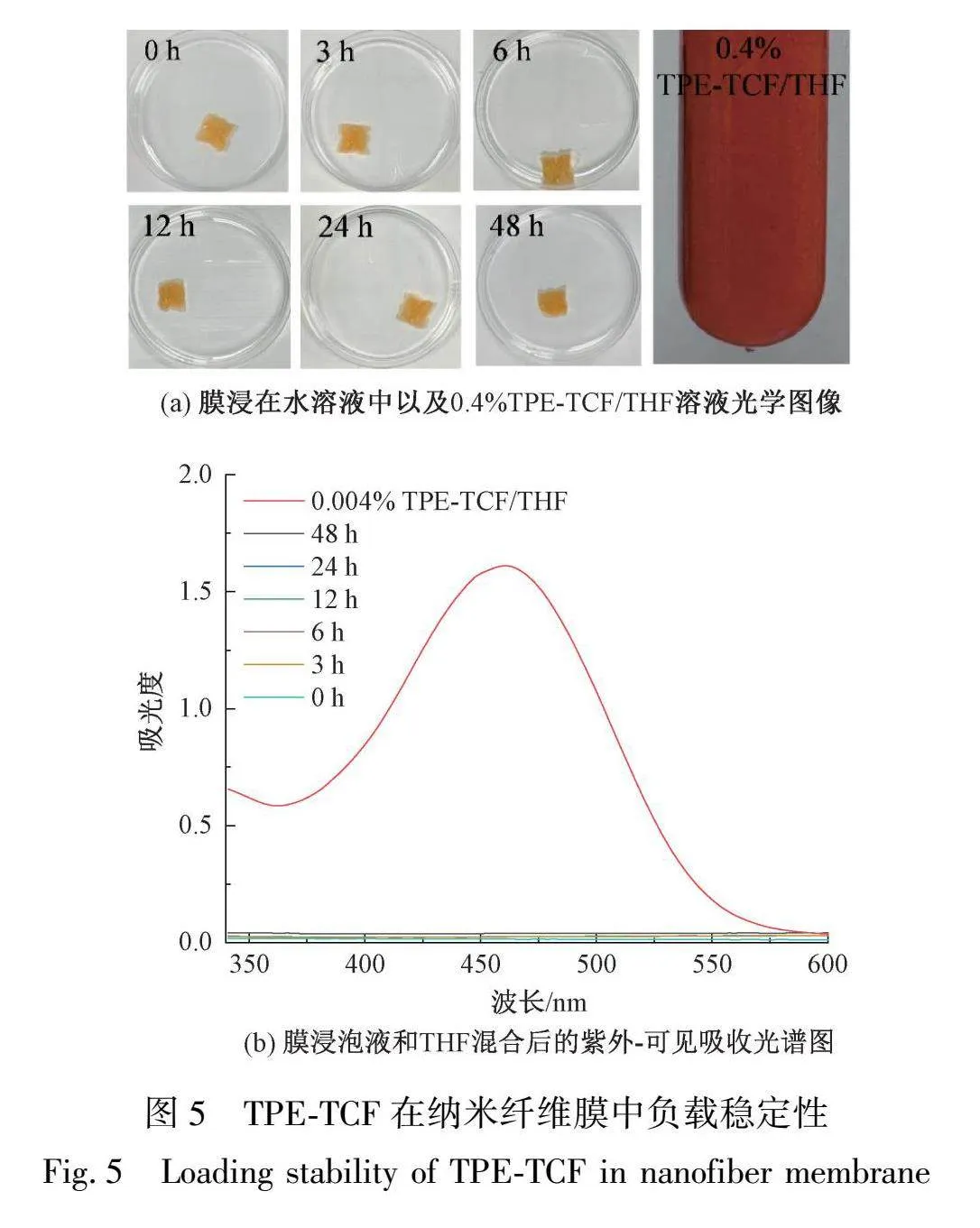
TPE-TCF在纳米纤维膜中的负载稳定性是影响其应用效果和长期生物安全性的重要因素。由于TPE-TCF在THF溶液在460 nm处存在明显的紫外吸收峰,因此,可以通过测定膜浸出液在460 nm处的紫外吸收峰来判别膜中是否有未负载的TPE-TCF分子溢出至浸出液中,从而分析TPE-TCF在膜中的负载稳定性。TPE-TCF在纳米纤维膜中的负载稳定性测试如图5所示,从图5(a)可以看出,质量分数为0.4%的TPE-TCF溶液呈现明显的红色,而将同等TPE-TCF掺杂质量分数的纳米纤维膜(0.4%TPE-TCF@PAN/PVP)浸泡48 h之后,培养皿中的溶液仍可保持无色透明状态。此外,将0.4%TPE-TCF@PAN/PVP纳米纤维膜浸泡液于THF混合后测试的紫外吸收光谱如图5(b)所示,通过紫外吸收光谱图分析可知浸出液均未检测到TPE-TCF紫外吸收峰;而质量分数为0.004%的TPE-TCF溶液在460 nm处的吸光度为1.61。以上结果均可证明,通过共混静电纺丝技术得到的TPE-TCF@PAN/PVP膜具有优异的TPE-TCF负载稳定性。
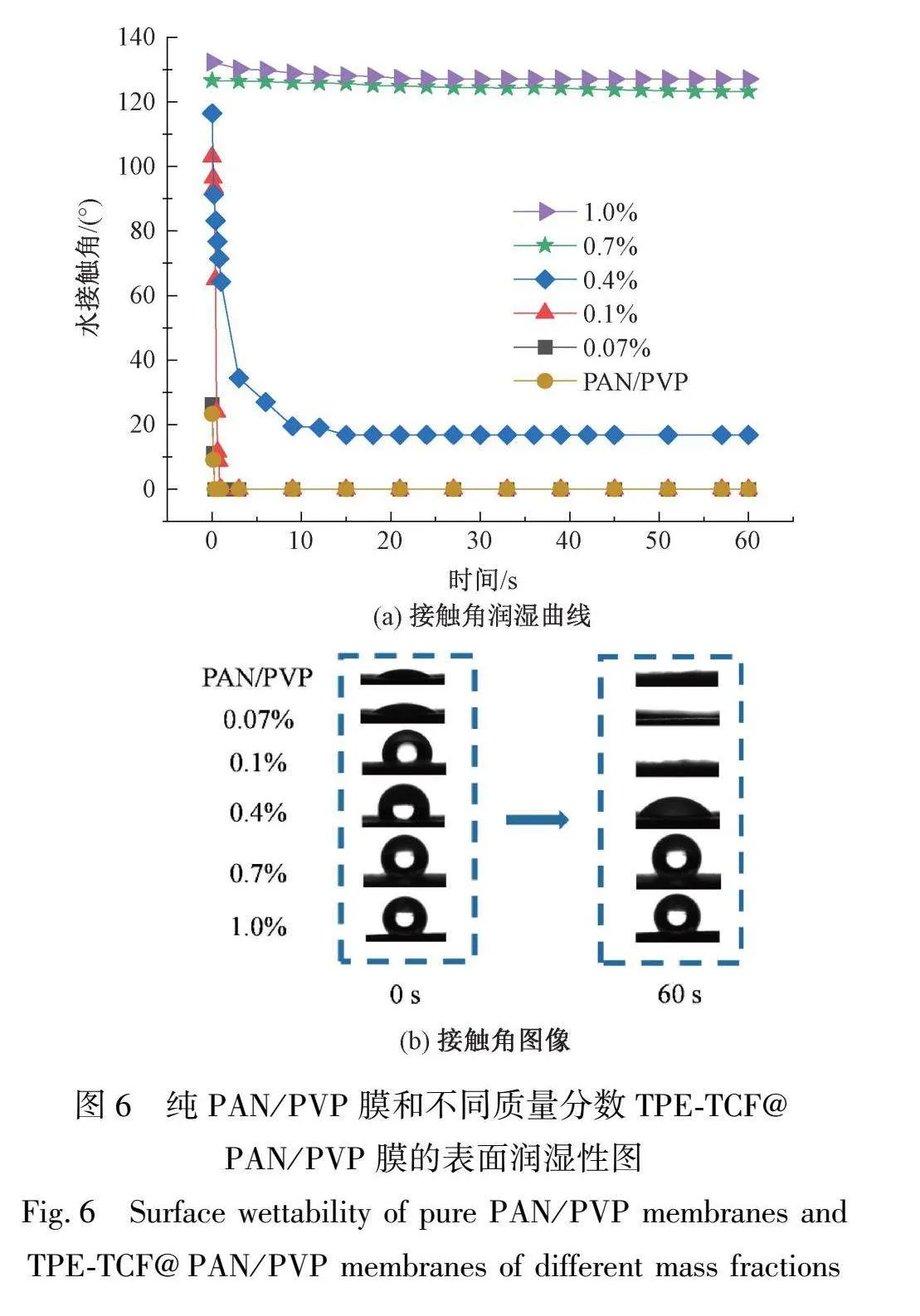
2.6 TPE-TCF@PAN/PVP纳米纤维膜的表面润湿性
纳米纤维膜的表面润湿性直接影响它与外部水相菌液环境的接触效率,进而影响纤维膜中负载的光敏剂TPE-TCF生成的ROS对菌液中细菌的杀灭效果[15]。因此,以水滴接触角(WCA)为指标,表征了具有不同TPE-TCF掺杂量的纳米纤维膜的表面润湿性,用于筛选具有最佳抗菌性能的纳米纤维膜。如图6(a)所示,PAN/PVP纳米纤维膜存在固有的亲水性,在刚接触水时(0.3 s)就达到了完全润湿。但TPE-TCF为疏水有机PS,它在PAN/PVP纳米纤维膜中的掺杂会影响所得TPE-TCF@PAN/PVP纳米纤维膜的亲水性。从图6(b)中可知,随着TPE-TCF质量分数的增加,纳米纤维膜疏水性不断增加。其中,质量分数为0.07%和0.1%的TPE-TCF@PAN/PVP纳米纤维膜完全润湿时间分别为0.3 s和0.9 s,质量分数为0.4%的TPE-TCF@PAN/PVP纳米纤维膜的接触角可在42~60 s内维持在16.8°,均表现出较好的亲水性。而随着TPE-TCF质量分数的进一步增加,0.7%和1.0%的TPE-TCF@PAN/PVP纳米纤维膜在60 s内的接触角为127°,表现出明显的疏水性能。
2.7 TPE-TCF@PAN/PVP 纳米纤维膜的ROS生成效率
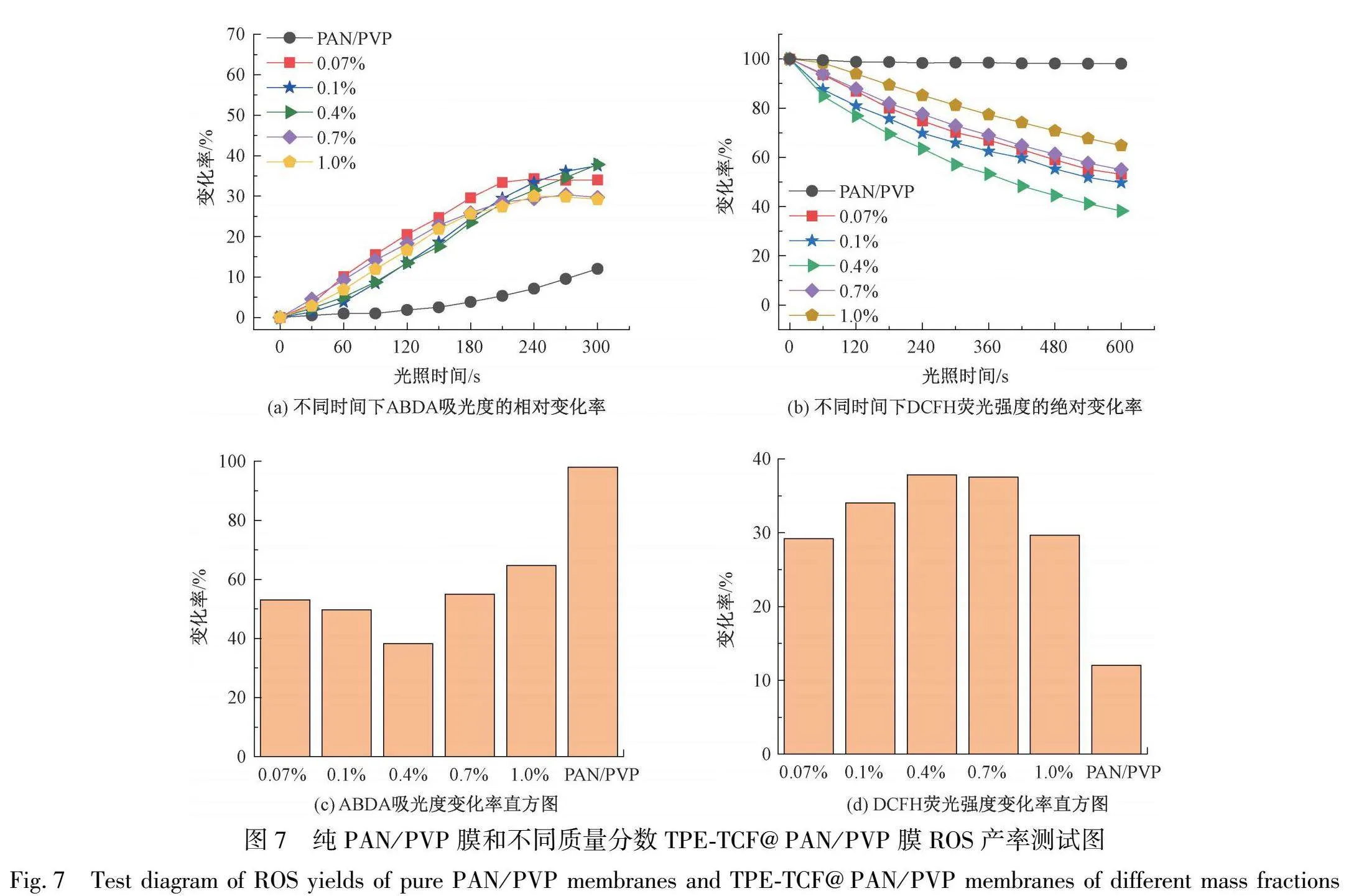
分别以DCFH和ABDA为总ROS和1O2指示剂,如图7所示,进一步研究了不同质量分数TPE-TCF@PAN/PVP纳米纤维膜的ROS生成效率。与纯PAN/PVP纳米纤维膜相比,具有不同TPE-TCF掺杂量的纳米纤维膜均产生了大量ROS,且随着白光照射时间的延长,DCFH溶液在525 nm的荧光强度相对变化率增加(见图7(a)),ABDA溶液在378 nm处的紫外吸光度降解率提升(见图7(b))。不同TPE-TCF质量分数的纳米纤维膜的ROS生成效率不同。其中,质量分数为0.4%的TPE-TCF@PAN/PVP膜具有最好的ROS生成效果,其ABDA相对变化率从100%降至38.22%(见图7(c)),DCFH绝对变化率从0%升至37.82%(见图7(d))。与质量分数为0.4%的TPE-TCF@PAN/PVP膜相比,质量分数为0.07%和0.1%时的膜ROS产率降低。这是由于纳米纤维膜的ROS产生源于TPE-TCF,TPE-TCF分子掺杂量减少,ROS产量下降;质量分数为0.7%和1.0%时,膜ROS产率同样降低,这是由于当TPE-TCF掺杂量大时,纳米纤维膜表现出明显的疏水性能。此时,包裹在纳米纤维膜内部的TPE-TCF无法与外部氧气与水相溶液充分接触,因而限制了其产生和释放ROS的能力。以上结果表明,当纳米纤维膜的TPE-TCF掺杂量适当且亲水性较好时,才具有最佳的ROS产生效率。
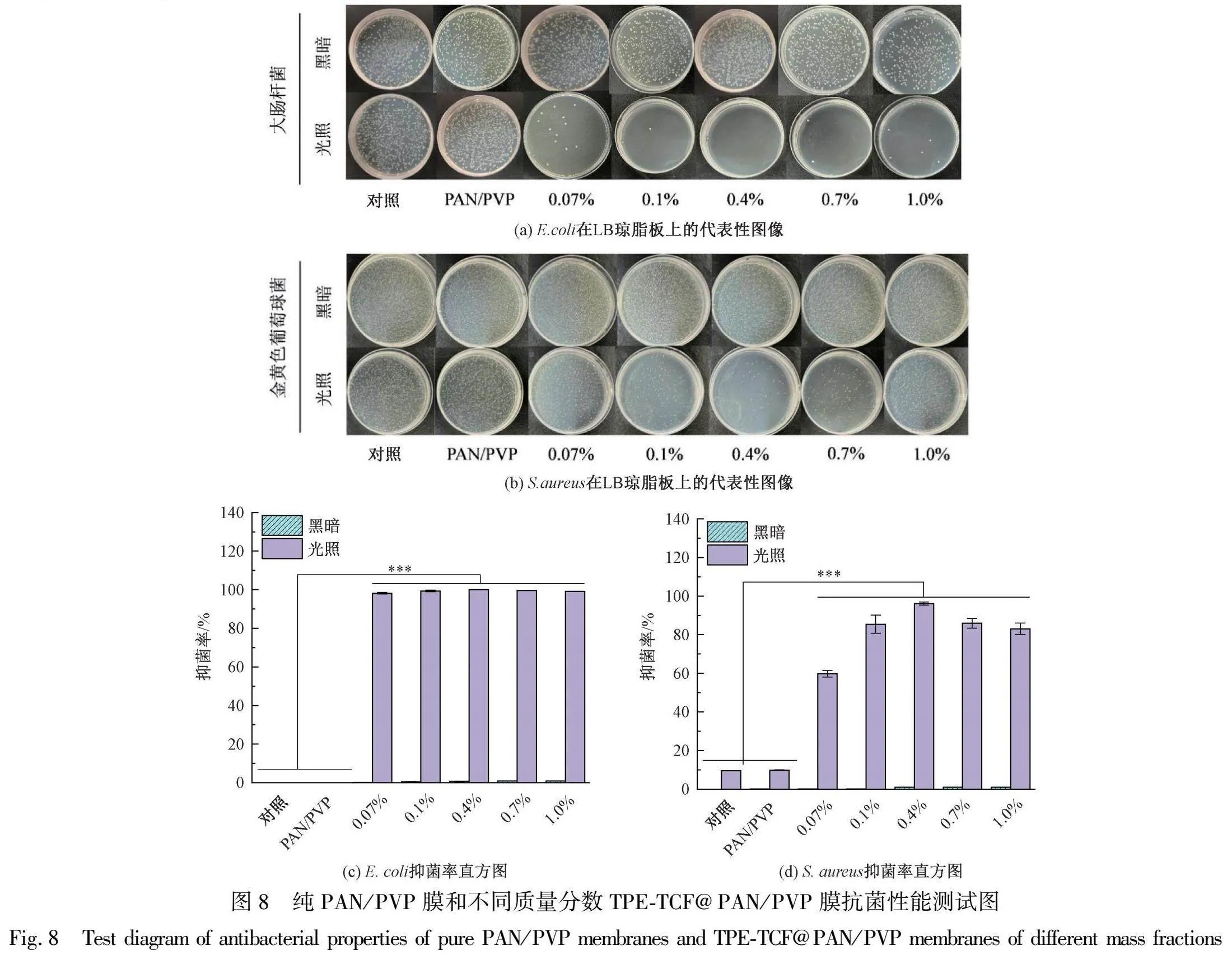
2.8 TPE-TCF@PAN/PVP纳米纤维膜的抗菌性能
选用两种模型细菌(E.coli和S.aureus)对不同TPE-TCF质量分数的TPE-TCF@PAN/PVP纳米纤维膜进行抗菌性能评价。E.coli和S.aureus菌落在LB琼脂板上的图像如图8中(a)和(b)所示。PAN/PVP在黑暗和光照条件下几乎没有表现出杀菌效果。TPE-TCF@PAN/PVP在黑暗中也没有表现出明显细菌灭活效果;相反,其在光照下表现出显著的细菌灭活效果。这是由于在光照下,负载于纳米纤维膜中的聚集诱导发光光敏剂可高效产生ROS。当光敏剂质量分数为0.4%时,纳米纤维膜具有最好的抗菌效果,对E.coli和S.aureus抑菌率分别高达100%和96.2%(见图8(c)和图8(d)),表现出较高的广谱杀菌能力。这是由于此时纳米纤维膜具有最理想的光敏剂含量和亲水性,光敏剂产生的ROS可与水相菌液中的细菌充分接触,实现对细菌的高效灭活。
3 结论
本文以聚集诱导发光分子TPE-TCF为新型PS,选用亲水聚合物PAN和PVP,采用静电纺丝技术制备TPE-TCF@PAN/PVP纳米纤维膜,用于白光驱动下高效产生ROS,达到广谱抗菌的效果。讨论了不同TPE-TCF掺杂量的纳米纤维膜的表面浸润性、TPE-TCF负载稳定性、ROS产生效率和抗菌性能,得出如下结论:
a)聚集诱导发光光敏剂TPE-TCF以聚集状态稳定负载于PAN/PVP纳米纤维膜中,制得形貌规整的TPE-TCF@PAN/PVP纳米纤维膜,并高效产生ROS。
b)亲水聚合物PAN和PVP为TPE-TCF@PAN/PVP纳米纤维膜提供亲水性,促进纤维膜中负载的光敏剂与外部环境水相菌液的接触,提升抗菌效果。
c)TPE-TCF质量分数为0.4%的TPE-TCF@PAN/PVP纳米纤维膜具有亲水性和适当的光敏剂含量,表现出最佳的ROS产生效率和抑菌效果,对S.aureus和E.coli抑菌率分别高达96.2%和100%。
本文研究的TPE-TCF@PAN/PVP纳米纤维膜在白光下具有优越的广谱杀菌效果,在医用抗菌纤维领域展现出巨大的应用潜力。
参考文献:
[1]BAKER R E, MAHMUD A S, MILLER I F, et al. Infectious disease in an era of global change[J]. Nature Reviews Microbiology, 202 20(4): 193-205.
[2]杨玉荣, 张晓妍, 邹明辰, 等. 光动力广谱抗菌型复合材料的制备及性能研究[J]. 化工新型材料, 202 49(S1): 264-267.
YANG Yurong, ZHANG Xiaoyan, ZOU Mingchen, et al. Preparation and property of photodynamic broad-spectrum antibacterial composite[J]. New Chemical Materials, 202 49(S1): 264-267.
[3]NGUYEN V N, ZHAO Z, TANG B Z, et al. Organic photosensitizers for antimicrobial phototherapy[J]. Chemical Society Reviews, 202 51(9): 3324-3340.
[4]LI T T, WU Y, CAI W T, et al. Vision defense: Efficient antibacterial AIEgens induced early immune response for bacterial endophthalmitis[J]. Advanced Science, 202 9(25): 2202485.
[5]HU F, XU S D, LIU B. Photosensitizers with aggregation-induced emission: Materials and biomedical applications[J]. Advanced Materials, 2018, 30(45): 1801350.
[6]ZHU J X, WEN H Y, ZHANG H, et al. Recent advances in biodegradable electronics-from fundament to the next-generation multi-functional, medical and environmental device[J]. Sustainable Materials and Technologies, 2023, 35: e00530.
[7]HU R, QIN A J, TANG B Z. AIE polymers: Synthesis and applications[J]. Progress in Polymer Science, 2020, 100: 101176.
[8]苏芳芳, 经渊, 宋立新, 等. 我国静电纺丝领域研究现状及其热点:基于CNKI数据库的可视化文献计量分析[J]. 东华大学学报(自然科学版), 2024,50(1):45-54.
SU Fangfang, JING Yuan, SONG Lixin, et al. Present situation and hotspot of electrospinning in China: Visual bibliometric analysis based on CNKI database[J]. Journal of Donghua University (Natural Science), 2024,50(1):45-54.
[9]LI M, WEN H F, LI H X, et al. AIEgen-loaded nanofibrous membrane as photodynamic/photothermal antimicrobial surface for sunlight-triggered bioprotection[J]. Biomaterials, 202 276: 121007.
[10]WANG Y J, Shi Y, Wang Z Y, et al. A red to near-IR fluorogen: Aggregation-induced emission, large stokes shift, high solid efficiency and application in cell-imaging[J]. Chemistry-A European Journal, 2016, 22(28): 9784-9791.
[11]LIN J, YAO Z, XIONG M M, et al. Directional transport of drug droplets based on structural and wettability gradients on antibacterial Janus wound plaster with hemostatic, antiextravasation, and prehealing properties[J]. Advanced Composites and Hybrid Materials, 2023, 6(6): 193.
[12]LIU S S, WANG B N, YU Y W, et al. Cationization-enhanced type I and type II ROS generation for photodynamic treatment of drug-resistant bacteria[J]. ACS Nano, 202 16(6): 9130-9141.
[13]HO T H, HONG S Y, YANG C H, et al. Preparation of green emission and red emission ligand-free upconverting nanoparticles for investigation of the generation of reactive oxygen species applied to photodynamic therapy[J]. Journal of Alloys and Compounds, 202 893: 162323.
[14]YANG D L, TU Y X, WANG X R, et al. A photo-triggered antifungal nanoplatform with efflux pump and heat shock protein reversal activity for enhanced chemo-photothermal synergistic therapy[J]. Biomaterials Science, 202 9(9): 3293-3299.
[15]LEE M M S, YU E Y, YAN D Y, et al. The role of structural hydrophobicity on cationic amphiphilic aggregation-induced emission photosensitizer-bacterial interaction and photodynamic efficiency[J]. ACS Nano, 2023, 17(17): 17004-17020.
Preparation and antibacterial properties of loaded aggregation-induced emission
photosensitizers nanofiber membranes
ZHANG Yanan XU Bingjie LI Mengwei REN Haotian GAO Yujie WANG Yijia WU Jindan 2
(1.Zhejiang Provincial Engineering Research Center for Green and Low-carbon Dyeing & Finishing,
Zhejiang Sci-Tech University, Hangzhou 310018, China;
2.Zhejiang Provincial Key Laboratory of Green Cleaning Technology and Washing Supplies, Lishui 323000, China)
Abstract:
Photodynamic antibacterial fibers can generate reactive oxygen species (ROS) under light exposure, rapidly reacting with microorganisms, including Gram-positive and Gram-negative bacteria, fungi, viruses, etc., so as to achieve sterilization effects. In the field of medical protective textiles, such highly efficient, low-toxicity, and low-resistance antimicrobial materials play a crucial role. However, traditional photodynamic antibacterial fibers face challenges such as low ROS production rates and leakage of photosensitizers (PS).
In this study, the AIE molecule with photosensitizer properties, (3-cyano-5,5-dimethyl-4-(4-( 2-triphenylvinyl)styryl)furan-2(5H)-ylidene)malononitrile (TPE-TCF), which possesses a donor-acceptor (D-A) structure, was used as the photosensitizer. By blending it with polyacrylonitrile (PAN) and the hydrophilic polymer polyvinylpyrrolidone (PVP), TPE-TCF@PAN/PVP, a nanofiber membrane with excellent hydrophilicity, was prepared by using electrospinning technology. The study explored the effects of TPE-TCF doping level on the wettability, ROS production rate, and antibacterial properties of the nanofiber membrane.
Proton nuclear magnetic resonance spectroscopy (1H-NMR) confirmed the synthesis of TPE-TCF molecules, and UV-Vis spectrophotometry and fluorescence spectroscopy demonstrated that the aggregation-induced emission (AIE) property of TPE-TCF facilitated the generation of total ROS. Fourier transform infrared spectroscopy (FTIR) analysis confirmed the successful loading of TPE-TCF into the nanofiber membrane. Scanning electron microscopy (SEM) and confocal laser scanning microscopy (CLSM) showed that the TPE-TCF@PAN/PVP nanofiber membrane exhibited a regular morszQsrGA5ZhHq4iCLNlXTGg==phology, and TPE-TCF molecules were aggregated and distributed in the nanofiber membrane. The loading stability of TPE-TCF was also evaluated by measuring the UV absorption of the leach solution from the nanofiber membrane. The results indicated excellent loading stability of TPE-TCF in the nanofiber membrane. Water contact angle (WCA) experiments demonstrated that the hydrophobicity of the nanofiber membrane increased with the increase of TPE-TCF doping levels. ROS production rates of nanofiber membrane with different TPE-TCF doping levels were evaluated by using indicators such as ABDA and DCFH, revealing that the TPE-TCF@PAN/PVP nanofiber membrane with a TPE-TCF mass fraction of 0.4% exhibited the optimal ROS production efficiency. Finally, the antimicrobial performance of the nanofiber membrane was assessed. The results showed that the TPE-TCF@PAN/PVP nanofiber membrane with a TPE-TCF mass fraction of 0.4% demonstrated the best bacteriostatic effect, achieving inhibition efficiencies of 96.2% for S.aureus and 100% for E.coli under 20 minutes of white light irradiation at ultra-low power.
In summary, this study successfully prepared a TPE-TCF@PAN/PVP nanofiber membrane with highly efficient broad-spectrum antibacterial properties using electrospinning technology. The research offers a new approach to the development of medical protective materials and has the potential to address issues related to cross-infection.
Keywords:
aggregation-induced emission photosensitizer (AIE PS); ROS; electrospinning; nanofiber membrane; photodynamic antibacterial

