高亲水性壳聚糖纳米纤维膜的制备及性能




摘 要:为满足医用创伤敷料对高亲水性和抑菌性的要求,以壳聚糖(CS)、聚乙烯醇(PVA)、甘油(GL)为原料,通过静电纺丝技术制备了PVA/CS/GL纳米纤维膜。对纳米纤维膜的形貌和结构进行表征,分析其热稳定性、亲水性、溶胀度和力学性能,并探究其抗菌性能。结果表明:当甘油质量分数为3%时,PVA/CS/GL纳米纤维膜综合性能最佳,具有较好的网状结构和均匀的纤维直径,其中甘油的添加改善了壳聚糖基纳米纤维膜亲水性差、力学强度低等不足。当加入质量分数为3%的甘油后,纳米纤维膜的接触角从53.3°降低至25.3°,在PBS缓冲液中的平衡溶胀率从239.5%提高到332.1%,拉伸强度和断裂伸长率分别从2.68 MPa、8.2%提升到5.83 MPa、17.9%。抗菌实验表明,PVA/CS/GL纳米纤维膜对大肠杆菌和金黄色葡萄球菌的抑菌率分别为94.39%、89.65%,表现出良好的抑菌效果。因此,该 PVA/CS/GL纳米纤维膜在医用创伤敷料方面具有潜在应用价值。
关键词:壳聚糖;聚乙烯醇;甘油;纳米纤维膜;亲水性;溶胀性
中图分类号:TQ340.64中图分类号
文献标志码:A文献标志码
文章编号:1009-265X(2024)10-0011-09
医用敷料是一种常见的医疗用品,在医疗领域扮演着重要角色[1]。医用敷料在创伤和手术伤口的处理、愈合以及感染控制方面有着广泛的应用。研究发现,伤口在湿润的环境中可以更好更快地愈合[2],因此,理想的医用敷料应保持创面适当的湿润,吸收创面的渗出液。医用敷料作为微生物的屏障,还需要有良好的力学性能和柔韧性以适应各种创面形状,且具有较好抗菌性能,以加速伤口愈合过程。
静电纺丝是一种利用高压静电场制备超细纤维的技术,因其制备的纳米纤维膜具有高度类人体天然细胞外基质的结构而备受关注[3]。静电纺丝通常以天然或合成聚合物材料为原料,这些材料大多数具有良好的生物相容性,能够与人体组织相容,并减少对患者的过敏反应。通过对膜表面进行修饰、调节静电纺的材料或负载药物,可以制备特定功能的敷料来适应更多的应用场景,从而为医务人员及患者提供便捷。因此,对纳米纤维膜医用敷料的进一步研究和应用具有重要的临床意义和前景[4]。
壳聚糖(Chitosan,CS)作为一种多功能的生物材料,兼具无毒、可生物降解、良好的生物相容性等特点。此外,以CS为基体的材料还具有免疫刺激和抗菌等作用,常被应用于伤口愈合、止血、组织工程和医用纺织品等领域[5]。然而CS的电纺性较差且力学性能较低[6],往往需要通过交联或与其他聚合物进行混纺。聚乙烯醇(Polyvinyl alcohol,PVA)是一种水溶性聚合物,因其良好的生物相容性和可生物降解性而在生物医学领域广泛应用,尤其是在组织工程和伤口敷料方面。PVA还具有优异的成膜性和成纤性,因此,其在静电纺丝领域得到广泛应用[7]。甘油(Glycerol,GL)是由甘油三酯水解产生,通常是透明、无色、无味、黏稠、吸湿的液体,其常作为食品工业(增塑剂、稳定剂和乳化剂)和化妆品配方中的湿润剂。
传统壳聚糖创面敷料吸湿溶胀性较差,无法为创面提供湿润的微环境,使创面难以愈合。为解决这一问题,本文在壳聚糖、聚乙烯醇中加入对人体和环境无伤害无污染易降解的甘油,通过静电纺丝技术拟制备PVA/CS/GL纳米纤维膜,对其形貌和结构进行表征,分析纳米纤维膜的热稳定性、亲水性、溶胀度和力学性能,并探究其抗菌性能。
1 实验
1.1 实验材料
聚乙烯醇(PVA,1799型,醇解度99%,上海麦克林生物化学有限公司),壳聚糖(CS,脱乙酰度90%,MW=200000,上海麦克林生物化学有限公司),甘油(AR,99%,上海麦克林生物化学有限公司),乙酸(醋酸,AR,99.5%,上海麦克林生物化学有限公司),去离子水(实验室自制)。
1.2 纳米纤维膜的制备
1.2.1 纺丝液的制备
取一定量的PVA颗粒并将其溶解于去离子水中,利用磁力搅拌器在80 ℃条件下持续搅拌至PVA完全溶解,制备质量分数为10%的PVA溶液。再取一定量的CS粉末溶解于体积浓度为2%的乙酸溶液中,磁力搅拌器80 ℃下搅拌至完全溶解,制备质量分数为3%的CS溶液。将制得的PVA、CS溶液按体积比6∶4的比例进行混合,在常温下搅拌至完全混合。在制得的CS/PVA纺丝液中加入不同质量分数的GL,于120℃油浴搅拌至均匀混合,得到含GL质量分数分别为1%、3%、5%的混合纺丝液。
1.2.2 纺丝膜的制备
将制备的纺丝溶液装入体积为10 mL、针头内径为0.4 mm的注射器中,固定在静电纺丝机的注射泵上,连接针头与高压电源,设置接收距离为15 cm、纺丝电压为18 kV、推液速度为1.0 mL/h、滚筒转速为300 r/min,连续纺丝10 h。实验在温度(25±2) ℃,相对湿度(50±5)%的条件下进行。
1.3 纳米纤维膜的性能表征及测试
采用GeminiSEM500型扫描电子显微镜(SEM)对制备的纳米纤维膜的微观形貌进行表征分析,使用ImageJ软件随机选取100根纳米纤维测试纤维的直径分布并计算平均直径。
采用VERTEX70v型红外光谱仪对CS、PVA以及制得的纳米纤维膜进行测试分析,扫描范围设置为600~4000 cm-1。
采用A8Advance型X射线衍射仪对纳米纤维膜结晶度进行测试分析,设置工作电压为40 kV,电流30 mA,2θ的测试范围为5°~50°。
采用TGA550型热重分析仪来测定并连续记录纳米纤维膜质量随温度的变化。设置温度范围是20~600 ℃,测试气体为氮气,升温速率为10 ℃/min。
向pH值为7.4的磷酸盐缓冲溶液(PBS)中加入吐温80,其中吐温80质量分数占1%,常温下搅匀作为人体模拟液。取一定膜样品于干燥箱中以60 ℃烘干,将其置人体模拟液中,37 ℃下静置一段时间,取出样品并擦拭其表面溶液,分别称量溶胀前后的质量,以式(1)计算其溶胀比,测量静置不同时间的纳米纤维膜的溶胀率:
S/%=(W2-W1)/W1×100(1)
式中:S为溶胀率,%;W1为干重,g;W2为湿重,g。
采用接触角表面能测量仪,通过静滴法对膜样品的接触角进行测定。利用高速数码相机捕获测试界面并记录接触角大小以研究膜的亲水性。
使用万能材料试验机测试纳米纤维膜的拉伸力学性能。将加入GL制得前后的纳米纤维膜裁剪成5 mm×50 mm规格,并随机取5个点测量其厚度取平均值,再进行拉伸力学测试。
根据《纺织品 抗菌性能的评价 第3部分:振荡法》(GB/T 20944.3—2008)对PVA、PVA/CS、PVA/CS/GL纳米纤维膜进行抗菌测试,该测试中所使用的菌种为革兰氏阳性菌-金黄色葡萄球菌菌株和革兰氏阴性菌-大肠杆菌菌株,所使用的培养基为琼脂培养基,用接种环从含有金黄色葡萄球菌和大肠杆菌的平板上挑取单菌至肉汤培养液中,并在(37±2) ℃以及180 r/min条件下震荡20 h。使用生理盐水将培养后的菌液稀释到1×105~2×105 CFU/mL,称取0.75 g待测试样品,将其放置于配好的含有5 mL菌液的生理盐水中振荡培养20~24 h,进行稀释涂板,再培养24 h后可在菌落计数仪上统计菌落数。抗菌实验中所使用的样品、琼脂营养液、生理盐水和玻璃器皿均在121 ℃条件下灭菌25 min。根据式(2)计算抑菌率:
Y/%=(Wt-Qt)/Wt×100(2)
式中:Y为试样抗菌率,%;Wt为对照样活菌浓度平均值,CFU/mL;Qt为原样或抗菌样活菌浓度平均值,CFU/mL。
2 结果与讨论
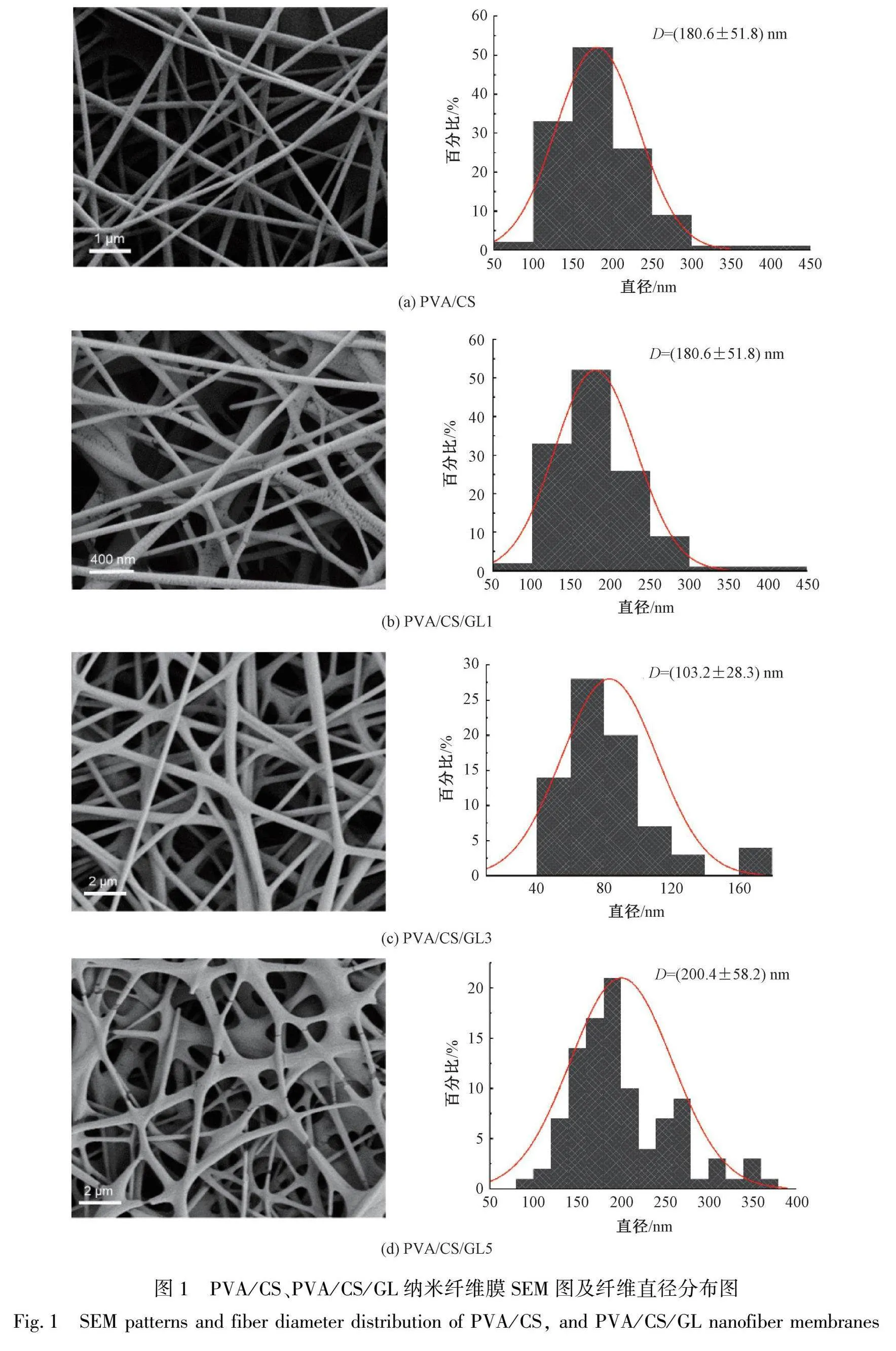
2.1 纳米纤维膜表面形貌测试(SEM)
图1为PVA/CS纳米纤维膜以及加入不同质量分数GL后的纳米纤维膜的SEM图。通过将CS与粘度较大易纺丝的PVA混纺,可以使纺丝过程更加稳定,防止溶液在纺丝过程中过快流动或滴落,有助于形成纤维。图1(a)为PVA/CS纳米纤维膜的纤维形貌图,可以看出图中纤维连续且分布较均匀,纤维之间没有珠串,纤维形貌较好。图1(b)—(d)为加入不同质量分数GL的纳米纤维膜的SEM图像以及纤维直径分布图,从图中可以看出质量分数为1%GL的纳米纤维膜中出现串珠状结构,质量分数为5%GL的纳米纤维膜纤维断裂且粘连较严重,质量分数为3%GL的纳米纤维膜纤维形貌较好且尺寸分布较为均匀。这可能是因为GL在水介质中会破坏PVA聚合物链,使纤维在静电纺丝过程中取向困难从而导致纤维直径增加,继续增加GL则会增加纺丝液的粘度从而使纺丝过程不稳定,纤维直径降低。过量的GL会导致纺丝液黏度过高而堵住针头,使纺丝变得困难,最终导致纤维直径分布较差[8]。
2.2 红外光谱分析(FTIR)
通过对红外光谱数据分析,能够识别材料中的特定官能团,通过对反应前后材料的特征峰位置、强度变化以及新特征峰的出现进行分析,可以判断化学反应是否发生。图2为PVA、CS、PVA/CS纳米纤维膜以及加入不同质量分数GL后的纳米纤维膜的红外光谱图。在CS的谱图中,1593 cm-1处的吸收峰是N—H的变形振动所引起,1360 cm-1处的吸收峰归属于O—H的弯曲振动,3000~3600 cm-1处属于N—H与O—H的伸缩振动发生重叠[9]。在3000~3600 cm-1附近的吸收峰是由O—H和N—H的伸缩振动所引起的,随着PVA和CS混合而变宽并向低波数移动,表明共混溶液中CS、PVA分子间形成了较强的氢键[10]。在PVA/CS/GL的光谱图中,3296 cm-1处的吸收峰属于O—H和N—H的伸缩振动,1039 cm-1处是属于C—O的伸缩振动吸收峰,随着GL的加入峰强发生变化,且无新的吸收峰出现。由此可以得出加入的GL与CS通过氢键作用形成均一的复合纳米纤维膜。
2.3 X射线衍射光谱分析(XRD)
通过XRD的表征来分析各物质的结晶度变化,图3是PVA、CS、PVA/CS纳米纤维膜以及加入不同质量分数GL的复合纳米纤维膜的XRD图谱。从PVA图谱中,可以明显地看到2θ在19.4°处存在特征衍射峰。在2θ在12.1°、20.3°和26.7°处可以观察到CS的特征衍射峰,这些衍射峰与CS线型分子结晶区有关。在PVA/CS纳米纤维膜图谱中,可以看到2θ在19.4°的衍射峰,这是因为PVA与CS进行混纺后,衍射峰强度变低;2θ在12.1°处没有出现明显的衍射峰,这证明了PVA和CS并非是简单的机械混合模式,而是PVA与CS混合之后形成了氢键[11],这种混合作用在一定程度上降低了CS的结晶度,从而有助于改善纺丝过程的进行。从2θ在19.4°处的吸收峰可以看出随着GL含量增加,PVA/CS/GL纳米纤维膜的衍射峰逐渐减弱,表明加入GL能与CS形成氢键,破坏CS的晶体结构导致其结晶度降低,这与FTIR分析结果一致。
2.4 热重分析(TG)
图4为PVA、CS以及加入不同质量分数GL前后的PVA/CS纳米纤维膜的TGA图谱。从图4中可以看出,纳米纤维膜均有3个失重阶段:50~200 ℃为第一阶段,PVA/CS纳米纤维膜失重率为5.48%,PVA/CS/GL纳米纤维膜失重率分别为9.31%、12.62%、13.12%,这阶段主要是膜中结合水和溶剂的蒸发。第二阶段为200~350 ℃,在此阶段PVA/CS纳米纤维膜失重率为59.69%,加入GL后的纳米纤维膜的失重率分别为44.64%、34.56%、34.49%。此阶段主要是由膜中CS的分解所致[12]。第三阶段为350~450 ℃,该阶段中PVA的分解占主导地位。由于其分子结构中含醋酸基团,在高温下迅速裂解产生醋酸、乙醛、丁烯醇和水,其质量迅速降低[13],PVA/CS和加入GL后的纳米纤维膜失重率分别为31.17%、26.51%、24.65%、25.31%。从图4中可以看出,加入不同质量分数GL混纺后的纳米纤维膜的热分解温度较低,热稳定性较差,这可能是由于GL自身在高温下可能会分解或挥发,以及GL与CS分子链上的极性官能团间是通过氢键作用结合,在高温下氢键断裂,纳米纤维膜一定程度发生分解[14],致使致膜的失重和热稳定性下降。
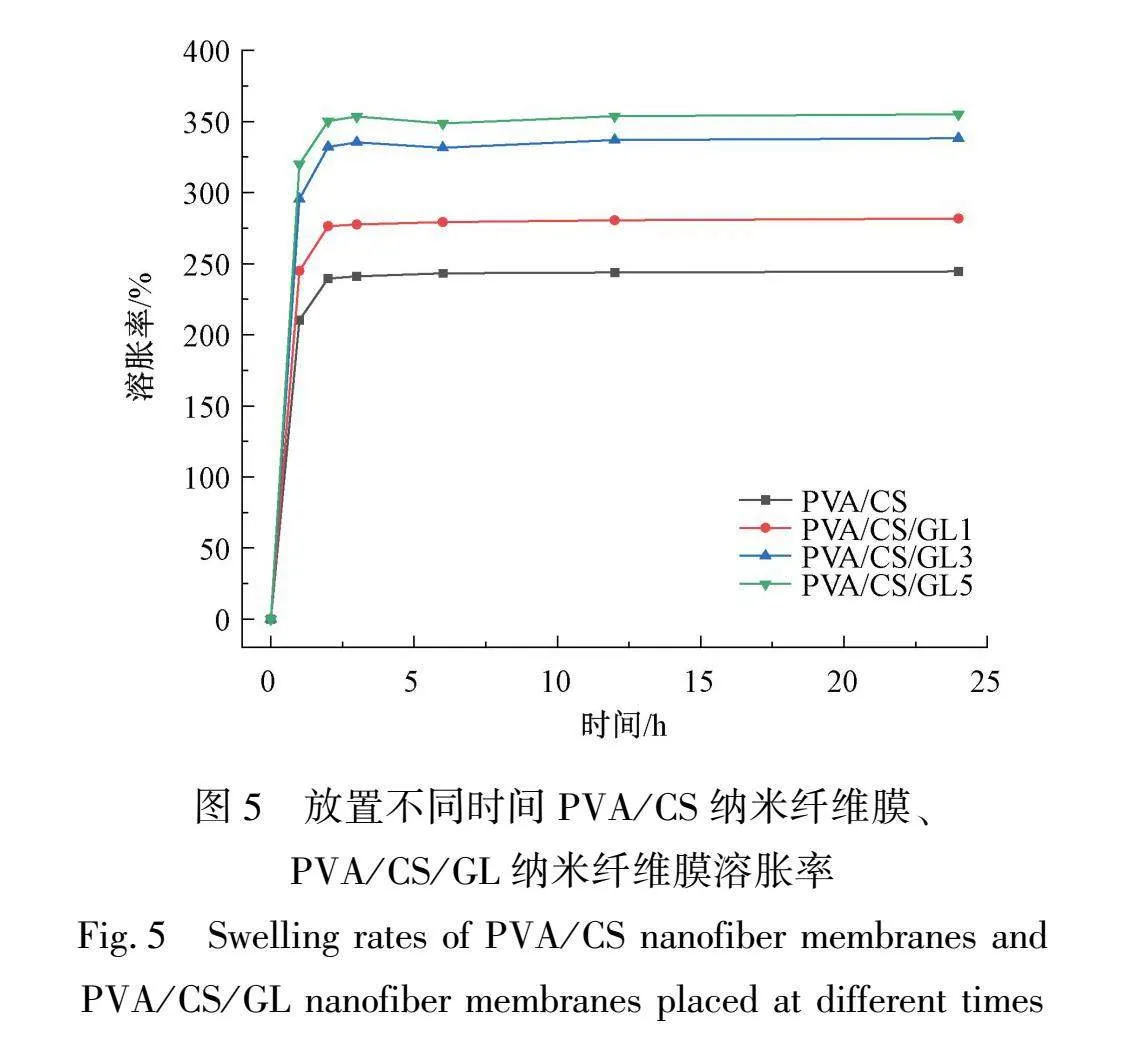
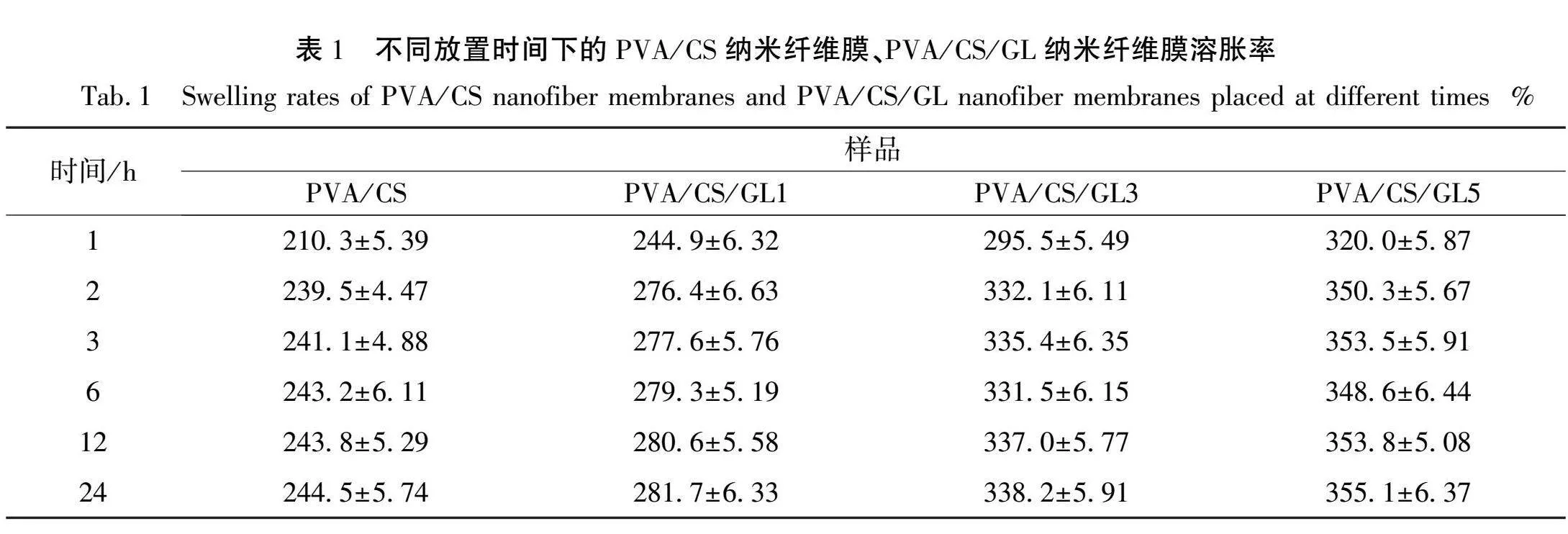
2.5 溶胀性能分析
伤口敷料需要较好的溶胀性能,即高溶胀率,以吸收伤口周围的渗出液,从而保持伤口清洁和湿润,促进愈合。对于需要释放药物或化学物质的医用领域,高溶胀率的纳米纤维膜还可以在体内释放药物,用于缓慢释放和控制药物输送。表1显示的是PVA/CS纳米纤维膜以及加入不同质量分数GL纳米纤维膜放置在PBS和吐温模拟的人体液中的溶胀率。从表1中和图5中可以看出放置2 h后基本达到平衡,此时PVA/CS纳米纤维膜溶胀率为239.5%,加入GL后分别为276.4%、332.1%、350.3%。从图5中可以看出,加入质量分数为1%和3%GL后纳米纤维膜的溶胀率有显著增强,这是因为GL本身对水有较强的吸收性,与CS混合后,会进入到CS分子中占据一定的空间,并通过溶胀作用增加相邻CS分子链间的距离,暴露出更多的氨基和羟基,水合能力大幅提高[15]。而GL质量分数增加至5%时溶胀率增幅变小,这是因为纳米纤维膜吸水不仅与材料本身结合水分子的能力有关,还与水分子对材料的溶胀性能有关,质量分数过大时可能会对纳米纤维的结构进行破坏,限制了其对水分子的装载,从而导致提升效果不明显。
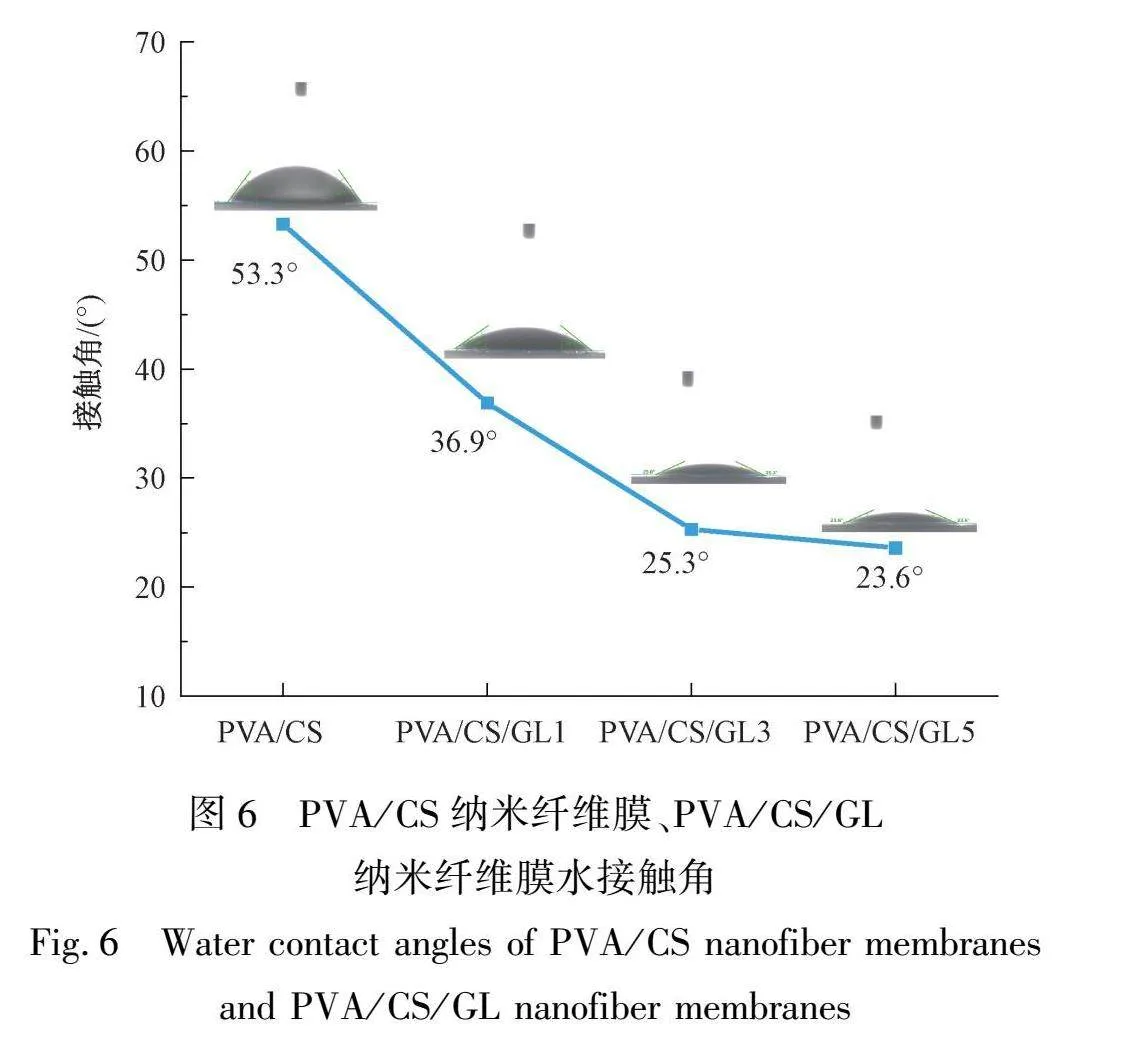
2.6 接触角分析
通过接触角的大小来判断材料表面的亲水性的强弱。图6显示了加入GL前后膜的接触角变化情况。从图6中可以看出,PVA/CS纳米纤维膜的接触角为53.3°,加入不同质量分数GL后,纳米纤维膜的接触角均发生降低,接触角分别为36.9°、25.3°、23.6°,亲水性得到显著提高,有利于其作为医用敷料吸液过程的进行。此外,加入质量分数为1%和3%GL的纳米纤维膜的亲水性提高明显,而质量kgRfWlJh9c6WEdaKqExamlvVUYJnvlgWHHCJbLm4LlE=分数为5%GL的纳米纤维膜的亲水性提高幅度较低,这与溶胀结果相吻合。通过加入GL而引入大量羟基,释放出CS链内与链间的自由羟基,极大程度地提高了对水分子的吸收,GL质量分数过大时限制了纳米纤维膜对水分子的容纳[16],从而导致提升幅度下降。
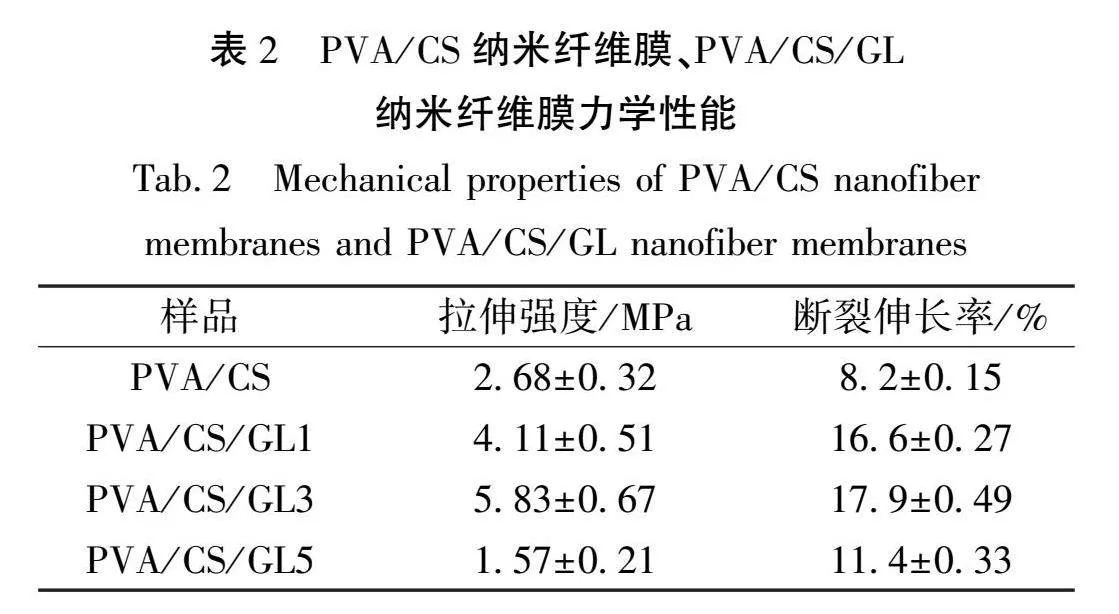
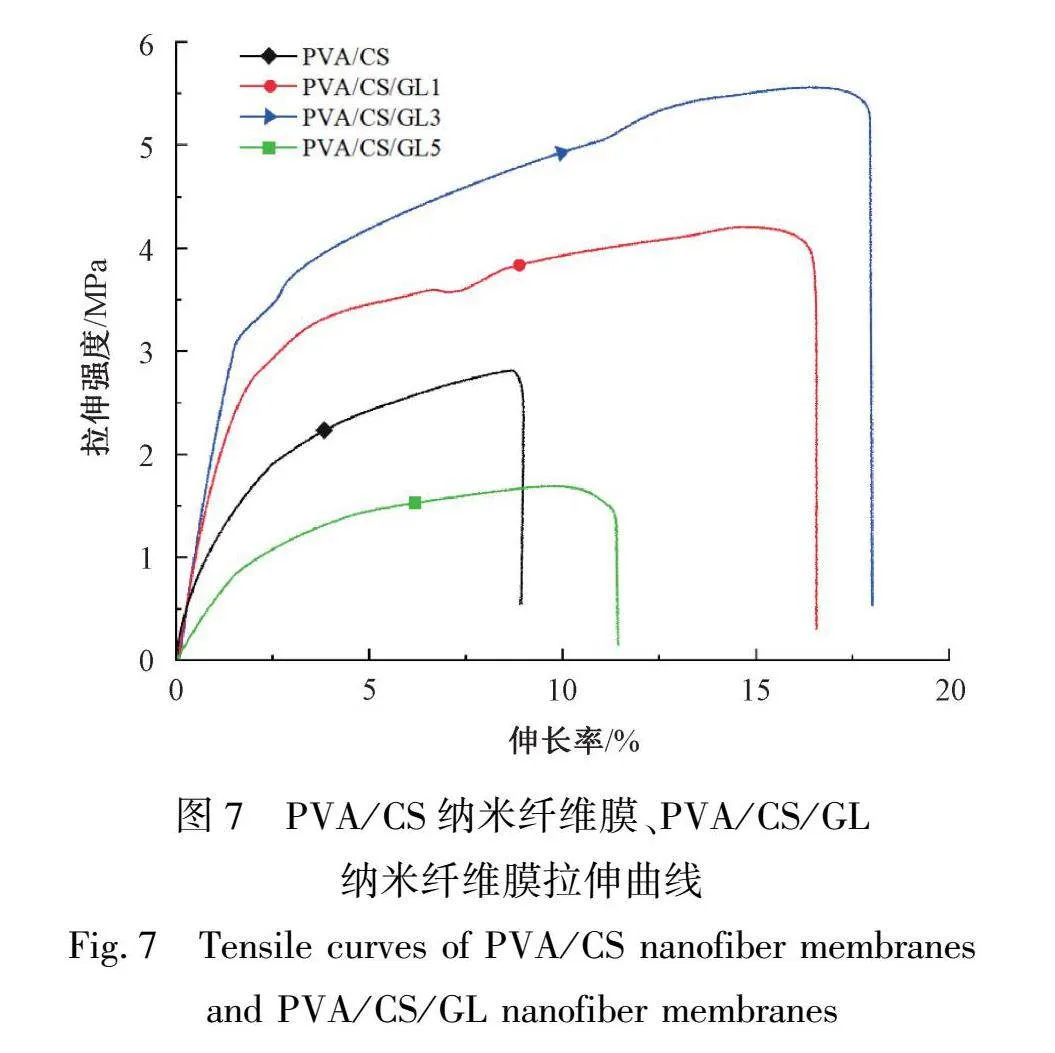
2.7 力学性能分析
伤口敷料不仅需要较高的亲水性能,还需要一定的强力和柔韧性以适应不同部位和不同形状的伤口。表2为PVA/CS、PVA/CS/GL纳米纤维膜的拉伸强度和断裂伸长率,图7为不同纳米纤维膜拉伸曲线。从表2的结果可以看出,通过测试得出PVA/CS的拉伸强度为2.68 MPa,伸长率为8.2%,含不同质量分数GL的纳米纤维膜拉伸强度分别为4.11、5.83、1.57 MPa,伸长率分别为16.6%、17.9%、11.4%。由此可见,加入质量分数为1%、3%GL使得纳米纤维膜的力学性能有较明显的提高。这是因为GL不仅可与CS中的羟基、氨基形成氢键,减弱CS分子之间的相互作用,还可以在PVA聚合物链之间插入,降低链间作用力,增加链的可移动性,使膜的刚性下降,改善膜的机械性能[17]。但过量的GL会对分子链间造成强的破坏作用,导致膜的结构受损,进而使其机械性能下降。
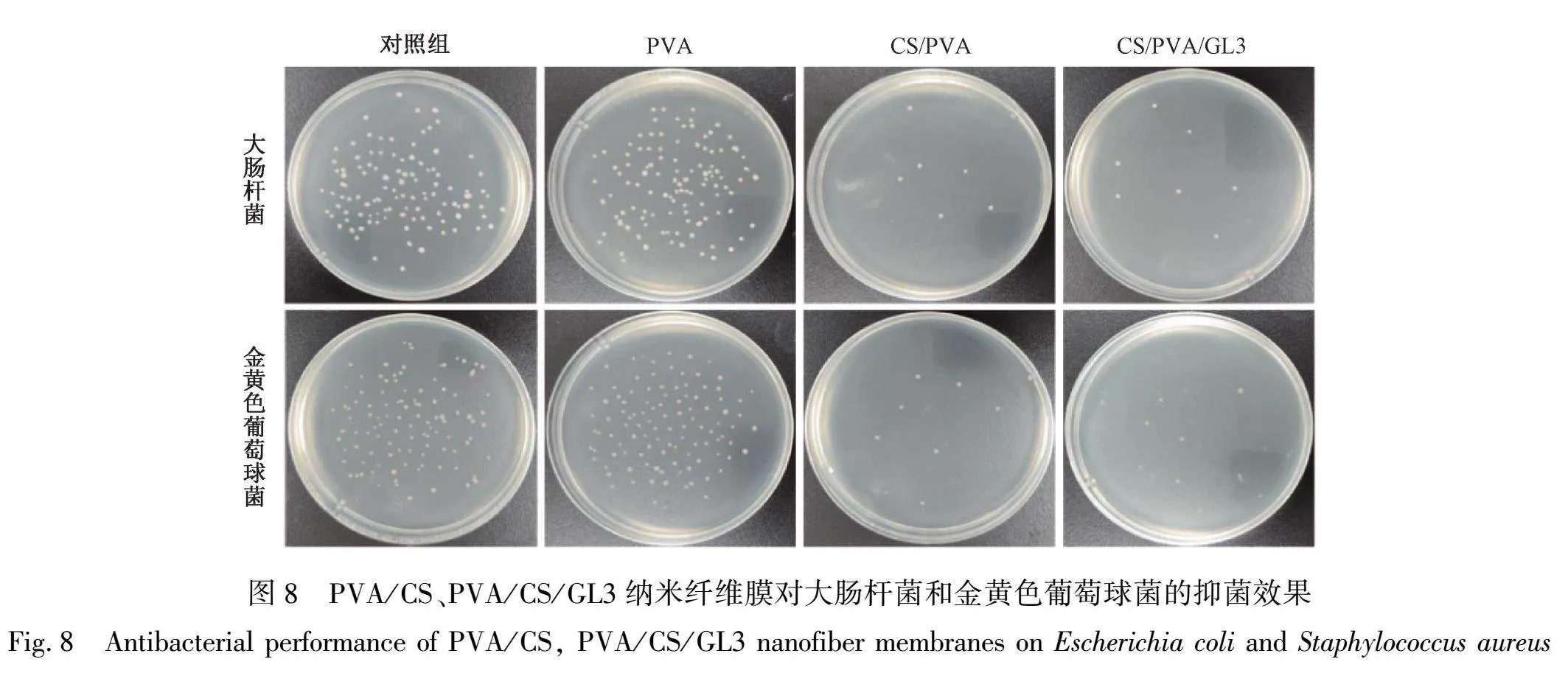
2.8 抗菌性能分析
以未放入样品即直接培养稀释菌液为对照组,通过统计菌落数来观察纳米纤维膜对大肠杆菌与金黄色葡萄球菌的抑菌情况。图8为纯PVA以及加入CS和GL的纳米纤维膜对两种菌的抑菌情况。从图8中可以看出,纯PVA纳米纤维膜两种菌的抑菌效果与对照组基本一致,即无抑菌效果。加入CS混纺后的纳米纤维膜对于两种菌均产生良好的抑菌效果。通过计算可得出PVA/CS纳米纤维膜对大肠杆菌的抑菌率为94.39%,对金黄色葡萄球菌的抗菌率为89.65%,且加入GL对抗菌性能无明显影响。这主要是因为CS带正电的性质,使其能够与带负电的蛋白质、脂多糖和磷壁酸等相互作用,形成絮凝物。这种絮凝作用可以破坏细胞膜的渗透屏障,影响细菌细胞完整性,进而表现出抑菌特性。此外,CS也可能通过静电作用吸附带负电的细菌, 干扰其细胞壁的合成,最终导致细胞壁溶解和细菌死亡,进而表现出抗菌作用。
3 结论
本文以CS、PVA、GL为原料,通过静电纺丝技术制备了PVA/CS/GL纳米纤维膜,并进一步对纤维膜进行结构表征与性能测试,结果表明PVA/CS/GL纳米纤维膜在作为医用敷料方面具有良好的应用价值。主要结论如下:
a) 通过FTIR、XRD和TG结果证实了GL在复合纳米纤维膜中成功混纺。
b) 制得的PVA/CS/GL纳米纤维膜具有优异的亲水性能、溶胀性能和良好的力学性能。在GL质量分数为3%时综合性能较佳,此时接触角为25.3°,平衡溶胀率可达332.1%,拉伸强度和伸长率可达5.83 MPa和17.9%。
c) 制得的纳米纤维膜对大肠杆菌和金黄色葡萄球菌均表现出良好的抗菌效果,抑菌率分别可达94.39%、89.65%,且加入GL后不影响其抗菌性能。
参考文献:
[1]ZHANG H, CHEN C, ZHANG H, et al. Janus medical sponge dressings with anisotropic wettability for wound healing[J]. Applied Materials Today, 202 23: 101068.
[2]刘永旭. CS/PVA静电纺丝纳米纤维膜的制备与力学、抑菌、缓释等性能研究[D]. 哈尔滨: 东北林业大学, 2020: 2-3.
LIU Yongxu. Preparation of CS/PVA Electrospun Nanofibrous Membranes and Its Mechanical, Antibacterial and Slow-release Properties[D]. Harbin: Northeast Forestry University, 2020: 2-3.
[3]苏芳芳, 经渊, 宋立新, 等. 我国静电纺丝领域研究现状及其热点:基于CNKI数据库的可视化文献计量分析[J]. 东华大学学报(自然科学版), 2024,50(1):45-54.
SU Fangfang, JING Yuan, SONG Lixin, et al. Present situation and hotspot of electrospinning in China: Visual bibliometric analysis based on CNKI database[J]. Journal of Donghua University (Natural Science), 2024,50(1):45-54.
[4]MERZOUGUI C, MIAO F, LIAO Z, et al. Electrospun nanofibers with antibacterial properties for wound dressings [J]. Journal of Biomaterials Science Polymer Edition, 202 33(16): 2165-2183.
[5]朱灵奇,刘涛,徐国平,等. 同轴静电纺壳聚糖/聚氧化乙烯-丝素纤维的制备及其生物活性[J/OL].现代纺织技术, 2024:1-12[2024-04-07]. http://kns.cnki.net/kcms/detail/33.1249.TS.20240118.1639.004.html.
ZHU Lingqi, LIU Tao, XU Guoping, et al. Preparation and biological properties of coaxial electrostatically spun chitosan/polyethylene oxide-sericin fibers[J/OL]. Advanced Textile Technology, 2024:1-12[2024-04-07]. http://kns.cnki.net/kcms/detail/33.1249.TS.20240118.1639.004.html.
[6]刘旖旎, 许晓曦, 刘芳, 等. 静电纺明胶/壳聚糖可食用纳米纤维膜的制备、表征及其抑菌特性研究[J]. 食品工业科技, 2020, 41(24): 180-185.
LIU Yini, XU Xiaoxi, LIU Fang, et al. Preparation, characterization, and antibacterial properties of electrospun gelatin/chitosan edible nanofiber membrane[J]. Science and Technology of Food Industry, 2020, 41(24): 180-185.
[7]CHEN Q, WANG Y, YIN F, et al. Preparation and characterization of polyvinyl alcohol-chitosan/cerium-nanocellulose hydrogel for medical dressing application [J]. Starch-Strke, 202 74(3/4): 2100197.
[8]FEI W, WU Z, CHENG H, et al. Molecular mobility and morphology change of poly (vinyl alcohol)(PVA) film as induced by plasticizer glycerol [J]. Journal of Polymer Science, 2023, 61(17): 1959-1970.
[9]CHEN L, LIU Z, SHI J, et al. Preparation and antibacterial properties of chitosan/polyvinyl alcohol nanofibrous mats using different organic acids as solvents [J]. Process Biochemistry, 202 122: 13-28.
[10]CHEN S, WANG H, JIAN Z, et al. Novel poly(vinyl alcohol)/chitosan/modified graphene oxide biocomposite for wound dressing application [J]. Macromolecular Bioscience, 2020, 20(3): 1900385.
[11]马烨. 壳聚糖医用敷料的制备及性能研究 [D]. 南京: 南京理工大学, 2018: 26-27.
MA Ye. Research on Preparation and Performance of Chitosan Wound Dressing [D]. Nanjing: Nanjing University of Science and Technology, 2018: 26-27.
[12]杨梅, 孙润军. 静电纺壳聚糖/聚乙烯醇纳米纤维膜的制备及表征 [J]. 化工新型材料, 2019, 47(4): 120-124.
YANG Mei, SUN Runjun. Preparation and characteri-zation of electrospun chitosan/PVA nanofiber membrane[J]. New Chemical Materials, 2019, 47(4): 120-124.
[13]潘晴彦, 周闯, 杨子明, 等. 季铵盐壳聚糖/聚乙烯醇复合膜的制备及性能研究 [J]. 食品研究与开发, 202 42(20): 100-107.
PAN Qingyan, ZHOU Chuang, YANG Ziming, et al. Preparation and properties of chitosan quaternary ammonium salt/polyvinyl alcohol composite membrane [J]. Food Research and Development, 202 42(20):100-107.
[14]BANO I, ARSHAD M, YASIN T, et al. Preparation, characterization and evaluation of glycerol plasticized chitosan/PVA blends for burn wounds [J]. International Journal of Biological Macromolecules, 2019, 124: 155-162.
[15]RIVERO S, DAMONTE L, GARCIA M A, et al. An insight into the role of glycerol in chitosan films [J]. Food Biophysics, 2016, 11(2): 117-127.
[16]ZOGHI N, FOUANI M H, BAGHERI H, et al. Characterization of minocycline loaded chitosan/polyethylene glycol/glycerol blend films as antibacterial wound dressings [J]. Journal of Applied Polymer Science, 202 138(32): 50781.
[17]ZHU X, ZHANG Y, DENG J, et al. Effect of glycerol onn7RzmZ8sJhJ33ei04ySnZg== the properties of the cross-linked polyvinyl alcohol hydrogel beads [J]. ChemistrySelect, 2018, 3(2): 467-470.
Preparation and performance of highly hydrophilic chitosan nanofiber membranes
GE Yafeng WANG Yan XU Chuqi JIRI Militky
DANA Kremenakova ZHU Guocheng
(1a. College of Textile Science and Engineering (International Institute of Silk); 1b. Zhejiang-
Czech Joint Laboratory of Advanced Fiber Materials, Zhejiang Sci-Tech University, Hangzhou 310018, China;
2.Faculty of Textile Engineering, Technical University of Liberec, Liberec 46117, Czech Republic;
3.Zhejiang Provincial Innovation Center of Advanced Textile Technology(Jianhu Laboratory), Shaoxing 312000, China)
Abstract:
Medical dressings are a common medical device, playing a significant role in the medical realm. It has a wide range of applications in the treatment, healing, and infection control of trauma and surgical wounds. Research has found that wounds can heal better and faster in a moist environment. Hence, an ideal medical dressing should maintain optimal moisture levels at the wound site and effectively absorb exudates. Serving as a barrier against microorganisms, medical dressings must possess robust mechanical properties, flexibility to conform to diverse wound shapes, and effective antibacterial qualities to expedite the healing process.
Electrospinning, a technique that utilizes a high-voltage electrostatic field to produce ultrafine fibers, has attracted much attention due to the highly similar structure of the nanofiber membrane to the natural extracellular matrix of the human body. Electrospinning usually uses natural or synthetic polymer materials as raw materials, most of which have good biocompatibility, can be compatible with human tissues, and reduce allergic reactions to patients. By modifying the membrane's surface, adjusting the electrospun material, or incorporatinCJf6kV+GRjKNZG4PU3rGYA==g drugs, we can create specialized functional dressings tailored to diverse application scenarios, thus offering convenience to both medical professionals and patients Consequently, further investigation and utilization of nanofiber membrane medical dressings hold substantial clinical importance and promise for the future Chitosan (CS), a multifunctional biomaterial, is renowned for its non-toxicity, biodegradability, and excellent biocompatibility. In addition, materials based on CS also have immune stimulation and antibacterial performance, and are often used in fields such as wound healing, hemostasis, tissue engineering, and medical textiles. Nonetheless, CS suffers from poor electrospinning performance and insufficient mechanical strength, often necessitating crosslinking or blending with other polymers to enhance these properties. Polyvinyl alcohol (PVA), a water-soluble polymer, is extensively employed in the biomedical field, particularly in tissue engineering and wound dressings, owing to its favorable biocompatibility and biodegradability. PVA also has excellent film-forming and fiber forming properties, making it widely used in the field of electrospinning. Glycerol (GL) is a transparent, colorless, odorless, viscous, and hygroscopic liquid produced by the hydrolysis of triGLcerides. It is often used as a wetting agent in the food industry (plasticizer, stabilizer, and emulsifier) and cosmetic formulations.
To meet the requirements of high hydrophilicity and antibacterial properties for medical trauma dressings, PVA/CS/GL nanofiber membranes were prepared by using CS, polyvinyl alcohol (PVA), and GL as raw materials through electrospinning technology. The morphology and structure of the nanofiber membranes were characterized, and their thermal stability, hydrophilicity, swelling degree, mechanical properties, and antibacterial properties were analyzed. The results indicated that the PVA/CS/GL nanofiber membrane exhibited optimal overall performance when the mass fraction of GL was set at 3%, featuring a well-structured network and uniform fiber diameter. The addition of GL improved the poor hydrophilicity and low mechanical strength of chitosan based nanofiber membranes. After adding GL with a mass fraction of 3%, the contact angle of the nanofiber membrane decreased from 53.3° to 25.3°, and the equilibrium swelling rate in PBS buuqo6d3418XCg8NPItCWnxA==ffer increased from 239.5% to 332.1%. The tensile strength and elongation at break increased from 2.68 MPa and 8.2% to 5.83 MPa and 17.9%, respectively. Antibacterial experiments showed that the antibacterial rates of PVA/CS/GL nanofiber membranes against Escherichia coli and Staphylococcus aureus were 94.39% and 89.65%, respectively, showing good antibacterial performance. Therefore, the PVA/CS/GL nanofiber membrane has potential application value in medical trauma dressings.
Keywords:
chitosan; polyvinyl alcohol; glycerin; nanofiber membranes; hydrophilic; swollen

