乳液静电纺制备PCL/TCH图案化纳米纤维膜








摘 要:为解决药物突释问题,实现药物的有效包埋和长效释放,设计了具有稳定皮芯结构的图案化微纳米纤维膜,用于药物控释领域。采用乳液静电纺丝技术,将盐酸四环素(TCH)作为模型药物,以聚己内酯(PCL)/六氟异丙醇(HFIP)作为油相、TCH/水溶液作为水相进行纺丝并优化工艺参数,使盐酸四环素(TCH)在纺丝过程中保持性能稳定并能够持续释放。同时,探究图案化对纳米纤维膜的力学性能、载药能力和TCH在体外释放性能的影响。结果表明:当药物质量分数为2%时,纺丝乳液的液滴均匀性较好,液滴的平均直径为0.65 μm,制备的纤维形貌均匀连续,平均直径为200 nm,药物累计释放率达到了52.15%;图案化纤维膜具有良好的柔韧性和延展性,断裂伸长率从78.65%提高到98.96%,载药能力和TCH在体外释放性能均有所提升,药物累计释放率从52.15%提高到65.60%。该研究表明,通过乳液静电纺丝技术,可以将模型药物TCH包裹在PCL的内部,有效改善PCL/TCH纤维膜的药物释放性能,同时图案化可进一步提高机械性能。因此,通过乳液静电纺制备的PCL/TCH图案化纳米纤维膜在医疗敷料方面具备一定的应用前景。
关键词:聚己内酯;盐酸四环素;乳液静电纺;图案化;药物控释
中图分类号:TQ340.64
文献标志码:A
文章编号:1009-265X(2024)10-0020-11
静电纺丝微纳米纤维可以在功能和尺度上模拟天然细胞外基质[1],并具有比表面积大、孔隙率高和孔径分布均匀等优点[2-3],能够有效地促进细胞生长和附着[4],在生物医用材料[5]、组织工程[6]、药物控释[7-8]等领域应用前景广阔。然而,传统静电纺丝法制备的纳米纤维有一定的局限性,如药物在初始阶段突释现象严重,具有在纤维中分布不均匀、长期释放能力较弱[9]等缺陷,故开发一种能够提高药物控释效果、延长药物释放周期的纳米纤维缓控释体系迫在眉睫。
乳液静电纺是一种简单、新型的静电纺丝方法,其制备的纳米纤维具有稳定的皮芯结构[10-11]。将药物包埋至芯层,可减少芯层中药物/活性分子与有机溶剂的接触[12],确保芯层药物的活性,增强药物控释的能力[13-14],有效减缓药物突释现象。聚己内酯(Polycaprolactone,PCL)具有良好的相容性[15]、生物降解性[16]以及机械性能,可作为皮层包埋芯层药物[17],实现药物的缓慢释放和有效控制[18]。同时,为了进一步改善药物长期释放能力较弱的缺陷,以盐酸四环素(Tetracycline Hydrochloride,TCH)作为芯层,通过控制药物质量分数[19],可以提高TCH的包埋效果,延长药物释放周期。
改进静电纺丝的接收装置,如使用旋转接收器或特殊形状的接收器接收纤维,对纳米纤维膜进行图案化处理,可改变纤维的聚集形态、结构和性能[20]。图案化处理会导致纤维间的连接更加蓬松,从而改善纳米纤维膜的机械性能。此外,图案化结构能够增加纳米纤维膜的表面积,进而调控TCH的释放速率及细胞的黏附、迁移、分化[21-22],有望促使细胞沿着纤维的取向方向生长,加速伤口愈合[23]。
本文将PCL作为皮层,TCH水溶液作为芯层,通过乳液静电纺丝技术,采用铁丝编织的金属网格作为接收装置制备PCL/TCH图案化纳米纤维膜,并对PCL/TCH图案化纳米纤维膜的形貌结构、亲水性能、热学性能以及药物释放性能进行分析。本文可为PCL/TCH纤维膜在医用敷料方面的设计提供参考。
1 实验
1.1 实验材料
聚己内酯(PCL,Capa6800),山东优索化工科技有限公司;六氟异丙醇(HFIP,纯度99.5%),上海阿拉丁科技有限公司;盐酸四环素(TCH,USP级别),上海阿拉丁科技有限公司;失水山梨糖醇单油酸酯(Span80,分析纯),上海麦克林生化科技股份有限公司;磷酸盐缓冲液 (PBS,浓度0.10 mol/L),飞净生物科技有限公司。
1.2 实验方法
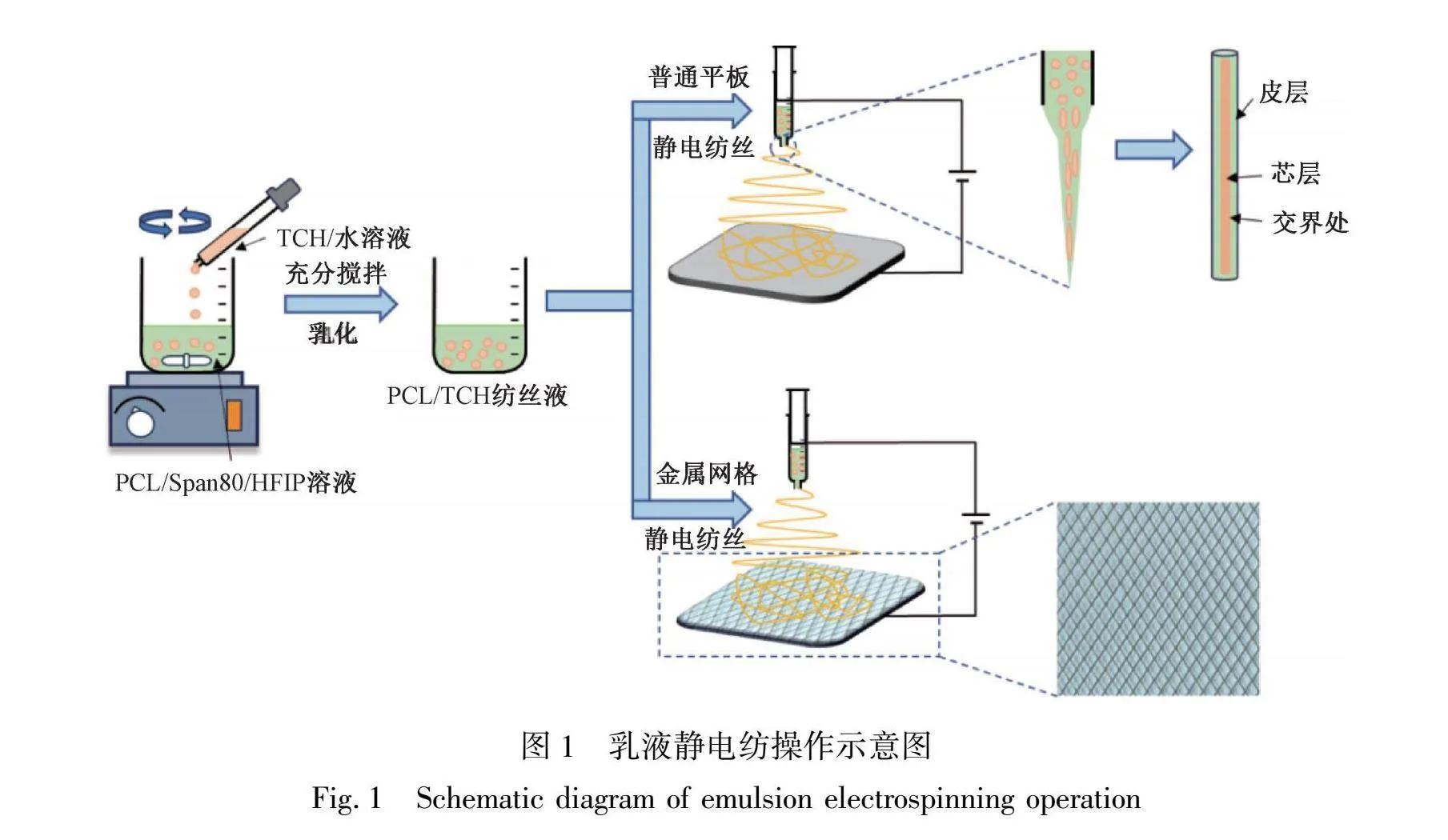
1.2.1 静电纺丝PCL/TCH乳液的配制
根据预实验,选用14%PCL进行纺丝,药物质量分数为2%、3%、4%,具体参数如表1所示。首先,将一定量的PCL溶解于1 mL纯度为99.5%HFIP中,常温搅拌2 h,配制出PCL溶液。随后将19.88 mg的Span80作为乳化剂,加入PCL溶液中,搅拌均匀。同时,将定量的TCH溶解在去离子水中,分别配制成药物质量分数为2%、3%、4%的水相溶液,用针管抽取TCH水相溶液,加入正在搅拌的PCL油相溶液中,配制成水相溶液体积与油相溶液体积比为6∶100的混合液,并避光搅拌10 h。根据表 1所示,将称量后的TCH粉末放入西林瓶中,并放入一定量的去离子水进行搅拌,直至TCH粉末完全溶解。
1.2.2 乳液静电纺纳米纤维膜的制备
抽取1 mL乳液,连接到注射泵上,用铝箔纸包裹的铁板和金属网格作为纳米纤维的接收装置,开始纺丝,示意图如图1所示。静电纺丝的工艺参数为:电压12 kV,注射泵(SPLab01-E型,保定申辰泵业有限公司)推进速度1 mL/h,接收距离为18 cm,针头式静电纺丝喷头的规格为19 G。
1.3 测试与表征
1.3.1 光学显微镜
为了观察液滴形态及纤维形貌,利用载玻片接取约为20 μL的乳液液滴,使用光学显微镜(BH200M型,深圳市兴宇鑫光学仪器有限公司)观察其形貌。通过ImageJ软件确定平均纤维直径,每个样品随机选取50 个纤维用于测量。
1.3.2 倒置荧光显微镜
采用倒置的荧光显微镜(Ti-U型,尼康仪器(上海)有限公司)观察TCH在乳液 PCL/TCH 纳米纤维中的封装和分布。将电纺纳米纤维层收集在显微镜盖玻片上,放置于显微镜下,采用波长为440 nm的紫外线(UV)观察纤维中TCH的分布情况。
1.3.3 红外光谱测试
在室温条件下,选取一小块洁净平整的纳米纤维膜放入样品架中,采用红外光谱仪(Spectrum Tow型,铂金埃尔默仪器(上海)有限公司)对纳米纤维膜进行测试,光谱扫描范围为4000~400 cm- 扫描样品次数为4次。
1.3.4 拉伸测试
根据条样法测试国标GB/T 3923.1—2013,把纳米纤维膜裁剪成10 mm×20 mm,利用电子织物强力机(XS(08)F2-250型,上海旭赛仪器有限公司)测试其拉伸性能,预加张力0.10 N,夹距20 mm,速度50 mm/min,每个样品测 5 次。
1.3.5 热重测试
称取接近5 mg的样品,利用热重分析仪(TGA4000型,铂金埃尔默仪器(上海)有限公司)记录样品质量随温度的变化情况,测试温度范围在30~600 ℃,温度上升速度为10 ℃/min。
1.3.6 水接触角测试
采用视频光学接触角测量仪(OCA25型,德国dataphysics公司)测试纳米纤维膜在空气中的接触角。将样品粘在载玻片上后置于观察台上,并将3 μL去离子水滴在样品表面,观察并记录其接触角随时间的变化。
1.3.7 药物体外释放测试
为探究TCH的释放情况,首先用0.01 mol/L的PBS缓冲液将TCH配制成0.022 g/L的溶液,再分别稀释成质量浓度为0.004、0.006、0.008、0.010、0.012、0.014、0.016、0.018、0.020、0.022 g/L的TCH溶液,并使用双光束紫外可见分光光度计(TU-1901型,北京普析通用仪器有限责任公司)在 200~400 nm波长范围内测试其吸光度,记录TCH在269 nm处的吸收峰,并绘制出TCH的药物释放标准曲线:
C=(0.03963A+0.00367)/1000(1)
式中:C为TCH质量浓度,g/L;A为吸光度数值,Abs。
称取15~20 mg的PCL/TCH纳米纤维膜放入5 mL离心管中,注入4.5 mL PBS缓冲液,在恒温振荡器(BSD-TF270型,上海博迅实业有限公司医疗设备厂)中避光进行药物体外释放性能测试,温度为37 ℃,速度为70 r/min。在特定时间(2、6、12、24、48、72、120、168、240 h)吸出全部的4.5 mL缓冲液作为释放样本,并补充等量新鲜的PBS缓冲液。通过双光束紫外可见分光光度计测量释放样本在269 nm处的吸光度值,根据标准曲线计算每个试样在特定时间上的药物释放曲线,并根据式(2)计算累计释放率,绘制药物累计释放曲线。
Y/%=XN×100(2)
式中:X为第t小时的药物累计释放量,mg;N为理论药物质量,mg。
2 结果与讨论
2.1 接收装置选择分析
本文选用金属菱形网格作为接收装置,如图 2(a)所示,菱形网格的尺寸为5 mm×5 mm,从图 2(b)中观察到金属菱形网格上收集到的纳米纤维膜为圆形,在金属菱形网格上接收的纳米纤维膜呈现清晰的图案化结构,见图 2(c)。形成这种结构的原因是:大多数纳米纤维沉积在菱形网格周围,导致网格中形成的纳米纤维膜较薄,菱形四边上的纤维膜较厚,这样的结构不仅增加了纳米纤维膜的表面积,还有望调控细胞的迁移及黏附情况。
2.2 形貌结构分析
不同药物质量分数的PCL/TCH纺丝乳液液滴形貌及其直径分布如图 3所示。通过对图3中600 个乳液液滴数量的测量,药物质量分数为2%TCH(见图3(a))乳液液滴直径分布均匀,平均直径为(0.65±0.36) μm,乳化效果好。3%TCH乳液液滴直径差异
较大(见图3(b)),平均直径为(0.75±0.61) μm,乳化效果一般。4%TCH乳液液滴直径差异明显(见图3(c)),液滴分散,平均直径为(0.83±0.93) μm,乳化效果较差。这可能是因为,药物质量分数从2%增加到4%时,乳液中液滴的分布均匀性受到了影响,液滴之间的相互作用增强,更易于出现聚集体。
利用以上3种不同TCH质量分数的乳液静电纺PCL/TCH纳米纤维并观察其形貌,光学显微镜图片及直径分布见图 4。由图 4(c)可知,2%TCH的纤维形貌均匀且连续,平均直径为(200±68) nm,有少量分叉,无串珠和液滴。图 4(f)的3%TCH纤维平均直径为(244±117) nm,存在分叉现象,但未观察到明显的串珠和液滴形成。从图 4(i)中观察到4%TCH的纤维粗细不均,平均直径为(245±150)nm,存在较多分叉,有少量的串珠和液滴。出现上述现象的原因可能是盐酸四环素(TCH)与聚合物(PCL)之间存在相互作用力,随着药物质量分数从2%增加到4%,相互作用强度也会增加,导致纳米纤维直径不均;也可能是因为在较低的药物质量分数下,TCH分子相对较少,可均匀分散在纤维中,在较高药物质量分数下,TCH分子数量增多,易形成串珠,导致直径不均。
图5为乳液静电纺PCL/TCH纳米纤维的荧光图像,通过倒置荧光显微镜拍摄乳液PCL/TCH皮芯纳米纤维,观察药物TCH在纳米纤维芯层的分布,在波长为440 nm的紫外线(UV)的扫描下,TCH发出绿色的荧光信号,这说明药物TCH被很好地包裹在纳米纤维的内部。
2.3 红外光谱分析
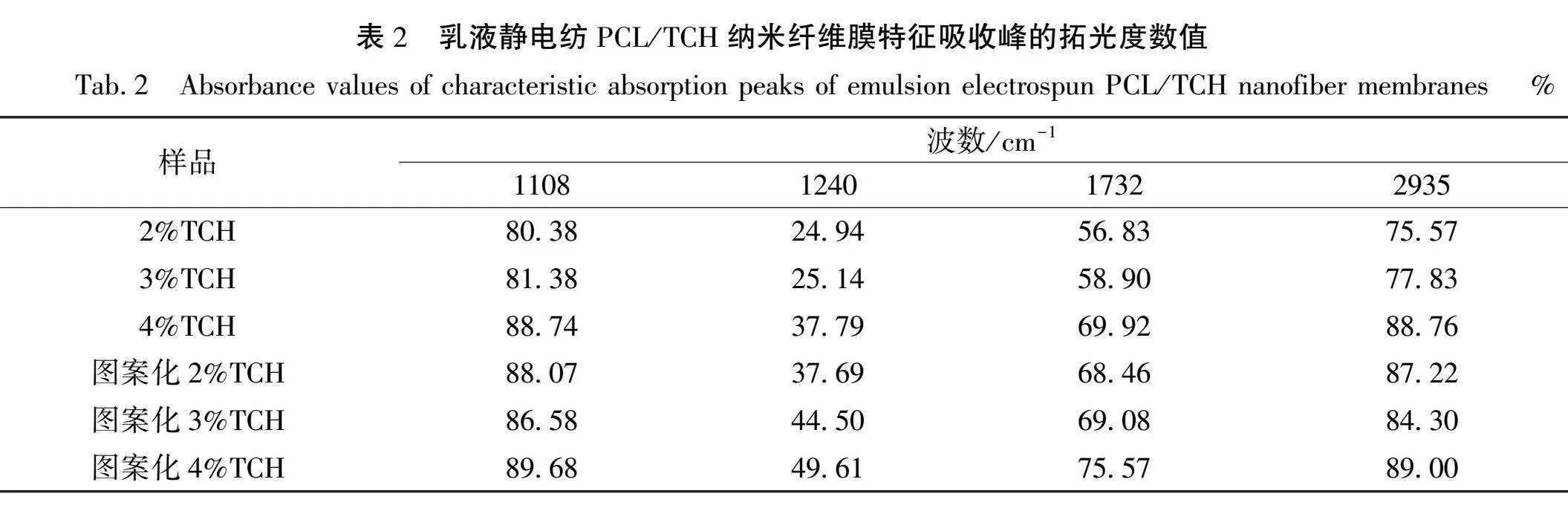
乳液静电纺PCL/TCH纳米纤维膜的红外光谱图如图 6所示,表2为乳液静电纺PCL/TCH纳米纤维膜特征吸收峰的拓光度数值。从图 6中可以看出,在1107、1240、1723、2935 cm-1处分别出现了环酯结构(C—O—C)的伸缩振动峰,TCH中芳香环C—C基团的特征峰,PCL和TCH中CO基团的伸缩振动峰以及TCH中C—H基团的伸缩振动峰。结合图 6和表 2可知,随着药物质量分数的增加,拓光度也相应增加,同时图案化处理的纳米纤维膜,拓光度更大,这可能是因为图案化处理可以通过增加纤维膜的表面积,或者在纤维膜上形成更多的凹凸纹理,使更多的TCH分子能够吸附在纤维膜表面,导致特征峰拓宽。
2.4 拉伸性能分析
为了满足纳米纤维膜的使用要求,其应当具备一定的拉伸性能,乳液静电纺PCL/TCH及其图案化纳米纤维膜的应力-应变曲线如图 7所示。由图 7可知,乳液静电纺PCL/TCH及其图案化纳米纤维膜在断裂之前的应力-应变曲线接近直线状,这一阶段被称为弹性阶段,符合胡克定律,并在经历过很小的屈服阶段后纤维断裂。
不同质量分数TCH下纤维膜的力学性能见图 7(a)—(b)。对于常规纳米纤维膜,药物质量分数从2%增加到4%,断裂强度从5.33 MPa增加到6.96 MPa,断裂伸长率稳定在78.65%~80.31%范围内。图案化纳米纤维膜与常规纳米纤维膜呈现出相同趋势,随着药物质量分数从2%增加到4%,断裂强度从3.22 MPa增加到4.75 MPa,断裂伸长率先从98.96%减少到83.25%,然后增加到93.23%。这是因为药物TCH的增加使纳米纤维的平均直径由200 nm增加到了245 nm,从而在一定程度范围内增加纳米纤维膜的断裂强度。对于常规纳米纤维膜来说,药物TCH的增加对断裂伸长率的影响仅为1.65%;对于图案化纳米纤维来说,药物TCH的增加,断裂伸长率先减少后增加,可能的原因有以下两点:一是因为图案化形成的凹凸纹理影响了断裂伸长率的稳定性,二是因为随着TCH的增加,导致纳米纤维直径不均匀,但药物质量分数的增加提高了纳米纤维膜的韧性。
由图 7(c)—(e)结果可知,药物质量分数为2%TCH时,图案化处理后的纤维膜断裂强度从5.33 MPa减少到3.22 MPa,断裂伸长率从78.65%增加到98.96%;TCH的药物质量分数增加到3%后,图案化处理后的纤维膜断裂强度从5.68 MPa减少到3.48 MPa,断裂伸长率从80.31%增加到83.25%;药物质量分数为4%TCH时,图案化处理后的纤维膜断裂强度从6.96 MPa减少到4.75 MPa,断裂伸长率从79.30%增加到93.23%。其原因可能是图案化导致纤维间的结合力变弱,从而使整体纳米纤维膜的断裂强度降低,但是纤维间也因此变得松弛,改善了纳米纤维膜的柔韧性和延展性,使得纳米纤维膜的断裂伸长率增加。
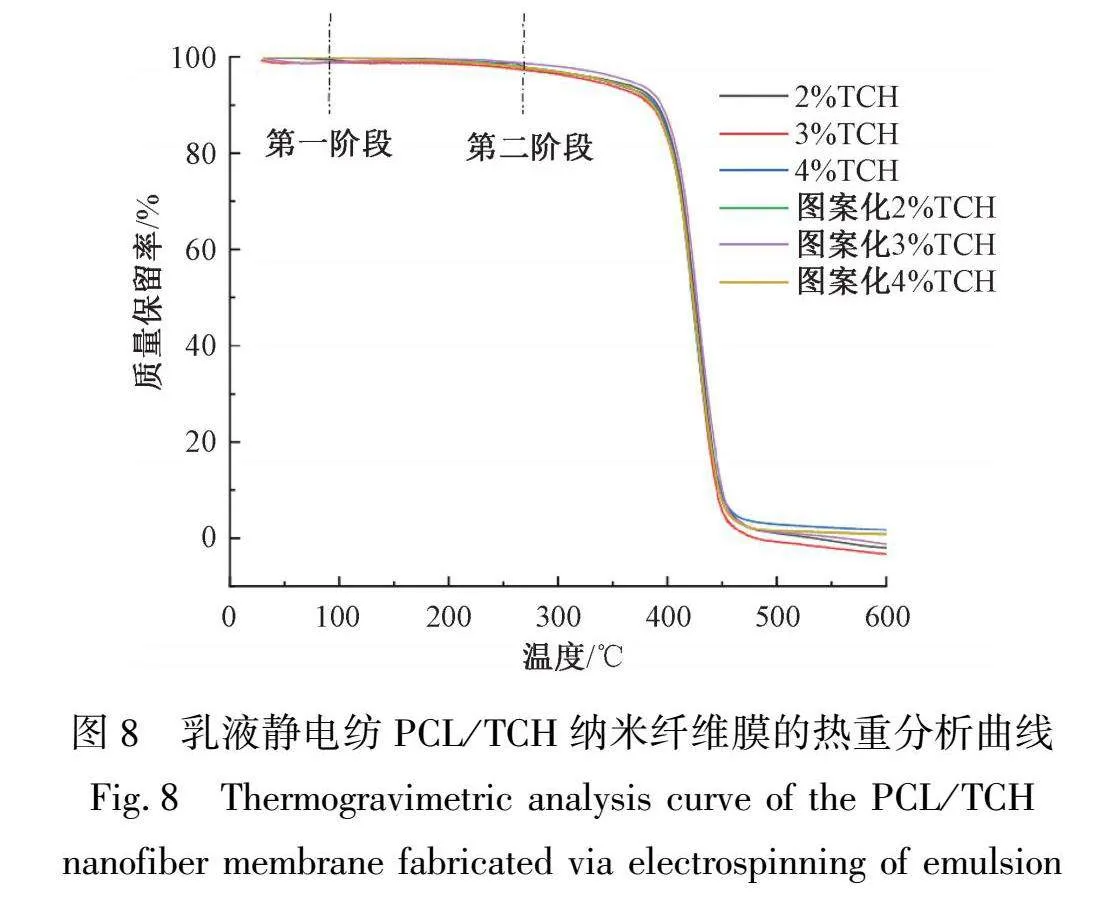
2.5 热重性能分析
为了探究药物质量分数及图案化对纳米纤维膜的热分解的影响,测试了乳液静电纺PCL/TCH纳米纤维膜的热重分析曲线,如图8所示。从图 8中观察到,乳液静电纺PCL/TCH纳米纤维膜的热重分析曲线呈现出相似的趋势:纳米纤维膜的热分解曲线可分为两个阶段,30~90 ℃为第一阶段,样品的质量产生了轻微的减少,从100%下降到98%左右,此阶段主要发生样品内水分的蒸发;268 ℃之后为第二阶段,样品的质量呈快速下降的趋势,从98%左右下降为0%,此阶段主要发生PCL的断裂和分解以及TCH的热分解。由于TCH本身就具有较好的热稳定性,所以增加TCH的质量分数或采用图案化处理,对纳米纤维膜的热分解过程不会产生较大的影响。
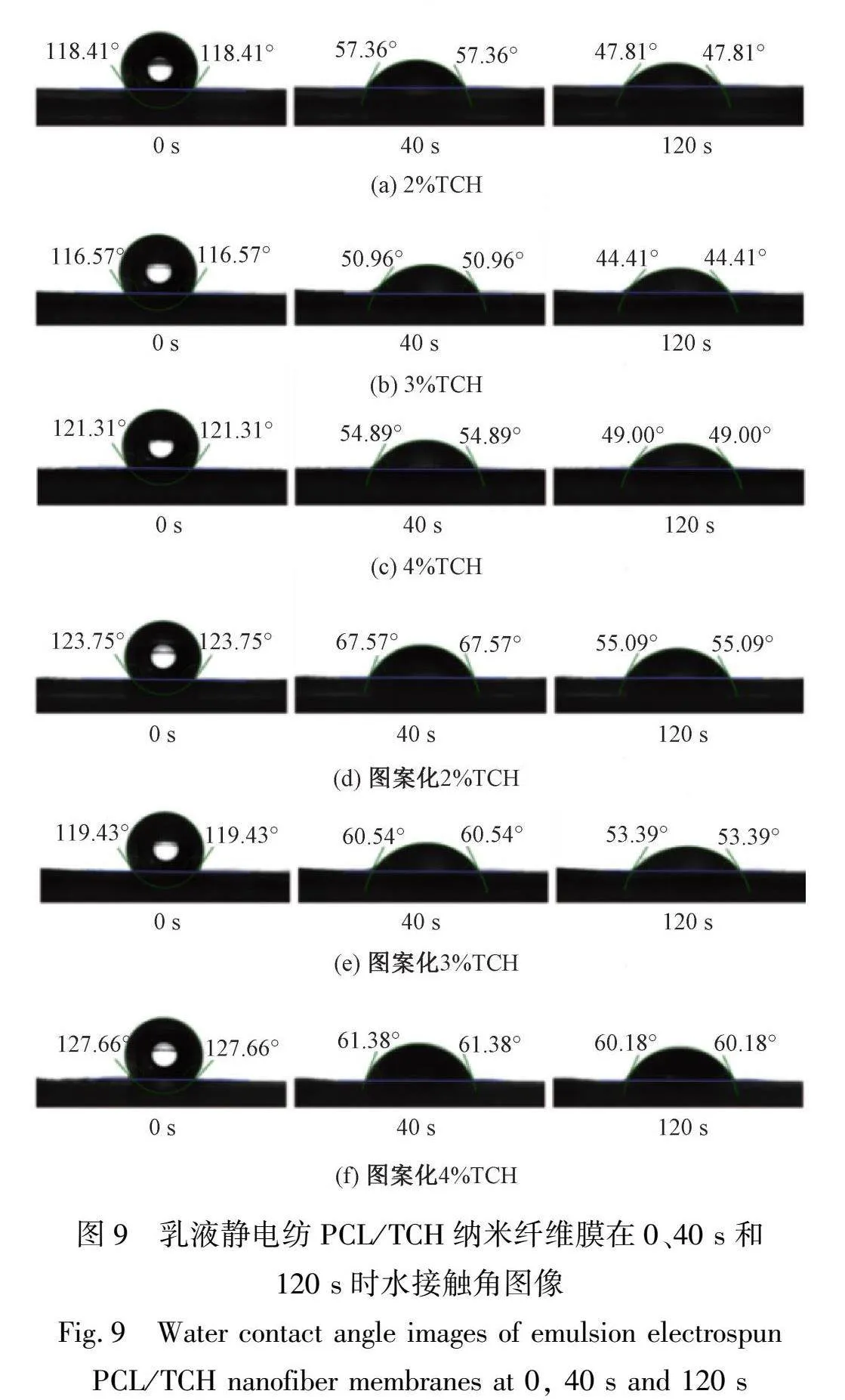
2.6 亲水性能分析
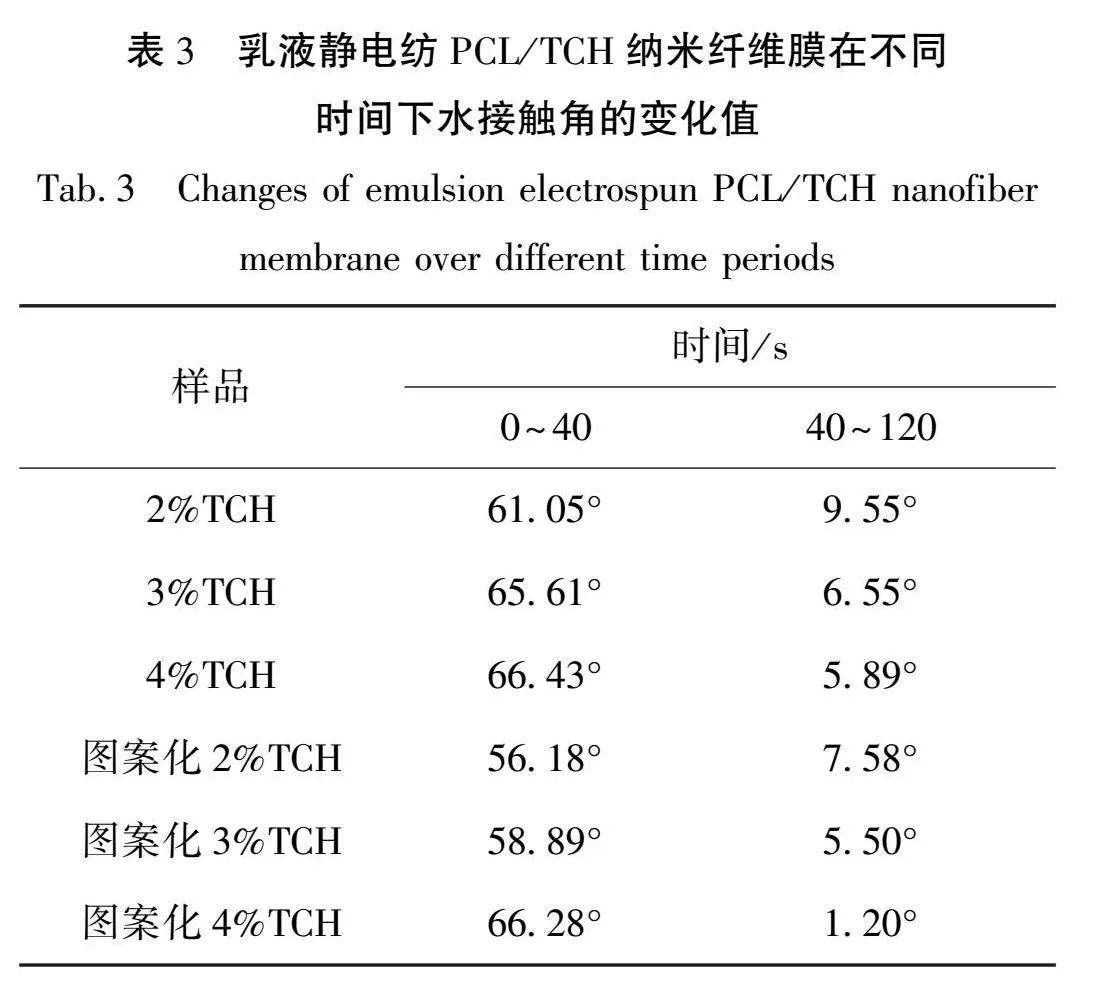
为了探究纳米纤维膜的亲水性与TCH质量分数及其图案化之间的关系,测试了乳液静电纺PCL/TCH纳米纤维膜在0、40、120 s时水接触角变化,如图 9所示。表 3为乳液静电纺PCL/TCH纳米纤维膜在不同时间下的水接触角值与变化值,由表 3可知:在0~40 s内,随着药物质量分数从2%增加到4%,在纳米纤维膜表面的水接触角变化从61.05°增加到66.42°;图案化后,纳米纤维膜表面水接触角从56.18°升至66.28°。相较于同药物质量分数的纳米纤维膜,图案化纳米纤维膜的接触角变化值均低于常规纳米纤维膜。这主要是由于TCH是水溶性药物,药物质量分数增加使纤维膜的亲水性增强;图案化处理后,纤维膜表面特性可能发生改变,使其更具有更低的粗糙度,并减少水接触角的变化值,水接触角增加;在40~120 s内,随着药物质量分数从2%增加到4%,纳米纤维膜表面的水接触角变化值从9.55°减少到5.89°,然而,经过图案化处理的纳米纤维膜表面的水接触角变化从7.58°降低到了1.20°,小于相同药物质量分数情况下普通平板接收的纤维膜。这可能是因为纤维膜达到了吸水平衡状态,此时水接触角的变化较小,随着药物质量分数的增加,导致纤维膜会更快速地吸水达到饱和状态,从而水接触角的变化值减少。
2.7 药物体外释放性能分析
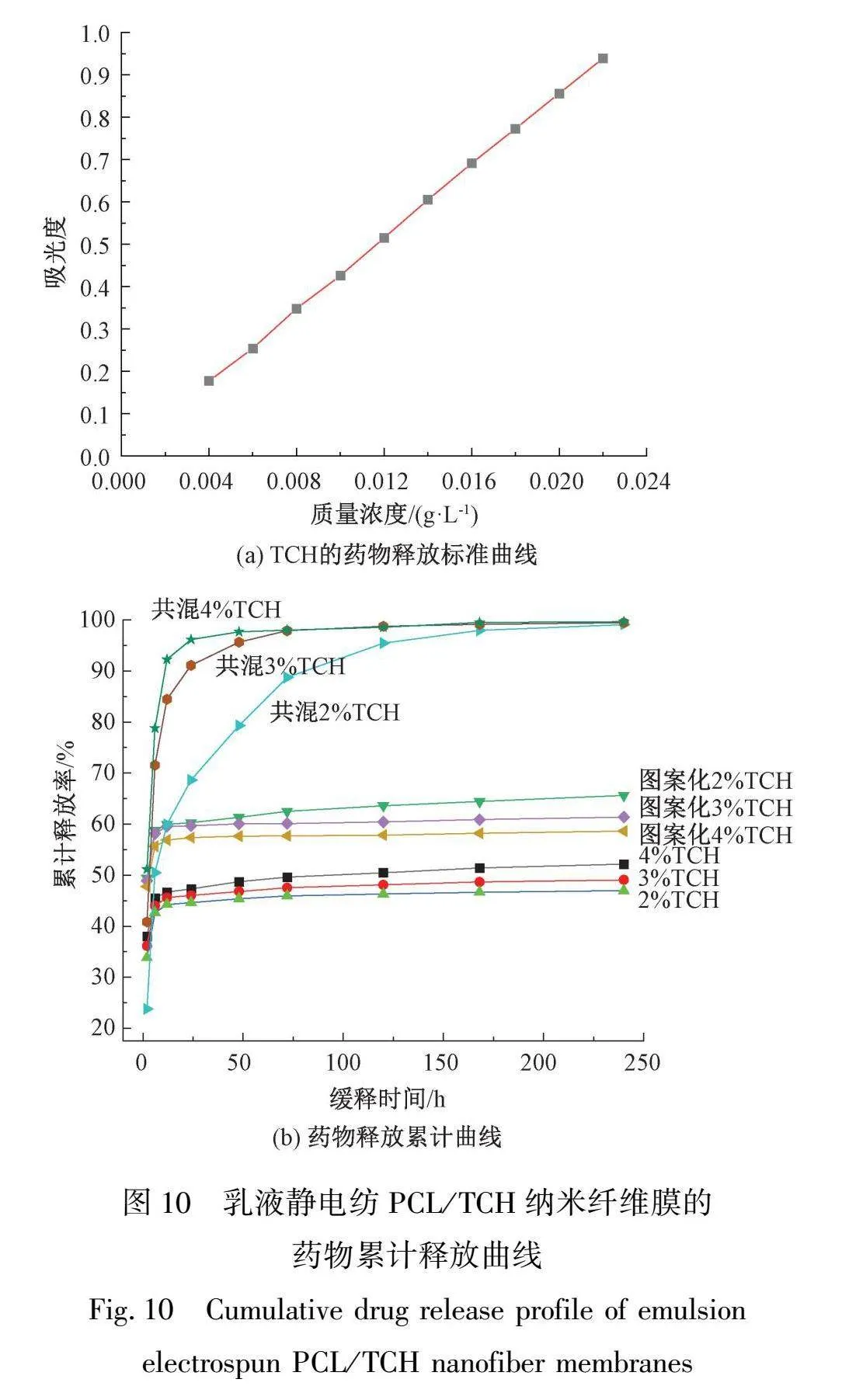
本文测得波长为269 nm处TCH质量浓度为0.004、0.006、0.008、0.010、0.012、0.014、0.016、 0.018、0.020、0.022 g/L的吸光度数值,分别为0.16、0.24、0.32、0.40、0.48、0.56、0.64、0.72、0.80、0.87,根据这些数据绘制了标准曲线,如图 10(a)所示。
为进一步分析载药量及图案化对缓释行为的影响,绘制了乳液静电纺PCL/TCH纳米纤维膜的药物累计释放曲线,如图 10(b)所示。从图10(b)中可知,2%TCH、3%TCH、4%TCH混纺纳米纤维膜在2 h的药物突释率为23.77%、40.83%、51.13%,随着缓释时间从2 h延长到240 h,药物累计释放率达到了99%~100%。从12 h之后,共混PCL/TCH纳米纤维膜的药物累计释放率均高于乳液PCL/TCH纳米纤维膜。这可能是因为乳液静电纺丝技术制备出了具有明显皮芯结构的纳米纤维,该结构可以将TCH稳定包封在纤维的芯层中。与之相比,传统的混纺纳米纤维中,会有部分TCH分布在纤维表面或近表面区域,当纤维接触于PBS缓冲液时,TCH会因为快速溶解、扩散而导致突释现象。皮芯结构的设计有效避免这一问题,因为它限制了药物的扩散路径将TCH包封在芯层,从而减缓了TCH在释放初期的释放速率,有效缓解了突释现象。
对于乳液静电纺纳米纤维膜,由于纤维形成了皮芯结构,TCH被包裹在纤维内侧,能够有效地缓解药物突释。随着药物质量分数增加,纺出的纤维直径增大,皮层厚度也增加,TCH扩散到纤维表面并释放的路径更长。
在TCH浓度相同的情况下,对比乳液静电纺常规纳米纤维膜和图案化纳米纤维膜的释放行为。药物质量分数为2%TCH时,图案化纳米纤维膜的药物累计释放率提升了13.46%;当药物质量分数达到3%TCH及4%TCH时,图案化纳米纤维膜的累计药物释放率分别提升了21.31%和11.66%。以上说明图案化的 PCL/TCH 乳液静电纺纳米纤维膜的药物累计释放率均高于相同药物质量分数的以普通平板作为接收装置纺制的纳米纤维膜,这可能存在两点原因:一是因为图案化纳米纤维膜有着更大的表面积,可有效增加药物TCH与缓冲液的接触面积,加速药物扩散速度;二是因为金属网格可在静电纺丝过程中形成局部电场的材料,可改变纳米纤维膜内的离子浓度分布,影响TCH的释放性能。
3 结论
本文采用了乳液静电纺丝技术制备了具有皮芯结构的纳米纤维,PCL作为皮层,将模型药物TCH包封在芯层,并以金属菱形网格作为接收装置,得到了图案化纳米纤维膜,同时对其性能进行了测试和分析,得出以下主要结论:
a) 增加药物质量分数会影响乳液的均匀性,导致液滴尺寸不均匀,差异增大,进而降低了纺丝乳液的乳化效果。同时,纳米纤维直径随药物质量分数的增加而增大,但直径均匀性变差,出现少量串珠和液滴,分叉现象更加明显。
b) 在一定范围内,药物质量分数的增加使得纤维直径增大,有助于提高纳米纤维膜的力学性能。在相同药物浓度下,图案化纤维膜的强度略微减小,表面粗糙度增大,水接触角增加。
c) 混纺纳米纤维膜2 h内的突释及累计释放率较乳液静电纺皮芯纳米纤维膜高,说明乳液静电纺形成的皮芯结构可有效缓解突释。对于乳液静电纺纤维膜,随着药物质量分数从2%增加到4%,纤维直径增加,增长了芯层药物扩散到纤维表面并释放的路径,导致了药物累计释放率增高;而相同药物质量分数下,图案化比常规纳米纤维膜具有更大的表面积,药物累计释放率更高。
参考文献:
[1]LI T, SUN M, WU S. State-of-the-art review of electrospun gelatin-based nanofiber dressings for wound healing applications [J]. Nanomaterials, 202 12(5): 784.
[2]LI Y, ZHU J, CHENG H, et al. Developments of advanced electrospinning techniques: A critical review[J]. Advanced Materials Technologies, 202 6(11): 2100410.
[3]苏芳芳, 经渊, 宋立新, 等. 我国静电纺丝领域研究现状及其热点:基于CNKI数据库的可视化文献计量分析[J]. 东华大学学报(自然科学版), 2024,50(1):45-54.
SU Fangfang, JING Yuan, SONG Lixin, et al. Present situation and hotspot of electrospinning in China: Visual bibliometric analysis based on CNKI database[J]. Journal of Donghua University (Natural Science), 2024,50(1):45-54.
[4]LIU J, CUI T, XU X, et al. Robust alcohol soluble polyurethane/chitosan/silk sericin (APU/CS/SS) nanofiber scaffolds toward artificial skin extracellular matrices via microfluidic blow-spinning [J]. Advanced Fiber Materials, 2023, 5(1): 349-361.
[5]HAIDER A, HAIDER S, KANG I-K. A comprehensive review summarizing the effect of electrospinning parameters and potential applications of nanofibers in biomedical and biotechnology[J]. Arabian Journal of Chemistry, 2018, 11(8): 1165-1188.
[6]RAHMATI M, MILLS D K, URBANSKA A M, et al. Electrospinning for tissue engineering applications [J]. Progress in Materials Science, 202 117: 100721.
[7]YING H W, TOSHIYA H, ICHIRO S S, et al. Electrospun collagen core/poly-l-lactic acid shell nanofibers for prolonged release of hydrophilic drug[J]. RSC Advances, 202 11(10): 5703-5711.
[8]郭文娟,邱帅,李楠,等. 淫羊藿苷-淀粉纳米纤维的制备及其药物释放性能[J].天津工业大学学报,2023,42(5):7-12.
GUO Wenjuan, QIU Shuai, LI Nan, et al. Preparation and drug release properties of icariin-starch nanofibers[J]. Journal of Tiangong University, 2023, 42(5): 7-12.
[9]CHAN PARK S, KIM M J, CHOI K, et al. Influence of shell compositions of solution blown PVP/PCL core-shell fibers on drug release and cell growth[J]. RSC Advances, 2018, 8(57): 32470-32480.
[10]WENG J, ZOU Y, ZHANG Y, et al. Stable encapsulation of camellia oil in core-shell zein nanofibers fabricated by emulsion electrospinning[J]. Food Chemistry, 2023, 429: 136860.
[11]YAN X, XU B, XIA C, et al. Dual drug-loaded core-shell nanofibers membranes via emulsion electrospinning and their controllable sustained release property[J]. Journal of Drug Delivery Science and Technology, 2023, 88: 104909.
[12]LURAGHI A, PERI F, MORONI L. Electrospinning for drug delivery applications: A review[J]. Journal of Controlled Release, 202 334: 463-484.
[13]杨海贞,魏肃桀,马闯,等.纤维素静电纺丝及其衍生纳米纤维在生物医学中的应用研究进展[J].现代纺织技术, 2023, 31(3): 212-224.
YANG Haizhen, WEI Sujie, MA Chuang, et al. Research progress of cellulose electrospinning and its derived nanofibers in biomedicine applications[J]. Advanced Textile Technology, 2023, 31(3): 212-224.
[14]RIEBER J, MEIER-BURGISSER G, Miescher I, et al. Bioactive and elastic emulsion electrospun DegraPol tubes delivering IGF-1 for tendon rupture repair[J]. International Journal of Molecular Sciences, 2023, 24(12): 10272.
[15]葛祥军, 田源, 熊向源, 等. 聚己内酯在药物载体方面的研究进展[J]. 高分子通报, 2017(3): 11-18.
GE Xiangjun, TIAN Yuan, XIONG Xiangyuan, et al. Research progresses of poly-ε-caprolactone as drug carriers[J]. Ploymer Bulletin, 2017(3): 11-18.
[16]TAO F, CHENG Y, TAO H, et al. Carboxymethyl chitosan/sodium alginate-based micron-fibers fabricated by emulsion electrospinning for periosteal tissue engineering[J]. Materials & Design, 2020, 194:108849.
[17]彭晓, 丁辛, 林刚, 等. 乳化剂Span 80对乳液静电纺PCL纤维担载盐酸四环素能力的影响 [J]. 东华大学学报(自然科学版), 2017, 43(1): 9-14.
PENG Xiao, DING Xin, LIN Gang, et al. Influence of span 80 on drug loading capability of emulsion electrospun PCL fibers loaded with tetracycline hydrochloride[J]. Journal of Donghua University(Natural Science), 2017, 43(1): 9-14.
[18]EKAMBARAM R, SARAVANAN S, BABU V P S, et al. Fabrication and evaluation of docetaxel doped ZnO nanoparticles incorporated PCL nanofibers for its hemocompatibility, cytotoxicity and apoptotic effects against A549[J]. Materialia, 202 21: 101278.
[19]JOHNSON P M, LEHTINEN J M, ROBINSON J L. Surfactant interactions and solvent phase solubility modulate small molecule release from emulsion electrospun fibers[J]. AIChE Journal, 202 67(12): 17470.
[20]BU J, CHEN L, SONG J. In situ nanofibers patterned deposition based on electrostatic attraction-repulsion induction[J]. Chemical Engineering Journal, 2024, 480: 147997.
[21]GAYDHANE M K, SHARMA C S, Majumdar S. Electrospun nanofibres in drug delivery: Advances in controlled release strategies[J]. RSC advances, 2023, 13(11): 7312-7328.
[22]ZHANG P, JIANG Y, LIU D, et al. A bioglass sustained-release scaffold with ECM-like structure for enhanced diabetic wound healing[J]. Nanomedicine, 2020, 15(23): 2241-2253.
[23]LI J, ZHANG T, PAN M, et al. Nanofiber/hydrogel core-shell scaffolds with three-dimensional multilayer patterned structure for accelerating diabetic wound healing[J]. Journal of Nanobiotechnology, 202 20(1): 28.
Preparation of PCL/TCH patterned nanofiber membranes by emulsion electrospinning
ZHANG Jun YU Jinghong LI Tingxiao XIN Binjie1
(1.School of Textiles and Fashion, Shanghai University of Engineering Science, Shanghai 201620, China;
2.College of Textiles, Donghua University, Shanghai 201620, China)
Abstract:
With the continuous innovation and vigorous development of advanced textile technology, new technologies such as emulsion electrostatic spinning, coaxial electrostatic spinning and patterning are gaining popularity. In the field of drug delivery, the nanofiber membrane made by the traditional electrostatic spinning technology as a drug carrier has certain limitations, such as the serious phenomenon of sudden drug release, uneven distribution of drugs in the fiber, and so on. In order to alleviate the phenomenon of sudden drug release, a nanofibrous membrane with a skin-core structure shall be prepared as a solution to effectively encapsulate the drug and maintain the biological activity of the drug molecules by taking advantage of the fact that the core layer of the fiber is not in contact with the outside world. Currently, emulsion electrostatic spinning and coaxial electrostatic spinning can prepare nanofibrous membrane with skin-core structure. Compared with coaxial electrospinning, emulsion electrostatic spinning is simple to operate, and the encapsulation of different drugs/active molecules can be achieved by water-in-oil or oil-in-water. Meanwhile, by patterning to mimic the multi-layered structure of the extracellular matrix (ECM), not only the surface area of the fibrous membrane can be increased to improve its drug release properties, but also the orientation of the fibers can be altered to improve the ability of cell adhesion, growth and differentiation.
In this paper, patterned nanofibrous membranes with polycaprolactone (PCL) as the skin layer and tetracycline hydrochloride (TCH) as the core layer were prepared by emulsion electrostatic spinning. Firstly, a certain amount of PCL was dissolved in 1 mL of hexafluoroisopropanol (HFIP), and then 19.88 mg of Span80 was added as an emulsifier and stirred thoroughly, and afterwards, aqueous solutions of TCH at various concentrations were introduced into the stirring PCL oil-phase solution, creating a mixture with a 6% aqueous-oil phase volume ratio. In the final step, the PCL/TCH patterned nanofibrous membranes were fabricated by using emulsion electrostatic spinning technology, and employing a metal collector with a rhombus-shaped pattern. This was achieved by utilizing a metal lattice receiving device. The performance of the patterned nanofibrous membranes was also analyzed at different drug concentrations. The results showed that the droplet homogeneity of the spinning emulsion was relatively excellent at a drug mass fraction of 2% TCH, which led to a uniform and continuous fiber morphology and an increase in the cumulative drug release rate of 5.17%. Furthermore, the elongation at break of the patterned fibrous membranes improved by 20.31%, and there was a 13.45% increase in the cumulative drug release rate.
In summary, the emulsion electrostatically spun PCL/TCH patterned nanofibrous membrane has good drug release properties. It alleviates the phenomenon of sudden drug release and prolongs the drug release cycle when compared to traditional drug delivery methods, avoiding the defect of frequent wound dressing change. Meanwhile, the patterned treatment provides a favourable environment for cell growth and promotes cell migration and adhesion. Therefore, the membrane has important application potential in drug delivery, wound healing and tissue engineering.
Keywords:
polycaprolactone; tetracycline hydrochloride; emulsion electrospinning; patterning; controlled drug release

