初步构建与评估递送柚皮素的RGD外泌体


[摘要]" 目的: 本研究旨在制备生物合成纳米载体递送柚皮素(naringenin,Ng),并研究其对乳腺癌的体外抑瘤效果。方法: 使用精氨酸甘氨酸天冬氨酸前列腺素F2受体阴性调节因子绿色荧光蛋白(Arg-Gly-Asp-prostaglandin F2 receptor negative regulator-green fluorescent protein,RGD-P-G)质粒进行转染,构建分泌RGD-P-G外泌体(RGD-P-G-Exosomes,RGD-P-G-Exo)的293F细胞。通过超速离心收集293F细胞上清液中的RGD-P-G-Exo,加入Ng,并通过水浴超声促使RGD-P-G-Exo包封Ng,形成RGD-P-G-Exo@Ng。使用荧光显微镜对转染RGD-P-G的293F细胞进行鉴定。通过透射电子显微镜、纳米颗粒跟踪分析技术、蛋白质免疫印迹等方法对RGD-P-G-Exo@Ng的形貌、粒径、标志物和绿色荧光蛋白(GFP)表达情况进行表征。采用紫外分光光度法评估包封率和载药量。通过细胞摄取实验评估纳米药物被吞噬摄取的效果。通过CCK-8法检测Exo@Ng和RGD-P-G-Exo@Ng对乳腺癌MDA-MB-231细胞的杀伤能力。结果: 电镜结果显示RGD-P-G-Exo@Ng呈茶托状结构,纳米颗粒追踪分析技术显示RGD-P-G-Exo@Ng粒径主要分布在147.0 nm。蛋白免疫印迹结果表明RGD-P-G-Exo@Ng表达CD9、CD63等外泌体标志物和GFP,证明RGD-P-G-Exo的构建成功。RGD-P-G-Exo@Ng纳米药物的包封率为(28.1±0.6)%,载药量为(6.0±0.1)%。在高浓度下,Exo及RGD-P-G-Exo对MDA-MB-231细胞的存活率无显著影响,具有良好的生物相容性。在细胞摄取实验中,与Exo@Ng相比,RGD-P-G-Exo@Ng具有更强的细胞摄取效果(Plt;0.05)。药效实验中,Exo@Ng和RGD-P-G-Exo@Ng均表现出浓度依赖性的MDA-MB-231细胞毒性,其中RGD-P-G-Exo@Ng比相同浓度的Exo@Ng具有更强的细胞杀伤能力(Plt;0.05)。结论: 本研究初步合成了一种用于靶向递送Ng的纳米药物,为开发生物纳米靶向肿瘤药物递送系统提供了新的策略。
[关键词]" 乳腺癌;精氨酸甘氨酸天冬氨酸;前列腺素F2受体阴性调节因子;外泌体;柚皮素
[中图分类号]" R944.9" [文献标志码]" A" [文章编号]" 1671-7783(2024)05-0407-07
DOI: 10.13312/j.issn.1671-7783.y230246
[引用格式]冯玘, 刘洪峰. 初步构建与评估递送柚皮素的RGD外泌体[J]. 江苏大学学报(医学版), 2024, 34(5): 407-413.
[基金项目]安徽省教育厅重点项目(2022AH053142);校级科研项目(WZK201906)
[作者简介]冯玘(1989—),男,博士,讲师,主要从事药理学和生物药剂学研究;刘洪峰(通讯作者),主任药师,E-mail: 418825724@qq.com
Preliminary construction and evaluation of RGD exosomes for delivering naringin
FENG Qi1, LIU Hongfeng2
(1. Department of Pharmacy, North Anhui Health Vocational College, Suzhou Anhui 234000; 2. Department of Pharmacy, Suzhou Municipal Hospital Affiliated to Anhui Medical University, Suzhou Anhui 234000, China)
[Abstract]" Objective: To prepare biosynthetic nanocarriers to deliver naringenin (Ng) and to investigate its in vitro tumor-suppressive effect on breast cancer. Methods: 293F cells secreting Arg-Gly-Asp-prostaglandin F2 receptor negative regulator-green fluorescent protein exosomes (RGD-P-G-Exo) were constructed by transfection using Arg-Gly-Asp-prostaglandin F2 receptor negative regulator-green fluorescent protein (RGD-P-G) plasmid. The nanomedicine (RGD-P-G-Exo@Ng) was prepared by collecting RGD-P-G-Exo in the supernatant by ultracentrifugation, adding Ng, and inducing the RGD-P-G-Exo to encapsulate the Ng by sonication in a water bath. 293F cells transfected with RGD-P-G were characterized using fluorescence microscopy. The morphology, particle size, markers and green fluorescent protein (GFP) expression of RGD-P-GFP-Exo@Ng were characterized by transmission electron microscopy, nanoparticle tracking analysis technique and protein immunoblotting. The encapsulation rate and drug loading capacity were assessed by UV spectrophotometry. Phagocytic uptake of the nanodrugs was assessed by cellular uptake assay. The killing ability of Exo@Ng and RGD-P-G-Exo@Ng on MDA-MB-231 cells was detected by CCK-8 assay. Results: Electron microscopy revealed a cup-like structure of RGD-P-G-Exo, with a particle size of 147.0 nm according to nanoparticle tracking analysis. Immunoblotting confirmed the surface expression of exosome markers (CD9, CD63) and GFP on RGD-P-G-Exo, validating the successful construction of RGD-P-G-Exo. The encapsulation efficiency of RGD-P-G-Exo@Ng was (28.1±0.6)%, and the drug loading content was (6.0±0.1)%. At high concentrations, Exo and RGD-P-G-Exo had no significant effect on the viability of MDA-MB-231 cells with good biocompatibility. In the cellular uptake assay, the RGD-P-G-Exo@Ng group had a stronger cellular uptake effect compared with the Exo@Ng group (Plt;0.05). In the pharmacodynamic assay, both Exo@Ng and RGD-P-G-Exo@Ng groups exhibited concentration-dependent cytotoxicity in MDA-MB-231 cells, in which the RGD-P-G-Exo@Ng group possessed a stronger cell-killing ability compared with the same concentration of Exo@Ng group (Plt;0.05). Conclusion: In this research, a nanoparticle for targeted delivery of Ng was initially synthesized, providing a new tool for the development of bio-nanotargeted tumor drug delivery systems.
[Key words]" breast cancer; Arg-Gly-Asp; prostaglandin F2 receptor negative regulator; exosome; naringenin
乳腺癌是威胁女性健康的主要疾病,据2022年国际癌症研究机构(IARC)调查的数据显示,乳腺癌的发病率超过25%,其中发展中国家发病率超过50%[1]。柚皮素(naringenin,Ng)是一种广泛存在于芸香科植物中的二氢黄酮类化合物,具有抗氧化、抗肿瘤与抗炎等活性[2]。最近的研究已经证明Ng能够抑制乳腺癌细胞增殖、调控细胞周期、使细胞周期阻滞于G1期,并诱导细胞的凋亡[3]。但Ng溶解度较低,使药物难溶出、从而降低生物利用度[4]。近年来为了提高Ng溶解度、改善吸收,研究者已开发出脂质体、纳米乳与纳米凝胶等剂型提高药物溶解度以提高疗效[5-6]。但人工合成的纳米载体存在靶向性不足与免疫原性高易被免疫系统清除等缺陷而限制了其应用[7]。外泌体(exosomes,Exo)是一类由细胞分泌的纳米级胞外囊泡,与其他药物载体相比,具有生物相容性高、生物可降解性和免疫原性低等优势[8-9]。将蛋白质或多肽类融合到具有高Exo分选能力的支架蛋白中是目前一种新型和强大的货物装载递送策略。例如,前列腺素F2受体阴性调节因子(prostaglandin F2 receptor negative regulator-green fluorescent protein,P)是一种在外泌体膜上大量表达的膜蛋白[10],Lewis等[11]通过P膜蛋白融合IL-12,以P为支架搭载递送IL-12,发挥抑制肿瘤的作用。RGD肽含有的精氨酸甘氨酸天冬氨酸(Arg-Gly-Asp)三肽结构能够与整合素αvβ3特异性结合,是重要的细胞识别位点,而乳腺癌细胞表面存在高表达的αvβ3整合素[12-13]。外源性RGD肽不仅能够抑制肿瘤细胞黏附和侵袭,促进肿瘤细胞凋亡,还能与抗肿瘤药物或其载体连接、提高药物靶向性,被广泛用于肿瘤靶向递送[14-15]。因此,表面修饰RGD肽是靶向抑制肿瘤细胞的重要策略。但传统的化学修饰效率有限[16]。本研究通过构建P编码序列与RGD肽融合构建RGD-P-G跨膜蛋白融合质粒,导入293F细胞中,然后分泌具有靶向性的外泌体(RGD-P-G-Exo),通过RGD-P-G-Exo与Ng水浴超声获得生物合成的纳米靶向药物RGD-P-G-Exo@Ng,为Ng更好地应用于临床治疗乳腺癌提供理论依据。
1" 材料与方法
1.1" 主要材料与试剂
293F细胞、乳腺癌MDA-MB-231细胞株(中国科学院上海细胞库);Ng(上海麦克林生化科技股份有限公司);DMEM、氨苄西林(大连美仑生物技术有限公司);0.25%胰蛋白酶-EDTA消化液、293F培养基(美国Gibco公司);胎牛血清(浙江天航生物科技有限公司);青霉素链霉素溶液庆大霉素、BCA蛋白定量试剂盒、辣根过氧化物酶标记的山羊抗兔IgG(江苏碧云天生物技术公司);质粒RGD-P-G(上海吉凯基因医学科技股份有限公司);无内毒素质粒检测试剂盒(天根生化科技有限公司);LB培养基干粉(默克);转染试剂Lipo3000,DiD红色荧光染料,CD63、CD9、Calnexin、绿色荧光蛋白(GFP)抗体(美国Thermo Fisher公司)。
1.2" 细胞培养
将293F细胞、乳腺癌MDA-MB-231细胞冻存管从-80 ℃冰箱中取出,置于37 ℃恒温水浴箱中迅速复温解冻,将解冻后的冻存液吸入含培养基的离心管中,900 r/min、离心4 min,重悬沉淀后移入培养瓶,293F细胞置于37 ℃、8%CO2振荡培养箱培养,MDA-MB-231细胞置于37 ℃、5%CO2培养箱培养。
1.3" RGD-P-G-Exo@Ng纳米药物的构建
1.3.1" 提取融合质粒RGD-P-G" 取菌液1 mL,转入装有200 mL的含有氨苄西林的LB液体培养基中,过夜,按照试剂盒说明书操作,提取融合质粒RGD-P-G。
1.3.2" RGD-P-G-Exo的提取" 取100 μg的RGD-P-G与转染试剂Lipo3000 20 μL加入10 mL细胞密度为2×106/mL的293F细胞中,转染72 h收集细胞上清液,然后在4 ℃下按照300×g(10 min),2 000×g(10 min),10 000×g(30 min)离心取上清液,最后以100 000×g(70 min)离心2次,收获沉淀重悬得RGD-P-G-Exo。
1.3.3" 荧光显微镜观察细胞转染效率" 取“1.3.2”项下转染的293F细胞,按照试剂盒说明书,取100 μg的RGD-P-G与20 μL转染试剂Lipo3000加至10 mL细胞密度为2×106/mL的293F细胞中,转染48 h,荧光显微镜观察转染效率。
1.3.4" 纳米流式检测RGD-P-G-Exo的阳性率" 取“1.3.2”项下收集的RGD-P-G-Exo 50 μL,稀释为107~109颗粒数/mL,上机进行纳米流式检测GFP标签蛋白的标记率。
1.3.5" 制备RGD-P-G-Exo@Ng" 利用BCA定量试剂盒测定制备的RGD-P-G-Exo的总蛋白浓度。按照一定质量比(6∶1、4∶1、2∶1、1∶1、1∶2、1∶4、1∶6)将RGD-P-G-Exo(1 μg/μL)和Ng混合,水浴超声(功率20 W,超声1 min,循环6次,循环间隔2 min),经超声处理的混合物于37 ℃静置0.5 h,4 ℃静置1 h,以恢复外泌体膜结构。然后使用分子截留量100 kD超滤管,重复3次,去除游离的Ng,得到RGD-P-G-Exo@Ng,同时重复步骤制备对照组Exo@Ng。
1.4 "纳米药物的表征
1.4.1" 纳米颗粒跟踪分析检测Exo、Exo@Ng与RGD-P-G-Exo@Ng粒径和浓度" Exo、Exo@Ng与RGD-P-G-Exo@Ng三种样品分别通过涡流混合,PBS稀释,采用高灵敏度相机进行捕获,每个视野调整为20~40个颗粒,使用纳米颗粒跟踪分析3.2 Dev Build 3.2.16软件Malvern分析Exo、Exo@Ng与RGD-P-G-ExoExo@Ng的粒径分布与浓度。
1.4.2" 透射电镜检测Exo、Exo@Ng与RGD-P-G-Exo@Ng的形貌" 分别取10 μL提取的Exo与制备得到的适宜浓度Exo@Ng与RGD-P-G-Exo@Ng的溶液,滴加在200目有碳支持膜的铜网上,常温放置2 h,干燥后用透射电子显微镜观察样品的结构。
1.4.3" 蛋白免疫印迹检测外泌体的特异性蛋白及GFP蛋白" 将Exo、RGD-P-G-Exo及转染RGD-P-G-Exo的293细胞提取蛋白后,按一定比例与上样缓冲液混合均匀,95 ℃加热5 min使蛋白变性。冷却至室温,取适量蛋白样品先用SDS-PAGE分离(先75 V、30 min,后100 V、60 min),然后转移至PVDF膜上。用快速封闭液在室温下封闭膜30 min,TBST洗涤后分别于CD63、CD9、Calnexin及GFP抗体溶液(1∶1 000)中4 ℃孵育过夜,TBST洗涤3次后,加入辣根过氧化物酶标记的山羊抗兔IgG(1∶2 000)室温下孵育2 h,使用增强型化学发光试剂盒检测蛋白表达。
1.5" RGD-P-G-Exo@Ng的制剂学评价
1.5.1" 检测波长的确定" 通过紫外分光光度法测定Ng的含量,称取一定量的Ng,用乙腈稀释至适宜的浓度,紫外分光光度计200~600 nm进行扫描。
1.5.2" 标准曲线的制备" 精密称取5 mg的Ng,用乙腈定容于50 mL的容量瓶中配制成100 μg/mL的溶液,分别取一定量母液,定容于10 mL容量瓶中稀释成1、2、4、8、10、12、16 μg/mL的Ng标准工作液。用紫外分光光度计测定标准工作液在284 nm波长处的光密度(D),并绘制标准曲线。
1.5.3" 包封率与载药量的测定" 按“1.3.5”所述方法制备出RGD-P-G-Exo@Ng,将所得RGD-P-G-Exo@Ng超速离心(4 ℃,100 000×g,70 min),收集上清液中未包封的Ng。用紫外分光光度计测定上清液在284 nm波长处的D值,根据Ng溶液的标准曲线,计算出游离药物质量。按以下公式计算包封率(EE)和载药量(DLC)。
EE(%)=(Wtotal-Wfree)/Wtotal×100%(1)
DLC(%)=(Wtotal-Wfree)/Ntotal×100%(2)
注:Wtotal是系统中的Ng总质量;Wfree是溶液中游离的Ng质量;Ntotal是Ng与RGD-P-G-Exo的总质量。
1.6" RGD-P-G-Exo@Ng的体外评价
1.6.1" 纳米载体的生物相容性考察" 将对数生长期的MDA-MB-231细胞以每孔5×103个密度接种到96孔板中(每孔100 μL),培养24 h后弃去旧培养基,将含不同浓度Exo、RGD-P-G-Exo(0、20、40、80、120、160、200 μg/mL)的DMEM无血清培养基各取100 μL加入96孔板中。继续培养24 h后,每孔加入10 μL CCK-8试剂,于37 ℃培养箱中孵育1 h后,酶标仪测450 nm处D值,按照公式计算细胞存活率。
细胞存活率(%)=(D实验-D空白)/(D对照-D空白)×100%(3)
1.6.2" MDA-MB-231细胞对RGD-P-G-Exo@Ng的吞噬摄取实验" 取适量DiD荧光染料添加到载药修饰的Exo中,置37 ℃避光孵育1 h标记Exo@Ng、RGD-P-G-Exo@Ng,得到DiD-Exo@Ng和DiD-RGD-P-G-Exo@Ng。将MDA-MB-231细胞以5×104的密度接种于共聚焦小皿中,培养过夜,待细胞融合至70%时,吸去培养基,将DiD-Exo@Ng和DiD-RGD-P-G-Exo@Ng与MDA-MB-231细胞共孵育4 h,PBS洗3遍,4%多聚甲醛室温固定15 min,PBS洗3遍,Hoechst33258室温染色5 min,PBS洗3遍,立即至共聚焦显微镜下观察。
1.6.3" RGD-P-G-Exo@Ng对MDA-MB-231细胞的体外毒性实验" 通过CCK-8研究Exo@Ng、RGD-P-G-Exo@Ng对MDA-MB-231细胞的毒性。将MDA-MB-231细胞接种在96孔板(5×103细胞/孔)培养24 h。弃去旧的培养基,将含有不同浓度Ng(0、20、40、80、120、160、200 μg/mL)的Exo@Ng与RGD-P-G-Exo@Ng培养基溶液每孔100 μL加到96孔板中,继续培养24 h后每孔加入10 μL CCK-8试剂,于37 ℃培养箱中孵育1 h后在450 nm处测D值。计算细胞存活率。
1.7" 统计学分析
数据采用OriginPro 2021软件进行统计学分析,计量资料用均数±标准差(x±s)表示,两组均数比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。Plt;0.05表示差异有统计学意义。
2" 结果
2.1" RGD-P-G-Exo的构建及鉴定
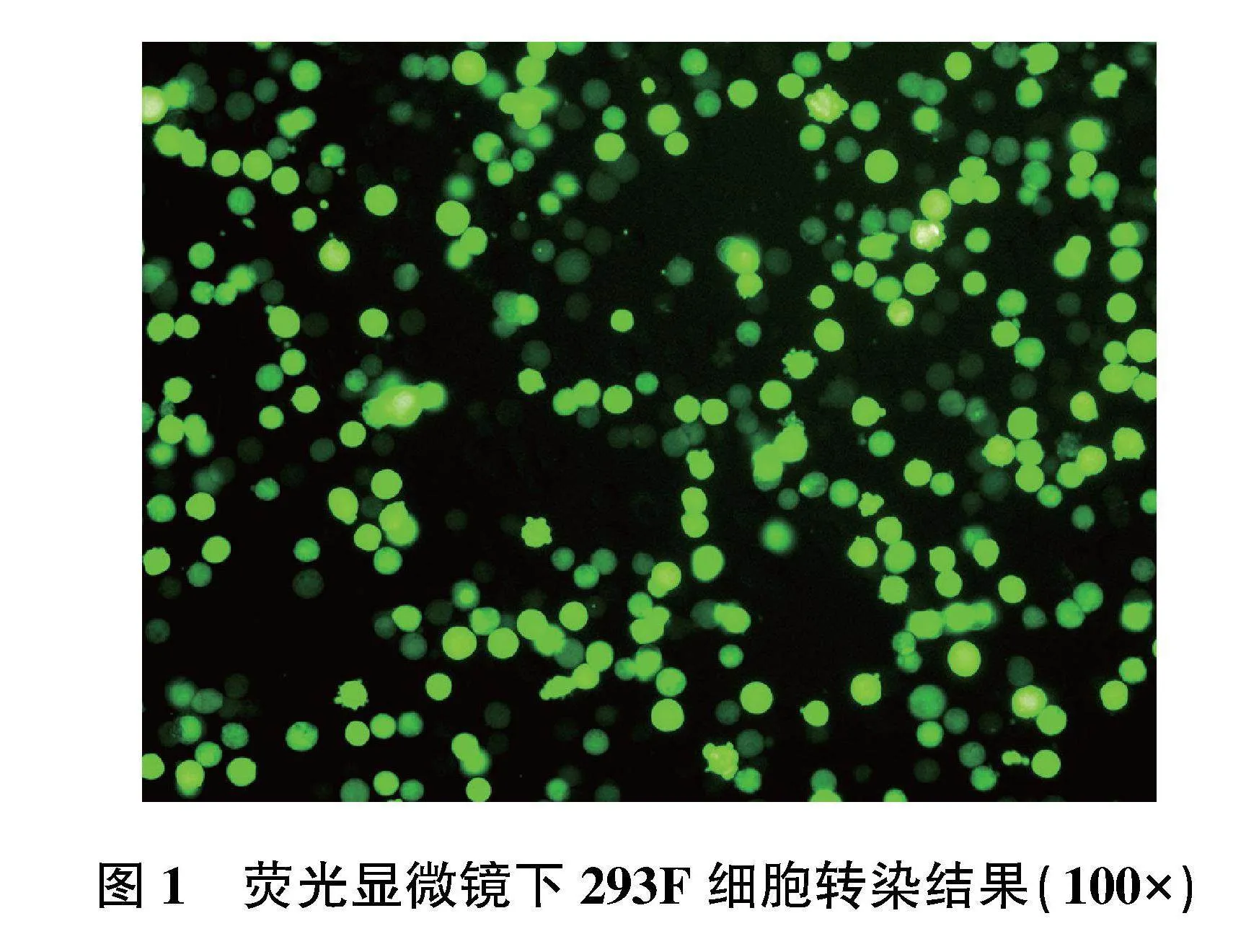
2.1.1" 荧光显微镜对293F细胞转染RGD-P-G质粒的鉴定" RGD-P-G转染结果如图1所示,293F细胞可见表达明亮的绿色GFP荧光,半定量分析转染效率高达90.2%。结果表明,RGD-P-G成功转染至293F细胞上。
2.1.2" 纳米流式检测外泌体RGD-P-G表达" 结果如图2所示,纳米流式检测外泌体GFP荧光表达情况,结果表明293F细胞分泌的外泌体表达RGD-P-G,阳性率达到36.0%,表明RGD高效地跟随跨膜蛋白P分选整合到外泌体上。
2.2" RGD-P-G-Exo@Ng的构建及表征
2.2.1" Exo、Exo@Ng和RGD-P-G-Exo@Ng的粒径分布" 结果如图3所示,Exo的粒径为140.0 nm,Exo@Ng为144.0 nm,RGD-P-G-Exo@Ng为147.0 nm。Exo@Ng和RGD-P-G-Exo@Ng的粒径在药物加载后略有增加,尺寸的变化可能与RGD-P-G和Ng融入Exo的脂质双分子层有关,这可能是由于疏水作用引起的表面吸附。
2.2.2" Exo、Exo@Ng和RGD-P-G-Exo@Ng的形貌考察" 透射电镜结果显示,Exo、Exo@Ng与RGD-P-G-Exo@Ng三者的形态完整,呈经典的茶托状结构,颗粒分散良好,背景清晰(图4)。表明整个过程温和,未明显破坏RGD-P-G-Exo@Ng结构。
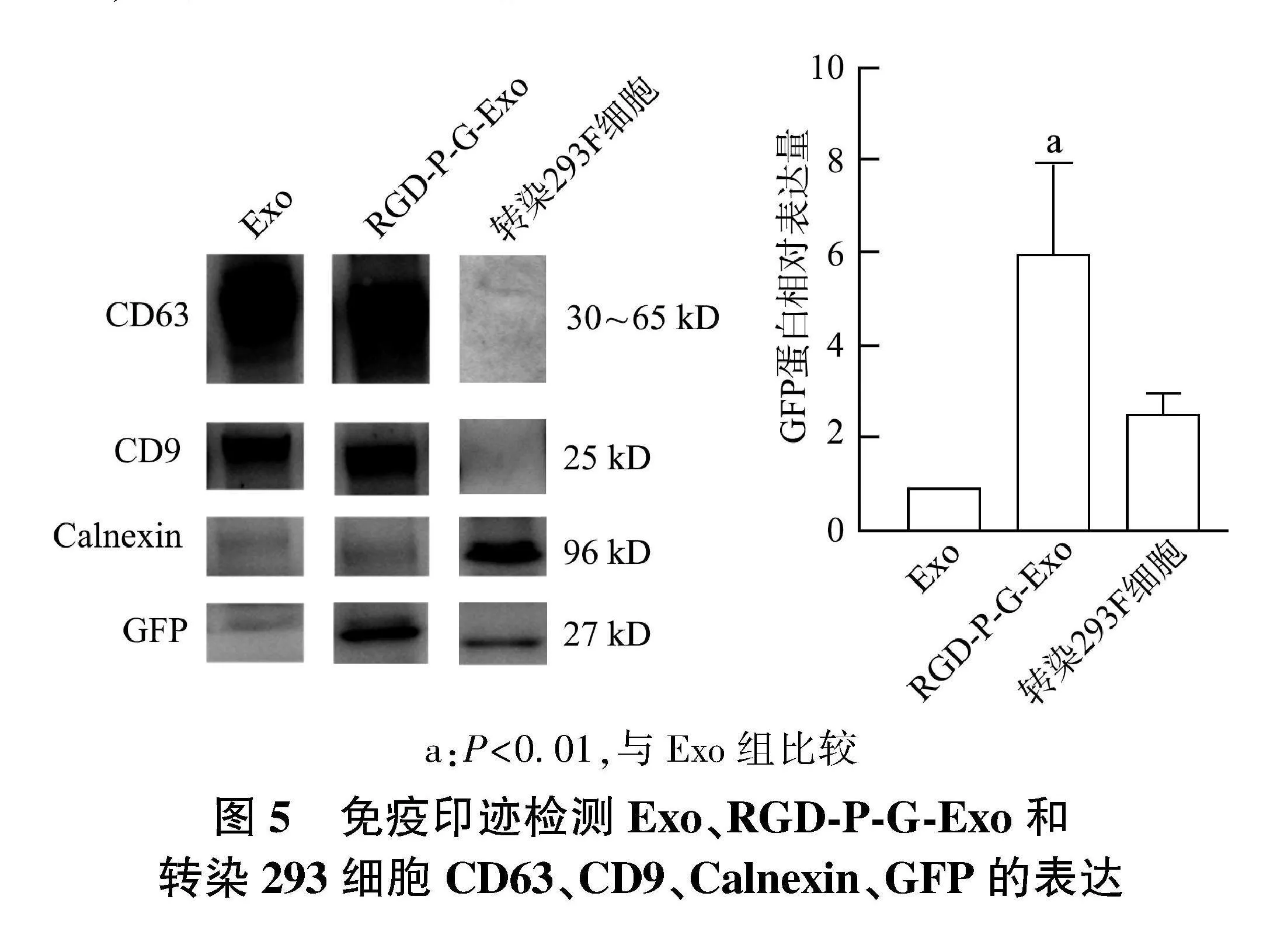
2.2.3" 蛋白免疫印迹检测RGD-P-G-Exo标志物" 结果如图5所示,所提取的Exo与RGD-P-G-Exo能够表达CD63、CD9外泌体标志蛋白,同时不表达细胞内容物Calnexin,表明提取得到符合要求的外泌体产物。其次,Exo不表达GFP蛋白,转染RGD-P-G的293F细胞与RGD-P-G-Exo表达GFP蛋白,表明RGD-P-G的成功转染与表达,并随着Exo的产生,被分选装入Exo。
a:Plt;0.01,与Exo组比较
2.3" RGD-P-G-Exo@Ng制剂学评价
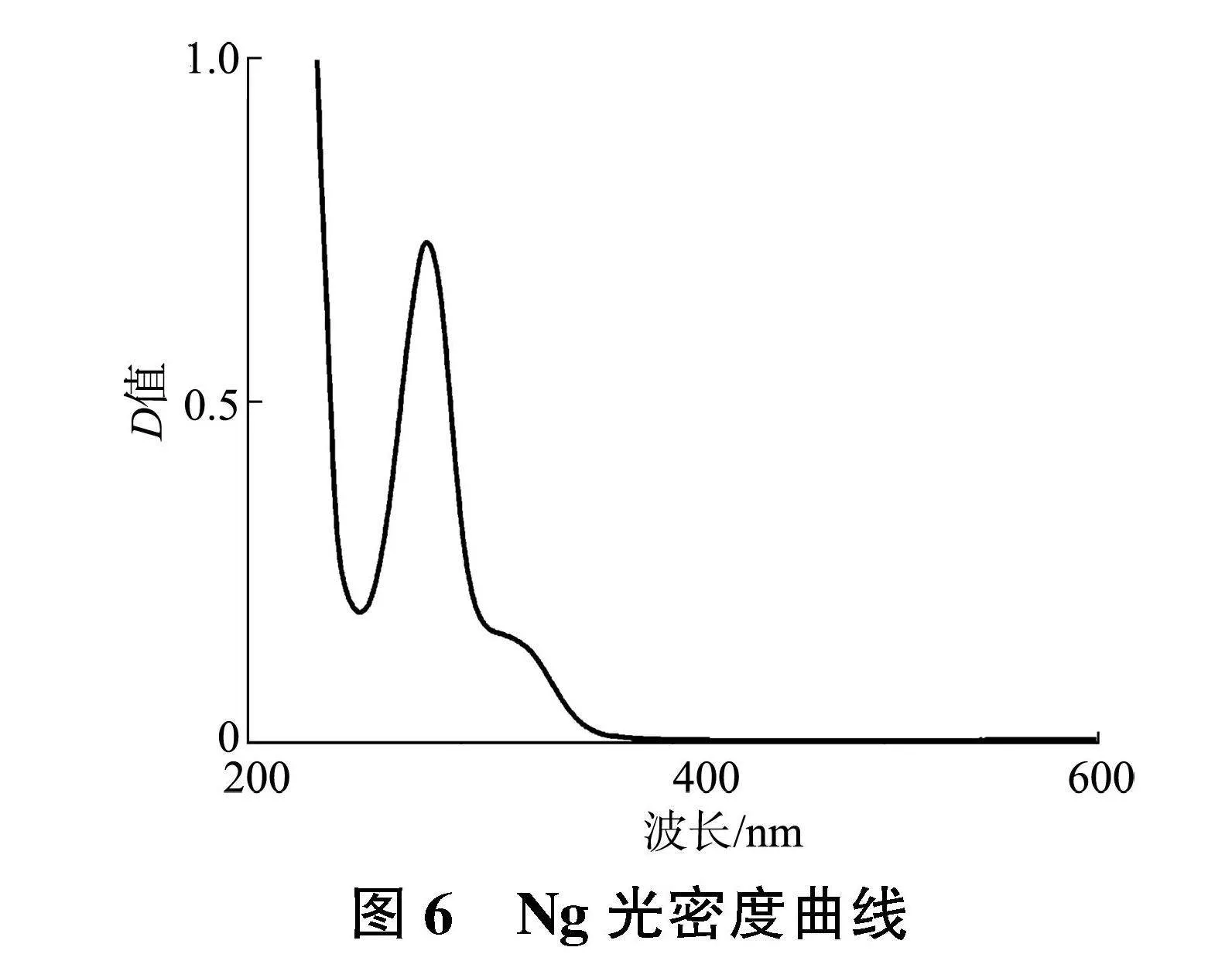
2.3.1" Ng检测波长的确定" 紫外可见分光光度计扫描200~600 nm波长范围内紫外吸收,结果如图6所示,确定紫外吸收峰在284 nm处。
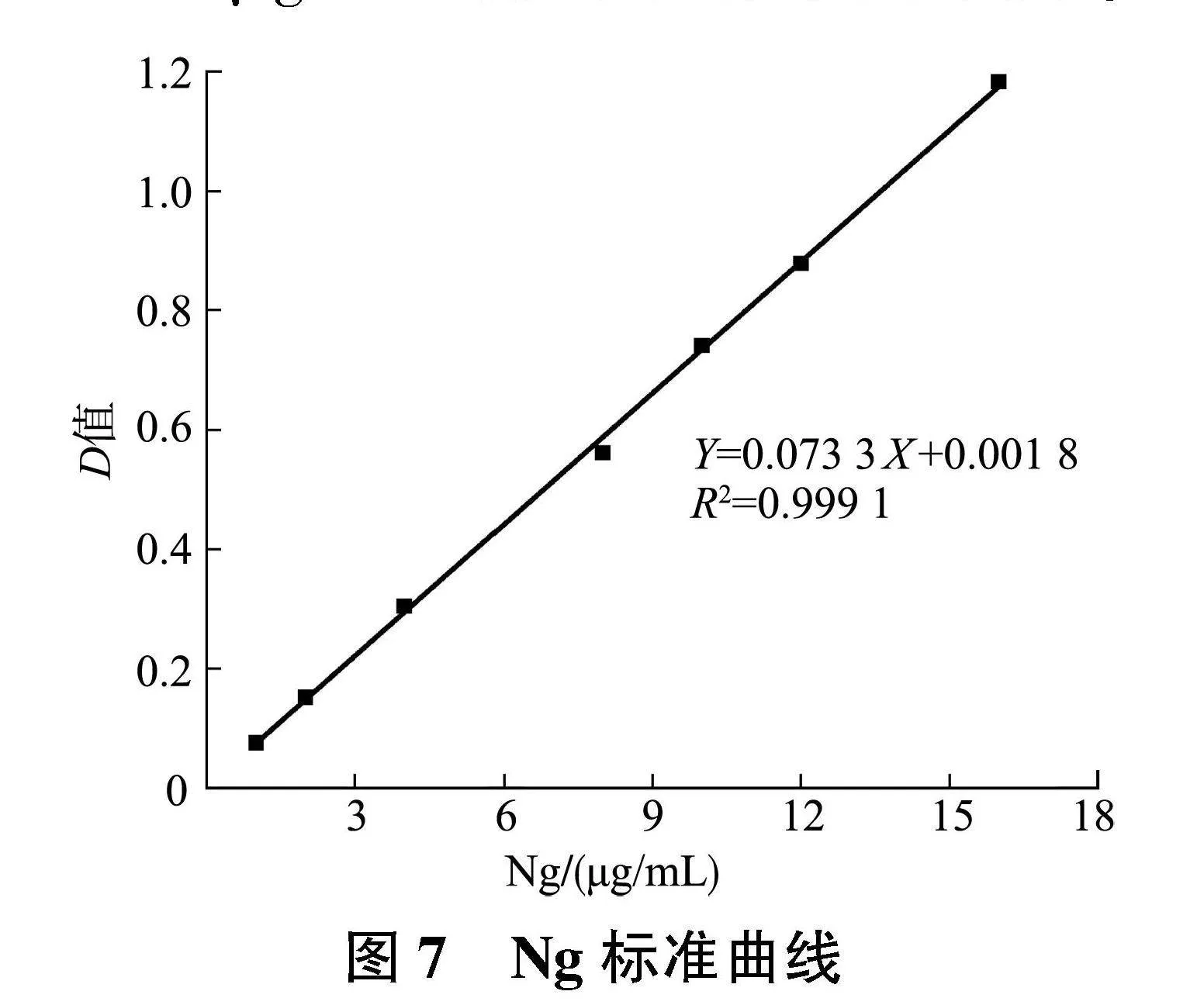
2.3.2" Ng标准曲线的建立" 如图7所示,Ng的标准曲线为Y=0.073 3X+0.001 8,R2=0.999 1,Ng的浓度在0~16 μg/mL范围内线性关系良好。
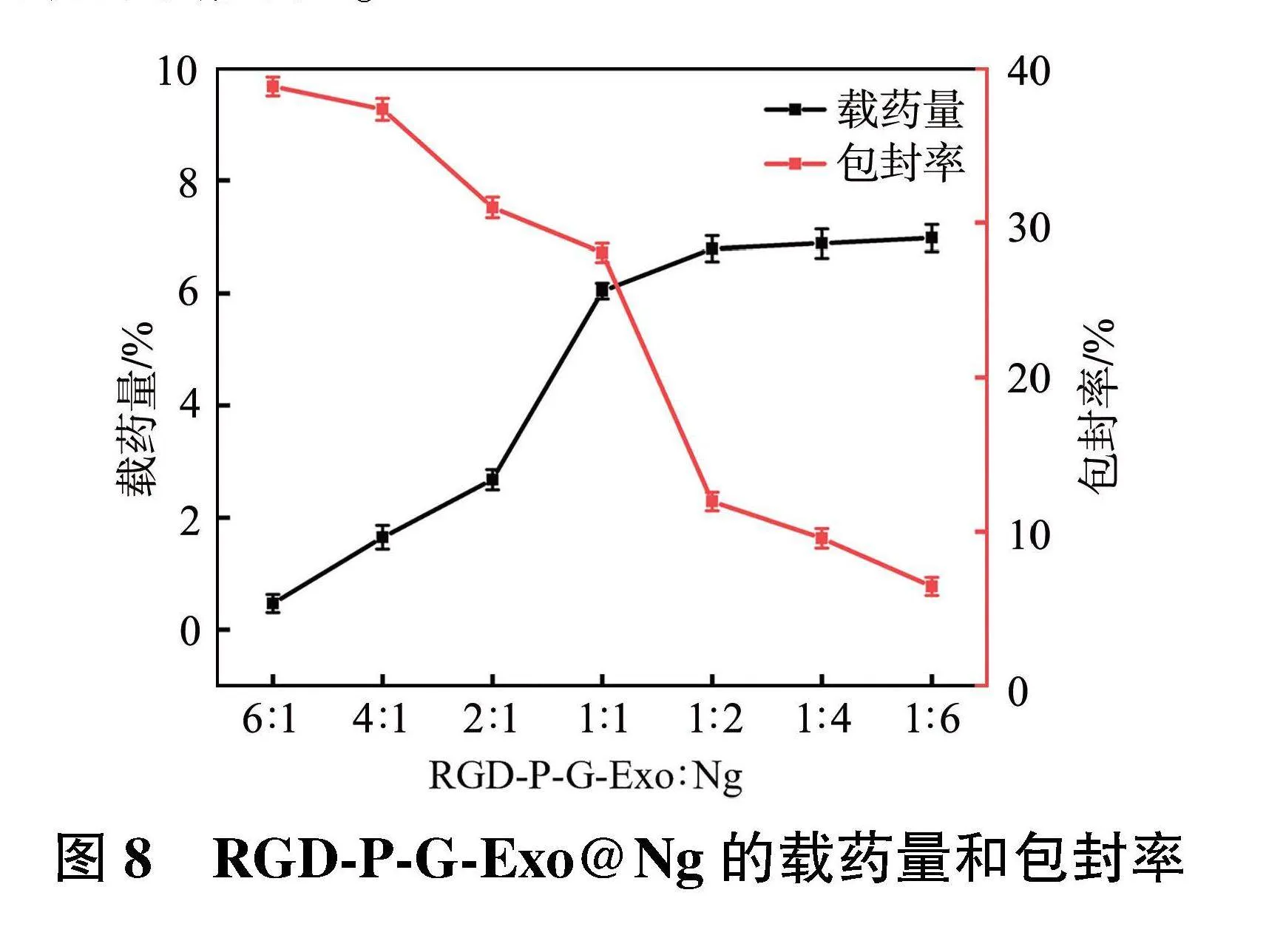
2.3.3" RGD-P-G-Exo@Ng载药量和包封率的测定" 图8为不同RGD-P-G-Exo和Ng质量比制备的RGD-P-G-Exo@Ng的包封率和载药量,随着Ng加入量的增加,RGD-P-G-Exo@Ng 的载药量逐渐增加,包封率下降明显,但由于Exo载药有限,载药量增加到一定程度后几乎不变。因此设置不同投药比,结果表明RGD-P-G-Exo总蛋白含量与Ng的质量比为1∶1时,具有较高的包封率和载药量,分别为(28.1±0.6)%和(6.0±0.1)%,因此选择此投药比进行后续实验。
2.4" RGD-P-G-Exo@Ng的体外抗肿瘤效果
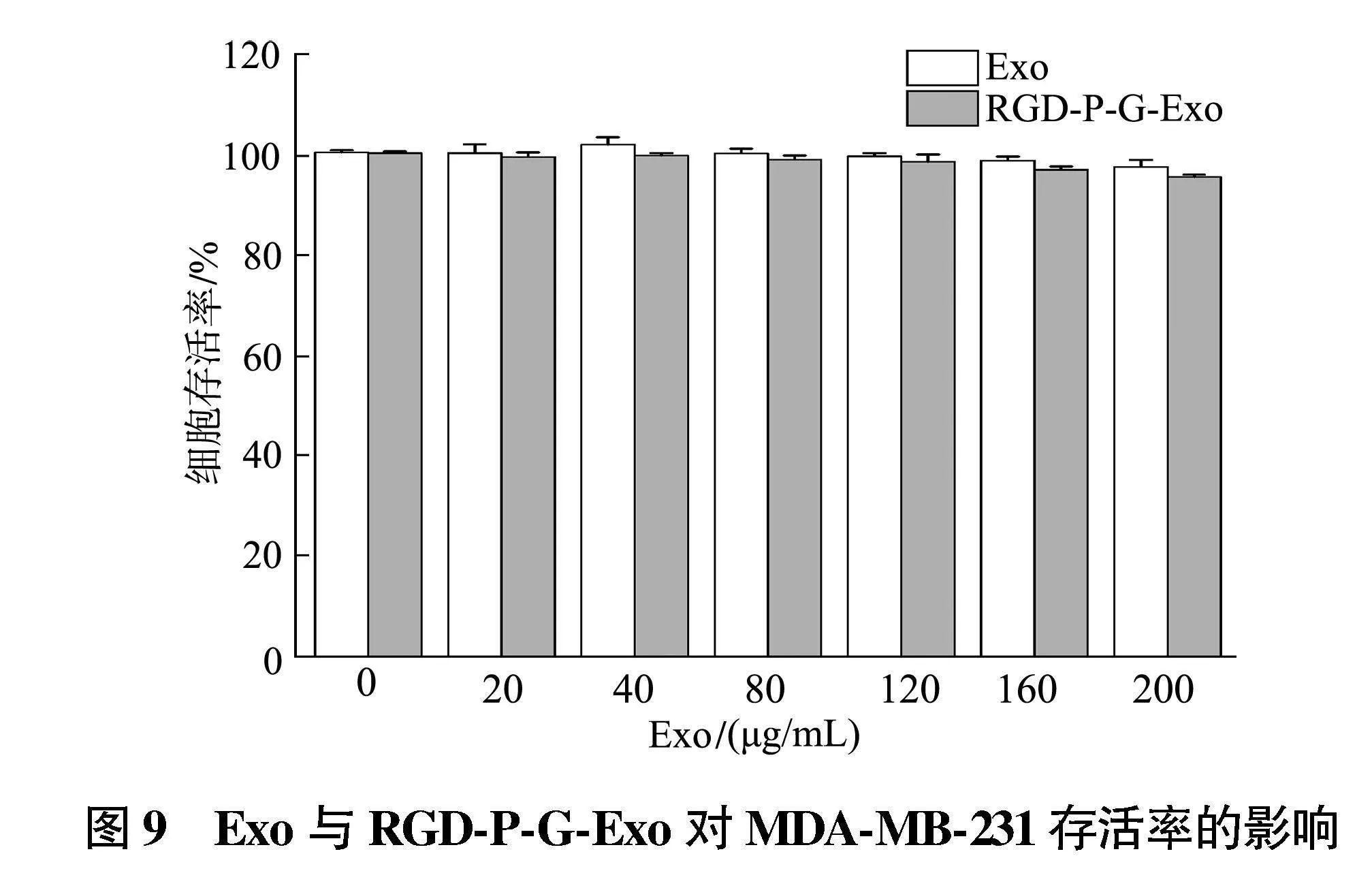
2.4.1" 载药外泌体的生物相容性" 结果如图9所示,在测试的所有浓度中,细胞的存活率均在95%以上,细胞增殖情况未受明显影响,表明Exo与RGD-P-G-Exo对MDA-MB-231细胞具有良好的相容性。
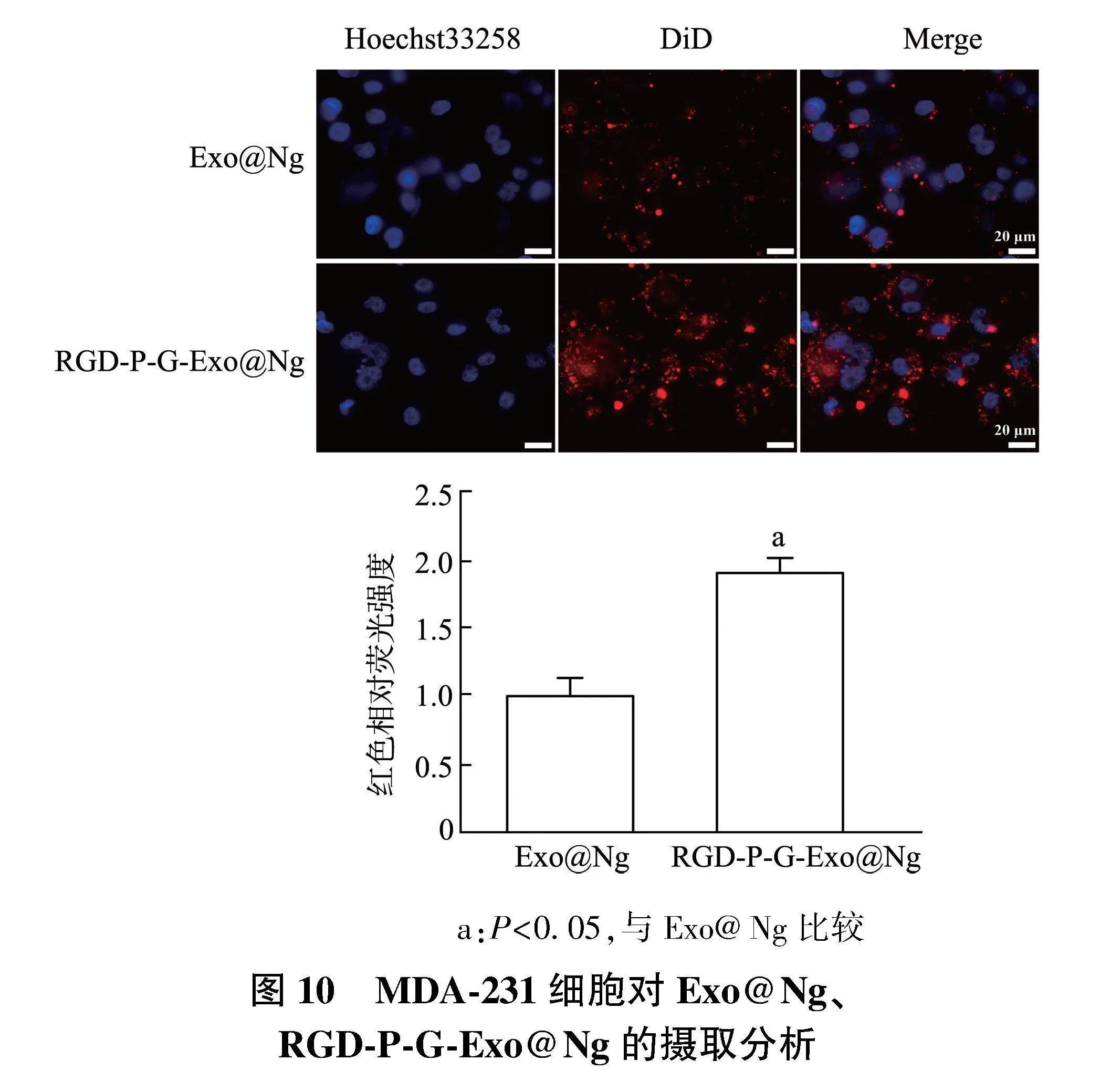
2.4.2" RGD-P-G-Exo@Ng的细胞摄取实验" 结果如图10所示,图中蓝色荧光为Hoechst33258标记的细胞核,红色荧光为DiD标记的Exo@Ng、RGD-P-G-Exo@Ng,红色荧光能反映出细胞摄取的情况。MDA-MB-231细胞对Exo@Ng的摄取较弱,而经过RGD-P-G修饰后,细胞摄取RGD-P-G-Exo@Ng作用增强(Plt;0.05)。
a:Plt;0.05,与Exo@Ng比较
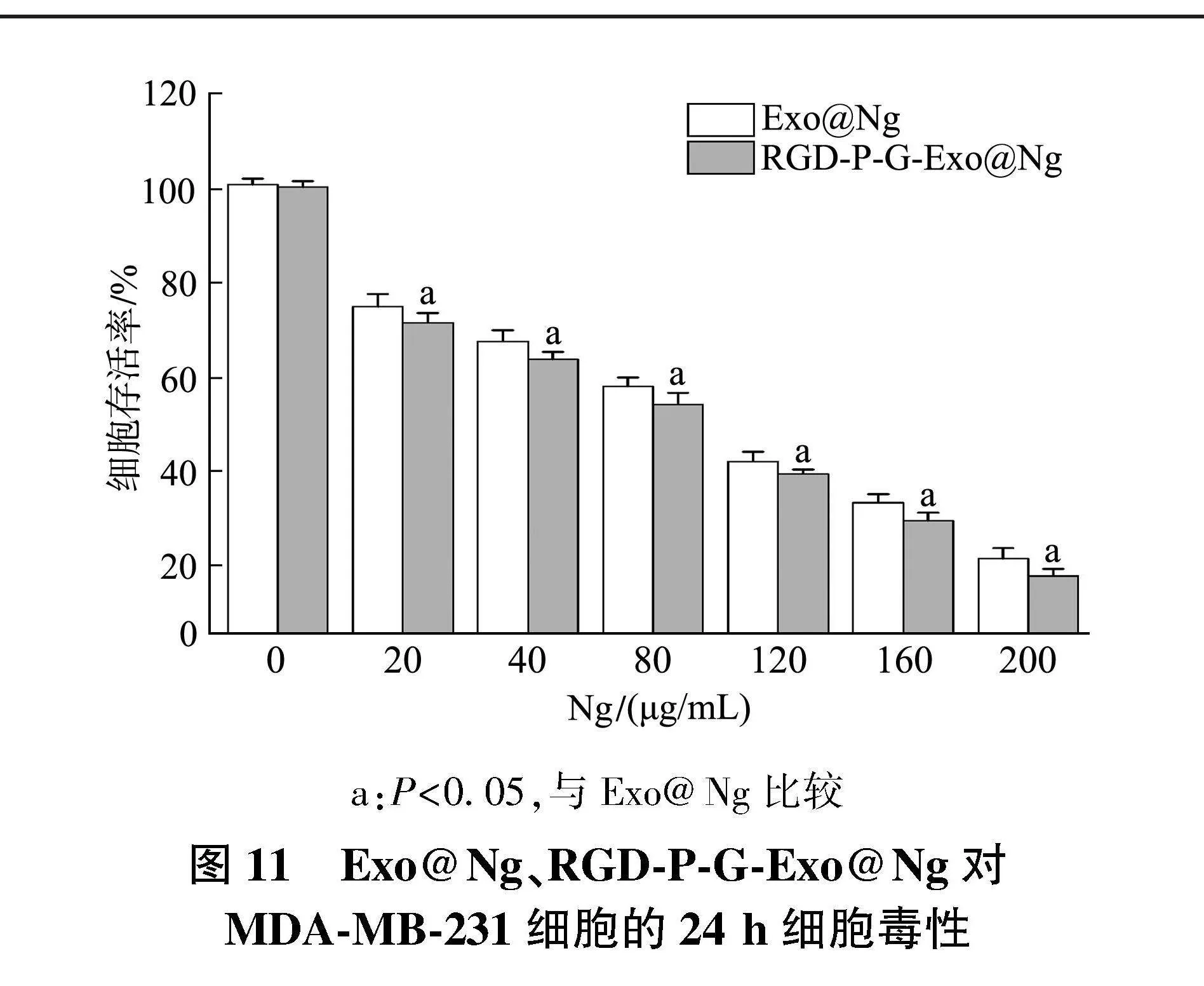
2.4.3" RGD-P-G-Exo@Ng体外抗肿瘤评价" 结果如图11所示,与Exo@Ng相比,RGD-P-G-Exo@Ng对MDA-MB-231细胞表现出更强的细胞毒性,差异有统计学意义(Plt;0.05)。表明RGD-P-G-Exo@Ng相较于Exo@Ng在体外对乳腺癌细胞的增殖具有更强的抑制效果。
a:Plt;0.05,与Exo@Ng比较
3" 讨论
乳腺癌是女性最常见的恶性肿瘤,而原发病灶的转移是导致乳腺癌患者高死亡率的主要原因。癌细胞的迁移能力与癌症的转移密切相关,其中整合素αvβ3在乳腺癌细胞中表达较高,同时在调节肿瘤的生长、局部侵袭和迁移能力等方面发挥着关键作用[17]。RGD肽与整合素αvβ3特异性结合,对肿瘤细胞具有靶向性[18]。研究表明,采用纳米药物结合多肽介导的肿瘤靶向制剂可以提升药物进入肿瘤细胞的剂量,从而提高肿瘤治疗效果[19]。作为外泌体表面大量表达的Ⅰ型膜蛋白,支架蛋白P可作为外泌体膜上显示RGD肽的支架[20]。外泌体具有较高的生物相容性、物质负载能力以及一定的靶向归巢能力,因此被视为药物分子的理想载体[21]。通过表面修饰能够被肿瘤细胞迅速识别的RGD肽,可以提高载药系统对肿瘤细胞的靶向性。这样的载体与Ng的联合应用在一定程度上解决了Ng水溶性差等问题,从而增强了Ng的治疗效果。
本研究成功将RGD-P-G质粒转染至293F细胞中,转染率高达90.2%。纳米流式检测结果显示成功获得了RGD-P-G标记的外泌体,阳性率达到了36.0%。免疫印迹分析进一步证实了RGD-P-G-Exo表达了外泌体标志蛋白CD9、CD63和GFP。本研究证实提取到符合要求的RGD-P-G-Exo。表征结果显示,超声载药处理后的外泌体在形态和功能上并无明显差异,但修饰载药后的粒径逐渐增大。同时,RGD-P-G-Exo@Ng的药物载药量达到了(6.0±0.1)%。体外细胞毒性实验结果显示,RGD-P-G-Exo@Ng成功递送Ng至肿瘤细胞,相较于Exo@Ng显著抑制了乳腺癌细胞的生长。与Exo@Ng相比,RGD-P-G-Exo@Ng增强了药物系统对肿瘤细胞的靶向性,优化了治疗效果。但是,本研究局限于体外水平的验证,缺乏对体内动物水平进一步的系统性评价。因此,并不能确定在体内的稳定性和靶向递送效果。
综上所述,本研究初步构建了一种生物合成纳米给药系统,通过构建RGD-P-G-Exo递送系统,成功实现了对Ng的高效递送,为Ng在乳腺癌治疗中的应用提供了一种新的可行途径。
[参考文献]
[1]" Sun YS, Zhao Z, Yang ZN, et al. Risk factors and preventions of breast cancer[J]. Int J Biol Sci, 2017, 13(11): 1387-1397.
[2]" 张海生, 王思琦, 佘胜楠, 等. 高效液相色谱法同时测定赤芍中没食子酸、没食子酸丙酯和柚皮素的含量[J]. 江苏大学学报(医学版), 2019, 29(6): 476-480.
[3]" Zhao Z, Jin G, Ge Y, et al. Naringenin inhibits migration of breast cancer cells via inflammatory and apoptosis cell signaling pathways[J]. Inflammopharmacology, 2019, 27(5): 1021-1036.
[4]" Askar MA, El Shawi OE, Abou Zaid OAR, et al. Breast cancer suppression by curcumin-naringenin-magnetic-nano-particles: In vitro and in vivo studies[J]. Tumour Biol, 2021, 43(1): 225-247.
[5]" Zobeiri M, Belwal T, Parvizi F, et al. Naringenin and its nano-formulations for fatty liver: cellular modes of action and clinical perspective[J]. Curr Pharm Biotechnol, 2018, 19(3): 196-205.
[6]" Mitchell MJ, Billingsley MM, Haley RM, et al. Engineering precision nanoparticles for drug delivery[J]. Nat Rev Drug Discov, 2021, 20(2): 101-124.
[7]" Xie R, Yang P, Peng S, et al. A phosphorylcholine-based zwitterionic copolymer coated ZIF-8 nanodrug with a long circulation time and charged conversion for enhanced chemotherapy[J]. J Mater Chem B, 2020, 8(28): 6128-6138.
[8]" Zhang M, Zang X, Wang M, et al. Exosome-based nanocarriers as bio-inspired and versatile vehicles for drug delivery: Recent advances and challenges[J]. J Mater Chem B, 2019, 7(15): 2421-2433.
[9]" 白跃宗. 外泌体在肿瘤体外诊断中的临床研究和应用前景[J]. 药学进展, 2023, 47(6): 433-441.
[10]" Marquez J, Dong J, Dong C, et al. Identification of prostaglandin F2 receptor negative regulator (PTGFRN) as an internalizable target in cancer cells for antibody-drug conjugate development[J]. PLoS One, 2021, 16(1): e0246197.
[11]" Lewis ND, Sia CL, Kirwin K, et al. Exosome surface display of IL12 results in tumor-retained pharmacology with superior potency and limited systemic exposure compared with recombinant IL12[J]. Mol Cancer Ther, 2021, 20(3): 523-534.
[12]" Wang J, Li W, Lu Z, et al. The use of RGD-engineered exosomes for enhanced targeting ability and synergistic therapy toward angiogenesis[J]. Nanoscale, 2017, 9(40): 15598-15605.
[13]" Danhier F, Le Breton A, Préat V et al. RGD-based strategies to target alpha(v) beta(3) integrin in cancer therapy and diagnosis[J]. Mol Pharm, 2012, 9(11): 2961-2973.
[14]" 钟桃, 马大友, 刘丽君, 等. 外源性RGD肽在肿瘤诊断与治疗中的应用研究进展[J]. 中南药学, 2017, 15(10): 1396-1400.
[15]" 司梦晨, 张维迅, 屈伊婷, 等. 靶向肿瘤细胞表面受体的多肽偶联药物研究进展[J]. 海峡药学, 2023, 35(6): 1-5.
[16]" Yao R, Sui A, Wang Z, et al. Induction of non-small cell lung carcinoma apoptosis using soluble RGD-TRAIL by targeting the integrin receptor of tumor cells[J]. Mol Med Rep, 2012, 6(6): 1355-1360.
[17]" Ho Y, Li ZL, Shih YJ, et al. Integrin αvβ3 in the mediating effects of dihydrotestosterone and resveratrol on breast cancer cell proliferation[J]. Int J Mol Sci, 2020, 21(8): 2906.
[18]" Ghabraie E, Kemker I, Tonali N, et al. Phenothiazine-biaryl-containing fluorescent RGD peptides[J]. Chemistry, 2020, 26(52): 12036-12042.
[19]" 戚筱羽, 叶雨霏, 陈雪梅, 等. 基于透明质酸的靶向纳米探针的构建及体外抗肿瘤活性[J]. 中国药科大学学报, 2022, 53(5): 542-553.
[20]" Dooley K, McConnell RE, Xu K, et al. A versatile platform for generating engineered extracellular vesicles with defined therapeutic properties[J]. Mol Ther, 2021, 29(5): 1729-1743.
[21]" Bowers EC, Hassanin AAI, Ramos KS et al. In vitro models of exosome biology and toxicology: New frontiers in biomedical research[J]. Toxicol In Vitro, 2020, 64: 104462.
[收稿日期]" 2023-11-27" [编辑]" 郭" 欣