共表达膜结合型与可溶性H9N2亚型禽流感病毒HA蛋白的重组基因Ⅶ型新城疫病毒的构建及免疫效果评价


摘 要: 旨在构建能高效稳定表达H9N2 AIV的HA蛋白的重组基因Ⅶ型新城疫病毒,有望开发抗新城疫和H9N2亚型禽流感病毒的二联疫苗,为控制H9N2 AIV和NDV提供新的防御思路,对NDV疫苗载体的构建和优化有重要的参考意义。利用反向遗传技术,以rDHN3-mF为骨架,在病毒基因组的P和M之间的非编码区插入全长膜结合HA和另外一个带有截短跨膜结构域的可溶性HA蛋白,获得了能高效稳定表达H9N2 AIV的HA蛋白的基因Ⅶ型NDV减毒株重组病毒rDHN3mF-HA和rDHN3mF-2HA。通过鸡胚接种、Western blot、血凝效价(HA)及平均鸡胚致死时间(MDT)等试验来检测重组病毒的稳定性以及生物学特性,将重组病毒以106 EID50·只-1剂量免疫7日龄SPF鸡并测定血凝抑制(HI)抗体,在免疫后28 d对各组进行攻毒保护试验。结果显示:重组病毒在鸡胚中连续传至十五代后HA基因无突变发生;Western blot证明重组病毒可稳定高效地表达特异性的HA蛋白;重组病毒的生长曲线说明了重组病毒与亲本毒株具有相似的复制特性和低毒力特征;重组病毒免疫组的SPF鸡均能产生针对NDV或者H9N2 AIV的特异性HI抗体;攻毒保护试验结果:重组病毒均能对攻毒后的鸡产生100%保护效果;喉、肛拭子检测结果说明重组病毒可显著减少NDV与H9N2 AIV的体外排毒;气管与肺qPCR检测结果显示攻毒后3 d,rDHN3mF-2HA较rDHN3mF-HA更显著地降低了脏器中H9N2 AIV含量。本研究成功构建了共表达膜结合型与可溶性H9N2亚型禽流感HA蛋白的基因Ⅶ型重组NDV,为H9N2 AIV和NDV的一种新型重组基因工程二联活载体疫苗的研制与应用奠定了基础。
关键词: H9N2亚型禽流感病毒;HA蛋白;新城疫病毒;免疫原性;载体疫苗;免疫保护效率
中图分类号:S858.315.3
文献标志码:A""" 文章编号:0366-6964(2024)05-2123-12
收稿日期:2023-08-10
基金项目:广东省重点领域研发计划项目,鸡传染性支气管炎和禽流感病毒样颗粒疫苗的研制及应用(2021B0707010009)
作者简介:吕亚迪(1998-),女,河南商水人,硕士生,主要从事畜禽疫病防控研究,E-mail: 15716327913@163.com;Tel:0758-3626781
*通信作者:陈瑞爱,主要从事动物疾病防控科研等,E-mail: chensa727@vip.126.com
Construction and Evaluation of the Immune Effect of Recombinant Genotype Ⅶ NDV
Strain Co-expressing Membrane-bound and Water-soluble HA Protein of Avian Influenza Virus H9N2
L Yadi1,2, YANG" Jie1,2, XIE" Wenting1,2, XU" Ting1,2, CHEN" Ruiai1,2,3,4*
(1.College of Veternary Medicine, South China Agricultural University,
Guangzhou 510642," China; 2.Zhaoqing Branch Center of Guangdong Laboratory for
Lingnan modern Agricultural Science and Technology Co.,Ltd, Zhaoqing 526238," China;
3.Zhaoqing Institute of Biological Medicine Co., Ltd, Zhaoqing 526238," China;
4.Zhaoqing Dahuanong Biological Medicine Co.,Ltd, Zhaoqing 526238," China)
Abstract: The purpose of this study was to construct a recombinant genotype Ⅶ Newcastle disease virus (NDV) that can efficiently and stably express H9N2 subtype avian influenza virus (AIV) HA protein. It is expected to develop a bivalent vaccine against NDV and H9N2 AIV to provide a new defense idea for the control of H9N2 AIV and NDV, and has important reference significance for the construction and optimization of NDV vaccine vector. A reverse genetic technique was used to insert the full-length membrane-bound HA and another soluble HA protein with truncated transmembrane domain gene into the non-coding region between the P and M genes of NDV using the genotype Ⅶ NDV-weakening strain rDHN3-mF as the backbone. The recombinant virus rDHN3mF-HA and rDHN3mF-2HA of gene type VII NDV attenuated virus which can express HA protein stably and efficiently was obtained. The stability and biological characteristics of recombinant virus were detected by chicken embryo inoculation, Western blot, HA, MDT and other experiments. Recombinant virus was immunized with 7 d SPF chickens and serum HI assay were measured. And the group was subjected to challenge protection experiments 28 d after immunization. The recombinant viruses were passed through fifteen generations in chicken embryos without mutations.Western blot results demonstrated that recombinant viruses can express specific HA proteins stably and efficiently; The growth curves illustrates the recombinant viruses have similar replication and low virulence characteristics to parental strains; Groups of SPF chickens immunized with recombinant virus produce specific HI antibodies against NDV or H9N2 AIV.The challenge protection test showed that the recombinant viruses can produce 100% protection against chickens after challenge, and the results of throat and swab detection indicate that recombinant virus can significantly reduce the amount of NDV and H9N2 AIV shedding. The results of tracheal and lung qPCR showed that rDHN3mF-2HA significantly reduced the shedding of H9N2 AIV in organs than rDHN3mF-HA 3 dpc. The results indicated that the recombinant NDV of genotype Ⅶ coexpressing membrane-bound and soluble H9N2 subtype avian influenza HA protein was successfully constructed, which laid a foundation for the development and application of a new type of recombinant genetic engineering live vector vaccine to prevent H9N2 AIV and NDV.
Key words: H9N2 subtype avian influenza; HA protein; Newcastle disease virus; immunogenicity; vector vaccines; immunoprotective efficacy
*Corresponding author:" CHEN Ruiai, E-mail: chensa727@vip.126.com
H9N2亚型禽流感病毒(avian influenza virus, AIV)于1966年首次从美国的火鸡中分离出来[1],现已在全球家禽中广泛存在,并成为中国鸡鸭群优势AIV亚型,给家禽生产造成了巨大的经济损失[2-3]。虽然H9N2 AIV是低致病性禽流感病毒,但与其他病原体混合感染可导致严重的临床疾病和高死亡率[4-5]。此外,H9N2 AIV为新发的对人类致命的H5N1、H7N9、H10N8和H5N6重组病毒提供了部分甚至全部的内部基因,严重威胁公共卫生安全[6]。2014—2016年中国部分省份禽类从业人员调查显示H9N2血清抗体阳性率达11.20%[7],因此,无论是对养禽业的发展,还是对人类健康,控制H9N2病毒在禽类中的传播都至关重要。
1998年,中国首次发布了鸡H9N2灭活疫苗[8],此后,用灭活疫苗免疫一直是预防鸡H9N2的主要方法[9-10]。灭活疫苗虽然能诱导体液免疫,但细胞免疫反应弱,只能提供有限的免疫原性[11],尽管在流行地区大量使用了H9N2灭活疫苗,但由H9N2病毒引起的疫情仍未得到有效控制。目前使用的H9N2灭活疫苗还存在生产成本高、给药费力、免疫期短和不同谱系间缺乏交叉保护等缺点,因此,有必要开发一种有效的疫苗,能够克服传统灭活疫苗的一些缺点,并对不同谱系的H9N2病毒提供交叉保护。与灭活疫苗相比,以载体为基础的活疫苗通常能提供体液、细胞和黏膜免疫[12-14],而且病毒载体疫苗可促进免疫程序,达到“一次免疫,多重保护”的目的。研究表明,表达H9N2病毒HA蛋白的载体疫苗是灭活疫苗的理想替代品[15],禽痘病毒、新城疫病毒(Newcastle disease virus, NDV)、腺病毒、马立克病病毒、火鸡疱疹病毒等病毒载体常用于构建禽重组病毒活疫苗[16-20]。
NDV是一种不分节段的单股负链RNA病毒,属于副黏病毒科新城疫样病毒属(Avulavirus)的禽副黏病毒Ⅰ型(APMV-1)。NDV编码六种结构蛋白,即核蛋白(NP)、磷蛋白(P)、基质蛋白(M)、融合糖蛋白(F)、血凝素-神经氨酸酶(HN)和大聚合酶蛋白(L)[21]。反向遗传技术的出现使NDV可以用作动物和人类疫病的载体疫苗,尤其是针对流感病毒的疫苗[22],表达HA蛋白的NDV载体疫苗可通过饮用水接种,诱导黏膜抗体和细胞免疫,可保护家禽免受AIV感染[23]。分子流行病学研究表明,基因Ⅶ型NDV是中国等亚洲国家流行的主要病毒,而目前普遍采用的基因Ⅱ型NDV疫苗株LaSota作为载体并不能产生有效的保护[24]。因此,本研究利用实验室前期构建的一株能有效对抗基因Ⅶ型流行毒株的减毒株rDHN3-mF作为载体[25],在rDHN3-mF病毒基因组的P基因和M基因之间的非编码区表达全长膜结合型HA和另外一个带有截短跨膜结构域的可溶性HA蛋白,获得能高效稳定表达H9N2 AIV的HA蛋白的新城疫基因Ⅶ型减毒株重组病毒rDHN3mF-2HA,经Western blot验证表明增加HA的可溶性表达与原HA基因相比,其表达效率更高,该重组病毒有望进一步开发成抗新城疫和H9N2亚型禽流感病毒的二联疫苗。
1 材料与方法
1.1 病毒、质粒、细胞、蛋白与引物
pBR322-DHN3mF、pXJ40-NP、pXJ40-P、pXJ40-L、pXJ40-DE3、弱毒株rDHN3-mF均由本实验室前期构建并保存[25];NDV强毒株DHN3(GenBank登录号:MT447874.1)、H9N2亚型禽流感病毒DA株、H9灭活苗均由肇庆大华农生物药品有限公司提供;BHK-21细胞、DF-1细胞由华南农业大学兽医学院实验室保存;根据NCBI网站公布的H9N2 AIV 的DA株HA基因序列,由生工生物工程(上海)股份有限公司合成HA基因,并克隆至pXJ40质粒中,命名为pXJ40-HA。本试验所用引物均由生工生物工程(上海)股份有限公司合成,见表1。
1.2 鸡胚与实验动物
SPF鸡胚购自新兴大华农禽蛋有限公司,孵育至9~11 d使用。7 d SPF白羽肉鸡购自肇庆大华农生物药品有限公司。
1.3 主要试剂
Lipofectamine LTX and Plus Reagent (15338-100) 购自Invitrogen;Premix-Taq (RR902A)及本文所有限制性内切酶购自TaKaRa;ClonExpress Multis One Step Cloning Kit (C113)购自南京诺维赞生物制品有限公司; Goat Anti-Rabbit IgG Hamp;L (Cy2 ) preadsorbed (ab6940)购自CST;兔抗鸡IgG-HRP(SE235)购自Solarbio;AIV-HA多抗与NDV高免血清由本实验室自制;ProteinFind Anti-β-Actin Mouse Monoclonal Antibody(HC201-01)购自全式金公司。
1.4 利用反向遗传学技术拯救共表达膜结合型与可溶性HA蛋白的重组NDV
根据图1所示,以质粒pXJ40-HA为模板,分别用引物2HA-F1/2HA-R1、2HA-F2/2HA-R2扩增HA片段与删减跨膜区与胞内区的sHA片段。随后,利用同源重组的方法将HA片段与sHA片段克隆至线性化载体pXJ40Flag上,将质粒命名为pXJ40Flag-2HA。以pBR322-rDHN3 载体为模板,分别用引物rDHN3-F1/rDHN3-SmaI-R1、rDHN3- SmaI-F2/rDHN3-R2 扩增F1(1 471 bp)和 F2片段(4 815 bp)。之后再以pXJ40flag-HA或pXJ40flag-2HA载体为模板用引物HA-F/HA-R扩增F3(1 713 bp)与F3′(3 869 bp)片段。用SmaⅠ 酶切pBR322-DHN3mF[25],通过胶回收纯化DNA片段F4(13 399 bp)。将上述4个片段进行同源重组,得到重组全长质粒 pBR322-DHN3mF-HA与pBR322-DHN3mF-2HA。
将重组全长质粒 pBR322-DHN3mF-HA与pBR322-DHN3mF-2HA分别与辅助质粒pXJ40-NP、pXJ40-P、pXJ40-L、pXJ40-DE3共转染BHK-21细胞,用反向遗传学技术拯救重组NDV,操作方法按照文献所述[25],简要流程为:转染前1 d,将约 2.5×106个BHK-21细胞铺种至6孔板中,细胞密度达到约80%时,将全长质粒 pBR322-DHN3mF-HA、 pBR322-DHN3mF-2HA分别与3个辅助质粒转染至BHK-21细胞,4 d后收获转染产物,于-80 ℃经3次反复冻融后,接种10 d SPF鸡胚,每胚0.2 mL,37 ℃孵育4 d,收获尿囊液进行红细胞凝集试验(hemagglutination test, HAT)验证病毒是否拯救成功。将HA≥6log2的鸡胚尿囊液继续在SPF鸡胚中传3代。以TRIzol法抽提尿囊液RNA,采用RT-PCR法扩增插入的HA与2HA基因片段,并送生工生物工程(上海)股份有限公司测序。
1.5 重组病毒rDHN3mF-HA和rDHN3mF-2HA生物学特性的鉴定及毒力测定
通过测定rDHN3-mF、rDHN3mF-HA与rDHN3mF-2HA的血凝效价(HA)、鸡胚半数感染量(median egg infectious dose, EID50)、组织细胞半数感染量(median tissue culture infective dose, TCID50)、最小致死量鸡胚平均死亡时间(mean death time, MDT)及脑内致病指数(intracerebral Pathogenicity Index,ICPI)等病毒毒力指数,评价HA基因的插入对病毒复制的影响,每组试验重复3次。
通过间接免疫荧光试验(immunofluorescence assay,IFA)鉴定rDHN3mF-HA与rDHN3mF-2HA感染BHK-21细胞后HA蛋白的表达情况,将重组毒株rDHN3mF-HA、rDHN3mF-2HA尿囊液、亲本毒株rDHN3-mF尿囊液和SPF鸡尿囊液以MOI=2感染BHK-21细胞,24 h后进行IFA试验。
为研究重组病毒和亲本病毒在BHK-21细胞上的生长动力学,将约 2.5×106个BHK-21细胞铺种至6孔板中,待BHK-21细胞在6孔板中长至80%~90%时,分别以MOI=1的比例感染BHK-21细胞,37 ℃温箱孵育2 h后弃去病毒液,换成含有0.01% Trypsin的DMEM培养液。分别感染后4、8、16、24、36、48及60 h这7个时间点收获感染病毒液,测定不同感染时间的病毒TCID50,绘制病毒生长曲线。
通过Western blot试验鉴定重组毒rDHN3mF-HA与rDHN3mF-2HA的HA蛋白在DF-1细胞中的表达情况。将在SPF鸡胚传代至第15代的rDHN3mF-HA与rDHN3mF-2HA以MOI=2的比例感染DF-1细胞,感染48 h后收获蛋白样品并进行Western blot试验。
1.6 重组病毒rDHN3mF-HA和rDHN3mF-2HA在鸡中的免疫原性评价
选取7日龄的SPF鸡进行重组病毒的免疫原性试验,实验动物的分组及免疫程序如表2所示,免疫后观察各组动物的临床表现和死亡情况,连续观察28 d。免疫后7 d,在各免疫组内随机选取3只进行临床剖检观察,对鸡的肝、脾、气管、腺胃和十二指肠等器官的病理变化进行观察。免疫后每隔7 d,每组随机抽取10只SPF鸡进行翅下静脉采血,连续采血4周,分离血清并检测HI效价。
1.7 重组病毒rDHN3mF-HA和rDHN3mF-2HA的攻毒保护试验
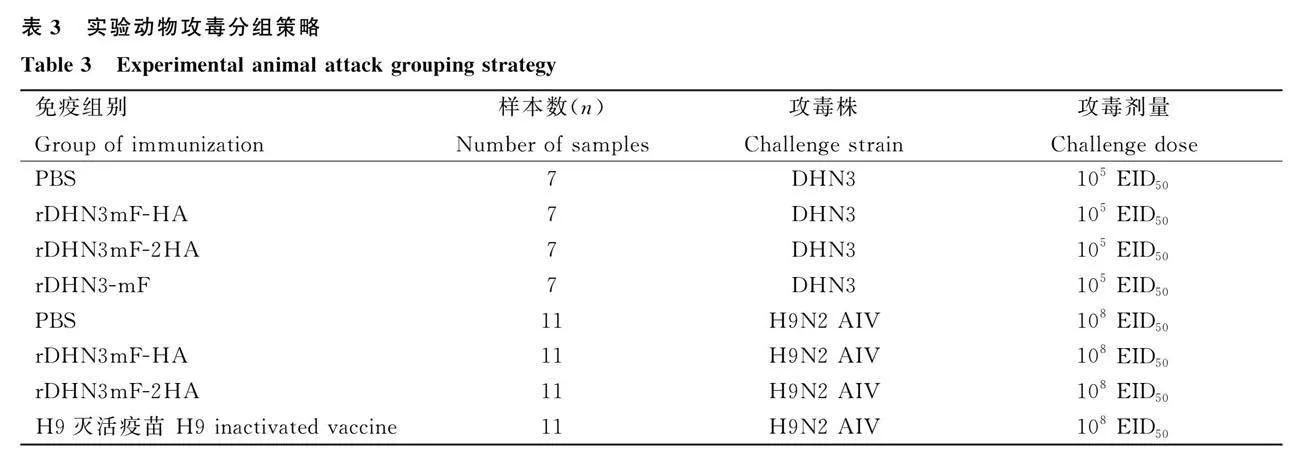
上述各组免疫后28 d,对各免疫组内实验动物通过点眼滴鼻的方式攻新城疫强毒株DHN3和H9N2 AIV,攻毒分组见表3,以此评价两株重组毒株在新城疫强毒株DHN3和H9N2 AIV攻毒下的免疫保护效果。
1.8 统计学分析
采用Graphpad Prism 8.0软件进行统计学分析,并用ImageJ进行灰度值分析,*表示Plt;0.05; **表示Plt;0.01;*** 表示Plt;0.001;**** 表示Plt;0.000 1。
2 结 果
2.1 重组病毒rDHN3mF-HA和rDHN3mF-2HA的拯救与鉴定
分别将重组毒株rDHN3mF-HA、rDHN3mF-2HA尿囊液、亲本毒株rDHN3-mF尿囊液和SPF尿囊液感染BHK-21细胞,感染24 h后做IFA试验,以1∶200兔源HA多克隆抗体为一抗,以1∶400稀释的FITC标记羊抗兔为二抗,然后用20×的荧光显微镜进行观察。试验结果(图2)表明重组病毒rDHN3mF-HA、rDHN3mF-2HA感染 BHK-21细胞后,能在细胞内检测到HA蛋白的活性,说明重组毒株 rDHN3mF-HA、rDHN3mF-2HA均能表达HA蛋白。
分别从重组病毒rDHN3mF-HA与rDHN3mF-2HA感染的F5、F10、F15代鸡胚尿囊液中提取RNA,用引物M-F2/P-R2进行RT-PCR。结果显示(图3),重组病毒3个代次的样本条带大小与预期一致,HA基因大小为2 306 bp,2HA基因大小为4 046 bp。经测序验证,PCR扩增产物序列与目的基因序列一致,表明重组病毒的遗传具有稳定性,以上试验说明救毒成功,成功获得两株重组NDV。
2.2 重组病毒rDHN3mF-HA与rDHN3mF-2HA的生物学特性及毒力分析
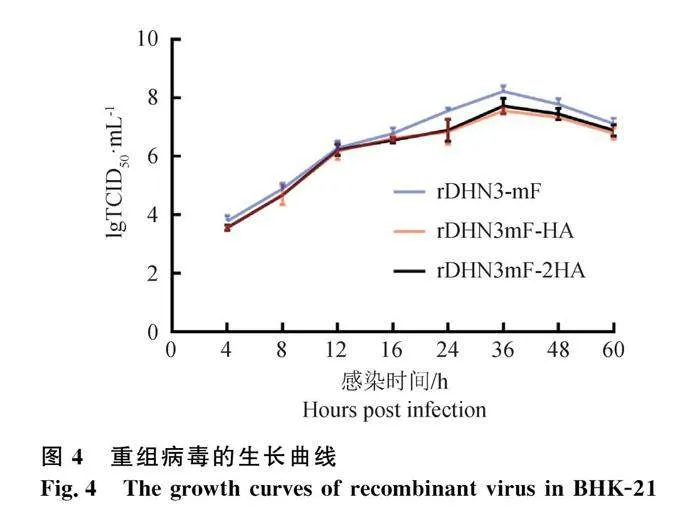
对重组病毒进行生物学特性分析,结果显示重组病毒在鸡胚中的复制效率较高,HA达到8log2,重组病毒的EID50和TCID50均低于亲本毒株(表4),这可能是由于插入外源基因所导致的。重组病毒的生长曲线见图4,结果显示重组病毒与亲本毒株具有相似的生长曲线,均在感染BHK-21细胞后的4 h开始复制,且在36 h达到峰值后开始下降。对重组病毒进行毒力测定,发现MDT和ICPI均与亲本毒株相似,说明重组毒株符合典型的弱毒株特征,可以用于后续的免疫效果分析。
2.3 重组病毒rDHN3mF-HA与rDHN3mF-2HA的Western blot鉴定
通过Western blot试验鉴定重组毒rDHN3mF-HA与rDHN3mF-2HA的HA蛋白在DF-1细胞中的表达情况,并使用Image J软件进行灰度值分析,以H9N2 DA 毒株作为阳性对照,未接毒的DF-1细胞作为阴性对照。结果如图5所示,重组病毒rDHN3mF-HA与rDHN3mF-2HA中HA蛋白均能正常表达,且rDHN3mF-2HA的HA蛋白量更高。
2.4 重组病毒rDHN3mF-HA与rDHN3mF-2HA对SPF鸡的免疫原性评价
2.4.1 重组病毒的安全性检测
将重组毒株rDHN3mF-HA、rDHN3mF-2HA以106 EID50·只-1的免疫剂量接种7 d的SPF鸡,接种后连续观察28 d,与空白对照组相比,各组试验鸡精神状态良好,食欲正常,被毛整齐。
免疫后7 d,分别自H9灭活疫苗组、重组病毒组(rDHN3mF-HA、rDHN3mF-2HA)、亲本毒组(rDHN3-mF)和空白对照组(PBS)各取3只鸡,进行剖检观察。结果见图6和图7,显示肝、心、肾、脾、肌胃和腺胃等器官无肉眼可见的病理变化,说明接种剂量为106 EID50·只-1时,重组毒株rDHN3mF-HA、rDHN3mF-2HA与亲本毒株对SPF鸡是安全的,可以用于后续的免疫效果分析。
2.4.2 血清中NDV特异性抗体及H9N2亚型AIV特异性抗体检测
分别以H9N2 AIV为四单位抗原和NDV为四单位抗原进行HI检测,结果(图8)显示rDHN3mF-HA和rDHN3mF-2HA均能诱导产生H9N2 AIV特异性抗体,抗体滴度从7 dpi提高到28 dpi,rDHN3mF-2HA诱导产生的H9N2 AIV特异性抗体在28 dpi显著高于rDHN3mF-HA (Plt;0.05);
与空白对照组相比,各试验组在免疫后7 d开始产生NDV抗体,并在21 d达到最高峰,然而rDHN3mF-2HA组产生的抗体水平极显著低于rDHN3-mF组 (Plt;0.001),可能是插入2HA影响NDV的复制,从而影响抗体的产生。
2.5 重组病毒rDHN3mF-HA和rDHN3mF-2HA的攻毒保护试验
2.5.1 攻毒后临床表现与存活率情况
攻毒后连续9 d观察全部鸡的临床表现与存活情况,并计算攻毒保护率。结果如表5所示:攻DHN3后,攻毒对照组SPF鸡3 d后均出现嗜睡,垂头,精神萎靡,排黄绿色稀粪等症状,攻毒后5 d开始有鸡死亡,攻毒后7 d鸡全部死亡,而所有免疫组均能对鸡只产生100%的保护作用;H9N2 AIV攻毒后,攻毒对照组与免疫组的SPF鸡的精神食欲无明显差异,肉眼观察无明显发病症状,并未出现死亡情况。
2.5.2 攻毒后拭子排毒情况
利用HA的试验
方法检测各组鸡的喉拭子与泄殖腔拭子,DHN3攻毒后,攻毒对照组的喉部、泄殖腔在3、6 d均全部排毒,而各免疫组在攻毒后3 d即可以有效抑制NDV排毒,攻毒后6 d则完全抑制NDV排毒(表6)。H9N2 AIV攻毒后,攻毒对照组的喉部、泄殖腔在3、6、9 d均全部排毒,而免疫各组均能有效抑制AIV排毒,与H9灭活疫苗组相比,rDHN3mF-HA组与rDHN3mF-2HA组在攻毒后6 d即可完全抑制AIV排毒(表7),说明rDHN3mF-HA与rDHN3mF-2HA有较好的攻毒保护效果。
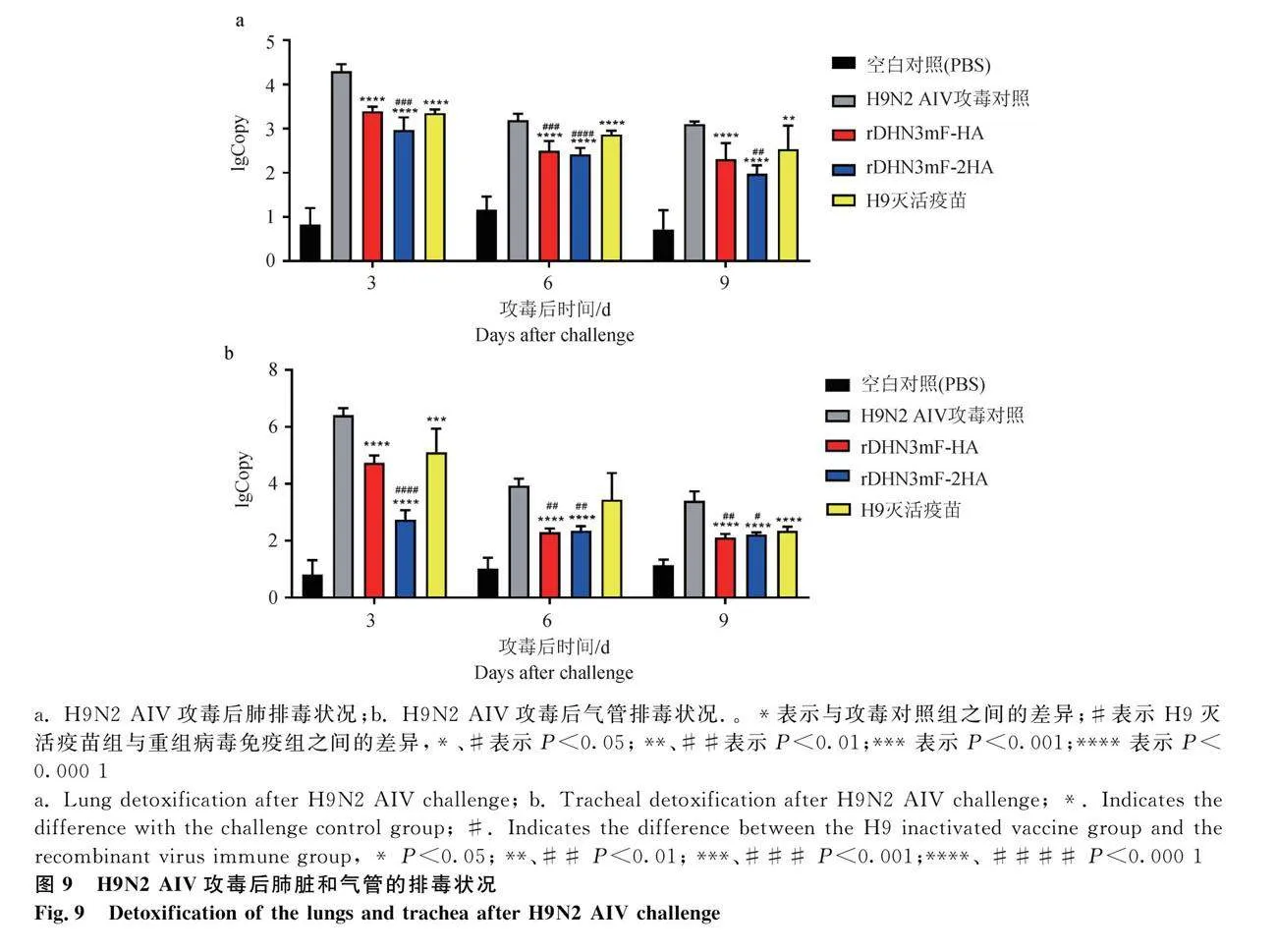
2.5.3 H9N2亚型AIV攻毒后脏器排毒检测
H9N2亚型AIV攻毒后,各免疫组的肺和气管病毒含量均随时间延长而逐渐下降(图9),在攻毒后3、6和9 d的肺中,各免疫组的病毒含量均显著低于攻毒对照组(Plt;0.01);其中,rDHN3mF-2HA组的肺病毒含量显著低于H9灭活疫苗组(Plt;0.01);攻毒3、6和9 d后的气管,各免疫组的病毒含量均显著低于攻毒对照组(Plt;0.01),6 d后的H9灭活疫苗组除外,rDHN3mF-2HA组的气管病毒含量均显著低于H9灭活疫苗组(Plt;0.05),这说明H9灭活疫苗、rDHN3mF-HA和rDHN3mF-2HA均能有效抑制H9N2亚型AIV在肺和气管中的病毒复制,其中rDHN3mF-2HA效果更佳。
3 讨 论
虽然已在流行地区大量使用H9N2 AIV灭活疫苗,但从鸡中分离出的H9N2病毒比例在中国所有亚型AIV中排名第一,这表明H9N2灭活疫苗的有效性不足,主要原因是疫苗的生产无法跟上流感病毒的变异,导致疫苗株与当地流行株不匹配;不仅如此,H9N2 AIV灭活疫苗必须通过肌肉注射,费时费力,且多次肌肉注射还会引起应激反应,进而导致鸡生长缓慢和产蛋量下降。因此,迫切需要一种能够在不同H9谱系之间提供有效交叉保护的新型疫苗。
随着反向遗传技术的发展,越来越多的研究倾向于将NDV作为病毒载体表达其他病毒的外源基因,与马立克病病毒、腺病毒等其他病毒载体相比,NDV的基因组较小,仅编码6种蛋白(NP-P-M-F-HN-L),因此对外源蛋白的表达和免疫影响较小[26]。例如,以NDV为载体表达人获得性免疫缺陷病毒I型(HIV-I)的表面糖蛋白gp160,并在豚鼠中诱导了强烈的黏膜和血清抗体反应[27]。在以NDV作为病毒载体表达ASFV p72蛋白时,重组NDV-p72病毒不仅能够顺利表达ASFV p72蛋白,诱导高滴度的p72特异性IgG抗体,而且还能诱导T细胞增殖和IFN-γ的分泌,表明NDV可以同时激活体液免疫和细胞免疫[28]。此外,多项研究还以NDV为病毒载体来表达H9N2 AIV的HA基因,结果显示重组病毒能同时抵抗NDV和H9N2 AIV的感染,有良好的保护作用[29]。
因此,本研究对H9N2 AIV的HA基因经过跨膜区分析预测,将全长膜结合HA和另外一个带有截短跨膜结构域的可溶性HA蛋白插进新城疫基因Ⅶ型DHN3-mF 弱毒株的P和M基因之间,有研究表明P与M基因之间是外源基因插入的优势位点,且该位点与NDV基因组中所有其他位置相比,产生的表达信号较强,对重组病毒的复制影响较小[30],成功构建了rDHN3mF-HA、rDHN3mF-2HA,2HA基因的长度约为3.4 kb,Western blot检测结果证明2HA蛋白的表达量比单基因HA的表达量更高,且在细胞和鸡胚中的复制水平无明显差别。
疫苗诱导的免疫反应是疫苗研制中需要考虑的重要因素之一。与rDHN3mF-HA相比,用rDHN3mF-2HA免疫28 d后能产生更多的特异性H9N2 HI抗体水平且有显著差异,但NDV的特异性抗体检测却与母源毒株相差接近2 log2,可能是插入3.4 kb左右的2HA基因会影响重组NDV在动物体内的复制,导致NDV HI抗体水平较低。有研究表明,在插入约2 kb左右的外源基因对NDV复制无明显影响,插入外源基因长度增加到3 126 bp或3 894 bp时,重组病毒在细胞中的复制无明显变化,但是在动物体内的复制下降十分之一左右[31]。
在SPF鸡的免疫试验中,NDV抗体水平的检测结果表明用rDHN3mF-HA或rDHN3mF-2HA重组病毒免疫14 d后均能在受试动物血清中检测到较高水平的NDV HI抗体。攻毒保护试验结果显示,免疫鸡群经NDV强毒攻毒后的存活率均为100%,表明虽然接种rDHN3mF-2HA的SPF鸡血清中的NDV抗体水平较另外三者低,但rDHN3mF-2HA仍能提供足够的保护作用。NDV体外排毒检测结果也证明两株重组病毒均能有效抑制NDV的排毒,达到与亲本毒株相当的抑制NDV排毒能力。
H9N2 AIV抗体水平的检测结果表明构建的重组病毒能产生H9N2 AIV特异性HI抗体,但H9商品化灭活疫苗组所产生的HI抗体水平比重组病毒高出一半以上,表明重组弱毒AIV疫苗刺激机体抗AIV的体液免疫反应较H9商品化全病毒灭活疫苗弱,但是攻毒保护试验结果显示,重组弱毒疫苗对攻毒后各组实验动物的保护率是100%,且能有效抑制攻毒后各组实验动物喉咙和泄殖腔排放量,这提示接种重组弱毒疫苗的鸡群存在特异性免疫记忆细胞。当这些鸡群攻毒后它们能识别入侵的病原并迅速地被激活,从而产生有效的细胞免疫反应。与rDHN3mF-HA组相比,在免疫后28 d,rDHN3mF-2HA组的HI抗体水平滴度显著提高,证明经过优化的HA基因通过NDV载体能刺激更好的特异性体液免疫。
在H9N2 AIV攻毒后,上述免疫鸡群均无明显眼观病症或死亡。从喉、肛拭子的排毒情况来看,攻毒后6 d,重组弱毒疫苗组检测不到排毒情况但H9灭活疫苗组仍能检测到排毒,说明表达H9N2 AIV HA蛋白的重组NDV可有效减少H9N2 AIV在气管和泄殖腔中的繁殖,这与以往的研究结果一致[32-34]。从脏器病毒含量检测结果来看,攻毒后3与6 d,重组弱毒疫苗组肺与气管的病毒含量均比H9灭活疫苗组更低,这可能是由于重组病毒相较于灭活疫苗有更好的诱导黏膜免疫与细胞免疫的能力[35]。rDHN3mF-2HA组在攻毒后3 d能显著降低肺与气管的病毒含量,但rDHN3mF-HA组在攻毒后6 d才出现,说明2HA比HA有更强的免疫保护作用,这可能与2HA能提供更多特异性抗原有关。
综上,本研究以基因Ⅶ型流行毒株的减毒株rDHN3-mF作为载体,表达全长膜结合型HA和另外一个带有截短跨膜结构域的可溶性HA蛋白,获得能高效稳定表达H9N2 AIV的HA蛋白的新城疫基因Ⅶ型减毒株重组病毒rDHN3mF-HA、rDHN3mF-2HA。重组病毒rDHN3mF-2HA的可溶性HA蛋白表达量显著提高,但是因为病毒载体携带了较大的外源基因,降低了其在鸡体内的复制水平。本研究有望开发出抗禽流感和抗新城疫二联疫苗,为控制H9N2 AIV和NDV提供新的防御思路,并且对NDV疫苗载体的构建和优化有重要的参考意义。
4 结 论
(1)利用反向遗传技术,在NDV基因组P基因与M基因之间插入不同形式的H9N2亚型AIV HA基因,成功拯救出重组病毒rDHN3mF-HA和rDHN3mF-2HA。
(2)两株重组病毒均可在细胞内稳定表达特异性HA蛋白,保持了亲本株的低毒力、遗传稳定、良好的鸡胚和细胞适应性特征。
(3)两株重组病毒免疫SPF鸡群后可以有效得保护鸡群免受基因Ⅶ型的NDV毒株和H9N2亚型AIV的攻击,且rDHN3mF-2HA的免疫效果优于rDHN3mF-HA和H9亚型禽流感灭活苗。
参考文献(References):
[1] HOMME P J, EASTERDAY B C. Avian influenza virus infections. I. Characteristics of influenza A-turkey-Wisconsin-1966 virus[J]. Avian Dis, 1970, 14(1):66-74.
[2] GU M, XU L, WANG X, et al. Current situation of H9N2 subtype avian influenza in China[J]. Vet Res, 2017, 48(1):49.
[3] SUN Y, LIU J. H9N2 influenza virus in China: a cause of concern[J]. Protein Cell, 2015, 6(1):18-25.
[4] KISHIDA N, SAKODA Y, ETO M, et al. Co-infection of Staphylococcus aureus or Haemophilus paragallinarum exacerbates H9N2 influenza A virus infection in chickens[J]. Arch Virol, 2004, 149(11):2095-2104.
[5] ARAFAT N, ELADL A H, MARGHANI B H, et al. Enhanced infection of avian influenza virus H9N2 with infectious laryngeotracheitis vaccination in chickens[J]. Vet Microbiol, 2018, 219: 8-16.
[6] SHEN Y Y, KE CW, LI Q, et al. Novel reassortant avian influenza A(H5N6) viruses in humans, Guangdong, China, 2015[J]. Emerg Infect Dis, 2016, 22(8):1507-1509.
[7] QUAN C, WANG Q, ZHANG J, et al. Avian influenza A viruses among occupationally exposed populations, China, 2014—2016[J]. Emerg Infect Dis, 2019, 25(12):2215-2225.
[8] LI C, YU K, TIAN G, et al. Evolution of H9N2 influenza viruses from domestic poultry in the mainland of China [J]. Virology, 2005, 340(1):70-83.
[9] ZHENG L, WANG F, YANG Z, et al. A single immunization with HA DNA vaccine by electroporation induces early protection against H5N1 avian influenza virus challenge in mice[J]. BMC Infect Dis, 2009, 9: 17.
[10] SWAYNE D E, KAPCZYNSKI D. Strategies and challenges for eliciting immunity against avian influenza virus in birds[J]. Immunol Rev, 2008, 225: 314-331.
[11] KRAMMER F, PALESE P. Advances in the development of influenza virus vaccines[J]. Nat Rev Drug Discov, 2015, 14(3):167-182.
[12] MCNULTY M S, ALLAN G M, ADAIR B M. Efficacy of avian influenza neuraminidase-specific vaccines in chickens[J]. Avian Pathol, 1986, 15(1):107-115.
[13] BULL J J, MOLINEUX I J, WILKE C O. Slow fitness recovery in a codon-modified viral genome[J]. Mol Biol Evol, 2012, 29(10):2997-3004.
[14] ALQAZLAN N, ASTILL J, RAJ S, et al. Strategies for enhancing immunity against avian influenza virus in chickens: a review[J]. Avian Pathol, 2022, 51(3):211-235.
[15] BALZLI C L, BERTRAN K, LEE D H, et al. The efficacy of recombinant turkey herpesvirus vaccines targeting the H5 of highly pathogenic avian influenza virus from the 2014—2015 North American outbreak[J]. Vaccine, 2018, 36(1):84-90.
[16] GREENALL S A, TYACK S G, JOHNSON M A, et al. Antibody fragments, expressed by a fowl adenovirus vector, are able to neutralize infectious bursal disease virus[J]. Avian Pathol, 2010, 39(5):339-348.
[17] STEENSELS M, BUBLOT M, Van BORM S, et al. Prime-boost vaccination with a fowlpox vector and an inactivated avian influenza vaccine is highly immunogenic in Pekin ducks challenged with Asian H5N1 HPAI[J]. Vaccine, 2009, 27(5):646-654.
[18] LI Y, REDDY K, REID S M, et al. Recombinant herpesvirus of turkeys as a vector-based vaccine against highly pathogenic H7N1 avian influenza and Marek’s disease[J]. Vaccine, 2011, 29(46):8257-8266.
[19] HUANG Z, ELANKUMARAN S, PANDA A, et al. Recombinant Newcastle disease virus as a vaccine vector[J]. Poult Sci, 2003, 82(6):899-906.
[20] ZHANG F, CHEN W, MA C, et al. Transcriptional activity comparison of different sites in recombinant Marek’s disease virus for the expression of the H9N2 avian influenza virus hemagglutinin gene[J]. J Virol Methods, 2014, 207:138-145.
[21] ALEXANDER D J. Newcastle disease and other avian paramyxoviruses[J]. Rev Sci Tech, 2000, 19(2):443-462.
[22] DINAPOLI J M, YANG L, SAMAL S K, et al. Respiratory tract immunization of non-human primates with a Newcastle disease virus-vectored vaccine candidate against Ebola virus elicits a neutralizing antibody response[J]. Vaccine, 2010, 29(1):17-25.
[23] MAO Q, MA S, SCHRICKEL P L, et al. Review detection of Newcastle disease virus[J]. Front Vet Sci, 2022, 9: 936251.
[24] KRISHNAMURTHY S, HUANG Z, SAMAL S K. Recovery of a virulent strain of Newcastle disease virus from cloned cDNA: expression of a foreign gene results in growth retardation and attenuation[J]. Virology, 2000, 278(1):168-182.
[25] WANG N, HUANG M, FUNG T S, et al. Rapid development of an effective Newcastle disease virus vaccine candidate by attenuation of a genotype VII velogenic isolate using a simple infectious cloning system[J]. Front Vet Sci, 2020, 7: 648.
[26] KAMEL M, EL-SAYED A. Utilization of herpesviridae as recombinant viral vectors in vaccine development against animal pathogens[J]. Virus Res, 2019, 270: 197648.
[27] KHATTAR S K, SAMAL S, DEVICO A L, et al. Retraction for Khattar et al., \"Newcastle disease virus expressing human immunodeficiency virus type 1 envelope glycoprotein induces strong mucosal and serum antibody responses in Guinea pigs\"[J]. J Virol, 2020, 94(6): e01868-19.
[28] CHEN X, YANG J, JI Y, et al. Recombinant Newcastle disease virus expressing African swine fever virus protein 72 is safe and immunogenic in mice[J]. Virol Sin, 2016, 31(2):150-159.
[29] XU X, XUE C, LIU X, et al. A novel recombinant attenuated Newcastle disease virus expressing H9 subtype hemagglutinin protected chickens from challenge by genotype VII virulent Newcastle disease virus and H9N2 avian influenza virus[J]. Vet Microbiol, 2019, 228: 173-180.
[30] ZHAO W, ZHANG Z Y, ZSAK L, et al. P and M gene junction is the optimal insertion site in Newcastle disease virus vaccine vector for foreign gene expression[J]. J Gen Virol, 2015, 96(Pt1):40-45.
[31] SKIADOPOULOS M H, SURMAN S R, DURBIN A P, et al. Long nucleotide insertions between the HN and L protein coding regions of human parainfluenza virus type 3 yield viruses with temperature-sensitive and attenuation phenotypes[J]. Virology, 2000,272(1):225-234.
[32] XU X, LI J, DING J, et al. Evaluation of the safety and protection efficacy of an attenuated genotype Ⅶ Newcastle disease virus strain as a candidate vaccine[J]. Microb Pathog, 2020, 139: 103831.
[33] ZHANG X, BO Z, MENG C, et al. Generation and evaluation of recombinant thermostable Newcastle disease virus expressing the HA of H9N2 avian influenza virus[J]. Viruses, 2021, 13(8): 1606.
[34] SHAO G, XIE Z, LIANG M, et al. Efficacy of recombinant Newcastle disease virus expressing HA protein of H9N2 avian influenza virus in respiratory and intestinal tract[J]. Poult Sci, 2022, 101(12):102078.
[35] KAPCZYNSKI D R, AFONSO C L, MILLER P J. Immune responses of poultry to Newcastle disease virus[J]. Dev Comp Immunol, 2013, 41(3):447-453.
(编辑 白永平)

