鸡源产气荚膜梭菌a毒素基因克隆表达及免疫原性的初步研究
张蓉蓉 艾地云 张腾飞 等

摘要:从鸡源产气荚膜梭菌C57-86中PCR扩增出a毒素基因,构建了表达质粒pGEXKG-a,并进行核苷酸序列进化分析。结果表明,鸡源产气荚膜梭菌的a毒素基因与参考菌株strainAL08-16相似性较高,核苷酸同源性为97.7%。对重组菌株BL21/KG-a诱导的表达产物进行了SDS-PAGE分析,重组菌株BL21/KG-a可以高效地表达毒素蛋白质;免疫试验表明,表达产物免疫的SPF试验鸡可抵抗A型产气荚膜梭菌的攻击。
关键词:产气荚膜梭菌;a毒素;克隆表达;免疫原性
中图分类号:Q78 文献标识码:A 文章编号:0439-8114(2015)20-5152-03
DOI:10.14088/j.cnki.issn0439-8114.2015.20.057
Molecular Cloning and Immunogenicity of the alpha-toxin of
Clostridium Perfringens Isolated from Poultry
ZHANG Rong-rong,AI Di-yun,ZHANG Teng-fei,LUO Qing-ping,WEN Guo-yuan,WANG Hong-Lin,
WANG Hong-cai,LUO Ling,SHAO Hua-bin
(Insitude of Animal Husbandry and Veterinary, Hubei Academy of Academy of Agricultural Sciences/Hubei Key Laboratory of
Animal Embryo and Molecular Breeding,Wuhan 430064, China)
Abstract: The gene CPA encoding a toxin was amplified from the strain C57-86 separated from poutry of Clostridium Perfringens type A by PCR, and pGEXKG-a was constructed. The sequence analysis based on the alpha-toxin gene revealed the strain was most closely related to reference strain AL08-16 gene sequence, only 97.7% nucleotide identity was observed. The purposed protein was expressed efficiently, and the purposed protein could react with antitoxin antibody which protected the SPF chick against the attack of C.perfringens type A culture filtrate.
Key words:Clostridium perfringens; alpha-toxin; molecular cloning and expression; immunogenicity
产气荚膜梭菌(Closteridium perfringens)是引起多种动物坏死性肠炎、肠毒血症和人类食物中毒的主要病原菌之一,分为A、B、C、D、E 5个血清型。其致病因子主要是菌体产生的外毒素,在产气荚膜梭菌所产生的12种毒素中,a毒素(CPA)被认为是最基本、最重要的致病因子。a毒素是由370个氨基酸组成的单链多肽,分子质量约43 ku,是一种依赖于锌离子的多功能性金属酶,具有磷脂酶C(PLC)和鞘磷脂酶2种酶活性,能同时水解细胞膜的主要组成成分——磷脂酰胆碱和鞘磷脂,破坏细胞膜的完整性,导致细胞裂解,从而具有细胞毒性、溶血性、致死性和皮肤坏死性等特性[1]。近年来,全国各地A型和C型产气荚膜梭菌引起的不同日龄禽类严重的坏死性肠炎,发病率达30%以上,病死率达18%~31%,病死鸡多为肌肉脂肪丰满、体格健壮的鸡。本研究克隆和表达了鸡源产气荚膜梭菌a毒素基因,并初步对其表达产物进行了序列分析及免疫原性研究,为下一步建立家禽坏死性肠炎的免疫学诊断方法及亚单位疫苗奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株 鸡源产气荚膜梭菌强毒株strainC57-86购自中国兽药监察所;大肠杆菌DH5α和BL21(DE3)以及pGEX-KG载体由湖北省农业科学院畜牧兽医研究所保存。
1.1.2 主要试剂 限制性核酸内切酶BamHⅠ、XhoⅠ,PCR试剂盒RNaseA、Taq DNA聚合酶均购自宝生物工程(大连)有限公司;细菌DNA提取试剂盒购自OMEGA公司。
1.2 方法
1.2.1 引物合成 参照NCBI中产气荚膜梭菌a毒素全基因组序列,设计1对a毒素基因引物,上游引物CPa01: 5-ACGGGATCCCACTATTTTGGAGATATA
GA-3,下游引物CPa02:5-ACGCTCGAGTTAATTATAAGTTGAATTTCCTG-3,目的片段大小为729 bp,由生工生物工程(上海)有限公司合成。上游引物和下游引物分别含有BamHⅠ和XhoⅠ酶切位点。
1.2.2 全基因组的提取 将鸡源产气荚膜梭菌在厌气肉肝汤中于37 ℃厌氧培养过夜离心后,将沉淀重悬于含2 mg/mL溶菌酶的TE溶液中,混匀后30 ℃水浴10 min。按照OMEGE bacterial DNA Kit说明书进行全基因组的提取。
1.2.3 PCR扩增 50 μL PCR反应体系为:10×Buffer缓冲液5.0 μL,MgCL2(25 mmol/L)4.0 μL,dNTPs(10 mmol/L)1.0 μL,模板5 μL,上、下游引物(10 μmol/L)各2 μL、Taq DNA聚合酶(25 U)1.0 μL,加灭菌双蒸水补足至50 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,52 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min。取5.0 μL PCR产物于1.0%琼脂糖凝胶电泳,观察结果。
1.2.4 PCR产物的回收、连接转化及鉴定 PCR产物经1.0%琼脂凝胶电泳回收后,以DNA胶回收试剂盒回收PCR产物,按说明书操作。将回收纯化的目的产物与pGEX-KG载体双酶切后,转化至大肠杆菌DH5α感受态细胞,以含有氨苄西林(Amp)抗性平板进行筛选培养,挑取白色菌落于含Amp的LB液体培养基上培养过夜,以SDS碱裂解法提取重组质粒,经PCR鉴定及BamHⅠ和XhoⅠ双酶切分析筛选阳性克隆。
1.2.5 序列的测定与分析 取阳性克隆菌送至生工生物工程(上海)有限公司测序,测序结果用BLAST(http://www.ncbi.nlm.nih.gov/BLAST)在线进行同源搜索。核苷酸和氨基酸分别用DNAStar软件中的MegAlign程序的Clustal W运算,结果用GeneDoc2.6 (http://www.psc.edu/biomed/genedoc/)进行核苷酸变异分析,分析所用菌株及其GenBank登录号见表1。
1.2.6 阳性质粒的诱导表达及表达产物的SDS-PAGE分析 将构建的阳性质粒转入受体菌BL21(DE3),经37℃加IPTG诱导,按文献[2]的方法收集菌体,变性处理后进行SDS-PAGE电泳分析。
1.2.7 动物免疫原性及攻毒试验 取阳性质粒表达的蛋白质测定其浓度,与等体积弗氏完全佐剂混匀乳化,制备抗原。取20只30日龄SPF鸡,分为两组,其中一组以600 μg剂量腿部肌肉注射SPF试验鸡,2周后取适量蛋白质与等体积不完全弗氏佐剂混匀并乳化完全后,以同种剂量加强免疫,另一组为生理盐水免疫的空白组。将过夜培养的鸡源A型产气荚膜梭菌上清作倍比稀释,从原液到10-4稀释做5个梯度,每个稀释度0.1 mL腿部肌肉注射30日龄SPF鸡6只,观察试验鸡存活情况。
2 结果与分析
2.1 PCR鉴定结果
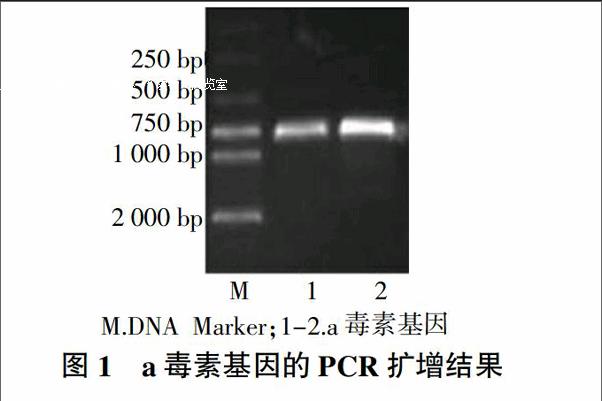
采用设计的特异性引物对a毒素基因进行PCR扩增,经1%琼脂糖凝胶电泳。结果表明,以产气荚膜梭菌为模板扩增出约729 bp的特异性条带,与预期大小相符(图1)。
2.2 重组质粒的双酶切鉴定
将质粒经PCR鉴定后用限制性内切酶BamHⅠ和XhoⅠ进行酶切鉴定,结果如图2所示。由图2可知,经双酶切后可获得大小约为5 000 bp和729 bp的2条DNA条带,即pGEX-KG载体和目的基因条带,初步表明已成功构建产气荚膜梭菌a毒素克隆表达质粒。
2.3 序列的测定与分析
将该菌株的a毒素基因序列与表1中的产气荚膜梭菌[3]进行同源性比较,结果表明,鸡源产气荚膜梭菌a毒素基因与参考菌株AL08-16[4]的核苷酸同源性均较高,为97.7%。
基于基因组序列建立的进化树(图3),结果鸡源产气荚膜梭菌C57-86与印度土壤中分离的AL08-16的亲缘关系较近,分别处于一较小的分支。与日本报道的ATCC13124和NCTC8237的亲缘关系较远。
2.4 a毒素基因表达产物SDS-PAGE分析
将BL21(DE3)菌株作为表达的宿主菌,经转化挑取单个菌落培养诱导后,菌体经超声波处理,提取包涵体,上清经80%饱和硫酸铵沉淀后得到浓缩,沉淀经透析后,用SDS-PAGE分析(图4),在相对分子质量约为46 ku处出现特异性蛋白质条带,表明a毒素已在宿主菌种得以表达,并且上清和沉淀均表达a毒素,包涵体中的浓度大于上清。
2.5 攻毒试验结果
以1个LD50剂量,腹腔感染2次、免疫2周后的SPF鸡及对照组SPF鸡各10只,结果表明,免疫组10只SPF试验鸡全部存活,获得100%的保护,而对照组10只SPF试验鸡全部死亡。
3 小结与讨论
鸡坏死性肠炎是由A型产气荚膜梭菌引起的一种常见禽病,以生长率降低、肠道损伤和死亡为特征[5]。自2006年欧盟立法禁止抗生素作为生长促进剂(AGPs)添加到饲料中使用[6,7]后,鸡坏死性肠炎发病率明显增高,对全球养禽业造成了巨大的经济损失。鸡群发病较突然,常常是突然患病,剖检可见大多数鸡的肠腔扩张3~5倍并充满气体,十二指肠出血性肠炎,肠黏膜充血、出血或坏死。
本试验成功克隆了鸡源产气荚膜梭菌a毒素的功能基因,并在大肠杆菌中高效表达,高表达的菌液经离心后提取包涵体,结果表明,构建的阳性克隆既可表达具有生物学活性的可溶性蛋白质,也可表达不可溶性蛋白质,这可能与设计a毒素的所选取的片段有关。a毒素基因其结构基因大小为1 194 bp,编码398个氨基酸,分子质量为46 ku,信号肽为28个氨基酸,成熟肽为370个氨基酸。已有相关研究表明,编码a毒素N端1~249氨基酸基因和编码a毒素C端247~370氨基酸的基因,这两种基因表达产物的生物学点效应有所变化[8]。通过免疫试验表明,该重组蛋白质免疫SPF鸡能产生很好的抗体,从而避免被A型鸡源产气荚膜梭菌的强毒株攻击。
参考文献:
[1] ROOD J I, COLE S T. Molecular genetics and pathogenesis of Clostridium perfringens[J].Microbiol Rev,1991,55(4):621-648.
[2] 梁宋平.生物化学与分子生物学实验教程[M].北京:高等教育出版社,2003.
[3] TITBALL R W, HUNTER S E, MARTIN K L,et al. Molecular cloning and nucleotide sequence of the alpha-toxin (phospholipase C) of Clostridium perfringens[J]. Infection and Immunity,1989,57(2):367-376.
[4] TSUTSUI K, MINAMI J,MATSUSHITA O,et al. Phylogenetic analysis of phospholipase C genes from Clostridium perfringens types A to E and Clostridium novyi[J]. Bacteriology,1995, 177(24):7164-7170.
[5] KALDHUSDAL M,HOFSHAGEN M. Barely inclusion and avoparcin supplementation in broiler diets.2.Clinical,pathological and bacteriological findings in a mild form of necroticenteritis[J]. Poult Scri, 1992,71(7):1145-1153.
[6] DIBNER J J,RICHARDS J D. Antibiotic growth promoters in agriculture:History and model of action[J]. Poult Sci,2005,84(4):634-643.
[7] CASTANON J I.History of the use of antibiotic growth promoters in European poultry feeds[J]. Poult Sci,2007,86(11):2466-2471.
[8] GINTER A,WILLIAMSON E D,DESSY F,et al. Molecular variation between the alpha-toxins from the type strain(NCTC8237) and clinical isolates of Clostridium perfringens associated with disease in man and animals[J]. Microbiology, 1996,142(1):191-198.

