基于代谢组学探究肾阳虚证患者激素代谢的变化研究



摘要:目的 探究肾阳虚证患者与平和质人群的尿液代谢物水平差异,分析激素变化情况,为肾阳虚证探索出有价值的生物标志物。方法 共纳入8例肾阳虚患者与4例平和质人群的尿液进行UPLC代谢组学分析,通过PCA、PLS-DA分析,筛选出有显著差异的代谢物并结合代谢通路进行分析。结果 与对照组相比较,试验组尿液中11-β-羟基雄酮-3-葡萄糖醛酸、三羟基孕酮、18-羟皮质醇、醛固酮18-葡糖苷酸、4-羟基雄烯二酮葡糖苷酸等激素代谢物显著上升,硫酸雄酮、本胆烷醇酮、16-脱氢黄体酮、5b-孕二醇、氟氢可的松、雌酮、5a-二氢睾酮等显著下降。结论 本研究进一步证明了肾阳虚证会导致机体多种激素代谢紊乱,降低氨基酸、脂肪酸等能量代谢,并与细胞内吞、昼夜节律夹带等通路有关。
关键词:肾阳虚证;代谢组学;代谢通路;生物标志物
中图分类号:R277.5 文献标志码:A 文章编号:1007-2349(2024)08-0068-06
肾阳虚属于中医理论体系中的重要证候之一,是一种虚寒证候,其病因主要为肾阳虚衰、肾脏温煦、气化功能下降等。由禀赋不足、年老体虚、耗损过度、补养不足及气机阻滞所引起。临床表现多见面色苍白、形寒肢冷、腰膝酸痛、下肢软弱无力、小便不利或小便频数、少腹拘急。对于肾阳虚证相关疾病的治疗已经成为国内外医学研究的热点。在以往的代谢通路研究中发现,该证候主要可能是“下丘脑—垂体—肾上腺皮质轴、甲状腺轴、性腺轴和胸腺轴”等环节发生了不同程度的紊乱所造成的[1]。
对于肾阳虚证相关疾病的病程中,人体各类生物标志物,特别是激素类的研究已经日渐深入,例如杜嫦燕等[2]利用经方加减治疗脾肾阳虚型卵巢早衰并探究相关激素水平变化,周歆等[3]通过对大量文献的二次研究发现“补肾阳”中医疗法治疗多种肾阳虚证疾病都与激素调节密切相关,但以证候分类进行激素水平变化特点的研究尚有待探索,本研究以肾阳虚患者与平和体质成人的尿液为样本,通过液相色谱-质谱(LC-MS)联用的代谢组学研究,靶向分离与鉴定样本中各种激素类物质,筛选出具有意义的生物标志物,从激素代谢的角度进一步揭示肾阳虚证的证候变化特点与人体激素的关系,为肾阳虚证相关疾病的诊断和治疗提供新思路。
1 资料与方法
1.1 研究对象的选择
1.1.1 研究对象 试验组8例肾阳虚患者及对照组4例平和质人群,均自愿签署知情同意书,并符合方案规定的相关标准。本试验方案获昆明市中医医院伦理委员会批准。
1.1.2 诊断标准 参照2002年国家食品药品监督管理局颁布的中的“肾阳虚证”诊断标准[4]。主症:畏寒肢冷,神疲乏力,腰膝酸软,夜尿频多,性欲减退。次症:动则气促,下肢浮肿,发槁齿摇。具备以上主症3项、次症1项,即可诊断肾阳虚证。
1.1.3 纳入标准 患者年龄在35~65岁之间;符合中医肾阳虚证诊断标准者及平和体质者;自愿签署知情同意书。
1.1.4 排除标准 患者正处于急性感染期;精神上或法律上的残疾患者;哺乳、妊娠或正准备妊娠的妇女;过敏体质或对多种药物有过敏史者;30天内参加过其他药物临床试验的患者;腋下体温>37.5℃;严重的心脑血管疾病、肝脏疾病、肾脏疾病、造血系统疾病、先天性心脏病患者等。
1.2 一般资料 试验组和对照组的患者均来自于本院的门诊患者,男女均有。平和质组平均年龄(47.20±13.40)岁;肾阳虚证组年龄(48.60±11.30)岁,2组试验对象年龄比较,差异无统计学意义,具有可比性(P>0.05)。
1.3 研究方法
1.3.1 主要仪器及试剂 仪器:液相色谱:2777C UPLC system(Waters,UK);质谱仪:Xevo G2-XS QTOF(Waters,UK)。
试剂:HPLC乙腈(Thermo,USA),乙酸铵(Sigma,USA),甲酸(Sigma,USA),甲酸铵(Sigma,USA)。
1.3.2 样本收集及处理 取-80 ℃低温保存的尿液样品,复温后用从每个样本中取100 μL混合作为QC样本,根据样本数目确定QC数目(样本数目的6%为样本制备插入的QC数目,至少为6个,取整数后将QC分装)。取数个新的EP管放置于EP管架上,标注标签,按上机顺序将样本排序,并随机插入qc样本;将每个样品(含QC)各取100 μL左右加入相应新EP管中,加入甲醇300 μL,每个EP管单独涡旋30 s混匀;静置1 min,确保体积不均的EP管,如有需重新处理该样品;置于-20 ℃冰箱2 h;25000 g×4 ℃离心 10 min后取350μL上清置于新的EP管中,25000 g×4 ℃再次离心10 min;将EP管从离心机中取出,按样品编码顺序将样品放置在离心管架上;每个样品取25 μL置于新的96孔板中,加入225 μL 50%甲醇进行稀释;剩余样品交于按条件妥善保存。
1.3.3 液相色谱质谱检测 (1)液相参数:采用ACQUITY UPLC HSS T3 column(100 mm×2.1 mm,1.8 μM,Waters,UK)进行色谱分离,色谱柱柱温为40 ℃,流速为0.5 mL·min-1,其中A流动相为水和0.1%甲酸,B流动相为乙腈和0.1%甲酸。对代谢物采用以下梯度进行洗脱:0~1 min,99 %流动相A;1~3 min,1-15%流动相B;3~6 min,15%~50%流动相B;6-9 min则为50%~95%流动相B;9-10 min则为95%流动相B;10.1-12 min则为99%流动相A。每个样本的上样体积为10 μL。(2)质谱参数:对从色谱柱上洗脱下来的小分子,利用高分辨串联质谱Xevo G2-XS QTOF(Waters,UK)分别进行正负离子模式采集。正离子模式下,毛细管电压和锥孔电压分别为2 kV和40 V。负离子模式下,毛细管电压及锥孔电压分别为2 kV和40 V。采用MSE模式进行centroid数据采集,一级扫描范围为50~1200 Da,扫描时间为0.2 s,对所有母离子按照20到40 eV的能量进行碎裂,采集所有的碎片信息,扫描时间为0.2 s。在数据采集过程中,对LE信号每3 s进行实时质量校正。同时,每隔10个样本进行一次混合后质控样本的采集,用于评估在样本采集过程中仪器状态的稳定性。
1.4 数据处理
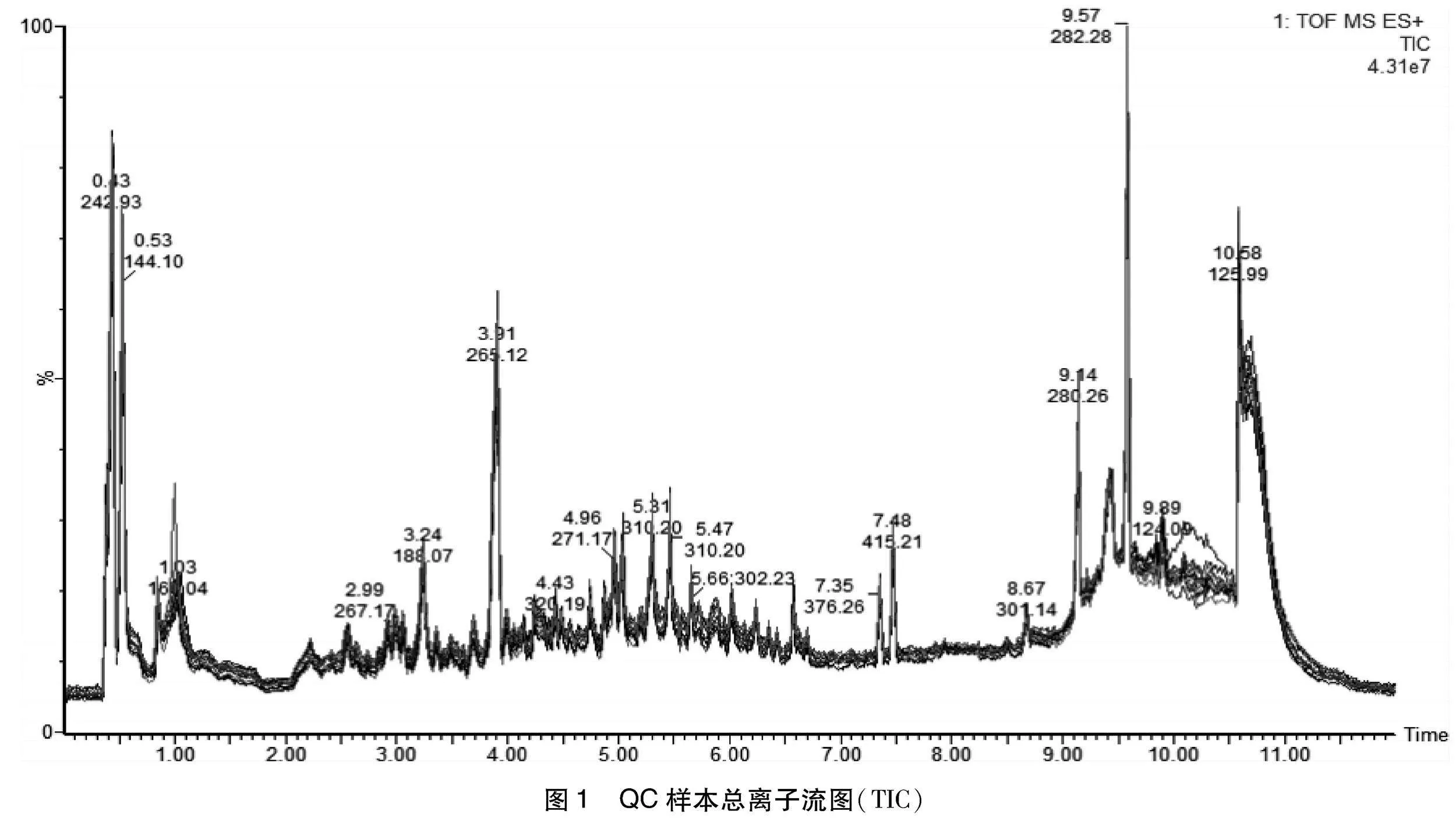
1.4.1 数据质控 QC样本在样本检测前用于平衡“色谱-质谱”系统,通过对QC样本的总离子流色谱图(TIC)进行重叠以在样本检测过程中用于评价质谱系统的稳定性,对QC样本进行主成分分析验证数据质量以及试验的重复性。本研究中大部分离子的保留时间与各色谱峰的响应强度基本重叠,表示生物学重复之间差异较小,取样精确,仪器误差小(图1)。
1.4.2 统计学及数据处理 质谱下机原始数据导入软件Progenesis QI(version 2.2)进行峰提取,获得代谢物相关的质荷比、保留时间和离子面积等信息。采用QC-RSC(quality control–based robust LOESS signal correction)方法校正,将所有QC样品中相对标准偏差(RSD)>30 %的离子舍弃(RSD>30 %的离子在实验过程中波动较大,不纳入下游统计学分析),最后进行分析。通过PCA对数据进行降维分析,以检测实验组间的差异性及组内的重复性。在二维图中,取前两个主成分 PC1、PC2来表示样本,空间分布差异越小表示两个样本的数据越接近。在本研究中,在做PLS-DA模型之前进行了log2转换及采用Pareto scaling的方法对数据进行比例调整(scaling)。最后对差异代谢进行分析筛选,得到各组中排名靠前的差异代谢物,通过火山图(Volcano plot)直观显示差异代谢物的整体分布情况。
本研究中采用t检验和变异倍数分析(fold change analysis,FC analysis)。在统计分析过程中,进一步对统计检验产生的p-value进行FDR校正得到q-value。最终结果以火山图形式呈现差异倍数(Fold change)和q-value两个指标,通常以差异倍数≥1.2或≤0.8333,q-value值小于0.05作为筛选差异代谢物的条件。
1.4.3 代谢通路功能分析 在生物体内,不同代谢物会形成一个相互作用网络,基于Pathway的分析有助于更进一步了解其参与的通路。KEGG Kyoto Encyclopedia of Genes and Genomes 是有关 Pathway的主要公共数据库,通过 Pathway分析能确定代谢物参与的最主要生化代谢途径和信号转导途径。计算差异代谢物在不同 Pathway 的分布情况,可以对差异代谢物进行归类,寻找差异代谢物与通路改变的关系。
2 结果
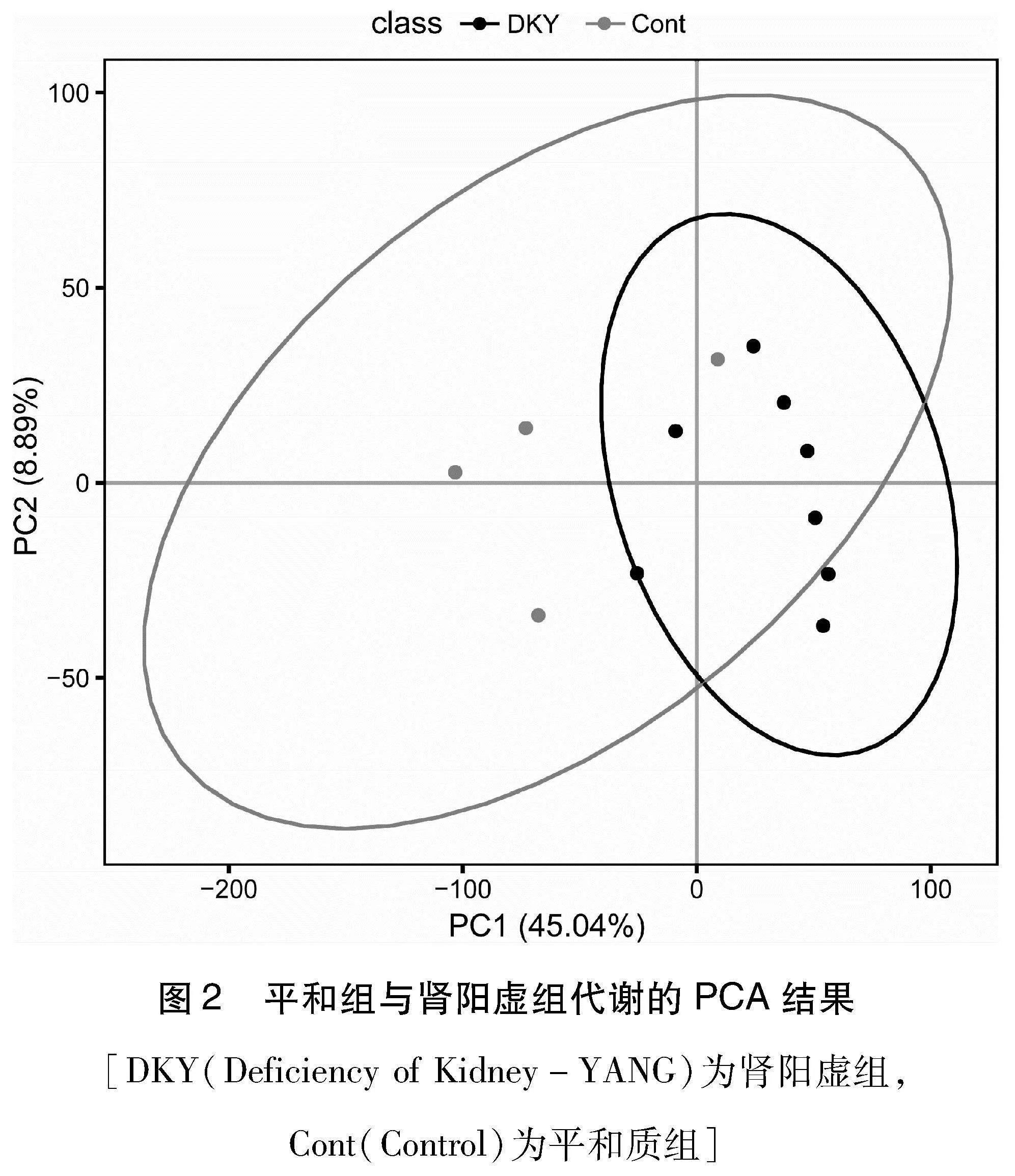
2.1 主成分分析(PCA) 本研究中PCA分析前对数据进行了log2转换和比例调整(scaling),采用Pareto调整法(Pareto scaling),结果发现,在同一组内各样本在一定范围内相对集中,重复性较好(图2)。PCA分析发现,对变异影响最大的因子有45.04 %的贡献率(PC1),第二大的因子有8.89 %的贡献率(PC2)。
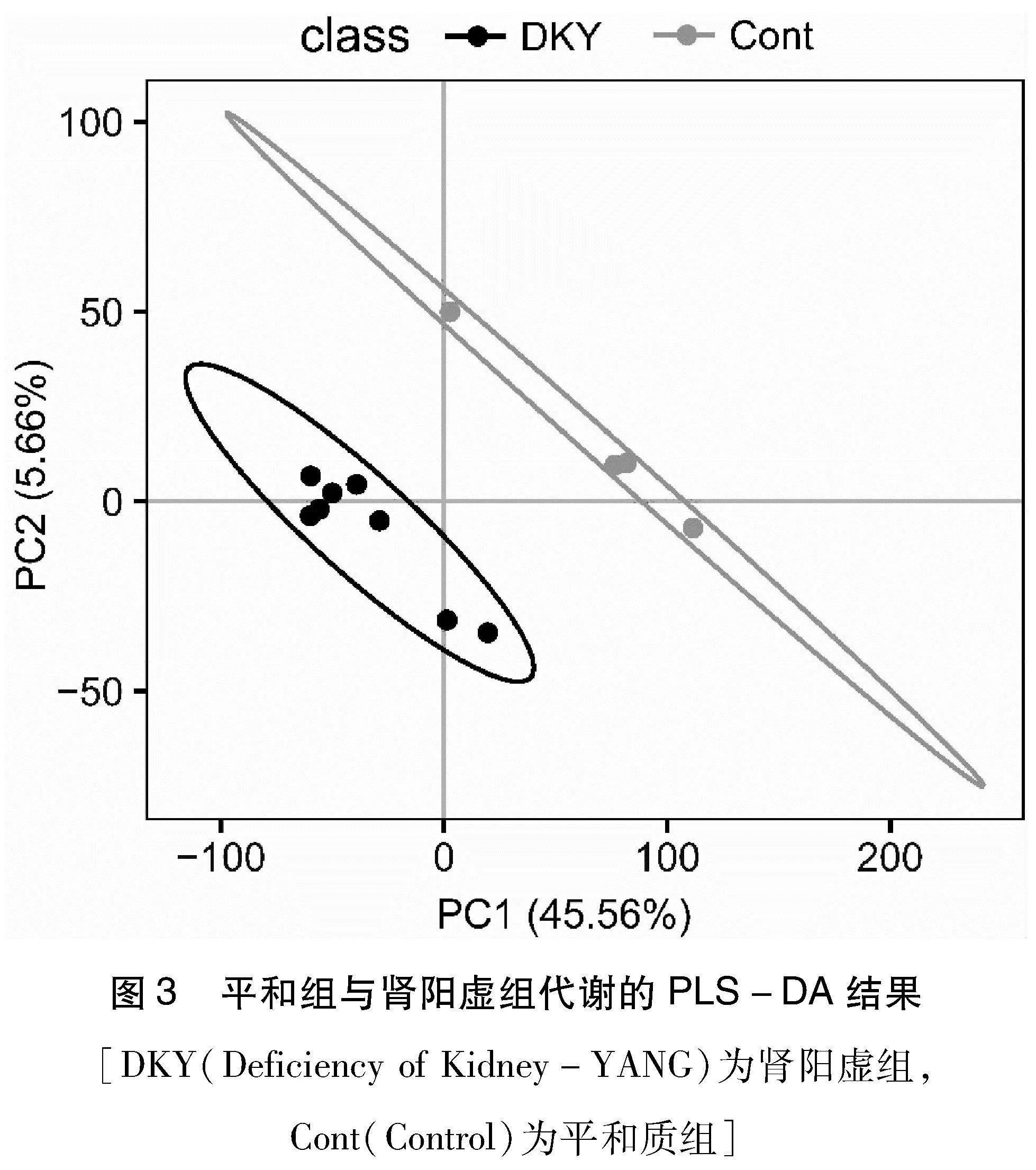
2.2 偏最小二乘法判别分析(PLS-DA) 在经过PCA的探索分析得到判别模型,以识别关键的生物标志物或样本差异;最后通过模型评估和结果可视化,确定模型的有效性和结果的清晰度。结果显示对照组与试验组之间分离情况更加完善,可以筛选出2组之间的差异代谢物(图3)。
2.3 差异代谢物 通过比较2组的代谢谱数据差异,结果显示(图4),2组间有大量代谢物存在差异(P<0.05),其中部分代谢物差异显著(P<0.01)并且差异倍数较大,试验组较对照组相比,代谢物上调的较多。
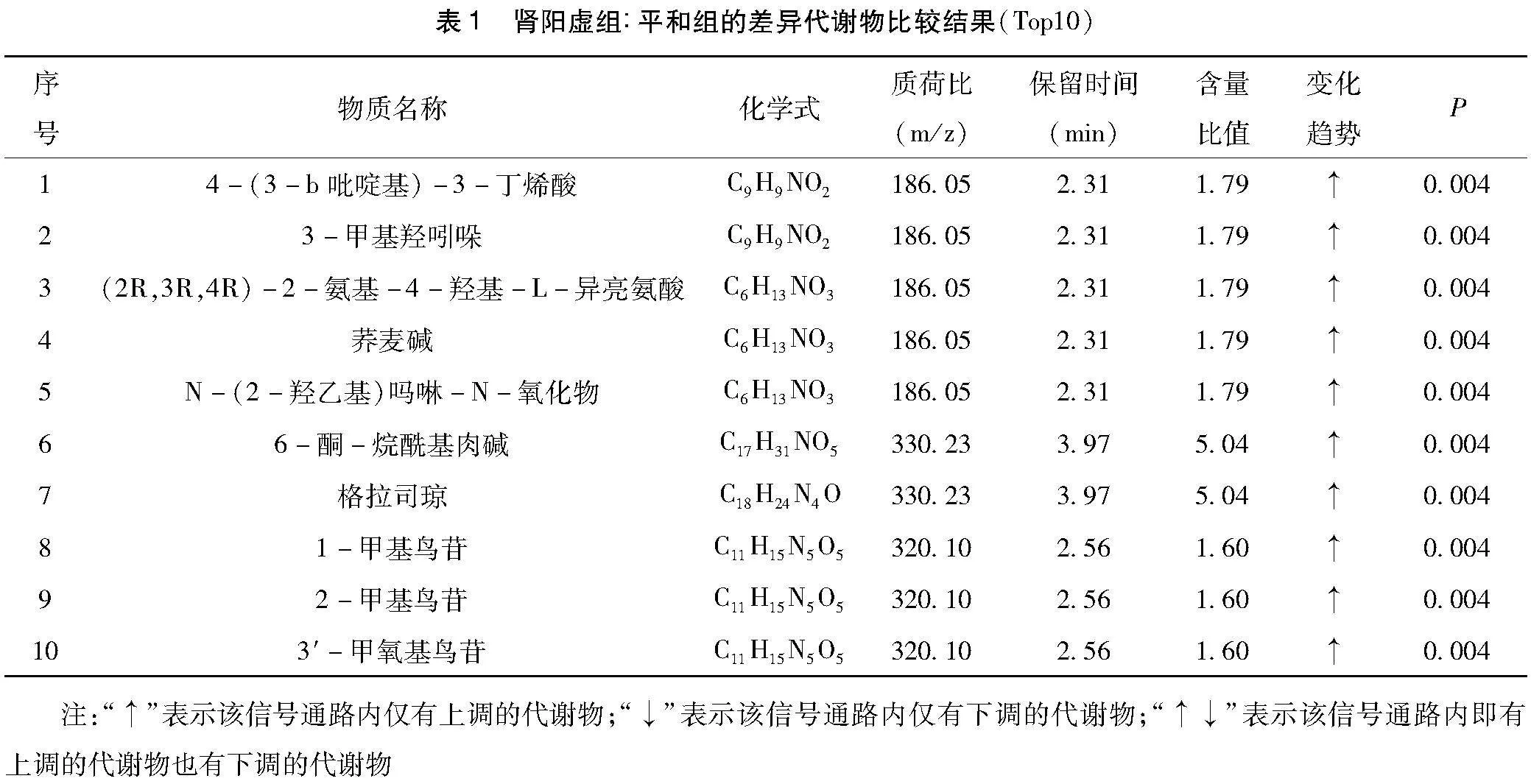
以RSD ≤ 30 %为条件筛选2组间代谢存在显著差异(P<0.01)的离子共有4308种(表1),同时筛选出与激素相关的差异代谢物13种,[HJ2.6mm]肾阳虚证患者尿液中的11-β-羟基雄酮-3-葡萄糖醛酸、三羟基孕(甾)酮、18-羟皮质醇、2-甲氧基-雌二醇-17b-3-葡萄糖醛酸、醛固酮18-葡糖苷酸、4-羟基雄烯二酮葡糖苷酸等激素代谢物或者其中间产物显著上升,而硫酸雄酮、本胆烷醇酮、16-脱氢黄体酮、5b-孕二醇、氟氢可的松、雌酮、5a-二氢睾酮等显著下降(表2),筛选条件为1)VIP ≥ 1;2)fold change ≥1.2或者≤ 0.8333;3)q-value<0.05。
2.4 代谢通路分析结果 将筛选出的代谢物与数据库中的代谢通路进行比对,计算通路在数据集中的富集程度,以评估通路活性状态。富集结果显示,肾阳虚组与平和组相比共有188个相关的代谢途径参与了差异代谢物的调控,主要集中在细胞质膜运送物质的通路以及对氨基酸、脂肪酸、药物代谢酶等多种物质的代谢通路(表3,Top10)。
3 讨论
肾为先天之本,藏精生髓,肾所藏的先天之精来源于父母禀赋,是生命的本源,其功能决定了人体生长,脏腑盛衰的变化。由于各种生理、病理原因导致精气不足,肾阳虚衰从而导致激素代谢异常,影响机体相关能量代谢通路与正常的生理功能,表现出畏寒喜暖、腰膝酸软,肾阳不足难以固摄肾精,精气外泄则夜尿频多、小便清长,对于生殖系统的影响表现为阳痿早泄、性欲低下,甚至不孕不育,并伴有神疲乏力、手足厥冷、精神萎靡、头晕目眩等症状[5-6]。
通过对肾阳虚体质和平和体质人群尿液的代谢组学分析,发现2组间有大量的代谢物存在差异,富集到不同功能的通路。现代医学研究表明,肾阳虚证与“下丘脑-垂体-肾上腺皮质轴”功能紊乱相关,通过神经内分泌网络中枢调节最后作用到促肾上腺皮质激素释放激素和促肾上腺皮质激素等肾上腺相关激素以及糖皮质激素的释放与代谢[7],在本研究中同样观察到在肾阳虚证患者的尿液代谢物中,氟氢可的松的含量显著下降,18-羟皮质醇含量升高,提示肾阳虚证患者的肾上腺皮质功能出现异常。由于肾上腺皮质功能受损导致激素代谢与调节发生紊乱从而表现出肾阳虚证的诸多症状,同时由于生理或者病理的可的松类激素分泌过度也同样容易导致肾阳虚证,并且在能量代谢、脂肪酸、氨基酸等代谢功能上出现异常[8],当机体的嘌呤代谢、脂肪酸生物合成相关通路受到影响,身体代谢效率低下后,从而导致线粒体能量代谢障碍,由此出现乏力、畏寒、肢冷和精神萎靡等肾阳虚证的典型症状[9],现代医学研究也表明,蒽醌类、糖类以及氨基酸等物质对改善肾阳虚证有显著作用,其机制可能与改善能量代谢和逆转氨基酸代谢紊乱,调控“下丘脑-垂体-肾上腺皮质轴”生理病理和功能状态相关[10]。
综上,根据本研究中试验组和对照组的激素代谢变化,以及相关代谢物的不同,在肾阳虚证的诊断和治疗方面,建议可以借助代谢组学的方法,从氨基酸、脂肪酸等能量代谢通路方面入手,将机体微观水平的变化与中医证候的整体观念相结合,通过激素代谢水平的异常与症状表现,对肾阳虚证的病理变化过程进行综合阐释,这样不仅遵循中医温肾补阳的治法治则,同时也可以从相关的代谢通路出发,并加以激素调节等方式,对肾阳虚证进行全面客观的诊治。
参考文献:
[1]邹海淼,辛雪,孙伟,等.肾阳虚生化指标的现代研究进展[J].现代生物医学进展,2015,15(30):5989-5993.
[2]杜嫦燕,关凤仪,罗宝玲.加减温经汤对脾肾阳虚型卵巢早衰相关激素水平及预后的影响[J].中华中医药学刊,2023,41(8):37-40.
[3]周歆,马贤德,新昕,等.“补肾阳”中医疗法对内分泌患者血清中激素调节作用的Meta分析[J].辽宁中医杂志,2020,47(7):6-13.
[4]郑筱萸.中药新药临床研究指导原则(试行)[M].北京:中国医药科技出版社,2002,385-388.
[5]孙明月,訾明杰,秦义,等.基于混合方法的《肾阳虚证诊断标准》制定[J].中华中医药杂志,2022,37(1):284-288.
[6]王舒月,赵宗江,张新雪,等.基于因子分析的558例肾阳虚证人群的证候量化分析研究[J].世界科学技术-中医药现代化,2023,25(7):2304-2312.
[7]周璇,程立红,闵友江.糖皮质激素受体、盐皮质激素受体对肾阳虚证下丘脑-垂体-肾上腺轴影响研究概况[J].亚太传统医药,2019,15(7):201-204.
[8]陶秀梅.“肾阳虚”模型及证候的代谢组学研究[D].上海:上海交通大学,2009.
[9]何林熹.中医体质分类辨识及肾阳虚体质线粒体基因SNP研究[D].成都:成都中医药大学,2020.
[10]王亚非,李运海,邢姝琴,等.巴戟天有效成分及其治疗肾阳虚证的研究进展[J].中华中医药杂志,2016,31(12):5165-5167.

