基于BDNF/CREB信号通路探讨藏药十一味维命胶囊的抗抑郁作用机制



摘要:目的 基于BDNF/CREB信号通路对藏药十一味维命胶囊对抑郁症小鼠的抗抑郁作用及机制进行研究。方法 将48只小鼠随机分为正常组(n=12)、造模组(n=36),造模组采用CUMS结合CRS方法造模3周。成模后,将造模组小鼠随机分为模型组、十一味维命胶囊组(藏药组)、氟西汀组,各12只,干预4周。采用行为学实验对抑郁症小鼠模型进行评估。WB法检测小鼠海马BDNF、GDNF、NGF、p-CREB/CREB、PSD-95表达;IHC法检测小鼠海马BDNF、GDNF、p-CREB MOD值。结果 造模3周后,造模组小鼠出现抑郁样行为,小鼠体质量、糖水偏好率均低于正常组(P<0.01);不动时间长于正常组(P<0.01);给药4周后,模型组小鼠体质量、糖水偏好率低于正常组(P<0.01);不动时间长于正常组(P<0.01);藏药组、氟西汀组小鼠体质量、糖水偏好率均高于模型组(P<0.05或P<0.01);不动时间均短于模型组(P<0.01)。模型组小鼠海马BDNF、GDNF、PSD-95蛋白表达及BDNF、GDNF、p-CREB MOD值均低于正常组(P<0.05或P<0.01)。藏药组、氟西汀组小鼠海马BDNF、GDNF、p-CREB/CREB、PSD-95蛋白表达均高于模型组(P<0.05或P<0.01)。藏药组小鼠BDNF、GDNF MOD值均高于模型组(P<0.05或P<0.01);氟西汀组小鼠海马BDNF、GDNF、p-CREB MOD值均高于模型组(P<0.01)。结论 十一味维命胶囊可以改善抑郁症小鼠的抑郁行为,其作用机制可能与调控BDNF/CREB信号通路有关。
关键词:抑郁症;十一味维命胶囊;BDNF/CREB信号通路;小鼠
中图分类号:R749.4+1 文献标志码:A 文章编号:1007-2349(2024)08-0061-07
抑郁症是临床上较为常见的慢性精神障碍,其常见症状主要包括持续性心境低落、快感缺失、思维迟缓及睡眠障碍等,严重者可伴有自残、自杀倾向,对人类身心健康造成严重危害[1-2]。据世界卫生组织(WHO)调查显示,全球约有3.22亿人受到了抑郁症的困扰,且发病率呈逐年上升的趋势[3]。因此,如何有效防治抑郁症是目前医学界亟待解决的问题之一。药物治疗是目前临床治疗抑郁症的主要手段,但由于抑郁症发病机制的复杂性,以及常用的抗抑郁药物存在起效慢、有效率低、不良反应多等缺陷,导致其治疗效果不佳[4]。近年来研究[5-6]显示神经可塑性障碍参与了抑郁症的发生,而通过各种方法激活脑内BDNF/CREB信号通路,有助于增强大脑神经可塑性,进而产生抗抑郁的效果[7-9]。
藏医学是祖国医学的重要组成部分,对精神类疾病具有其独特的认识及治疗手段。藏药是藏医治疗疾病的最主要手段,十一味维命胶囊是用于治疗抑郁症的有效藏成药,但究其发挥抗抑郁作用的机制尚不清楚。因此,本研究通过CUMS结合CRS的造模方法制备抑郁症小鼠模型,并通过观察十一味维命胶囊对抑郁症小鼠模型的行为学以及海马内BDNF/CREB信号通路的影响,来探讨十一味维命胶囊抗抑郁的潜在作用机制,为十一味维命胶囊的临床应用提供实验依据。
1 材料与方法
1.1 药品与试剂 十一味维命胶囊(青海久美藏药药业有限公司,批号:20200601);百优解(盐酸氟西汀胶囊)(礼来苏州有限公司,批号:21201A);BDNF、GDNF(WB)、GDNF(IHC)、NGF、CREB、p-CREB、PSD-95抗体(美国Abcam公司,货号分别为ab108319、ab176564、ab18956、ab52918、ab32515、ab32096、ab238135)。β-tubulin、羊抗兔IgG、羊抗鼠IgG抗体(美国Proteintech公司,货号分别为66240-1-Ig、SA00001-2、SA00001-1)。
1.2 仪器与设备 电泳仪系统(美国BIO-RAD公司,型号:PowerPac Basic),超声破碎仪(美国SONICS公司,型号:VCX150),全自动化学发光分析仪(上海天能有限公司,型号:5200),低温高速离心机(德国Eppendorf公司,型号:5404),病理切片机(中国上海徕卡仪器有限公司,型号:RM2016),全景切片扫描仪(匈牙利3Dhistech公司,型号:800)。
1.3 实验动物 SPF级 BALB/c小鼠48只(雄性,20±3 g),于北京维通利华实验动物技术有限公司购买(合格证号:SYXK(京)2020-0033)。实验前进行为期1周的适应性喂养。本实验经北京中医药大学实验动物伦理委员会批准,动物伦理号:BUCM-4-2021091001-3058。
1.4 造模及药物干预 于正式实验开始前期,应用糖水偏好实验剔除糖水偏好率异常的小鼠。将符合条件的48只小鼠以体质量进行随机分组:正常组(n=12)、造模组(n=36)。结合本课题组前期的抑郁症造模方法[10],经过改良后对造模组进行造模,持续3周。具体造模方法如下:(1)CRS:于每日上午9时在离心管中对小鼠进行为期6 h的束缚(离心管规格为50 mL);(2)CUMS:①昼夜颠倒;②夹尾3 min;③禁食24 h;④潮湿垫料24 h;⑤持续光照24 h;⑥笼体倾斜45°,持续24 h;⑦禁水24 h。每日采用1种CUMS应激源,每种应激源不得连续应用,且禁食与禁水不得连续应用。
造模持续3周后,通过糖水偏好实验和悬尾实验对抑郁症小鼠模型进行评估。成模后,将造模组小鼠以体质量随机分为3组:模型组(n=12)、十一味维命胶囊组(n=12)、盐酸氟西汀组(n=12)。给药剂量以动物与人体之间的等效剂量系数折算法进行计算,并应用蒸馏水进行相应浓度溶液的配制,具体灌胃剂量如下:十一味维命胶囊组小鼠应用十一味维命胶囊溶液灌胃,234.0 mg·kg-1·d-1;氟西汀组小鼠应用盐酸氟西汀溶液灌胃,5.2 mg·kg-1·d-1。正常组与模型组小鼠,每日应用等体积蒸馏水灌胃。实验小鼠的灌胃量为0.1mL·10 g-1,2次/d,于每日8时及16时给药,持续4 W。
1.5 行为学检测
1.5.1 体质量 计算造模3周末及给药4周末实验小鼠的体质量,用以评估小鼠的生长情况。
1.5.2 糖水偏好实验 计算造模3周末及给药4周末实验小鼠的糖水偏好率,糖水偏好率的上升与下降可以反映动物快感缺失的程度。进行正式的糖水偏好实验前,需要提前对全部实验小鼠进行糖水训练。首先给予小鼠两瓶蔗糖溶液(1%),持续24 h。随后给予小鼠蔗糖溶液(1%)和蒸馏水各1瓶,持续24 h。接下来将小鼠禁食禁水12 h。正式测试过程中,给予小鼠蔗糖溶液(1%)和蒸馏水各1瓶。2 h后计算各组小鼠2 h内糖水消耗量百分比。糖水消耗量百分比=[蔗糖消耗量·(蔗糖消耗量+蒸馏水消耗量)-1]×100%[11]。
1.5.3 悬尾实验 计算造模3周末和给药4周末小鼠悬尾不动时间,不动时间的延长与缩短可以反映动物的行为绝望程度[12]。将实验小鼠悬挂于观察箱顶部,使小鼠的头部自然垂直向下,持续5 min。记录后4 min内小鼠的不动时间。
1.6 免疫印迹法(western blot,WB)检测海马组织BDNF、GDNF、NGF、p-CREB/CREB、PSD-95的蛋白表达 每组选取6只小鼠进行WB检测。取小鼠海马组织,用RIPA裂解液提取总蛋白,BCA法蛋白定量。随后上样、电泳、电转以及5%脱脂牛奶封闭。封闭完成后,加入对应的一抗:BDNF(1∶1000)、GDNF(1∶1000)、NGF(1∶1000)、CREB(1∶1000)、p-CREB(1∶5000)、PSD-95(1∶1000),β-tubulin(1∶30000),放置于冰箱内以4℃孵育过夜。随后加入对应的二抗进行孵育:羊抗兔IgG(1∶10000),羊抗鼠IgG(1∶10000),以室温条件孵育1.5h。采用ECL发光法进行曝光。采用Image J软件对条带的灰度值进行分析。
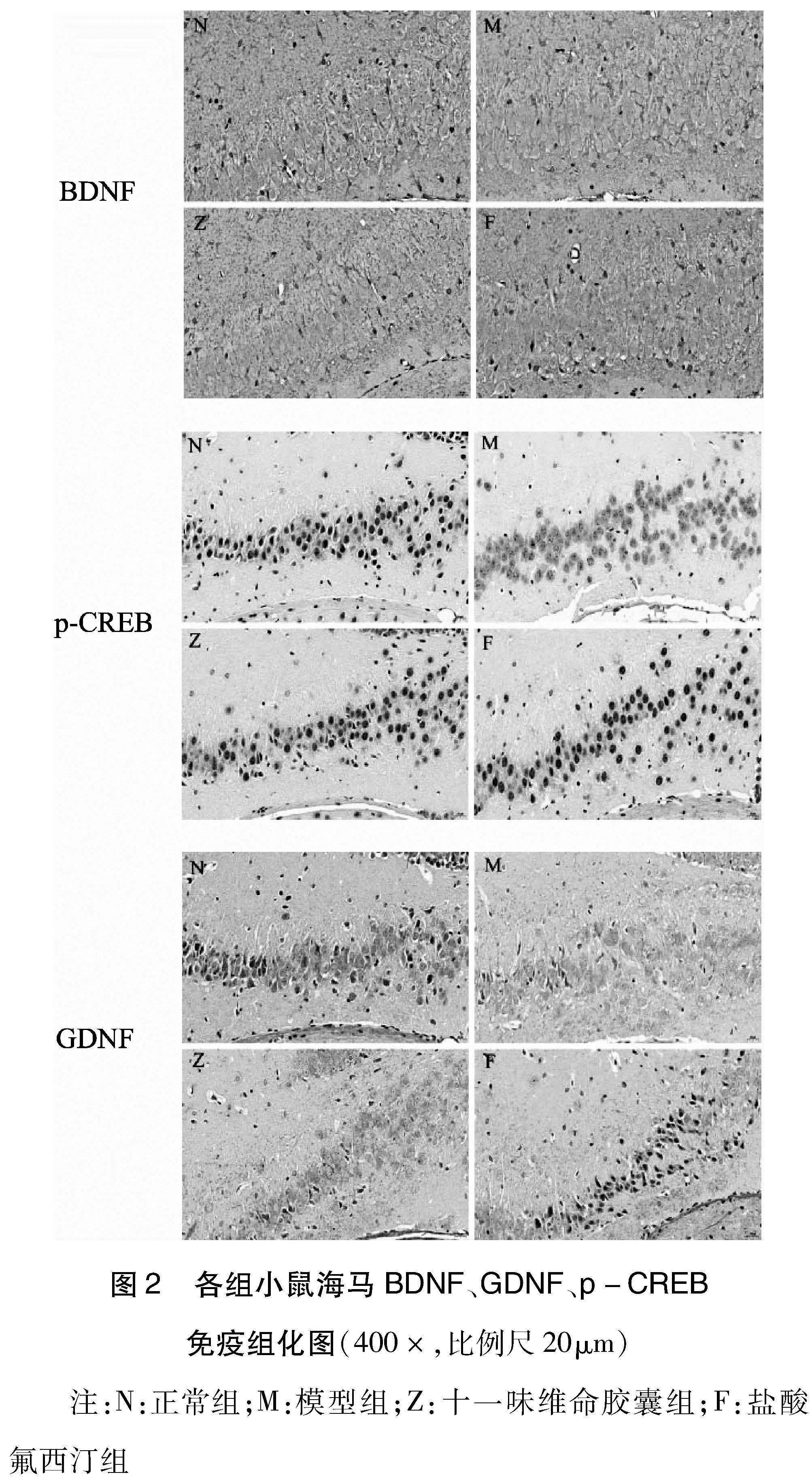
1.7 免疫组化法(Immunohistochemistry,IHC)检测海马组织BDNF、GDNF、p-CREB 的MOD值 每组选取6只小鼠进行IHC检测。将小鼠脑组织制备成石蜡切片。进行IHC检测时,对小鼠脑组织切片依次进行脱蜡至水、抗原修复、阻断内源性过氧化物酶、封闭。随后滴加对应的一抗:BDNF(1∶500)、GDNF(1∶200)、p-CREB(1∶100),以4℃孵育过夜。再滴加对应的二抗,以室温孵育30~50min。随后,DAB法染色、苏木素复染、脱水、封片,进行观察。组织出现褐色或棕褐色为阳性表达。采用Image-pro Plus 6.0软件进行分析。
1.8 统计分析 数据采用SPSS 26.0软件进行分析,计量资料以“均数±标准差”表示。当数据符合正态分布且方差齐时,2组间比较采用独立样本t检验;多组间比较采用单因素方差分析(One-Way Anova),两两比较采用LSD-t检验;不符合时,则采用非参数检验。P<0.05为差异具有统计学意义。
2 结果
2.1 模型评价 造模3周后,与正常组比较,造模组小鼠体质量、糖水偏好率均明显下降(P<0.01);造模组小鼠不动时间明显延长于正常组(P<0.01)。(见表1)
2.2 药效评价 治疗4周后,与正常组比较,模型组小鼠体质量、糖水偏好率均明显下降(P<0.01);不动时间明显延长(P<0.01)。与模型组比较,氟西汀组小鼠的体质量、糖水偏好率均明显上升(P<0.05或P<0.01);不动时间明显缩短(P<0.01)。与模型组比较,十一味维命胶囊组小鼠的体质量、糖水偏好率均明显上升(P<0.01);不动时间明显缩短(P<0.01)。(见表2)
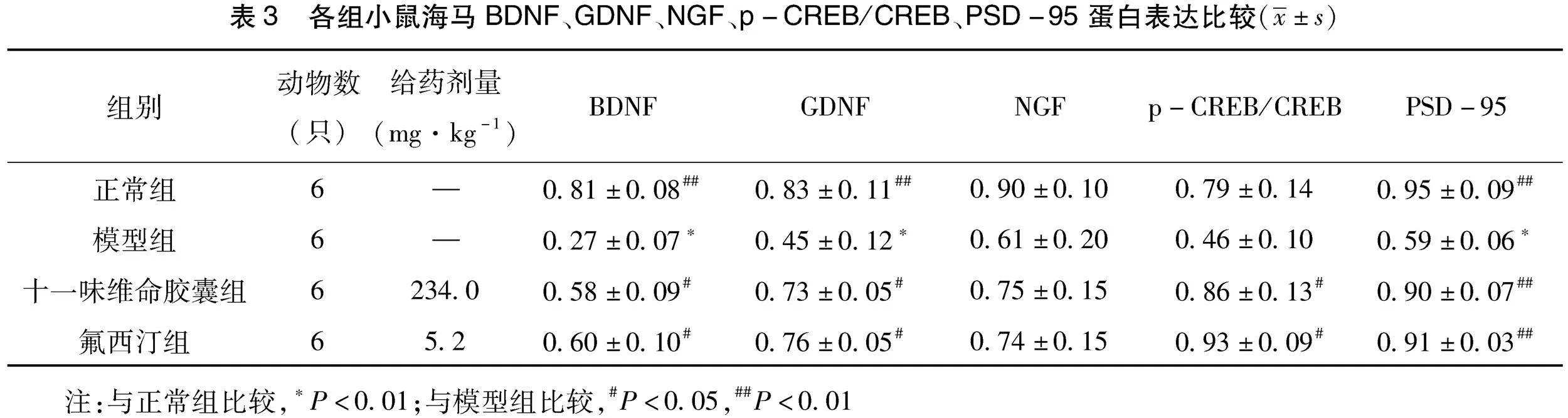
2.3 各组小鼠海马BDNF、GDNF、NGF、p-CREB/CREB、PSD-95蛋白表达比较 治疗4周后,与正常组比较,模型组小鼠海马BDNF、GDNF、PSD-95蛋白表达均明显下降(P<0.01);而NGF、p-CREB/CREB蛋白表达暂无明显统计学差异(P>0.05)。与模型组比较,盐酸氟西汀组小鼠海马BDNF、GDNF、p-CREB/CREB、PSD-95蛋白表达均明显上升(P<0.05或P<0.01);而NGF蛋白表达暂无明显统计学差异(P>0.05)。与模型组比较,十一味维命胶囊组小鼠海马BDNF、GDNF、p-CREB/CREB、PSD-95蛋白表达均明显上升(P<0.05或P<0.01);而NGF蛋白表达暂无明显统计学差异(P>0.05)。(见表3、图1)
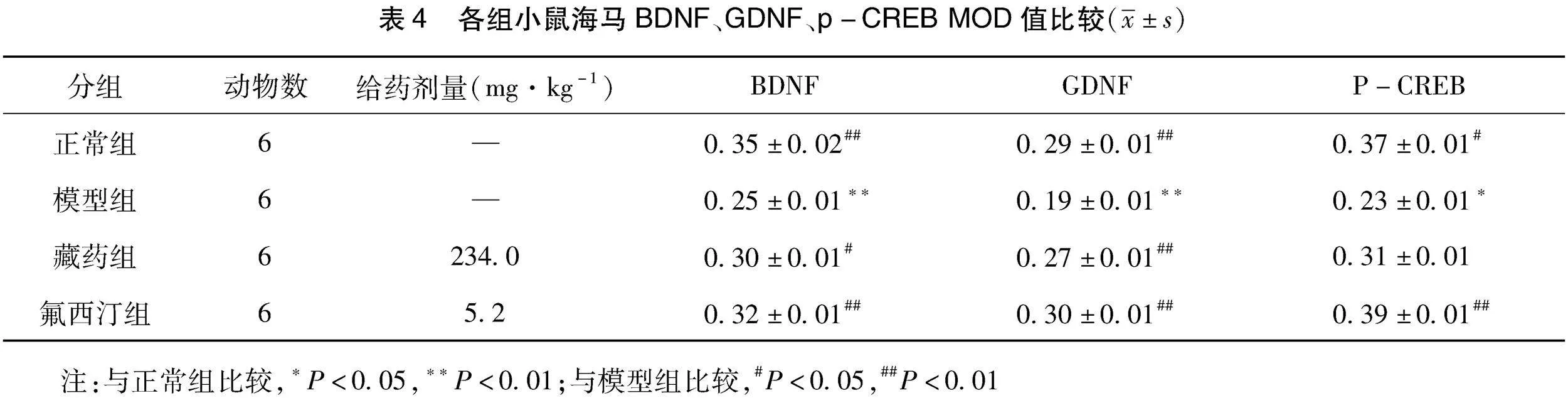
2.4 各组小鼠海马BDNF、GDNF、p-CREB MOD值比较 治疗4周后,与正常组比较,模型组小鼠海马BDNF、GDNF、p-CREB MOD值均明显下降(P<0.05或P<0.01)。与模型组比较,盐酸氟西汀组小鼠海马BDNF、GDNF、p-CREB MOD值均明显上升(P<0.01)。与模型组比较,十一味维命胶囊组小鼠海马BDNF、GDNF值均明显上升(P<0.05或P<0.01),而p-CREB暂无明显统计学差异(P>0.05)。(见表4、图2)
3 讨论
抑郁症作为一种慢性精神疾病,因其严重时会有自残或自杀的倾向,所以对人们的生命健康造成严重危害。由于目前对于抑郁症的病因及发病机制尚未完全明确,且临床常用抗抑郁药物存在多种不良反应,导致抑郁症治疗受到局限。大量研究显示,藏医药在抑郁症的治疗中具有独特优势,且安全性好、副作用少[13-14]。十一味维命胶囊是藏医临床用于抑郁症治疗的有效藏成药,包括肉豆蔻、沉香、广枣等十一味药物。通过对十一味维命胶囊药物成分进行分析发现,方中阿魏含有阿魏酸,阿魏酸能够显著上调抑郁症动物脑内BDNF、PSD-95及p-CREB的含量,增强神经可塑性[15-16];方中丁香含有丁香酚,同样具有调节BDNF的作用[17];方中广枣含有黄酮、有机酸、甾醇等,其水提液能够通过刺激星形胶质细胞分泌多种神经营养因子,GDNF作为维护神经可塑性的营养因子,主要来源于星形胶质细胞[18]。
本研究以CUMS结合CRS的方法模拟人类持续性应激所导致的抑郁症表现,诱导小鼠产生抑郁样行为。行为学结果显示:经过3周造模后,造模组小鼠体质量、糖水偏好率较正常组均明显下降,不动时间较正常组明显延长,提示抑郁症小鼠模型制备成功。经过4 W的药物干预后,两给药组的小鼠体质量、糖水偏好率较模型组均明显上升,不动时间较模型组均明显缩短。表明十一味维命胶囊对抑郁症小鼠的抑郁样行为具有显著的改善作用。
神经可塑性是指神经系统通过调节其结构、功能及连接进而对各种内外部刺激做出适应性改变的能力。据文献显示,神经可塑性障碍是导致抑郁症发生的重要原因之一[19-21]。而脑源性神经营养因子(brain derived neurotrophic factor,BDNF)、胶质细胞源性神经营养因子(Glial derived neurotrophic factor,GDNF)、神经生长因子(nerve growth factor,NGF)作为脑内重要的神经营养因子,广泛的参与了脑内神经元发育、成熟、存活及突触可塑性过程,对神经可塑性的维持具有重要支持作用[22-24]。环磷酸腺苷反应元件结合蛋白(cAMP response element binding protein,CREB)是神经可塑性以及情绪调节的关键因子[25-26]。活化后的CREB能够进一步激活下游的信号分子,参与到神经树突的形成与发育过程,并促进突触传递功能等。具体来说,CREB是BDNF发挥作用的重要调节因子,当脑内CREB高表达时,可以促进BDNF的表达,而BDNF又能够与其高亲和力受体紧密结合,进一步介导CREB的功能发挥,二者相辅相成,共同维护神经可塑性过程。突触后致密物质-95(postsynaptic density-95,PSD-95)是突触后末端重要标记物,作为突触重要的结构蛋白,参与突触后膜受体的激活及下游信号的传导[27]。实验结果显示:WB:治疗4周后,模型组小鼠海马BDNF、GDNF、PSD-95蛋白表达较正常组明显下降;NGF、p-CREB/CREB蛋白表达则暂无明显统计学差异。两给药组的小鼠海马BDNF、GDNF、p-CREB/CREB、PSD-95蛋白表达较模型组均明显上升;而NGF蛋白表达暂无明显统计学差异。IHC:治疗4周后,模型组海马BDNF、GDNF、p-CREB MOD值较正常组均明显下降。氟西汀组小鼠海马BDNF、GDNF、p-CREB MOD值较模型组均明显上升;十一味维命胶囊组小鼠海马BDNF、GDNF MOD值较模型组明显上升,p-CREB MOD值暂无明显统计学差异。上述结果提示十一味维命胶囊可以通过激活BDNF/CREB信号通路以及促进神经可塑性相关因子的分泌,发挥抗抑郁的作用。
综上所述,十一味维命胶囊具有抗抑郁作用,其机制可能与调控BDNF/CREB信号通路,增强神经可塑性密切相关。本研究为十一味维命胶囊的临床应用提供了实验依据。
参考文献:
[1]Howard DM,Adams MJ,Clarke TK,et al.Genome-wide meta-analysis of depression identifies 102 independent variants and highlights the importance of the prefrontal brain regions[J].Nat Neurosci,2019,22:343-352.
[2]Kim GM,Kim J,Hyun MK,et al.Comparison of the risk factors of Korean adolescent suicide residing in high suicidal regions versus those in low suicidal regions[J].Psychiatr Danub,2019,31:397-404.
[3]WHO.Depression and Other Common Mental Disorders:Global Health Estimates(2017)[EB/OL].(2023-3-12)https://www.afro.who.int/publications/depression-and-other-common-mental-disorders-global-health-estimates-2017.
[4]张自珍.21种抗抑郁药物治疗成人单相抑郁短期不良反应发生率的网状Meta分析[D].泸州:西南医科大学,2022.
[5]Price RB,Duman R.Neuroplasticity in cognitive and psychological mechanisms of depression:an integrative model[J].Mol Psychiatry,2020,25:530-543.
[6]Qin ZS,Shi DD,Li WQ,et al.Berberine ameliorates depression-like behaviors in mice via inhibiting NLRP3 inflammasome-mediated neuroinflammation and preventing neuroplasticity disruption[J].J Neuroinflammation,2023,20(1):54.
[7]赖克道,李冬梅,韦桂宁,等.基于CREB/BDNF通路探讨鸡血藤总黄酮对抑郁大鼠海马神经可塑性的影响[J].中国实验方剂学杂志,2022,28(5):55-61.
[8]王鑫鑫,赵杰,冯振宇,等.温阳解郁汤对皮质酮诱导的抑郁大鼠海马神经可塑性的影响[J].中国实验方剂学杂志,2022,28(2):93-103.
[9]Li X,Zhao J,Li ZG,et al.Applications of Acupuncture Therapy in Modulating the Plasticity of Neurodegenerative Disease and Depression:Do MicroRNA and Neurotrophin BDNF Shed Light on the Underlying Mechanism?[J].Neural Plast,2020,2020:8850653.
[10]约日古丽·麦海提,任小巧,范佳佳,等.基于慢性轻度不可预知性温和型应激的C57BL/6N小鼠抑郁模型的建立与评价[J].世界中医药,2022,17(13):1895-1901.
[11]Liu MY,Yin CY,Zhu LJ,et al.Sucrose preference test for measurement of stress-induced anhedonia in mice[J].Nat Protoc,2018,13(7):1686-1698.
[12]Steru L,Chermat R,Thierry B,et al.The tail suspension test:A new method for screening antidepressants in mice[J].Psychopharmacology(Berl),1985,85(3):367-370.
[13]华太.观察藏医霍尔麦疗法治疗产后抑郁症的疗效[J].中西医结合心血管病电子杂志,2018,6(36):188.
[14]拉毛措.藏医湖尔疗法治疗产后抑郁症的疗效研究[J].中西医结合心血管病电子杂志,2019,7(16):160.
[15]王文恺,张蔚,孙悦,等.当归补血汤及其主要活性成分阿魏酸对糖尿病抑郁症模型大鼠的影响及机制研究[J].中药新药与临床药理,2020,31(6):649-654.
[16]Liu YM,Hu CY,Shen JD,et al.Elevation of synaptic protein is associated with the antidepressant-like effects of ferulic acid in a chronic model of depression[J].Physiology &Behavior,2017,169:184-188.
[17]胡泓博,夏传余,李光武.丁香酚吸嗅对MCAO模型大鼠脑源性神经营养因子的影响[J].中风与神经疾病杂志,2015,32(1):28-32.
[18]郭华,姚文兵,王华,等.广枣及其提取组分对神经细胞的保护作用[J].中国生化药物杂志,2007,2:87-90.
[19]Rdulescu I,Drgoi AM,Trifu SC,et al.Neuroplasticity and depression:Rewiring the brains networks through pharmacological therapy(Review)[J].Exp Ther Med,2021,22(4):1131.
[20]Artin H,Zisook S,Ramanathan D.How do serotonergic psychedelics treat depression:The potential role of neuroplasticity[J].World J Psychiatry,2021,11:201-214.
[21]Bourin M.Neurogenesis and Neuroplasticity in Major Depression:Its Therapeutic Implication[J].Adv Exp Med Biol,2021,1305:157-173.
[22]Levy MJF,Boulle F,Steinbusch HW,et al.Neurotrophic factors and neuroplasticity pathways in the pathophysiology and treatment of depression[J].Psychopharmacology(Berl),2018,235:2195-2220.
[23]Chakrapani S,Eskander N,De Los Santos LA,et al.Neuroplasticity and the Biological Role of Brain Derived Neurotrophic Factor in the Pathophysiology and Management of Depression[J].Cureus,2020,12:e11396.
[24]Yang T,Nie Z,Shu HF,et al.The Role of BDNF on Neural Plasticity in Depression[J].Frontiers in Cellular Neuroscience,2020,14:82.
[25]Shen J,Yang L,Wei WS.Dl-3-n-butylphthalide prevents chronic restraint stress-induced depression-like behaviors and cognitive impairment via regulating CaMKII/CREB/BDNF signaling pathway in hippocampus[J].Neuroreport,2022,33:597-603.
[26]Zhang K,Liu R,Zhang JR,et al.Electroacupuncture Ameliorates Depression-Like Behaviour in Rats by Enhancing Synaptic Plasticity via the GluN2B/CaMKII/CREB Signalling Pathway[J].Evid Based Complement Alternat Med,2021,2021:2146001.
[27]王雪岩,郭易楠,阴赪宏.PSD-95的生物学功能与应用研究进展[J].临床和实验医学杂志,2018,17(18):2015-2017.

