乌梅丸加减治疗帕金森病的Meta分析及GRADE评价



摘要:目的 系统评估乌梅丸加减治疗帕金森病(parkinsons disease,PD)的疗效和安全性。方法 计算机检索Cochrane Library、EMBASE、Web of Science、PubMed、CNKI、CBM等中英文数据库及临床试验中心,关于乌梅丸治疗PD的临床随机对照试验(randomized controlled trial,RCT),检索时限从建库至2023年4月。进行资料整理及数据提取等工作后,最终纳入8项研究,治疗组(乌梅丸)和对照组分别纳入226例。使用RevMan 5.3及stata14软件进行荟萃分析,使用GRADEpro GDT评估各项结局指标的证据质量。结果 治疗组降低PD统一评分量表(unified Parkinson's disease rating scale,UPDRS)的各项量表积分较对照组明显,其中在改善UPDRS I、III、IV方面具有统计学意义,结果分别为[MD=-0.769,95%CI(-1.213~-0.324),P=0.001]、[MD=-2.211,95%CI(-2.713~-1.708),P=0]、[MD=-0.526,95%CI(-1.041~-0.012),P=0.045]。2组在改善UPDRS总分方面差异无统计学意义[MD=3.964,95%CI(-9.465~17.392),P=0.563]。治疗组能显著提高治疗有效率,差异具有统计学意义[RR=1.709,95%CI(1.361~2.145),P=0]。各项研究均未发现不良事件发生及与治疗有关的检验指标异常。GRADE证据质量分级结果为UPDRS I、UPDRS III、UPDRS IV及有效率方面均为中等级别,UPDRS II为低等级,UPDRS总分为非常低。结论 乌梅丸加减的应用对PD的治疗有一定效果,且具有良好的安全性。
关键词:乌梅丸;帕金森病;Meta分析;GRADE评价
中图分类号:R743 文献标志码:A 文章编号:1007-2349(2024)08-0024-09
帕金森病(parkinson's disease,PD)是全球常见的神经退行性疾病,其典型特点是多巴胺(dopamine,DA)神经元的丢失和路易体(lewy body,LB)的形成[1]。PD的临床表现包括运动症状(震颤、强直、运动迟缓和姿势不稳等)和非运动症状(嗅觉丧失、便秘、睡眠障碍、痴呆和抑郁),该疾病的复杂性和长疗程给患者和家属带来极大痛苦[2]。调查显示,在过去的十几年里,全世界受帕金森病和痴呆症困扰的绝对人数增加了一倍多,与1990年相比,2019年PD对整个社会经济及健康压力排名从第14位上升到第10位,PD负担在70~84岁人群中达到顶峰,且60岁以后,PD的发病率与年龄增长呈正比[3-4]。根据我国PD及运动障碍学组制定的治疗指南,药物治疗是主要且有效的手段,复方左旋多巴、抗胆碱能药物、金刚烷胺等在早期效果较显著,但效果会随着使用时间的延长而降低,且随着病程的逐渐进展,用药剂量增加,副作用和并发症也随之显现。
PD在祖国传统医学方面属“颤症”范畴,从其以肢体震颤为主的临床表现来看,辨病脏在肝,在经为厥阴。乌梅丸是仲景之方,具有安蛔止痛,温脏补虚之功。清代柯琴又认为“乌梅丸为厥阴主方”,用乌梅丸治疗颤症可收“敛肝熄风,养血濡筋”之效,根据患者“主症之异,阴阳之别”,随症加减后可以更好调节患者的焦虑、失眠、疼痛等非运动症状[5]。现已有多项临床研究围绕乌梅丸及其加减用药的方剂进行观察讨论,其治疗PD的疗效也比较确切,但尚缺乏系统整理评估。故本文将通过检索各大数据库,收集已发表的相关RCT进行Meta分析,客观评价该方在PD患者中的临床效果,以期提供更多的医学实践证据。
1 方法
1.1 纳入与排除标准
1.1.1 纳入标准 (1)研究类型:PD患者应用乌梅丸加减单药或联合治疗对比其他治疗的研究。(2)研究设计:RCT。(3)研究对象:符合明确的PD诊断标准的患者,其他条件不做设定。(4)干预措施:治疗组予乌梅丸加减单药或联合治疗,对照组予其他药物或物理治疗或安慰剂。乌梅丸方药组成参考中国中医药出版社出版的《方剂学》(第九版)。(5)结局指标中有以下其一项:①主要指标:UPDRS(包括 UPDRS-I、UPDRS-II、UPDRS-III、UPDRS-IV及总分)。②疗效指标:有效人数及有效率。③安全性指标:不良事件发生或检验指标异常。
1.1.2 排除标准 (1)动物试验、综述或重复登载的研究、会议论文。(2)文献为非RCT研究。(3)无法获取全文的文献。(4)数据不完整或错误,无法进行数据合并的文献。(5)试验设计不严谨,统计方法不恰当;
1.2 信息来源 检索包括Cochrane Library、EMBASE、Web of Science、PubMed、中国知网数据库(CNKI)、中国科技期刊数据库(VIP)、万方数据库和中国生物医学文献数据库(CBM)等中英文数据库及临床试验中心,检索时限设定:起始时间不限制,截止时间为2023年4月。
1.3 检索策略 检索时将主题词与自由词相结合。由于不同数据库的检索要求不一致,检索词有部分增减。中文检索词:PD、乌梅丸、随机对照试验等。英文检索词:Parkinsons disease、wumei pills、randomized controlled trial、randomized、Placebo、RCT等。(完整检索词和检索式见补充材料)
1.4 文献筛选、资料整理、数据提取
1.4.1 文献筛选 2位研究者阅读文献的题目及摘要后剔除研究内容不符合研究,对余下文献全文阅读后进一步筛选,除去研究内容相同的文章,若在筛查过程中产生异议则交由第三人最终判决。资料整理及数据提取工作也由2位研究者同时进行。
1.4.2 资料整理 资料提取表内容包括作者姓名、登载时间、样本量、随机方法、观察时间、干预手段(用法用量)、治疗症型、文献质量的评价指标、结局指标等。
1.4.3 数据提取 连续型变量的结局指标搜集治疗前后治疗组及对照组的均值、标准差以及样本量。二分类变量的结局指标结果分别搜集2组治疗后有效人数(包括稍进步+进步+明显进步)和总样本量。若文中未直接提供以上资料者,根据所使用软件结合相关公式进行计算。全部工作结束后再次进行验核,以避免错误和遗漏。
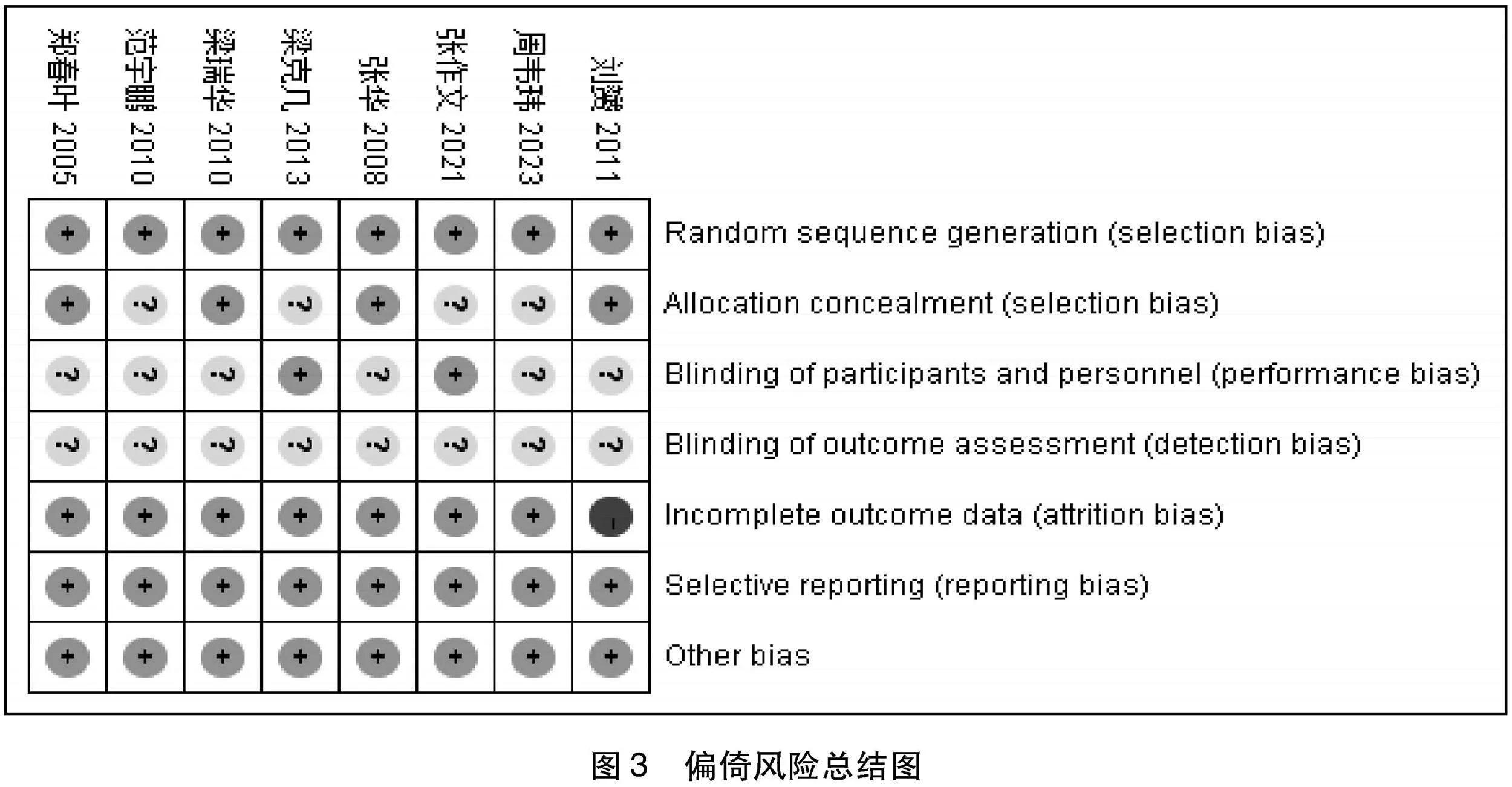
1.5 文献质量评价 按Cochrane系统评价手册风险偏倚评估工具对纳入的文献进行质量评价。评价内容包括:随机分配方法、分配方案隐藏、研究人员和受试者盲法、结果评估者盲法、结局资料的完整性、选择性报告研究结果、其他偏倚来源。每一项按照低风险(low risk)、不清楚(unclear risk)和高风险(high risk)三个等级进行评价。运用RevMan 5.3制作偏倚风险图。
1.6 统计学方法 采用stata14进行Meta分析。从原始研究中提取文献基本信息及数据后导入软件进行合并和换算。对于二分类变量,计算出2组的无效人数,先使用固定效应模型(Fixed,M-H)合并,效应量选用相对危险度(RR值),统计后I2作为评估异质性检验的标准,若I2≤50%,继续选择固定效应模型进行分析,绘制漏斗图查询偏倚,若有偏倚时可进行剪补法;若I2>50%时,则改用随机效应模型(Randomed,M-H)合并效应量,可制作拉贝图和星状图进一步考察异质性的大小,必要时进行敏感性分析、Meta回归和亚组分析查找异质性影响因素。对于连续性变量,先考察治疗前基线期是否一致,以保证结果的准确有效性。若所有原始研究的效应量数据的单位一致时,可以选用加权均值差(WMD);若参与分析的原始研究的效应量数据单位和测量方法不一致,或者均数之间的差异太大时,则使用标准化均数差(SMD)作为效应量,以排除测量单位和方差的差异,效应模型的选用及后续分析方法同上。[JP2]统计结果中若P<0.05,则否定原假设,表示两者差异有显著意义,反之。各效应量均以95%作为置信区间(95%CI)。
2 结果
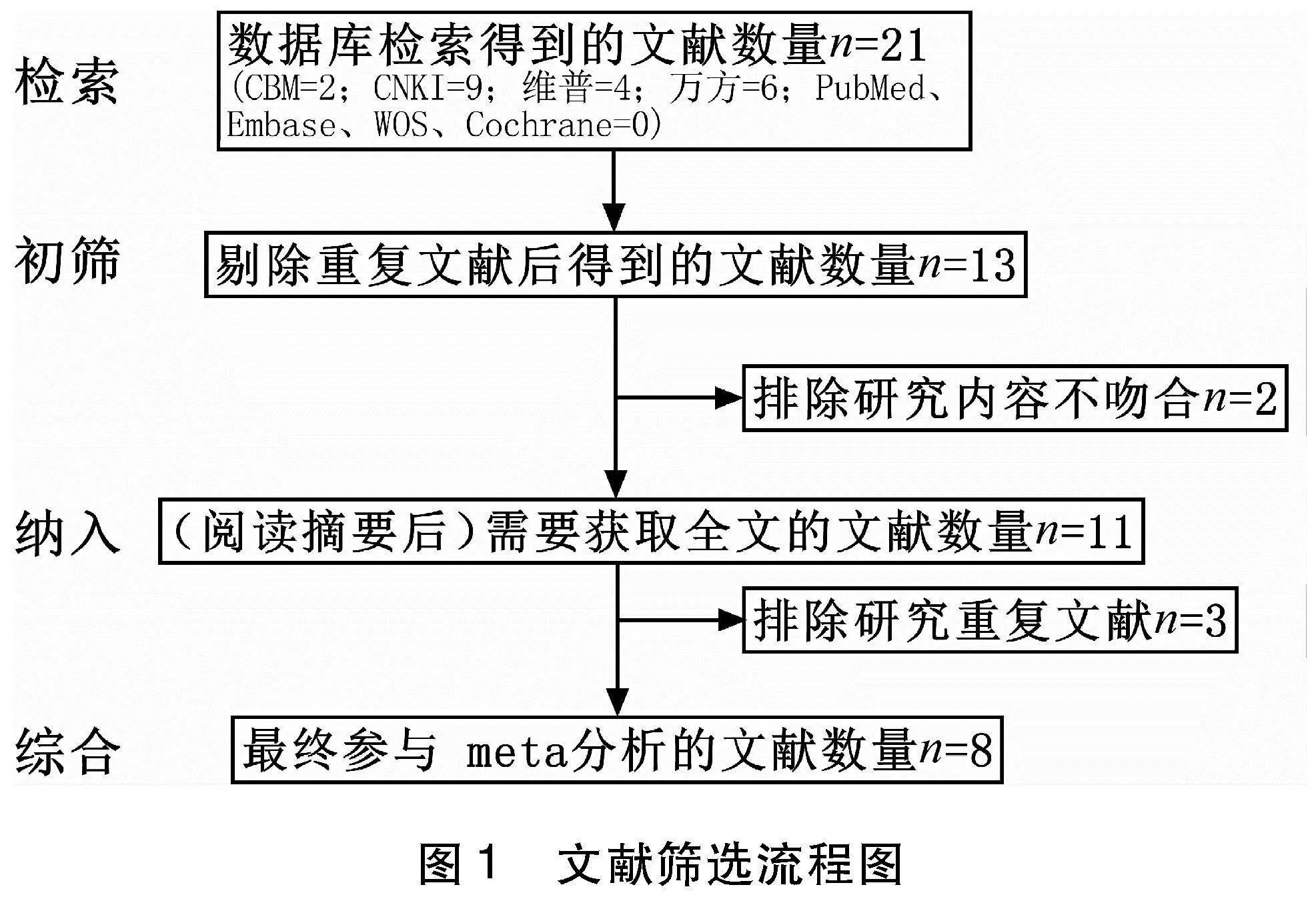
2.1 筛选结果 数据库检索出21篇文献,均为中文文献,剔重后剩余文献13篇,进一步阅读和筛除,结局入选中文文献8篇(具体筛选流程见图1)。
2.2 纳入文献特征 共纳入8项研究[6-13],皆为中文文献,合计452例患者,其中,治疗组纳入226例,对照组纳入226例(见表1)。
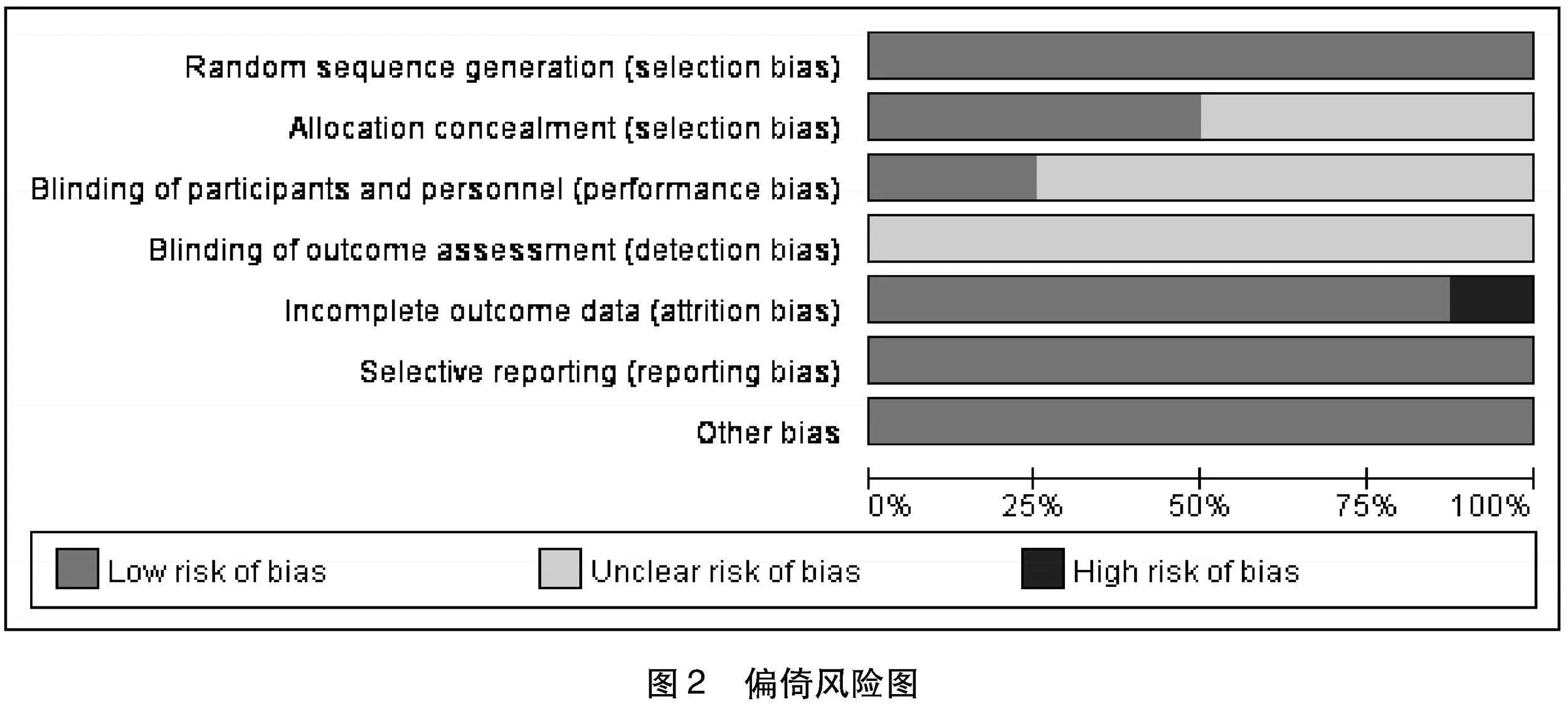
2.3 纳入文献质量 所有纳入研究均依照Cochrane风险偏倚工具进行文献质量评价,使用RevMan 5.3绘制(见图2、图3)。
2.4 Meta分析结果
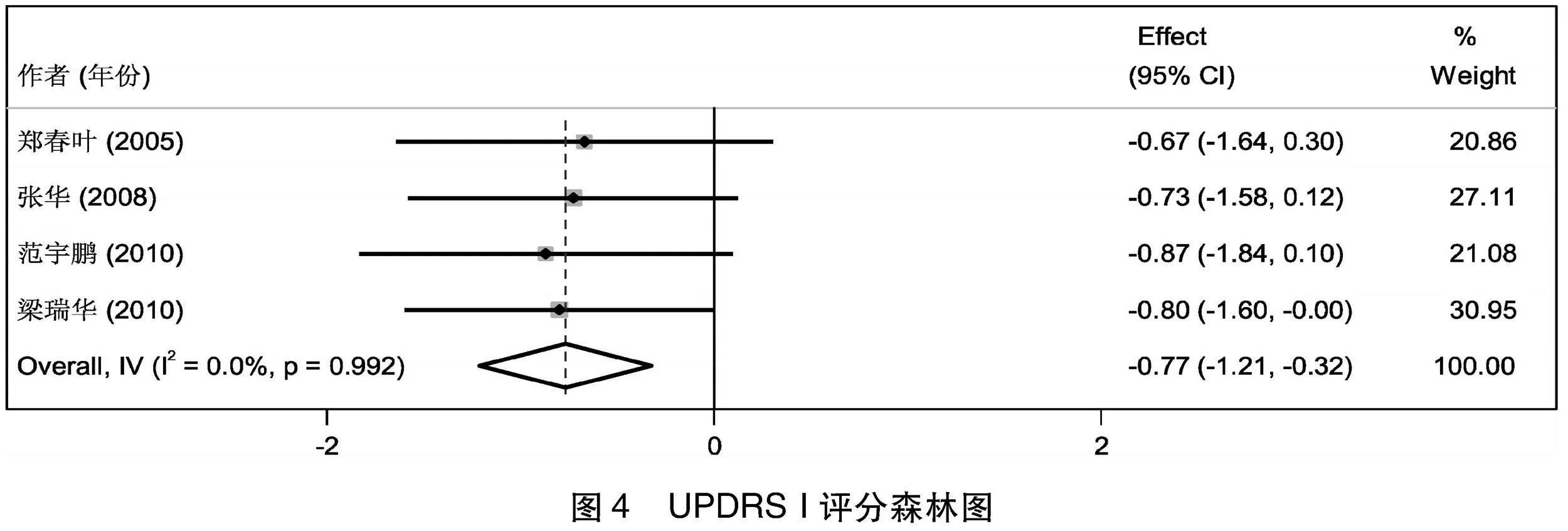
2.4.1 UPDRS I评分比较 4项[6-9]研究总结了治疗前后患者UPDRS I积分的变化情况,使用stata14进行基线期一致性检验,发现基线期2组的积分无差异(I2=0%,Z=0.018,P=0.985>0.05),可以进行后续Meta分析。将4篇文献进行异质性检验,得出I2=0%,Q检验的P=0.992>0.1,提示本次选择的文献之间不存在异质性,可以选择固定效应合并效应量,Meta合并后的效应量为-0.769,95%CI(-1.213~-0.324),且效应量显著(Z=-3.392,P=0.001<0.05),故治疗组治疗后的UPDRS I积分比对照组低0.769,2组差别有显著意义(见图4)。
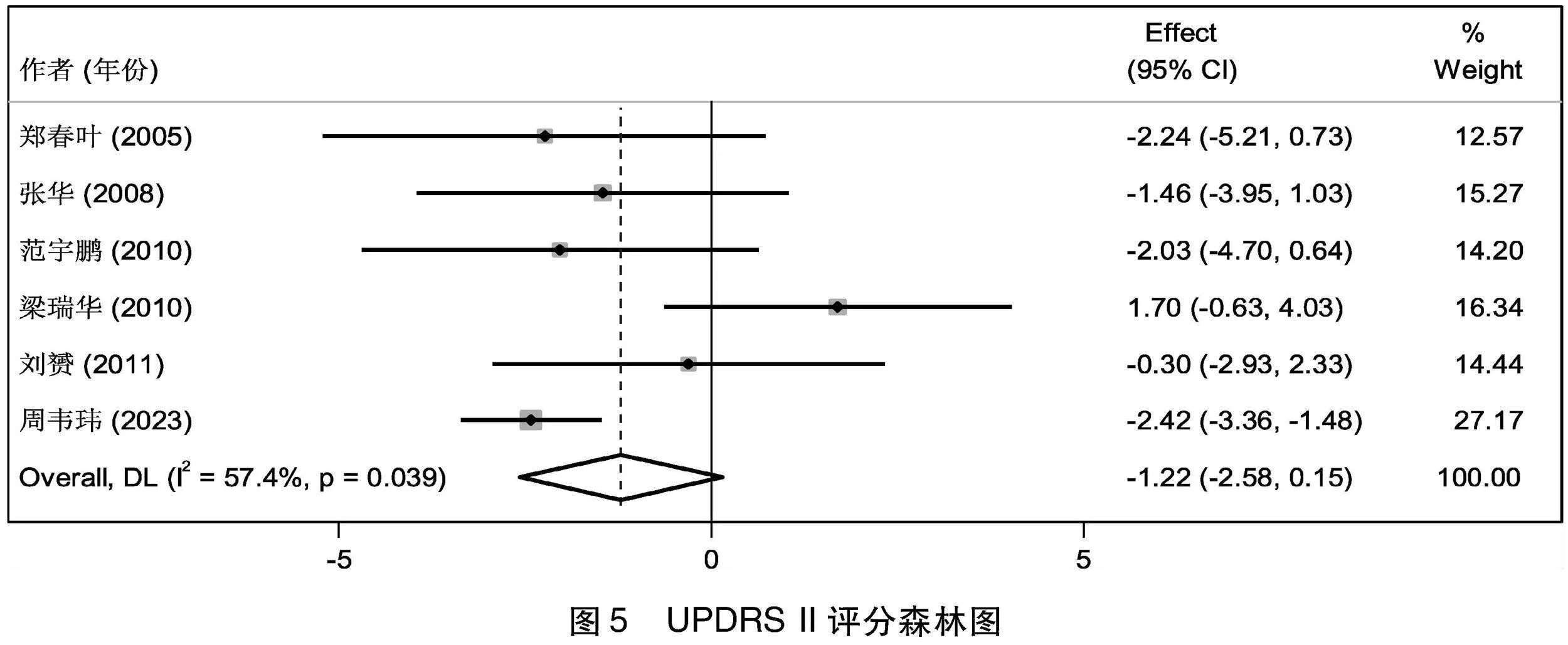
2.4.2 UPDRS II评分比较 6项[6-10,13]研究总结了治疗前后患者UPDRS II评分的变化情况,使用软件进行基线期一致性检验,提示2组治疗前的UPDRS II评分的基线期效应量无差异(I2=0%,Z=-0.293,P=0.770>0.05),即基线期2组的UPDRS II积分无差异,可以进行后续Meta分析。将本次研究的6篇文献,经过异质性检验,I2=57.4%>50%,Q检验的P=0.039<0.1,提示本次选择的文献之间存在中等异质性,可以选择随机效应进行Meta分析,Meta合并后的效应量为-1.216,95%CI(-2.580~0.148),且效应量不显著(Z=-1.747,P=0.081>0.05),即治疗组治疗后的UPDRS II积分比对照组低1.216,但差别无统计学意义(见图5)。
2.4.3 UPDRS III评分比较 6项[6-10,13]研究总结了治疗前后患者UPDRS III评分的变化情况,使用软件进行基线期一致性检验,提示2组治疗前的UPDRS III评分的基线期效应量无差异(I2=0%,Z=-0.147,P=0.883>0.05),即基线期2组的UPDRS III积分无差异,可以进行后续Meta分析。6篇文献经过异质性检验,I2=0%,Q检验的P=0.438>0.1,提示本次选择的文献之间异质性不具有统计学意义,选择固定效应合并效应量,Meta合并后的效应量为-2.211,95%CI(-2.713~-1.708),且效应量显著(Z=-8.626,P=0<0.05),治疗组治疗后的UPDRS III积分比对照组低2.211,2组差别有显著意义(见图6)。
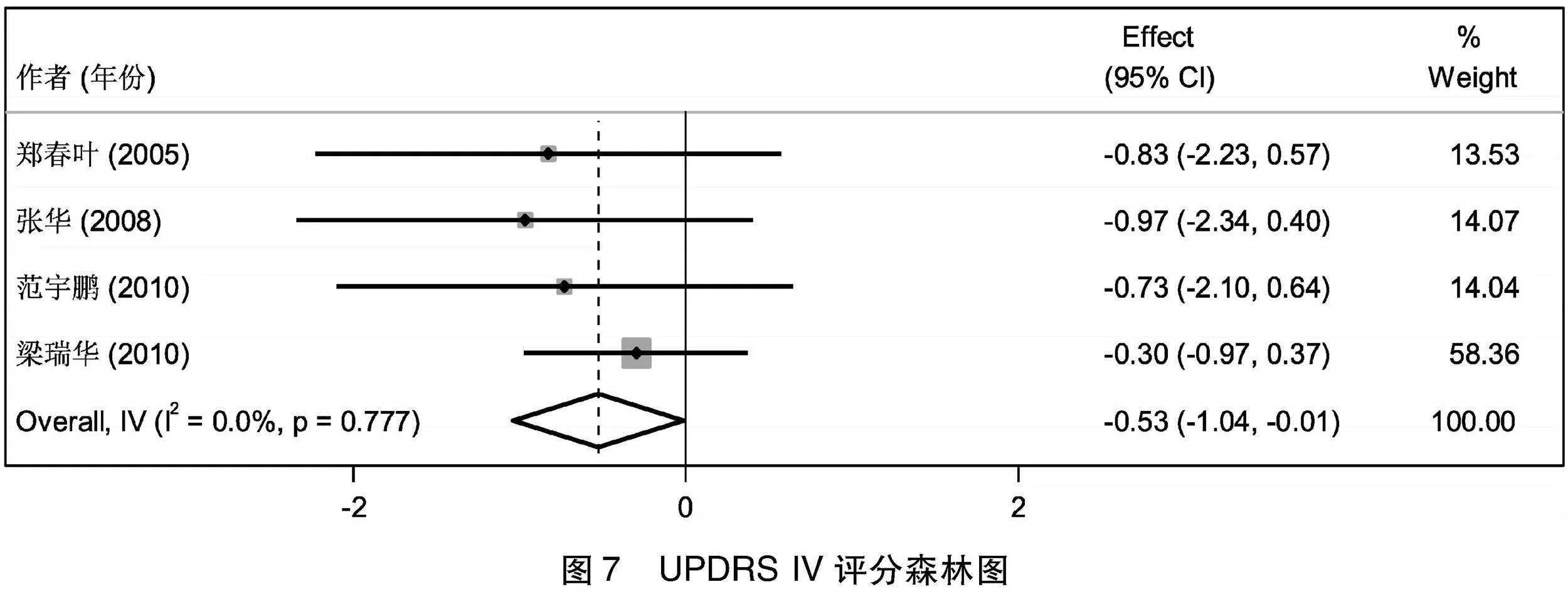
2.4.4 UPDRS IV评分比较 4项[6-9]研究总结了治疗前后患者UPDRS IV评分的变化情况,先进行基线期一致性检验,提示2组治疗前的UPDRS IV评分的基线期效应量无差异(I2=6.4%,Z=-0.982,P=0.326>0.05),即基线期2组的UPDRS IV积分无差异,可以进行后续Meta分析。4篇文献经过异质性检验,I2=0%,Q检验的P=0.777>0.1,提示本次选择的文献之间不存在异质性,选择固定效应合并后,Meta合并后的效应量为-0.526,95%CI(-1.041~-0.012),且效应量显著(Z=-2.006,P=0.045<0.05),治疗组治疗后的UPDRS IV积分比对照组低0.526,2组差别有显著意义(见图7)。
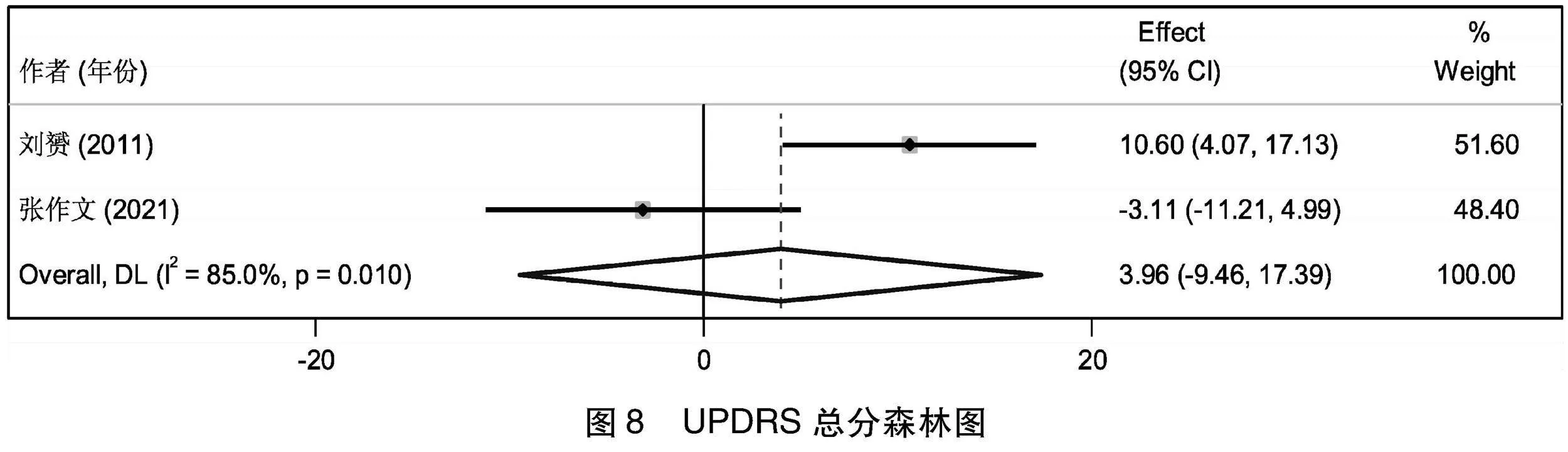
2.4.5 UPDRS总分比较 2项[10,12]研究总结了治疗前后患者UPDRS总分的变化情况,先进行基线期一致性检验,提示2组治疗前的UPDRS总分的基线期效应量无差异(I2=0%,Z=-0.452,P=0.651>0.05),即基线期2组的UPDRS总分无差异,可以进行后续Meta分析。2篇文献经过异质性检验,I2=85%>50%,Q检验的P=0.01<0.1,提示本次选择的文献之间存在高度异质性,选择随机效应合并后,Meta合并后的效应量为3.964,95%CI(-9.465~17.392),且效应量不显著(Z=0.579,P=0.563>0.05),治疗组治疗后的UPDRS总分积分比对照组高3.964,2组差别无统计学意义(见图8)。
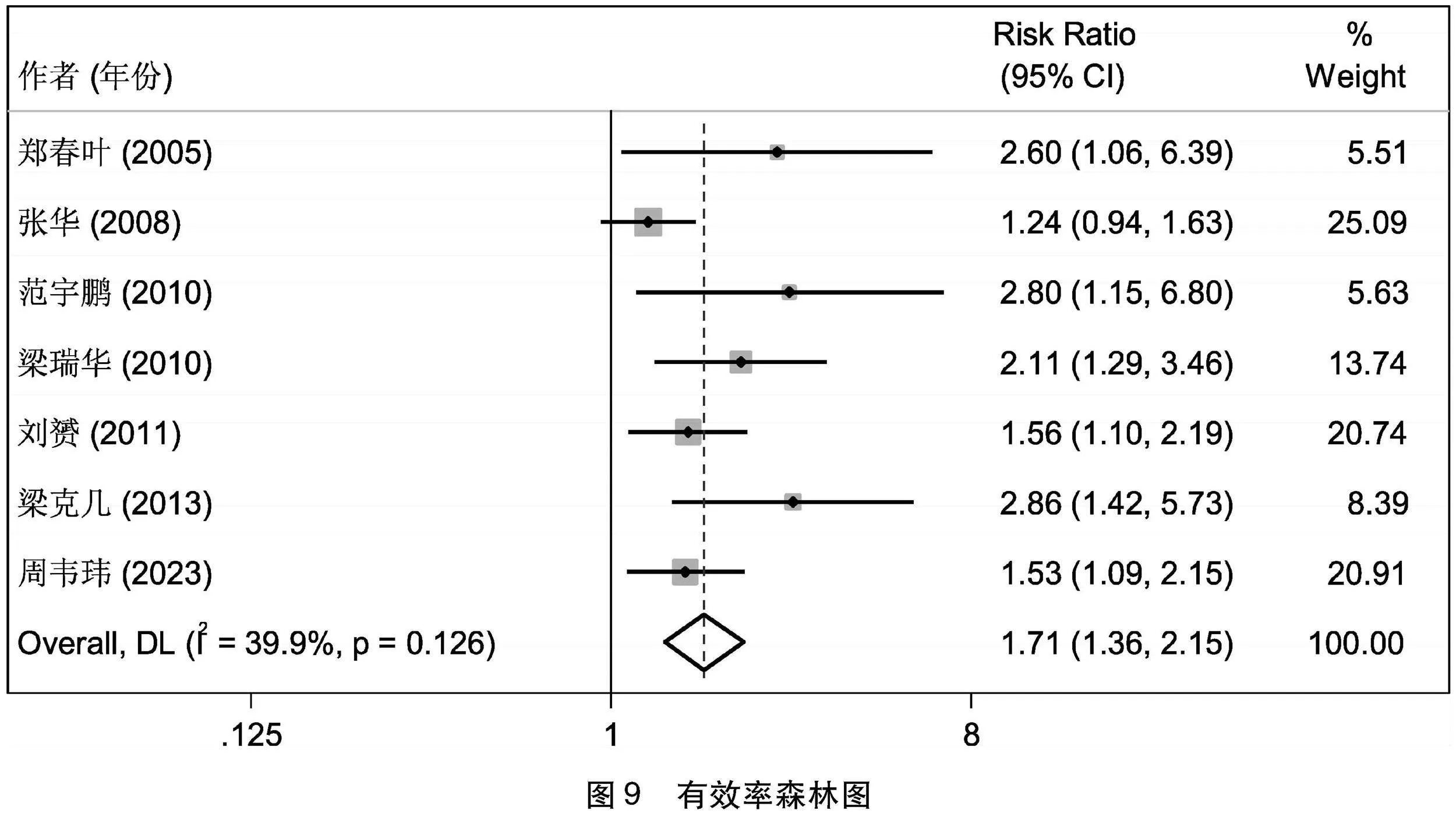
2.4.6 有效率比较 7篇[6-11,13]文献总结了治疗组和对照组的治疗有效人数和有效率,经过异质性检验I2=50.8%>50%,且Q检验的P=0.058<0.1,提示本次研究选择的文献之间有中度的异质性,进一步考察拉贝图和星状图,未发现对异质性影响很大的文献,可以使用随机效应合并效应量。选择随机效应合并RR,提示I2=39.9,Q检验的P=0.126>0.1,最终得出RR=1.709(1.361~2.145),意味着治疗组的有效率明显高于对照组,且具有统计学意义(Z=4.619,P=0<0.05),治疗组和对照组具有显著差异,提示乌梅丸加减可以有效提高PD的疗效(见图9)。
2.4.7 安全性指标 4篇[6-9,10]研究中,均未报道与治疗措施直接相关的不良事件或检验指标异常,表明本次评价中所采取的治疗方案具有较高的安全性。
2.4.8 敏感性分析 为了验证本次Meta分析中各项结果的稳健性,使用Stata14分别对各项UPDRS评分和有效率的相关文献进行敏感性分析,均未发现对数据造成很大影响的研究,因此各项结果稳定可靠。
2.4.9 发表偏倚检验 本次Meta分析中各项研究所纳入文献均不足10篇,进行偏倚检验意义不大,故不做进一步估算。
2.5 证据质量评价 使用GRADEpro GDT系统评估各项结局指标的证据质量,无重大缺陷的RCT预设为GRADE中的最高证据级别。根据5项降级因素和3项升级因素对证据进行质量评价和处理。结果提示,证据质量在UPDRS I、UPDRS III、UPDRS IV及有效率方面均为中等,其余指标质量偏低(见表2)。
3 讨论
PD作为一种慢性进行性疾病,目前还没有任何根治手段,对患者和护理人员都造成极大心理和生活负担。据报道,2019年PD的伤残调整寿命年(disability-adjusted life-years,DALYs)明显增加,全年龄段DALYs增加128.86%,且在70~84岁老年人中,男性超过女性。值得注意的是,年龄标准化患病率与社会人口指数(socio-demographic index,SDI)呈中度正相关,而年龄标准化DALY率与SDI呈弱负相关[4]。此外,它还形成巨大的社会压力,并带来重要的经济影响[14]。除了形成良好的生活习惯,我们没有其他有效预防措施,因此,早期诊断,早期治疗是延缓疾病进展的关键。
据目前了解,PD是由纹状体黑质变性(striatonigral degeneration,SND)和纹状体中DA水平降低引起,且其他神经递质和神经调节剂也受到影响。左旋-3,4-二羟基-苯丙氨酸(L-3,4-dihydroxy-phenylalanine,L-DOPA)是DA的代谢前体,与外周脱羧酶抑制剂卡比多巴或苄丝肼的组合,仍然是主要的治疗药物药物,通常在运动症状方面有显著改善[15-16]。但是,尽管左旋多巴具有显着缓解帕金森病症状的能力,是帕金森病治疗的“金标准”,但在进展期帕金森病中却伴随着副作用,大约80%接受治疗的帕金森病患者在疾病晚期会出现左旋多巴诱发的运动障碍(levodopa-induced dyskinesia,LID)[17]。不仅如此,复方左旋多巴的不良反应还表现在精神方面,Zhu Lei等人发现大剂量美多巴可引起不安腿综合征(restless leg syndrome,RLS)样症状,并伴有焦虑、抑郁、失眠等心理健康症状,当逐渐减少美多巴的剂量,并给予小剂量的长效DA制剂,症状大大缓解[18]。
中医药在缓解疾病进展和副作用方面有积极成效,已有多种草药应用于神经系统疾病[19]。多项研究概括和揭示了抗PD中药的现代药理机制[20]。乌梅丸作为传统中药制剂,由乌梅、细辛、桂枝、黄连、黄柏、当归、干姜等十味中药构成,辨证运用于临床上多种病症。该方以乌梅为君药,具有益气养阴,敛肺涩肠,生津驱蛔的功效。乌梅总黄酮(fructus mume total flavone,FMF)是乌梅的天然提取物,多项[21-22]实验表明FMF通过作用于细胞线粒体,调节其自噬功能,对PD模型大鼠起防治作用。当归具有活血补血、调经止痛、温通经脉的疗效,Li Huan等[23]总结了当归的抗炎和免疫调节作用以及对神经退行性疾病模型的保护作用,阐明了远志、当归和龙眼的20%乙醇提取物(WIN-1001X)可以有效缓解化学毒素引起的PD小鼠症状。人参在传统中药中占有非常重要的地位,具有大补元气,健脾益肺的功效,人参皂苷Rd(ginsenoside Rd)是人参的提取物,具有抗炎、抗氧化、抗凋亡、抑制Ca2+流入和保护线粒体的作用,可以抑制兴奋性毒性,调节神经生长因子,促进神经再生,是一种很有前途的天然神经保护剂[24]。人参皂甙Rg3(ginsenoside Rg3)还可以改善了鱼藤酮诱导的PD小鼠的运动功能[25]。黄柏清热燥湿、泻火解毒,它的提取物可有效抑制小胶质细胞产生和释放炎性细胞因子及一氧化氮,因此可能成为治疗PD、阿兹海默症(alzheimers disease)等脑神经退行性疾病的抗炎候选药物。
本次的Meta分析纳入了8项国内RCT研究,客观对比乌梅丸加减与常规药物治疗PD在改善有效率和UPDRS评分方面的差异。荟萃分析及GRADE评价结果均显示,治疗组在降低PD患者精神、行为和情绪、运动及并发症方面较对照组有明显优势,在改善日常生活及UPDRS总分方面与对照组相比无显著意义。在UPDRS总分的分析中,治疗组的积分较对照组偏高,考虑与其基线期过高及纳入文献量过少有关。其次,治疗组能显著提高有效率,治疗效果更明显,且具有良好的安全性。
本研究存在一定局限性:(1)纳入的RCT都是国内的研究,病例数不多,文献质量参差不齐,部分研究的优势没有统计学意义。(2)部分研究未提及分配方案隐藏、盲法及存在数据脱落,证据等级低,可能导致选择偏倚。(3)研究对象均为中老年患者,本次结果对其他年龄段可能缺乏适应性。(4)由于研究数目较少,结局指标局限,数据缺乏,无法按照年龄、性别、用药剂量等要素进一步分组讨论,研究结果有待进一步完善。
综合上述,乌梅丸加减具有良好的临床效果和安全性,对于使用西药治疗疗效欠满意的患者,可在疗程中经过辩证增减贯穿应用。由于乌梅丸中包含十种草药,系统研究极其复杂,且存在诸多不完善,往后的研究人员应该纳入更多优质的病例及文献,后续可进行网络药理学进行深入分析,并建立更多临床或动物试验阐明作用机理。
参考文献:
[1]Bloem Bastiaan R,Okun Michael S,Klein Christine. Parkinsons disease[J].LANCET.2021,397(10291):2284-2303.
[2]Hayes Michael T.Parkinsons Disease and Parkinsonism[J].American journal of medicine.2019,132(7):802-807.
[3]刘疏影,陈彪.帕金森病流行现状[J].中国现代神经疾病杂志,2016,16(2):98-101.
[4]Ding Chenyu,Wu Yuying,Chen Xiaoyong,et al.Global,regional,and national burden and attributable risk factors of neurological disorders:The Global Burden of Disease study 1990-2019[J].Frontiers in public health.2022,10:952161.
[5]李哲,胡瀛宇,雒晓东.从六经厥阴辨治帕金森病[J].中医杂志,2014,55(11):977-979.
[6]郑春叶.帕病3号方治疗帕金森病的临床疗效观察[D].广州:广州中医药大学,2005.
[7]张华.中医六经厥阴辨证治疗帕金森病的临床研究及干细胞体外分离培养纯化的实验研究[D].广州:广州中医药大学,2008.
[8]范宇鹏,曾亮,孙玉芝,等.帕病2号方治疗震颤型帕金森病的临床研究[J].天津中医药,2010,27(3):190-191.
[9]梁瑞华.乌梅丸加减治疗帕金森病疗效评价[D].广州:广州中医药大学,2010.
[10]刘赟.乌梅丸加减治疗帕金森病疗效评价[D].广州:广州中医药大学,2011.
[11]梁克几,庄艳姗,杨职.西药联合加减乌梅丸治疗震颤型帕金森病疗效观察[J].实用中医药杂志,2013,29(5):377-378.
[12]张作文,李时双,孙景环,等.乌梅丸方加减治疗帕金森病非运动性症状的疗效[J].中医学,2021,10(2):7.
[13]周韦玮.乌梅丸方加减治疗帕金森病非运动性症状的疗效[J].中文科技期刊数据库(引文版)医药卫生,2023(1):3.
[14]García-Ramos R,López Valdés E,Ballesteros L,et al.The social impact of Parkinsons disease in Spain:Report by the Spanish Foundation for the Brain[J].Neurologia.2016,31(6):401-413.
[15]Siderowf Andrew,Stern Matthew.Update on Parkinson disease[J].Annals of internal medicine.2003;138(8):651-658.
[16]DragaeviAc'1-MikoviAc'1 Nataa,PetroviAc'1 Igor,StankoviAc'1 Iva,et al.Chemical management of levodopa-induced dyskinesia in Parkinsons disease patients[J].Expert opinion on pharmacotherapy.2019,20(2):219-230.
[17]Kwon Destany K,Kwatra Mohit,Wang Jing,et al.Levodopa-Induced Dyskinesia in Parkinsons Disease:Pathogenesis and Emerging Treatment Strategies.Cells[J].2022,11(23).
[18]Zhu Lei,Li Jing,Ren Chongyang,et al.Clinical Study of Restless Leg Syndrome Accompanied by Psychological Symptoms Induced by High-Dose Treatment With Madopar[J].Frontiers in psychiatry.2019(10):360.
[19]Puri Vivek,Kanojia Neha,Sharma Ameya,et al.Natural product-based pharmacological studies for neurological disorders[J].Frontiers in pharmacology.2022(13):1011740.
[20]Chen Peng,Zhang Jie,Wang Chen,et al.The pathogenesis and treatment mechanism of Parkinsons disease from the perspective of traditional Chinese medicine[J].Phytomedicine.2022(100):154044.
[21]文晓东,罗宁,王春玲,等.乌梅总黄酮对帕金森病大鼠脑线粒体呼吸链酶复合物影响[J].辽宁中医药大学学报,2020,22(10):27-31.
[22]王春玲,罗宁,文晓东,等.乌梅总黄酮通过线粒体自噬对帕金森病大鼠的保护作用[J].西部中医药,2022,35(12):72-76.
[23]Li Huan,Kim Joonki,Tran Huynh Nguyen Khanh,et al.Extract of Polygala tenuifolia,Angelica tenuissima,and Dimocarpus longan Reduces Behavioral Defect and Enhances Autophagy in Experimental Models of Parkinsons Disease[J].Neuromolecular medicine.2021,23(3):428-443.
[24]Chen Yu-Ying,Liu Qiu-Ping,An Pei,et al.Ginsenoside Rd:A promising natural neuroprotective agent[J].Phytomedicine.2022(95):153883.
[25]Han Yingjie,Wang Tian,Li Chunyan,et al.Ginsenoside Rg3 exerts a neuroprotective effect in rotenone-induced Parkinsons disease mice via its anti-oxidative properties[J].European journal of pharmacology.2021(909):174413.

