仿生印迹亲和分析技术研究进展










摘要 分子印迹是一种模拟生物分子特异性识别的仿生技术,通过制备分子印迹聚合物(MIPs),结合高特异性亲和分析方法所构建的仿生印迹亲和分析(Biomimetic imprinting affinity analysis, BIA)技术具有灵敏度高、耐受性强、专一性好以及成本低等优势,在食品安全检测、药物分析和环境污染监测等领域展现出良好的发展潜力。本文首先介绍了BIA 识别界面的构建方法,包括本体聚合、电聚合和表面印迹法等,总结了近年来MIPs 在放射标记亲和分析、酶标记亲和分析、荧光标记亲和分析、化学发光亲和分析和电化学免疫传感等不同分析方法中的研究和应用进展,最后讨论了该技术在实际应用中所面临的挑战和未来的发展趋势。
关键词 分子印迹;仿生;亲和分析;评述
基于抗体和受体等的特异性识别作用建立的亲和分析方法,具有特异性强、亲和力和灵敏度高等优点,在现场快速检测领域得到了广泛应用[1-2]。但是,传统生物源识别元件的制备复杂、干扰因素多、稳定性差、成本高,限制了这些方法的应用和发展[3]。设计和合成具有高特异性、高稳定性及低成本的仿生识别元件已成为亲和分析方法发展的新方向。
分子印迹技术是一种模拟抗体和酶专一识别性能的仿生分子识别技术。分子印迹聚合物(Molecularlyimprinted polymers, MIPs)也称为仿生印迹抗体,是以目标物为模板进行聚合,洗去模板后得到的聚合物[4]。与天然抗体相比, MIPs 不仅对特定靶标表现出可构效预定和专一识别的特性,而且具有环境耐受性强、可重复使用、制备简单、适用范围广和成本低等优势,是抗体或适配体(Aptamer, Apt)的理想替代物及亲和分析的优良识别元件[5],基于此建立的仿生印迹亲和分析(Biomimetic imprinting affinityanalysis, BIA)法具有特异性强、稳定性高和灵敏度好等优点,在食品和环境污染物分析、微生物检测及临床诊断等领域具有广阔的应用前景[6]。本文介绍了BIA的构建原理及分类,概述了近年来其在环境检测、食品安全检测和临床医学检测等领域的应用进展,并分析了BIA 目前面临的挑战及未来发展趋势。
1 仿生印迹亲和识别界面的构建
BIA 是以MIPs 界面为识别元件的分析方法,通常利用靶标与标记探针竞争结合MIPs 界面的特异性识别位点,根据检测前后的信号变化实现目标分子的定性和定量检测[7],广泛应用于食品安全检测和药物分析等领域[8]。
作为BIA 的识别元件, MIPs 界面的结构和性能是影响检测分析的重要因素[9],构建性能良好的MIPs 印迹界面是BIA 的关键。目前, MIPs 界面的构建方法主要有本体聚合、悬浮聚合、沉淀聚合和电聚合等[10],其中,本体聚合法具有制备快速、操作简便和所得印迹材料纯度高等优势,应用最普遍。Torrini 等[11]采用本体聚合法,以去甲肾上腺素为功能单体,在酶标板内构建戈那瑞林MIPs 界面,此印迹界面结构稳定,识别性能良好,检出限低至0.277 μmol/L。但是,该方法不可避免地存在模板分子包埋过深的问题,难以洗脱。为了克服此缺陷,研究者开发了悬浮聚合和溶胶-凝胶等方法。Chen 等[12]以3-(甲基丙烯酰氧基)丙基三甲氧基硅烷为功能单体,利用表面活性剂介导的溶胶-凝胶法制备了一种新型磁性MIPs,同时借助外部磁场将其固定于微孔板表面,所构建的印迹界面对目标物表现出优异的选择性,检出限为0.3 μg/mL。虽然这些方法制备的MIPs 形貌规整、粒径均一,但仍未解决识别位点包埋过深和印迹效率低等问题。
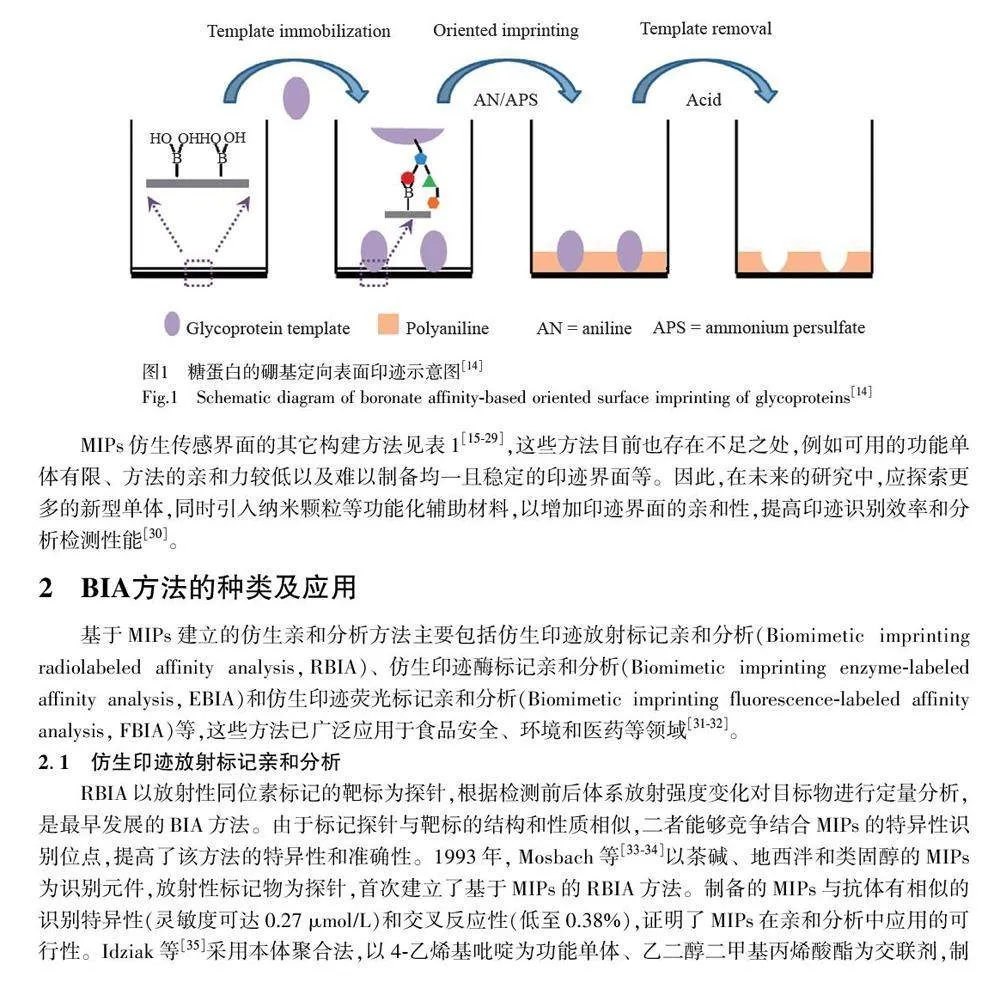
探索新型仿生印迹界面的构建方法是解决上述问题的有效途径。通过表面定向印迹技术将模板分子与功能单体引入基体材料表面,构建相应的结合位点,可有效避免MIPs 识别位点分布不均匀和模板难以洗脱等问题[13]。Bi 等[14]以96 孔酶标板为载体,采用硼亲和表面定向印迹法构建了糖蛋白仿生印迹界面,具体过程见图1。该研究利用席夫碱反应制备苯硼酸修饰的微孔板,通过硼亲和作用将糖蛋白模板固定在微孔板表面,同时借助苯胺自聚在微孔板表面形成仿生印迹界面,制备的印迹薄膜界面具有均一性好和印迹效率高(印迹因子可达25)等特点,提高了MIPs 对糖蛋白的识别性能,有效解决了MIPs 包埋过深导致洗脱不完全的问题。

