基于Au@SH-MIL-101(Fe)的类过氧化物酶活性和光电化学活性检测葡萄糖和谷胱甘肽






摘要采用原位生长策略在SH-MIL-101(Fe)表面生长金纳米颗粒(AuNPs),制备了Au@SH-MIL-101(Fe)复合纳米粒子,利用扫描电子显微镜、粉末X 射线衍射仪、X 射线光电子能谱和傅里叶变换红外光谱表征了Au@SH-MIL-101(Fe)的形貌、结构和组成。在中性条件下, Au@SH-MIL-101(Fe)表现出优良的类过氧化物酶(POD)活性和光电化学(PEC)性能。葡萄糖在葡萄糖氧化酶(GOx)的催化下生成过氧化氢(H2O2),而Au@SH-MIL-101(Fe)具有类POD 活性,可催化H2O2 生成羟基自由基,将3,3′,5,5′-四甲基联苯胺(TMB)氧化为蓝色OXTMB,基于此建立了快速、灵敏的葡萄糖比色检测方法,线性检测范围为1.0~200.0 μmol/L,检出限(S/N=3)为0.64 μmol/L。采用比色法检测血清中的葡萄糖,加标回收率为91.7%~106.6%。此外, Au@SHMIL-101(Fe)可与谷胱甘肽(GSH)中的巯基(—SH)形成Au—S 键,产生空间位阻,降低其光电流,基于此建立了检测GSH 的PEC 传感平台,线性检测范围为1.0~50.0 nmol/L, 检出限(S/N=3)为0.20 nmol/L。将此PEC方法用于检测血清中的GSH,加标回收率为95.0%~104.5%。
关键词金纳米颗粒;金属-有机框架;类过氧化物酶;光电化学;葡萄糖;谷胱甘肽
金纳米颗粒(AuNPs)具有优良的催化活性和独特的表面等离子共振效应[1],在催化、传感及储能等领域备受关注[2-4]。但是, AuNPs 具有较高的表面能,容易团聚成较大的颗粒,导致活性位点数量减少,从而影响其催化性能[5-6]。因此,开发理想的AuNPs 负载载体以控制其团聚程度是一种十分有效的方式。例如, PILL-LEE 研究组[7]通过静电纺丝法结合水热法合成了二氧化钛、石墨烯、聚[3-氨基苯基硼酸]和AuNPs 组成的异质结纳米杂化物TiO2(G)NW@PAPBA-Au HJNH,具有光电化学(PEC)和电化学性能,可分别用于检测葡萄糖和糖化血红蛋白。Kailasa 研究组[8-9]采用水热法合成了一种绿色碳点(CDs),利用CDs 和AuNPs 之间的静电作用,制备了CDs 功能化的AuNPs 复合纳米材料(CDs-AuNPs),并将其用于菠萝蛋白酶比色和荧光双模式的传感检测。然而,这些多功能的AuNPs 复合纳米材料的制备方法通常涉及复杂或高温合成步骤,限制了其进一步应用。因此,开发和设计合成步骤简单的载体对于制备多功能纳米复合AuNPs 材料非常重要。
金属-有机框架化合物(MOFs)通常是由金属或金属团簇与有机配体组成的具有一定形态的大分子框架化合物,具有比表面积大、形貌可控、水热稳定性和生物相容性好、具有空腔均匀和孔隙率高等特点,可作为AuNPs的有效载体。将AuNPs锚定在MOFs的孔道内,可有效防止AuNPs聚集[10-11]。Han等[12]采用简单的自下而上的合成策略制备了L-青霉胺修饰的AuNPs,并将其负载在2D 锌基卟啉MOF 表面,成功制备了L-Pen-AuNPs/ZnTCPP MOF,基于ZnTCPP MOF 优异的多功能特性,成功构建了用于S-萘普生(S-NAP)检测的电化学发光和电化学双模式传感器。Chen 等[13]利用硼氢化钠还原法制备了AuNPs 修饰的Cu MOF(Au/Cu MOF),此复合物具有优异的电化学性能和较高的类过氧化物酶(POD)活性,实现了对金黄色葡萄球菌的电化学和比色检测。因此,以MOFs 为载体并通过负载AuNPs 获得多功能纳米材料是一种非常有前景的策略。
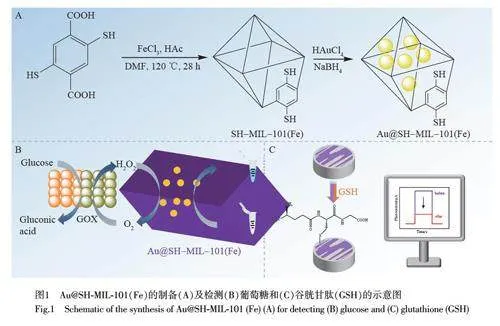
本研究以Fe3+为金属节点、2,5-二巯基对苯二甲酸((SH)2-BDC)为配体,通过水热法合成了SH-MIL-101(Fe),并以SH-MIL-101(Fe)为载体建立了一种简单、快速合成Au@SH-MIL-101(Fe)复合纳米粒子的化学方法(图1A)。基于均匀分散的AuNPs 与多孔SH-MIL-101(Fe)在Au@SH-MIL-101(Fe)中的协同作用,赋予了Au@SH-MIL-101(Fe)优良的类POD 性质和PEC 性能。基于其类POD 性质, Au@SH-MIL-101(Fe)在中性条件下可催化过氧化氢(H2O2)生成羟基自由基(·OH),将3,3′,5,5′-四甲基联苯胺(TMB)氧化为蓝色OXTMB。因此,基于葡萄糖在葡萄糖氧化酶(GOx)的作用下生成H2O2 的原理,建立了一种快速、灵敏的葡萄糖比色检测方法(图1B),用于血清样品中葡萄糖的检测。此外, Au@SH-MIL-101(Fe)可与谷胱甘肽(GSH)中的巯基(—SH)形成Au—S 键,形成空间位阻,从而降低Au@SH-MIL-101(Fe)的光电流(图1C),基于此,构建了一种检测GSH 的新型PEC 传感器,用于检测血清样品中GSH 的含量。
1 实验部分
1.1 仪器与试剂
IRPrestige-24 红外光谱仪(日本岛津公司);电感耦合等离子体发射光谱仪(美国安捷伦公司);D8 ADVANCE X-射线衍射仪(德国布鲁克公司);250Xi X-射线光电子能谱仪(美国赛默飞公司);S-4800 扫描电子显微镜和U-3010 紫外-可见分光光度计(日本日立公司);CHI 660E 电化学工作站(上海辰华仪器有限公司);CEL-PECX2000 型氙灯光电测试系统(北京中教金源有限公司)FeCl3∙6H2O(99%)、NaBH4(98%)、Na2SO4(99%)和GSH(98%)(上海阿拉丁生化科技有限公司);2,5-二巯基对苯二甲酸((SH)2-BDC, 98%)、3,3′,5,5′-四甲基联苯胺(TMB, 98%)、K4[Fe(CN)6](99%)和K3[Fe(CN)6](99%)(上海麦克林生化科技有限公司);冰醋酸(HAc, 99%)、乙醇(C2H5OH)和N,N-二甲基甲酰胺(DMF, 98%)(重庆化工有限公司);HAuCl4∙4H2O(99%,南京试剂有限公司);葡萄糖氧化酶(Gox,上海源叶生物科技有限公司);过氧化氢(H2O2, 99%,重庆川东化工有限公司);葡萄糖、果糖、蔗糖和乳糖(重庆钛新化工有限公司);麦芽糖(中国科学院上海生物化学与细胞生物研究所);L-精氨酸(L-Arg)、L-赖氨酸(L-Lys)、L-缬氨酸(L-Val)、L-脯氨酸(L-Pro)、L-亮氨酸(L-Leu)和L-异亮氨酸(LIso)(上海西格玛-奥尔德里奇有限公司);抗坏血酸(AA, 99%,成都科龙生化科技有限公司)。实验用水均为蒸馏水;血液样本由西南大学医院提供,相关研究经过伦理道德委员会批准,志愿者知情同意。
1.2 实验方法
1.2.1 材料合成
SH-MIL-101(Fe)的制备[14] 将FeCl3∙6H2O(270 mg, 1 mmol)分散于5 mL DMF 溶液中,(SH)2-BDC(115 mg, 0.5 mmol)分散于5 mL DMF 溶液中,将两种溶液混合均匀后,注入200 μL HAc,在室温下超声30 min 后转移到20 mL 聚四氟乙烯内衬高压釜中,于120 ℃下加热28 h,冷却至室温后取出,分别用DMF和C2H5OH 洗涤3 次,离心得到黄褐色固体。
Au@SH-MIL-101(Fe)的制备在25 mL圆底烧瓶中依次加入2 mL C2H5OH 分散的SH-MIL-101(Fe)纳米颗粒(1 mg/mL)、9 mL 水和不同体积(20、40、60、80、100 和120 μL)的HAuCl4 溶液(0.1 mol/L),将上述溶液在室温下搅拌5 min 后,加入100 μL NaBH4 溶液(0.1 mol/L), 继续搅拌5 min, 停止反应,获得深紫色的Au@SH-MIL-101(Fe)-X 纳米复合材料。将产物用水洗涤3 次,得到不同AuNPs 含量的Au@SH-MIL-101(Fe)-X(X 为HAuCl4 的用量)。相应的AuNPs 的负载量通过电感耦合等离子体发射光谱法(ICP-OES)测定(见电子版文后支持信息表S1)。
1.2.2 Au@SH-MIL-101(Fe)用于检测葡萄糖
将100 μL Gox(1 U/mL)加入到100 μL 不同浓度的葡萄糖溶液中, 37 ℃下孵育5 min, 然后依次加入100 μL HEPEs 缓冲液(5 mmol/L, pH 7.2)、100 μL Au@SH-MIL-101(Fe)(20 μg/mL)溶液、100 μL TMB(2 mmol/L)和600 μL去离子水,混匀,于37 ℃下孵育12 min, 离心,测定上清液的紫外-可见吸收光谱。
1.2.3 Au@SH-MIL-101(Fe)的光电性能测定和GSH的检测
用0.05 μm Al2O3 粉末将玻碳电极(GCE,直径为3 mm)抛光后,分别用乙醇和去离子水超声处理30 s, 氮气吹干,备用。PEC 和电化学阻抗谱(EIS)测试均采用三电极体系,以修饰Au@SH-MIL-101(Fe)的GCE为工作电极, Ag/AgCl电极为参比电极,铂丝电极为对电极。具体操作步骤如下:(1)EIS测试在含有1 mmol/L K4[Fe(CN)6]/K3[Fe(CN)6]的0.1 mol/L KCl 溶液中进行,频率范围为10–1~105 Hz, 开路电压为额定电压;(2)PEC 测试及GSH 检测将7.0 μL 0.3 mg/mL Au@SH-MIL-101(Fe)溶液滴加到GCE表面,室温下自然干燥2 h 后测试其光电流响应。将7.0 μL 不同浓度的GSH 溶液滴在Au@SH-MIL-101(Fe)/GCE 表面,室温下干燥过夜,作为工作电极用于光电流响应测试。以Na2SO4(0.1 mol/L)和AA(0.15 mol/L)的混合溶液为电解液、300 W 氙灯为光源,每20 s 开、关光源1 次,工作电压为–0.1 V。
1.2.4 血液样本中葡萄糖和GSH的检测
血液样本以12000 r/min 离心30 min, 收集上清液,获得血清样品。在血清样品中分别加入不同浓度的葡萄糖(50、100 和150 μmol/L)和GSH(20、30 nmol/L), 按1.2.2 节和1.2.3 节的方法测定血清样品中葡萄糖和GSH 含量。
2 结果与讨论
2.1 Au@SH-MIL-101(Fe)的表征
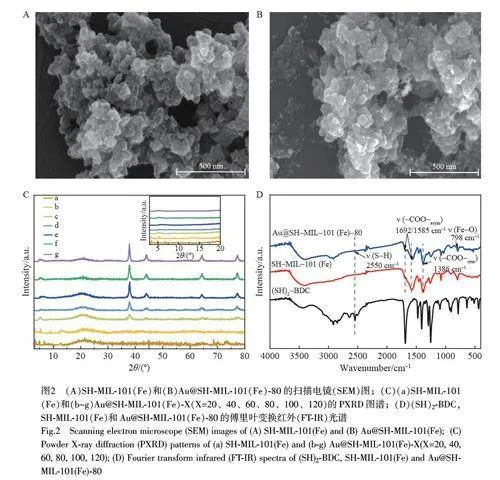
扫描电子显微镜(SEM)图像显示, SH-MIL-101(Fe)呈现不规则的颗粒堆积(图2A), Au@SH-MIL-101(Fe)-X 仍保持SH-MIL-101(Fe)不规则的颗粒堆积形貌特征与尺寸(图2B)。随着HAuCl4 用量增加,SH-MIL-101(Fe)表面的AuNPs 增多,当HAuCl4 的用量增至100 μL 时,生长的AuNPs 开始在载体SHMIL-101(Fe)上聚集(见电子版文后支持信息图S1)。利用粉末X-射线衍射(PXRD)方法研究了Au@SH-MIL-101(Fe)的晶体结构(图2C),在38.5°、44.8°、64.4°和78.1°处的特征衍射峰分别归属于AuNPs 的(111)、(200)、(220)和(311)晶格衍射峰,表明AuNPs 生长在SH-MIL-101(Fe)表面[15]。随着AuNPs 负载量增加,衍射峰强度增强,并且导致SHMIL-101(Fe)的部分特征衍射峰被覆盖(图2C 插图)。
采用傅里叶变换红外光谱(FT-IR)表征了SH-MIL-101(Fe)和Au@SH-MIL-101(Fe)的组成和官能团(图2D),可以观察到SH-MIL-101(Fe)在约2550 cm–1 处有1 个很弱的特征峰,对应于S—H 的伸缩振动。同时,在1692 和1585 cm–1 处的峰为配体中—COO—的不对称伸缩振动特征峰;在1386 cm–1 处的特征峰表明羧酸基团通过去质子作用与金属离子配位。798 cm–1 附近明显的特征峰归属于Fe—O 的伸缩振动[16],而Au@SH-MIL-101(Fe)在2550 cm‒1 处没有明显的—SH 峰,这是由于S 与AuNPs 之间存在强的相互作用,形成了Au—S 键[17]。
利用X-射线光电子能谱(XPS)研究了所制备的复合纳米颗粒表面化学成分的键合状态, XPS 全谱(见电子版文后支持信息图S2A)表明, Au@SH-MIL-101(Fe)-80 主要含有Au、Fe、S、C 和O 元素,Au@SH-MIL-101(Fe)的Fe 2p 的XPS 谱图显示位于711.3 和725.6 eV 处的2 个峰,分别对应于Fe 2p3/2和Fe 2p1/2,证明Fe 以Fe2+和Fe3+的混合价态存在(见电子版文后支持信息图S2B)。Au 4f 的XPS 谱图显示出84.8 和88.5 eV 处的2 个峰,分别对应于Au 4f5/2 和Au 4f7/2(电子版文后支持信息图S2C),表明Au 以Au0 的形式存在于Au@SH-MIL-101(Fe)-80 框架中[18]。
2.2 Au@SH-MIL-101(Fe)的类POD活性研究及其在葡萄糖检测中的应用
2.2.1 类POD活性
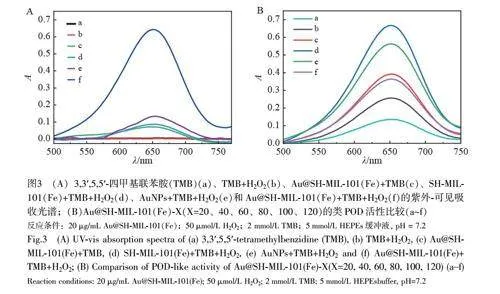
采用H2O2-TMB 体系研究了Au@SH-MIL-101(Fe)的类POD 活性。如图3A 所示,当不存在H2O2 时,Au@SH-MIL-101(Fe)对TMB 的催化活性较弱,即类氧化酶活性较低。H2O2 无法直接氧化TMB,而Au@SH-MIL-101(Fe)可催化H2O2 氧化TMB生成蓝色OXTMB,其催化能力远高于AuNPs及SH-MIL-101(Fe)。以上结果表明, Au@SH-MIL-101(Fe)的类POD 活性的增强主要来自于AuNPs 和SH-MIL-101(Fe)的协同作用。
考察了不同AuNPs 负载量的Au@SH-MIL-101(Fe)复合材料的类POD 活性。结果表明,单独的AuNPs(1%)以及SH-MIL-101(Fe)载体在652 nm 处的吸光度(A652 nm)很低,几乎不表现出类POD 活性。随着AuNPs负载量增加, Au@SH-MIL-101(Fe)-80吸光度增大, A652 nm最高,表明Au@SH-MIL-101(Fe)-80 的类POD 活性最强。然而,当HAuCl4 的用量增至100 μL 后,其类POD 活性反而降低(图3B),推测是由于生成的AuNPs 在SH-MIL-101(Fe)表面发生了聚集。
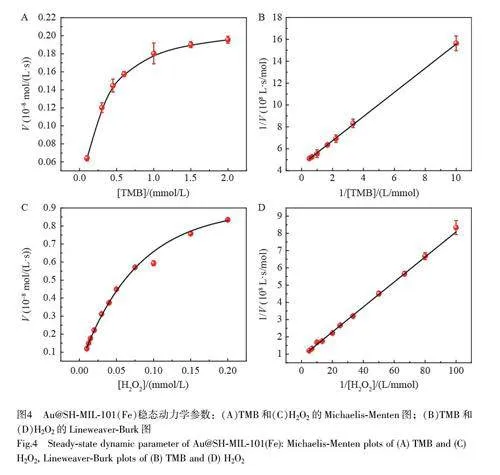
2.2.2 Au@SH-MIL-101(Fe)的稳态动力学分析
固定一种底物(TMB 或H2O2)的浓度,改变另一种底物浓度,探究Au@SH-MIL-101(Fe)催化H2O2 氧化TMB 反应的稳态动力学常数。图4A 和4C 表明,在考察的底物浓度范围内, Au@SH-MIL-101(Fe)催化H2O2 氧化TMB 的反应遵循Michaelis-Menten 动力学模式。通过双倒数方程Lineweaver-Burk 拟合的曲线表明1/V 与1/[S]呈线性相关(图4B 和图4D),根据公式(1)的斜率和截距,通过计算得到催化反应表观动力学常数[19-20]。
2.2.3 基于Au@SH-MIL-101(Fe)的类POD活性检测葡萄糖
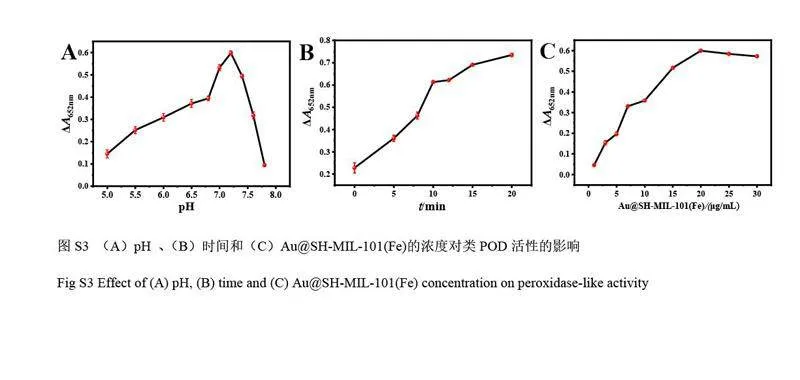
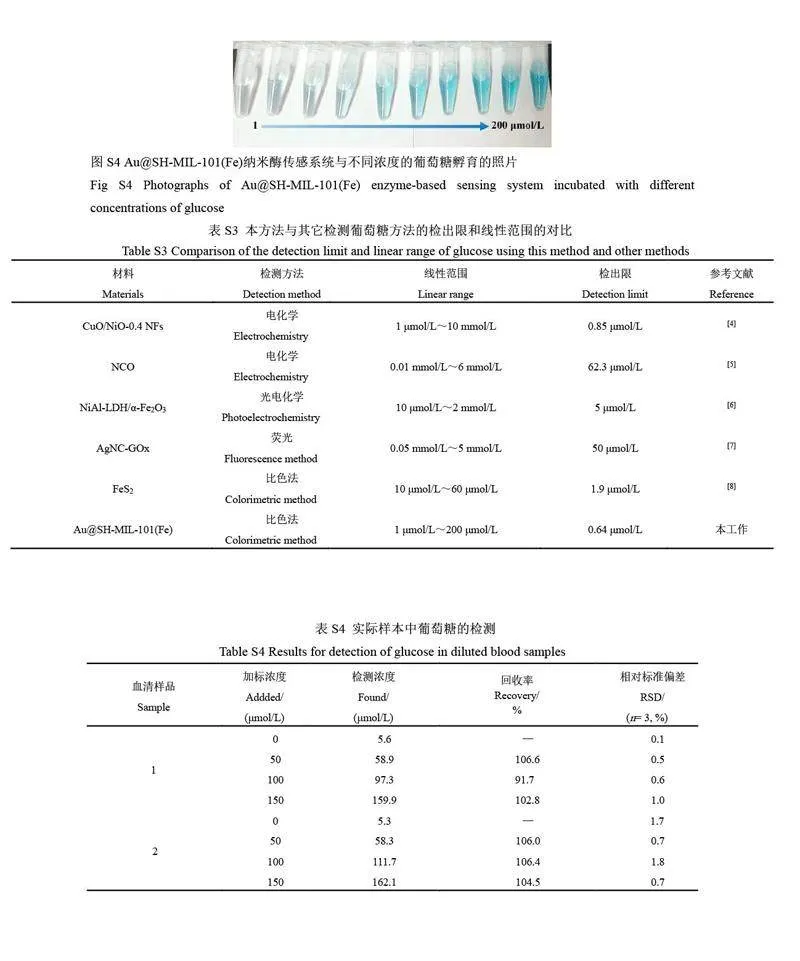
GOx 可催化葡萄糖生成H2O2,因此,利用Au@SH-MIL-101(Fe)催化H2O2 氧化TMB 的显色反应可间接实现葡萄糖的可视化检测。为了获得最佳的检测性能,对pH 值、孵育时间和Au@SH-MIL-101(Fe)的浓度进行了优化,得到最优的反应条件为pH=7.2、孵育时间为12 min、Au@SH-MIL-101(Fe)的浓度为20 μg/mL(见电子版文后支持信息图S3)。在最优条件下,检测不同浓度的葡萄糖(图5A),结果表明,随着葡萄糖浓度增大,体系的A652nm 值增大,颜色也逐渐变深(电子版文后支持信息图S4),在1.0~200.0 μmol/L范围内, A652 nm 变化值与葡萄糖浓度呈线性关系,线性方程为ΔA652 nm=0.0046C+0.0172(R2=0.998),检出限为0.64 μmol/L(S/N=3)(图5B)。
2.2.4 基于类POD活性检测葡萄糖的选择性以及实际样品测定
考察了体系中果糖、乳糖、蔗糖和麦芽糖共存时,对检测葡萄糖的的影响,以考察方法的选择性。结果表明,果糖、乳糖、蔗糖和麦芽糖存在时体系吸光度未发生明显变化(图5C),表明本方法检测葡萄糖具有良好的选择性[21]。与已报道的检测葡萄糖的传感器相比,本研究建立的比色传感器具有较低的检出限(见电子版文后支持信息表S3)。
为考察本方法用于实际样品的检测能力,采用本方法测定了实际血清样品中的葡萄糖,结果如电子版文后支持信息表S4 所示,血清中葡萄糖的加标回收率为91.7%~106.6%,相对标准偏差(RSD) lt; 2%,表明本方法具有良好的准确性和实用性,可用于实际血清样品中葡萄糖的测定。
2.3 Au@SH-MIL-101(Fe)的PEC性能研究以及在GSH检测中的应用
2.3.1 Au@SH-MIL-101(Fe)的PEC性能
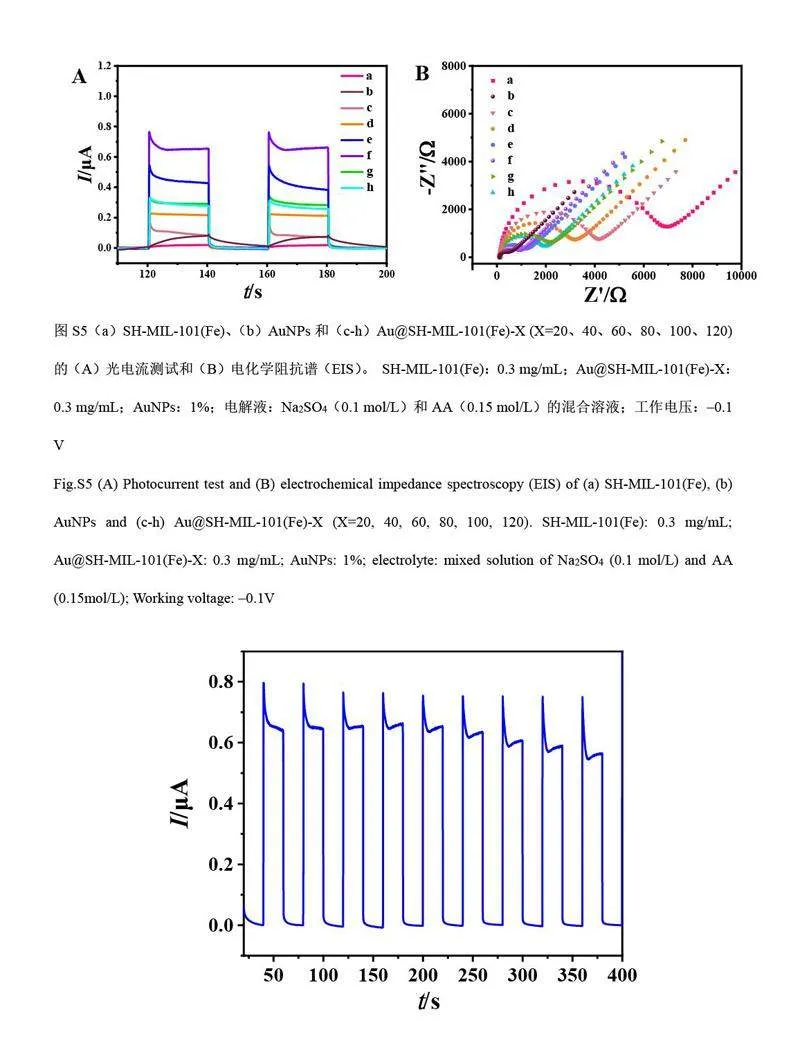
测试了不同AuNPs 负载量的Au@SH-MIL-101(Fe)的PEC 性能,以考察Au@SH-MIL-101(Fe)的电子-空穴分离效率(见电子版文后支持信息图S5A)。随着AuNPs 负载量增加,复合纳米材料的光电流信号逐渐增加。其中, Au@SH-MIL-101(Fe)-80 的光电流信号强度分别是AuNPs(1%)和SH-MIL-101(Fe)的8 倍和40 倍,表明AuNPs 的耦合极大地提高了SH-MIL-101(Fe)的电子-空穴分离效率。由于SH-MIL-101(Fe)和AuNPs 之间形成肖特基势垒, AuNPs 产生的热电子可穿过肖特基势垒转移到SH-MIL-101(Fe)导带,促进光生载流子的分离,有助于提高Au@SH-MIL-101(Fe)的光电流信号[22-23]。但是,随着AuNPs 负载量增加, AuNPs 会发生团聚,导致Au@SH-MIL-101(Fe)-100 和Au@SH-MIL-101(Fe)-120 的光电流信号降低。
通过EIS 研究了Au@SH-MIL-101(Fe)在光电过程中的电荷转移, Nyquist 曲线在高频区的半圆直径对应电极的电子传递阻抗(Ret),直径越小表明电子传递受阻越小,电子-空穴分离效率越高,相应的光电流信号越强[24]。如电子版文后支持信息图S5B 所示,随着SH-MIL-101(Fe)表面AuNPs 负载量增加,光电流信号不断升高,其中, Au@SH-MIL-101(Fe)-80 的半圆直径最小,说明Au@SH-MIL-101(Fe)-80 的Ret最小。为了测试Au@SH-MIL-101(Fe)光电信号的稳定性,以Au@SH-MIL-101(Fe)-80 为例,进行了9 次开/关光照循环测试。如电子版文后支持信息图S6 所示,光源每20 s 开/关1 次,其光电流强度无明显变化(RSD=2.39%),表明其光电性能稳定。
2.3.2 基于Au@SH-MIL-101(Fe)的PEC性能检测GSH
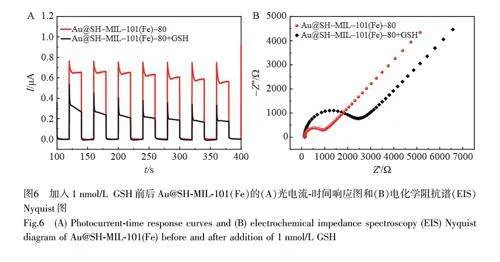
GSH 中的—SH 和Au@SH-MIL-101(Fe)中的AuNPs 相互作用形成Au—S 键,产生的空间位阻效应会降低光电流信号[25],基于此构建了PEC 传感器用于GSH 的检测。如图6A 所示,加入GSH 后, Au@SHMIL-101(Fe)的光电流大幅度降低。通过EIS 研究了Au@SH-MIL-101(Fe)与GSH 反应前后的阻抗谱变化。结果表明, Au@SH-MIL-101(Fe)与GSH 反应后, Au@SH-MIL-101(Fe)的Rct 值明显增加(图6B),这也进一步证明了GSH 与Au@SH-MIL-101(Fe)结合后会阻碍电极表面电子的转移,从而导致Au@SHMIL-101(Fe)光电流信号降低。
对基于Au@SH-MIL-101(Fe)的PEC 性能检测GSH 时的实验条件,包括Au@SH-MIL-101(Fe)的浓度、工作电压和AA 的浓度进行了优化(见电子版文后支持信息图S7),得到最优的反应条件如下:Au@SH-MIL-101(Fe)的浓度为0.3 mg/mL、工作电压为–0.1 V、AA 的浓度为0.15 mol/L。采用PEC 方法检测不同浓度的GSH,随着GSH 浓度增加,光电流逐渐降低(图7A 和7B)。在1.0~50.0 nmol/L 范围内,加入GSH 反应前后光电流的变化值(ΔI)与GSH 浓度的对数值呈线性关系(图7C),线性方程为ΔI =0.1689lgC+0.3956(R2=0.993),检出限为0.20 nmol/L(S/N=3)。与文献所报道的GSH 检测方法相比(见电子版文后支持信息表S5),本方法的检出限更低。
2.3.3 基于Au@SH-MIL-101(Fe)的PEC传感器检测GSH的抗干扰性、稳定性及实际样品测定
考察了10 nmol/L GSH 在500 nmol/L 不同干扰物(L-Arg, L-Lys, L-Val, L-Pro, L-Leu, L-Iso 和Glucose)存在下的光电流响应,以评估所构建的基于Au@SH-MIL-101(Fe)的PEC 传感器检测GSH 时的抗干扰性能。如电子版文后支持信息图S8 所示,测试的干扰物对此传感器检测GSH 的光电流响应没有显著影响,这是因为其分子结构中没有‒SH 基团[26]与Au@SH-MIL-101(Fe)相互作用。
为了考察此传感器的稳定性,将其在4 ℃下保存15 d, 每2 d 进行1 次测试,结果如电子版文后支持信息图S9 所示,储存15 d 后Au@SH-MIL-101(Fe)的光电流响应为初始光电流响应的96.1%,表明此传感器具有良好的稳定性。
采用本方法测定了实际血清样本中的GSH,加标回收率为95.0%~104.5%(见电子版文后支持信息表S6),表明本方法具有良好的实用性。
3 结论
以SH-MIL-101(Fe)为载体,通过原位生长AuNPs 策略制备了Au@SH-MIL-101(Fe)复合纳米粒子。探讨了所合成的Au@SH-MIL-101(Fe)的类POD 活性和PEC 活性,基于其类POD 活性以及葡萄糖在GOx的催化下生成H2O2 的原理,建立了快速、灵敏的葡萄糖比色检测方法,线性检测范围为1.0~200.0 μmol/L,检出限为0.64 μmol/L。另外,依据Au@SH-MIL-101(Fe)良好的PEC 性能研究了其对GSH 的检测性能。Au@SH-MIL-101(Fe)与GSH 中的—SH 形成Au—S 键,产生的空间位阻大大阻碍了电子转移,从而降低了Au@SH-MIL-101(Fe)光电流信号,基于此建立了检测GSH 的PEC 传感平台,线性检测范围为1.0~50.0 nmol/L, 检出限为0.20 nmol/L。Au@SH-MIL-101(Fe)在生物催化以及生物检测等领域具有良好的发展潜力,本研究也为多功能纳米材料的合成提供了新的思路。
References
[1] ZHAO M, LI Y, CUI S, CHEN S, YANG J. Appl. Surf. Sci. , 2023, 607: 154980.
[2] ZHANG H Y, LI S, QU A H, HAO C L, SUN M Z, XU L G, XU C L, KUANG H. Chem. Sci. , 2020, 11(48): 12937-12954.
[3] JIN L, LV S, MIAO Y, LIU D, SONG F. ChemCatChem, 2020, 13(1): 140-152.
[4] ZHU H G, YUAN X, YAO Q F, XIE J P. Nano Energy, 2021, 88: 106306.
[5] DENG Y, ZHANG Z, DU P Y, NING X M, WANG Y, ZHANG D X, LIU J, ZHANG S T, LU X Q. Angew. Chem. Int. Ed. ,
2020, 59(15): 6082-6089.
[6] WENG B, LU K Q, TANG Z C, CHEN H M, XU Y J. Nat. Commun. , 2018, 9(1): 1543.
[7] NALLAL M, IYENGAR G A, PILL-LEE K. ACS Appl. Mater. Interfaces, 2017, 9(42): 37166-37183.
[8] RAWAT K A, SINGHAL R K, KAILASA S K. RSC Adv. , 2016, 6(38): 32025-32036.
[9] ALI A, OVAIS M, ZHOU H G, RUI Y K, CHEN C Y. Biomaterials, 2021, 275: 120951.
[10] WANG X L, WANG H, GUO L, CHEN G, KONG R M, QU F L, XIA L. Analyst, 2020, 145(4): 1362-1367.
[11] DAI S, NGOC K P, GRIMAUD L, ZHANG S, TISSOT A, SERRE C J. J. Mater. Chem. A, 2022, 10(6): 3201-3205.
[12] HAN Q, WANG C, LIU P K, ZHANG G, SONG L, FU Y Z. Sens. Actuators, B, 2021, 330: 129388.
[13] CHEN Y, CHEN Y, YI H C, GU H W, YIN X L, XIANG D L, ZOU P. Microchem. J. , 2023, 190: 108681.
[14] HU C, YANG C, WANG X, WANG X, ZHEN S, ZHAN L, HUANG C, LI Y. Sep. Purif. Technol. , 2022, 300: 121801.
[15] ZHANG Z, XU C, XIONG X, WANG C, ZHANG Q, FAN Z, WANG Y. J. Alloys Compd. , 2023, 934: 167910.
[16] ZHANG Q, MI S N, XIE Y F, YU H, GUO Y H, YAO W R. Spectrochim. Acta, Part A, 2023, 287: 122018.
[17] XIE B X, WANG H S, ZHENG H Q, XU J, CHEN L, ZHANG F Z, WANG Y L, LIN Z J, LIN R G. Inorg. Chem. , 2023,62(34): 13892-13901.
[18] ZHANG Y, SONG J, SHAO W, LI J. Microporous Mesoporous Mater. , 2021, 310: 110642.
[19] ZHOU J, ZHU W, LV X, DU X, HE J, CAI J. ACS Appl. Nano Mater. , 2022, 5(12): 18885-18893.
[20] YANG W, ZHU L, YANG M, XU W. Small, 2022, 19(2): 2204782.
[21] JIN L H, MENG Z, ZHANG Y Q, CAI S J, ZHANG Z J, LI C, SHANG L, SHEN Y H. ACS Appl. Mater. Interfaces, 2017,9(11): 10027-10033.
[22] RUAN Y F, ZHANG N, ZHU Y C, ZHAO W W, XU J J, CHEN H Y. Anal. Chem. , 2017, 89(15): 7869-7875.
[23] ZHOU M, HUANG H, ZHAO X, CHENG Z, DENG W F, TAN Y M, XIE Q J. Anal. Chem. , 2022, 94(40): 13913-13920.
[24] WANG Q, ZHOU M, ZHANG L. J. Hazard. Mater. , 2020, 382: 121026.
[25] YANG C P, WU Q, JIANG Z W, WANG X, HUANG C Z, LI Y F. Talanta, 2021, 228: 122261.
[26] ZHUGE W, LI X, FENG S. Microchem. J. , 2020, 155: 104726.

