蜻蜓凤梨AfFT3基因克隆及功能鉴定








摘要:[目的】克隆蜻蜓凤梨成花素基因AFT3,并鉴定其生物学功能,为深入解析凤梨科植物开花分子机制提供理论依据。【方法】克隆A/FT3基因,利用生物信息学软件进行序列分析,并通过实时荧光定量PCR探究其在低温(18℃)、常温(25℃)和高温(35℃)及外源乙烯处理下的表达情况,采用农杆菌浸花法将AFT3基因转入拟南芥,观察转基因植株表型,通过异源表达预测其生物学功能。通过酵母单杂交试验初步鉴定其启动子与AfEIN3蛋白的互作关系。【结果】从蜻蜓凤梨中克隆获得AfFT3基因全长570 bp,编码区(CDS)序列为465 bp,编码154个氨基酸残基,蛋白分子量为17.3 kD,为稳定的亲水性蛋白,无跨膜螺旋区,含有PKC、PKA、cde2、INSR和GSK3等多个蛋白激酶磷酸化位点。同源序列比对发现,AfFT3蛋白中有2个氨基酸残基138Trp和140GIn突变为138Met和140Glu。系统发育分析结果显示,该蛋白属于PEBP家族的FT-like蛋白亚家族,与TFL-like亚家族的亲缘关系较近。与对照(大棚正常条件下栽培植株)相比,高温和低温处理下AfFT3基因在蜻蜓凤梨中的相对表达量显著(Plt;0.05,下同)或极显著(Plt;0.01,下同)升高。在高温、常温和低温条件下,使用外源乙烯处理后,A/FT3基因在蜻蜓凤梨中的相对表达量均较对照显著或极显著升高,在常温处理下其相对表达量最高。共获得6个转基因拟南芥株系(L1~L₆),其中转基因株系L3和L6较转空载体拟南芥和野生型拟南芥延迟抽墓8 d。通过分段扩增获得AfFT3基因启动子3段序列(AfFT3-P1、AfFT3-P2和AFT3-P3),长度分别为390、1077和552 bp,通过酵母单杂试验推测启动子序列AfFT3-P1和AFT3-P3可与AEIN3蛋白发生互作。【结论】高温、低温胁迫和乙烯均不同程度诱导A/FT3基因的高效表达,但在高温和低温条件下乙烯对AfFT3基因的表达诱导效果较常温有所降低,其转基因株系延迟抽薹,说明AfFT3基因参与调控蜻蜓凤梨开花过程,且响应温度和乙烯信号。
关键词:蜻蜓凤梨;A/FT3基因;开花;温度;乙烯;功能鉴定;启动子
中图分类号:S668.303.6文献标志码:A文章编号:2095-1191(2024)02-0411-11
Gene cloning and functional identification of AfFT3 gene in
Aechmea fasciata(Lindl.)Baker
JING Yong-lin1,2,3,WANG Xiao-bin¹,2,3,LI Jun-guo¹.2,3,CHEN Lang-xin1,2,3,
YANG Qing-quan¹·2.3,XU Li1.2.3*
('Institute of Tropical Crop Genetic Resources,Chinese Academy of Tropical Agricultural Sciences,Haikou,Hainan 571101,China;²Key Laboratory of Crop Gene Resources and Germplasm Enhancement in Southern China,Ministry of Agriculture and Rural Affairs,Haikou,Hainan 571101,China;³Key Laboratory of Tropical Crops Germplasm Resources Genetic Improvement and Innovationof Hainan Province,Haikou,Hainan 571101,China)
Abstract:[Objective]The flowering-related gene AfFT3 in Aechmea fasciata(Lindl.)Baker was cloned and its bio-logical function was identified,which provided atheoretical basis for further analysis of the molecular mechanism of floweringof Bromeliaceae plants.【Method]4A/FT3 gene was cloned and its sequence was analyzed by bioinformatics soft-ware.The expression levels of AFT3 at low temperature(18℃),normal temperature(25℃)and high temperature(35℃)and exogenous ethylene treatment were detected by real-time fluorescence quantitative PCR(qRT-PCR).AFT3 gene was transferred intoArabidopsis thaliana(L.)Heynh by Agrobacterium flower dipping.The phenotype oftransgenic plants was observed,and its biological function was predicted by heterologous expression.The interaction between the promoter and A/EIN3 protein was preliminarily identified by yeast one-hybrid assay.[Result]The full length of A/FT3 gene cloned from A.fasciata was 570 bp,and the coding sequence(CDS)was 465 bp,encoding 154 amino acid resi-dues.AfFT3 protein had amolecular weight of 17.3 kD,was astable hydrophilic protein without atransmembrane helical region and contained several phosphorylation sites of protein kinases including PKC,PKA,cdc2,INSR and GSK3.The homologous sequence alignment revealed that two amino acid residues of AfFT3 protein130 Trp and 148GIn mutated to 138Met and¹+Glu.Phylogenetic analysis indicated that AfFT3 protein belonged to the FT-like protein subfamily of the PEBP family,and was close to the TFL-like subfamily.Compared with thecontrol(plants cultivated in normal conditions in greenhouse),the relative expression of AfFT3 gene in A.fasciata was increased significantly(Plt;0.05,the same below)or extremely significantly(Plt;0.01,the same below)under the treatment of high temperature and low temperature.Under the conditions of high temperature,normal temperature and low temperature,after exogenous ethylene treatment,therela-tive expression of AfFT3 gene in A.fasciata was increased significantly or extremely significantly compared with the con-trol,with the highest relative expression at normal temperature.A total of six transgenic A.thaliana plants(L₁to L₆)were obtained,in which the transgenic plants L;and L₆were about 8 d delayed than the empty vector and wild-type A.thaliana The AFT3 gene promoter sequences(AfFT3-P1,AfFT3-P2 and AfFT3-P3)were obtained by segmented amplification with the lengths of 390,1077and 552 bp respectively.The results of yeast one-hybrid experiment preliminarily suggested that promoter sequence AfFT3-P1 and A/FT3-P3 might interact with AfEIN3 protein.【Conclusion]The effective expres-sion of AfFT3 gene is induced by high temperature,low temperature stress and ethylene in different degrees,but the in-duction effect of ethylene on the expression of AfFT3 gene under high temperature and low temperature conditions is lower than that of normal temperature.The genetically modified plants delay bolting,indicating that AfFT3 gene is in volved in the regulation of floweringprocess of A.fasciata,and respond to temperature and ethylene signals Key words:Aechmea fasciata(Lindl.)Baker;AFT3 gene;flowering;temperature;ethylene;functional identifica-tion;promoter Foundation items:National Natural Science Foundation of China(31372106);Hainan Natural Science Foundation (809195749021)
0引言
【研究意义】蜻蜓凤梨[Aechmea fasciata(Lindl.)Baker]是凤梨科(Beomeliae)附生凤梨属(Aechmea)的多年生常绿草本植物,其叶片具有虎纹状银白色横纹,淡粉色苞片中间开蓝紫色小花,色泽鲜艳,花形奇特,花期持久,故深受大众喜爱,市场需求量日益增加,成为重要的热带花卉之一。自然状态下,蜻蜓凤梨生长周期较长,花期存在较大不确定性,开花率低,花的形色特征参差不齐。蜻蜓凤梨开花会受到品种、年龄、植株重量、个体营养等内部因素及温度、水分、栽培条件等外部因素的制约,其催花成功率会严重影响商业化生产。生产上常人工施加外源乙烯及其衍生物进行催花,以满足市场需求。目前,对于蜻蜓凤梨各种成花因素之间的相互作用机制研究尚处于初始阶段,且乙烯促进凤梨开花的机理尚不清楚,使得人工催花效果不佳,同时温度对蜻蜓凤梨开花影响也较大。成花素基因(FLOWERING
LOCUS T,FT)作为植物开花途径中的关键调控基因,具有重要的研究价值(Nakamura et al.,2011)。因此,本研究开展蜻蜓凤梨FT基因克隆及功能鉴定,为深入研究乙烯和温度诱导蜻蜓凤梨开花的分子机制提供一定的参考依据,对克服其生长周期长及花期不一致的缺点具有重要的研究意义。【前人研究进展】植物成花诱导途径主要有5条途径:光周期途径、春化途径、温度途径、赤霉素途径和自主途径(Peng et al.,2016;陈锡等,2017;Kinoshita and Rich-ter,2020)。FT是调控植物开花的重要基因,对成花转变具有重要作用,是典型的促花因子,本身受光周期途径中的锌指蛋白诱导,其蛋白由叶片经维管束移动到茎顶端组织。FT编码磷脂酰乙醇胺结合蛋白(PEBP),不同物种的PEBP系统发育分析结果显示,PEBP蛋白可分为3个功能不同的亚类,FT-like蛋白、TFL₁-like蛋白和MFT-like蛋白亚家族(Kobayashi et al.,1999;Luo et al.,2019)。FT是光周期途径生理钟基因(CO)、春化途径和开花阻抑物基因(FLC)等调控开花时间相关基因的直接靶基因,几乎可将所有的开花信号传导途径进行整合。拟南芥FT蛋白合成于叶片韧皮部特定的伴胞细胞,在内质网膜蛋白(FTIP)的协助下,经过维管束转运至顶端分生组织(SAM),并与锌指转录因子FD相互作用,激活下游花分生组织特性基因的表达,从而启动植物开花(Schiessl et al.,2017;Kralemann et al.,2018;Abe et al.,2019;Shim and Jang,2020)。在接受合适的光周期诱导后,拟南芥FT基因在叶中被诱导表达,在顶端分生组织中FT蛋白与FD和14-3-3蛋白互作并形成复合体,共同促进下游开花基因的表达,从而促进开花(Abe et al.,2005;Taoka et al.,2011;Luo et al.,2019)。在单子叶模式植物水稻中也发现,水稻FT同源蛋白Hd3a同样能与14-3-3蛋白作用形成复合体,并结合水稻OsFD1基因的启动子调控该基因表达(Taoka et al.,2011)。FT基因除调控植物开花之外,还参与调控种子萌发与植物形态的建成等(蒋甲福等,2021)。乙烯是最早发现的种具有生物活性的植物激素,可调节植物的生长发育和各种生理活动(Iqbal etal.,2017)。根据乙烯特有的“三重反应”,已有研究对植物乙烯信号通路中的关键组分进行筛选、分离及鉴定,最终构建了乙烯信号转导通路的基本模型(Guo and Ecker,2003)。乙烯信号是被膜结合蛋白(乙烯受体)所感知。在拟南芥中,乙烯共有5个受体:乙烯受体1(ETR1)、乙烯受体2(ETR2)、乙烯不敏感因子4(EIN4)、乙烯响应传感器1(ERS1)和乙烯响应传感器2(ERS2)。在未与乙烯结合之前,受体和负调节因子(CTR1)的N端结合,CTR1对EIN2的C端进行磷酸化修饰,从而被EIN1靶向蛋白1/2(ETP1/ETP2)识别,并进入蛋白酶体降解,抑制信号向下传递。同时,在细胞核中转录因子EIN3/EIL1由乙烯不敏感因子3(EIN3)结合蛋白1/2(EBF1/EBF2)介导,被泛素化蛋白酶体降解,乙烯信号通路处于沉默或失活状态。当这些乙烯受体与乙烯结合后,使CTR1失活,并失去使EIN2磷酸化的能力,这种去磷酸化的EIN2 C端就会断裂,并由细胞质转运至细胞核中,抑制二聚体EBF1/EBF2的泛素化活性,稳定转录因子EIN3/EIL1并使其累积,进而调控乙烯响应基因的表达,以帮助植物应对环境变化(李文阳等,2013;赵赫等,2016)。【本研究切入点】本课题组前期根据蜻蜓凤梨转录组数据筛选出与其开花相关的3个FT基因,分别命名为AfFT1、AfFT2和AfFT3,其中,AfFT1基因对开花并无显著作用,A/FT2基因可促进蜻蜓凤梨提前开花(Li et al.,2022)。但目前未见对蜻蜓凤梨AfFT3基因进行克隆及功能鉴定的研究报道。【拟解决的关键问题]对AfFT3基因进行克隆及生物信息学分析,检测其在不同温度及外源乙烯处理下的表达模式,并通过在拟南芥中异源表达预测其功能,为深入解析凤梨科植物开花分子机制提供理论依据。
1材料与方法
1.1试验材料
供试材料为蜻蜓凤梨幼株(6~8个月)和成株(11~14个月),拟南芥种子为Clumbia-0型,均由中国热带农业科学院国家种质资源热带作物中期保存库提供。2×Taq Master Mix(DyePlus)、ChamQIMUni-versal SYBRqPCR Master Mix和ClonExpressⅡOne Step Cloning Kit购于南京诺唯赞生物科技股份有限公司。PrimeSTAR°Max DNA Polymerase购于宝日医生物技术(北京)有限公司。pEASY-Blunt克隆载体和TransScript Uni One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒购于北京全式金生物技术有限公司。DNA测序及各类引物合成均由生工生物工程(上海)股份有限公司完成。限制性内切酶KpnI和Xba I购于美国NEB公司。主要仪器设备:ZHJH-C2109C超净工作台(上海智城分析仪器制造有限公司)、高速冷冻离心机(德国Eppendorf公司)、PCR仪(德国Biometra公司)、荧光定量PCR仪(美国ABI公司)和凝胶成像系统(美国Bio-Rad公司)。
1.2高、低温及外源乙烯处理
为了研究AfFT3基因对温度及外源乙烯的响应,对蜻蜓凤梨进行不同温度和外源乙烯处理。温度处理:采用18℃(低温,LT)、25℃(常温,NT)和35℃(高温,HT)处理24 h,以大棚正常条件[昼夜温度分别为(29±4)℃和(20±3)℃]下栽培植株为对照(CK)。在不同温度下外源乙烯处理:分别在18、25和35℃条件下取0.06%外源乙烯20 mL进行灌心处理(ET)24 h,以清水灌心的心叶材料为对照(CK)。处理后取心叶材料在液氮中迅速冷冻,再转移至-80℃保存备用。
1.3目的基因克隆及生物信息学分析
采用CTAB法提取蜻蜓凤梨心叶总RNA(丛汉卿等,2013),再利用TransScript Uni One-Step gDNARemoval and cDNA Synthesis SuperMix试剂盒反转录合成cDNA第一链。基于转录组数据获得AfFT3和AfEIN3基因的参考序列,利用Primer 5.0设计其特异引物(AfFT3-F/R和AfEIN3-F/R)(表1),通过PCR扩增获得AfFT3和AfEIN3基因全长。反应体系20.0μL:2×PrimerSTAR Max Premix 10.0μL,0.5μg/μL cDNA模板1.0μL,10μmol/L上、下游引物各0.5μL,ddH₂O补充至20.0μL。扩增程序:98℃预变性5s,98℃10s,55℃5s,72℃3s,进行35个循环;72℃延伸10 min,4℃保存。克隆至pEASY-Blunt载体并经测序验证后保种。对AfFT3基因进行生物信息学分析,分别利用NCBI数据库的ORFfinder、BLASTp和Conserved domains预测开放阅读框(ORF)、查找同源氨基酸序列及分析蛋白的保守结构域,利用ProtParam预测蛋白的理化性质,采用TMHMM 2.0预测蛋白的跨膜螺旋区,采用NetPhos 3.1预测蛋白的激酶磷酸化位点,使用MEME预测蛋白结构基序,采用MEGA 7.0构建系统发育进化树(Leiet al.,2019)。
1.4 AfFT3基因启动子克隆
将AfFT3基因起始密码子上游2000 bp启动子序列(AfFT3promoter)分3段(AfFT3-P1、AfFT3-P2和AfFT3-P3)进行扩增,利用Primer 5.0设计这3段启动子序列引物(AfFT3-pl*F/R、AfFT3-p2'F/R和AfFT3-p3'F/R)(表1)。反应体系20.0μL:2×PrimerSTAR Max Premix 10.0μL,0.5μg/μL DNA模板1.0μL,10μmolL上、下游引物各0.5 pμL,ddH₂O补充至20.0μL。扩增程序:98℃预变性5 s;98℃10 s,55℃10s,72℃10 s,进行35个循环;72℃延伸10 min,4℃保存。分别将目的片段连接至pEASY-Blunt载体,经测序验证后即为AfFT3基因起始密码子上游2000 bp的3段启动子序列(AfFT3-P1、AfFT3-P2和AfFT3-P3)(图1),其引物序列见表1。
1.5实时荧光定量PCR检测
分别提取处理后的各样品总RNA,并反转录合成cDNA第一链,方法同1.3。以SYBR Green I作为荧光染料,利用实时荧光定量PCR检测不同处理样品中的相对表达量,采用2-A^0法(Livak and Schmitt-gen,2001)计算AFT3基因在外源乙烯处理下及其在转基因拟南芥中的相对表达量,分别以蜻蜓凤梨和拟南芥的β-actin为内参基因。所用荧光定量引物如表1所示。
1.6 AfFT3基因表达载体构建
以测序验证正确的含目的基因克隆载体菌液为模板,以添加同源重组接头的引物(AfFT3*F/R)进行扩增,并利用KpnI和Xba I限制性内切酶对CAMV35S载体进行双酶切。采用ClonExpressTMIⅡOne Step Cloning Kit试剂盒构建重组表达载体,经过菌液PCR和双酶切检测验证后将其命名为CAMV35S:A/FT3,将构建成功的CAMV35S:A/FT3质粒转化GV3101农杆菌感受态细胞,并获得阳性菌液。
1.7拟南芥遗传转化、转基因株系鉴定及表型观察
采用农杆菌花序侵染法转化野生型拟南芥Col-0(Clough and Bent,1998),利用含潮霉素培养基进行抗性筛选,获得转基因阳性植株,并筛选至T₃代。提取野生型拟南芥、转空载体拟南芥和转CAMV35S::AfFT3拟南芥植株叶片总RNA,反转录合成cDNA第一链,以其为模板,使用基因特异引物进行RT-PCR鉴定。将野生型拟南芥、转空载体拟南芥和转CAMV35S:AfFT3拟南芥株系同时播种,观察各株系的生长开花情况,记录抽墓时间和莲座叶数目,分析该基因的功能。
1.8 AfFT3基因启动子与AfEIN3互作的酵母单杂交试验
以测序验证正确的含目的基因克隆载体菌液为模板,以添加同源重组接头的引物(AFT3-pl*F/R、AfFT3-p2+F/R、AfFT3-p3*F/R和AfEIN3'F/R)扩增AfFT3基因启动子片段和A/EIN3基因片段,将上述目的片段纯化回收,利用ClonExpressTMII One Step Cloning Kit试剂盒将AfFT3基因启动子片段和AfEIN3片段分别连接至pHIS2和pGADT7-Rec2-53载体上,并转化大肠杆菌Trans-T1感受态细胞,菌落PCR后挑取阳性菌液进行测序。提取阳性克隆质粒,将pHIS2+AfFT3promoter转化Y187酵母感受态细胞,涂布在SD/-Trp-His固体培养基上,待长出菌落后,挑取单菌落稀释后涂布到SD/-Trp-His不同浓度梯度的3-氨基-1,2,4-三唑(3-AT)培养基,筛选出能抑制组氨酸渗漏的最低3-AT浓度。再将pHIS2-AfFT3promoter+pGADT7-Rec2-53-AfEIN3、pGADT7-Rec2-53+p53HIS2(阳性对照)和pGADT7-Rec2-53+pHIS2(阴性对照)分别共转化Y187酵母感受态细胞中,涂布于SD/-Trp-Leu固体培养基上,待长出单菌落后,取单菌落稀释10、100和1000倍后点涂在三缺固体培养基(-Trp/-Leu/-His,含有适宜浓度的3-AT)上,观察各组菌落的生长情况,确定其互作关系。
2结果与分析
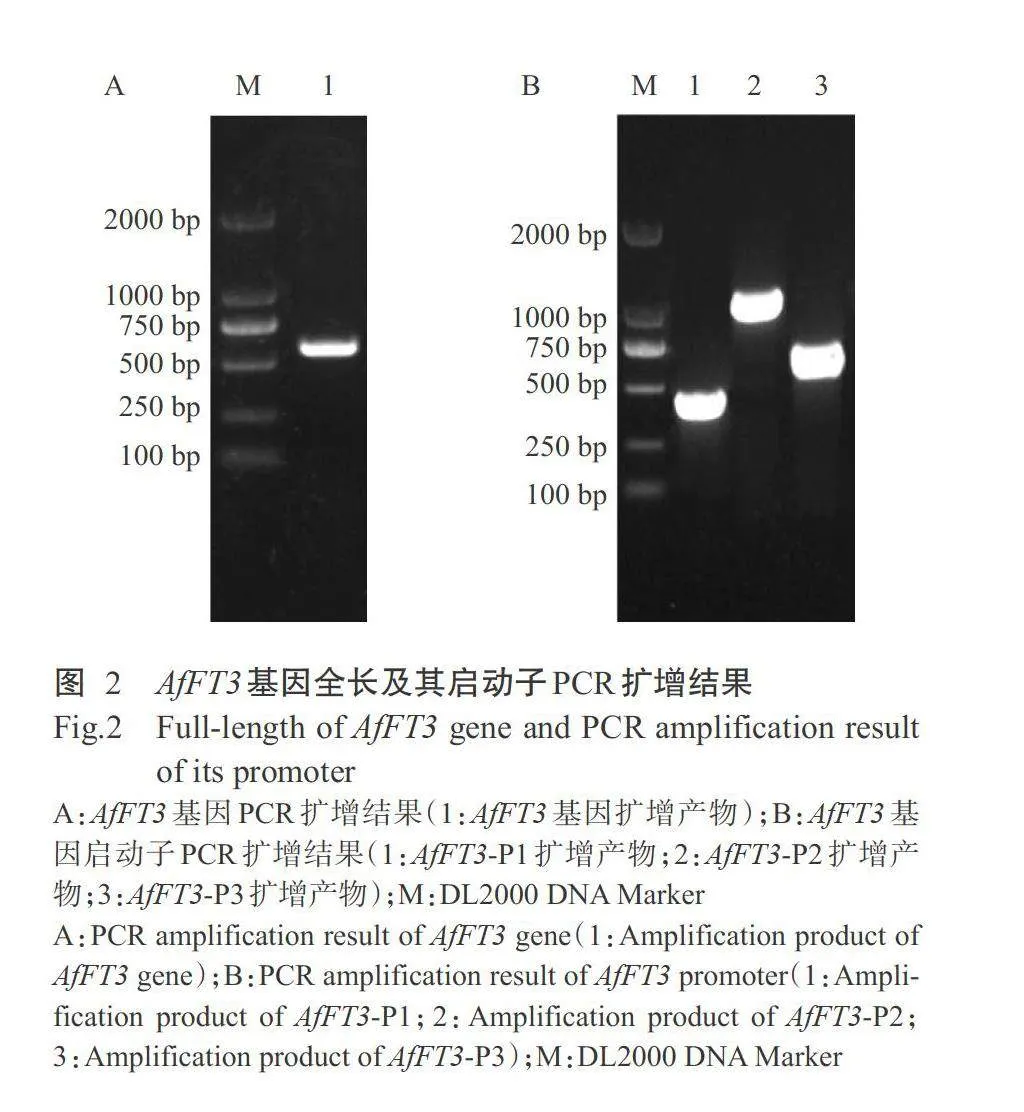
2.1 AfFT3基因及其启动子克隆结果
提取蜻蜓凤梨心叶总RNA并反转录合成为cDNA第一链,以其为模板进行PCR扩增,结果如图2-A。获得的AfFT3基因全长570 bp,编码区(CDS)序列为465 bp,测序结果与参考序列完全一致,克隆载体菌液保存于-80℃。以蜻蜓凤梨DNA为模板分段扩增获得A/FT3基因启动子3段序列(A/FT3-P1、A/FT3-P2和A/FT3-P3),序列长度分别为390、1077和552 bp(图2-B),测序验证正确后菌液保存备用。
2.2 AfFT3基因生物信息学分析结果
AfFT3基因编码154个氨基酸残基,含精氨酸(Arg)最多,不含吡咯赖氨酸(Pyrrolysine)和硒代半胱氨酸(Selenium cysteine),该蛋白分子量为17.3 kD理论等电点(pI)为9.35,不稳定指数和平均亲水性指数(GRAVY)分别为39.89和-0.330,说明该蛋白较稳定,为亲水性蛋白。为进一步了解该蛋白是否有其他膜结合相关的结构域,利用TMHMM 2.0预测发现,该蛋白无跨膜螺旋区(图3),说明该蛋白不是跨膜蛋白。通过SOPMA预测发现,AfFT3蛋白二级结构主要由α-螺旋(11.61%)、延伸链(27.74%)和无
规则卷曲(56.77%)构成。通过NetPhos 3.1预测发现,AfFT3蛋白有PKC、PKA、cdc2、INSR和GSK3等多个蛋白激酶磷酸化位点,为后续探究该基因功能调控机制提供参考。
选取拟南芥(Arabidopsis thaliana)、玉米(Zea mays)、水稻(Oryza sativa)、烟草(Nicotiana tabacum)、陆地棉(Gossypium hirsutumL.)和菠萝(Ananas como-sus)6个物种的FT蛋白与AfFT3蛋白进行多重比对及结构域分析,结果显示,AfFT3蛋白与其他FT蛋白具有高度相似性,且均包含保守的PEBP结构域(图4),说明AfFT3属于PEBP家族,且其中2个氨基酸残基138Trp和¹40GIn突变为1³⁸Met和¹4Glu。MEME分析结果显示,AfFT3蛋白与其他FT蛋白具有基本一致的保守基序,进一步验证了以上结果(图5)。从系统发育进化树(图6)可看出,PEBP家族可分为FT-like、TFL1-like和MFT-like蛋白亚家族,AfFT3属于FT-like蛋白亚家族,与TFL-like亚家族亲缘关系较近,与MTFL-like亚家族的亲缘关系较远,说明AfFT3蛋白具有与FT-like或TFL-like蛋白家族相似的功能。
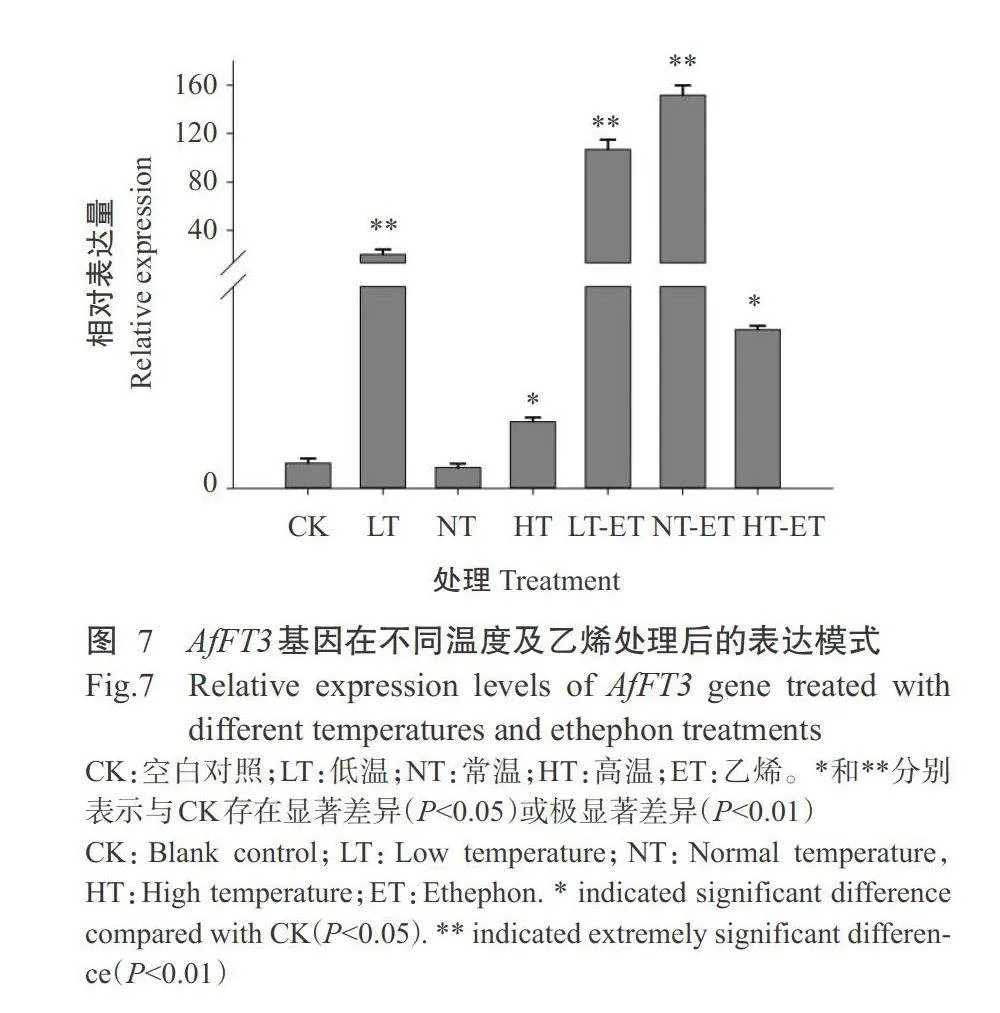
2.3 AfFT3基因在不同温度及外源乙烯处理下的表达分析结果
对蜻蜓凤梨进行不同温度和外源乙烯处理,通过实时荧光定量PCR检测AfFT3基因在不同温度及外源乙烯处理下表达水平变化,结果(图7)显示,与CK相比,高温处理下A/FT3基因在蜻蜓凤梨中的相对表达量均显著升高(Plt;0.05,下同),而低温处理下相对表达量差异极显著升高(Plt;0.01,下同),常温处理与CK的相对表达量差异不显著(Pgt;0.05,下同),可排除大棚与气候培养箱不同环境引起的基因表达差异,表明高温和低温胁迫均诱导AfF73基因的高效表达,但诱导程度不同。在高温、常温和低温条件下,使用外源乙烯处理后,AfFT3基因在蜻蜓凤梨中的相对表达量均较CK显著或极显著升高,在常温处理下其相对表达量最高,推测高温和低温环境下,乙烯对AFT3基因的表达诱导效果较常温有所降低,尤其在高温环境下下调更显著。
2.4 AfFT3基因表达载体构建及拟南芥转基因株系鉴定结果
将AfFT3基因连接至CAMV35S表达载体后,挑取单克隆进行菌液PCR检测,结果显示4个单克隆均与阳性对照条带大小一致,且阴性对照无扩增条带。测序结果显示,表达载体CAMV35S::AfFT3构建成功,将其转化农杆菌感受态细胞后进行培养,菌液PCR检测结果均为阳性单克隆,表明CAMV35S::AfFT3质粒已成功转化农杆菌(图8-A)。对野生型、转空载体株系及转CAMV35S::AfFT3拟南芥株系进行PCR鉴定,电泳检测结果显示,在转CAMV35S::AfFT3株系中扩增出目的基因条带(图8-B),表明AfFT3基因已成功转入拟南芥,共获得6个转基因拟南芥株系,命名为L1~L₆
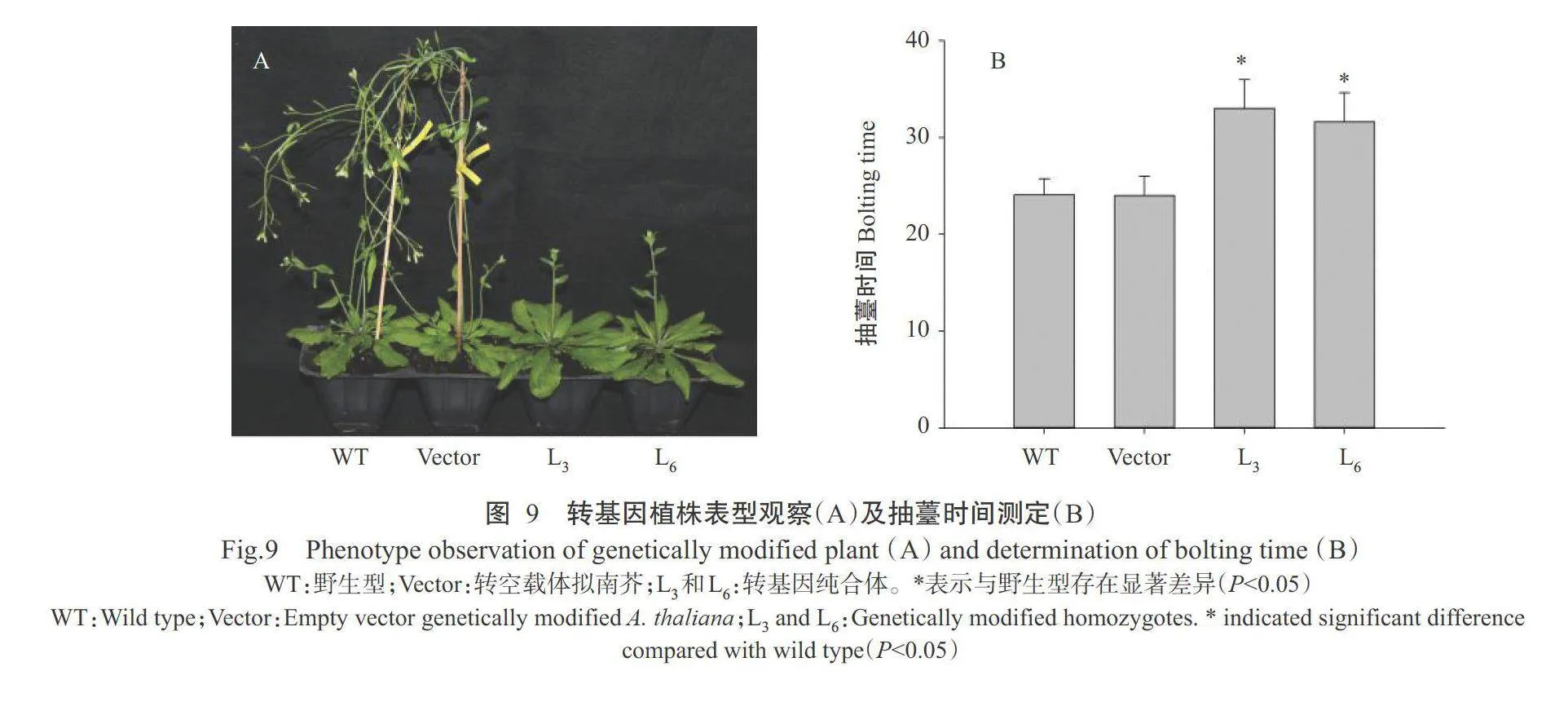
2.5 AfFT3基因表达对拟南芥开花的影响
对转基因拟南芥株系进行抗性筛选,获得超表达转基因纯合体L₃和L₆,而其他株系超表达不明显。将转基因株系和野生型拟南芥种子同时播种于基质中,对其生长状况进行观察,分别统计其抽墓时间,并观察开花情况。由图9-A可看出,转基因纯合体L₃和L₆较转空载体拟南芥和野生型拟南芥明显延迟抽墓。通过记录拟南芥抽墓时间,得出转基因株系与野生型拟南芥抽墓时间存在显著差异,平均晚8 d(图9-B),说明AfFT3基因在拟南芥中发挥延迟开花的调控功能。
2.6 AfFT3基因启动子与AfEIN3互作关系验证
通过酵母单杂交试验对AfFT3基因启动子片段和AfEIN3转录因子进行互作验证,结果发现,30℃倒置培养3~5 d后,含阳性对照质粒的菌落及含pHIS2-AfFT3-P1+pGADT7-Rec2-53-AfEIN3和pHIS2-AfFT3-P3+pGADT7-Rec2-53-AfEIN3的转化菌落均能在SD/-Trp-His-Leu固体培养基上正常生长,且在SD/-Trp-His-Leu+X-a-gal固体培养基中变蓝;含阴性对照质粒的菌落及含pHIS2-AfFT3-P2+pGADT7-Rec2-53-AfEIN3在三缺固体培养基上未长出菌落,也未变蓝(图10),表明AfFT3-P 1和AfFT3-P3可与AfEIN3发生互作。
3讨论
本研究从蜻蜓凤梨中克隆出FT-like亚家族中的AfFT3基因全长,探究其在蜻蜓凤梨生长发育过程中所发挥的作用。AfFT3基因编码的氨基酸序列含有FT蛋白的保守结构域,属于FT-like亚家族,且与TFL-like亚家族亲缘关系较近,且同源序列比对结果显示,AfFT3蛋白的¹38Trp和¹⁴0GIn分别突变为1³8Met和140Glu。FT-like亚家族最早在拟南芥中发现,大多数植物中FT-like具有促进开花的功能,FT蛋白功能相对保守,大多数残基的改变不会影响其功能。但随着研究植物种类的增加,发现FT的同源基因也会呈现抑制开花的功能,其中5个关键氨基酸位点(8STyr、0Glu、1³⁸Trp、¹4GIn和¹⁵Asn)的任意突变均导致功能的完全改变,由促进开花功能转变成其同源基因(TFL1)的抑制开花功能。如TFL1与FT氨基酸序列相似性较高,构象上存在微小差异,但功能截然相反,会抑制茎尖分生组织形成花原基,从而延迟植物开花(Fan et al.,2014;Ho and Weigel,2014;Schiessl et al.,2017)。拟南芥TFL1蛋白中氨基酸发生改变,会使其转变为开花素基因,导致植物提前开花(Xi et al.,2010)。菊花CmFTL3蛋白中氨基酸发生改变也会使其丧失促进开花的功能(Sun et al.,2018)。从烟草中分离出4个FT-like基因,其中NtFTI-3具有延迟开花的调控功能,NtFT4具有促进开花的调控功能(Harig et al.,2012)。在其他作物中也鉴定出具有相同功能的FT同源基因,如甘蔗ScFTI(Coelho et al.,2014)、大豆GmFT4(Hong et al.,2014)及矮牵牛PhFTI(Wu et al.,2019)等。结合上述研究结果,推测AfFT3基因具有延迟开花的功能,且这种功能的改变是由于残基的突变造成。
研究表明,温度对植物开花的影响不仅体现在低温诱导植物开花的春化途径中,还直接影响开花行为。当温度从20℃开始逐渐升高时,一些植物的花期会提前或延迟,一般情况下高环境温度促进开花,而低环境温度延迟开花(Jagadish et al.,2016)。拟南芥在短日照条件下开花会显著延迟,但温度较高时能克服短日照对开花延迟的影响(Halliday et al.,2003)。不同温度下FLC家族基因FLM和开花抑制因子基因SVP的表达稳定性影响了开花行为,同时发现光敏色素互作因子4基因(PIF4)、microRNA399和microRNA172等在高温下调控植物开花,而microRNA156在低温环境下表达上升,是低温下抑制开花的负调节因子(Verhage et al.,2014)。Hemming等(2012)研究发现,小麦和大麦可在25℃长日照下进行生殖发育,而在短日照下FT-like基因不表达。在中国水仙中,NFT1作为FT的同源基因,在温度升高时表达上调,从而促进了开花(Liet al.,2013)。Leeggangers等(2018)克隆获得郁金香TgFT2基因和麝香百合LIFT基因,分别在高温和低温下调控花的转变,而郁金香TgFTI和TgFT3基因却抑制开花。春兰CgSVP基因作用于花器官决定基因CgAP1和开花整合子基因CgSOCI,在低温诱导开花途径中可能发挥重要作用(Yang et al.,2019)。本研究中AfFT3基因具有抑制拟南芥开花的调控功能,通过不同温度处理后,相对表达量均呈上升趋势,但上升幅度不同,推测其表达受温度影响,从而抑制蜻蜓凤梨开花,今后应深入研究其对温度响应及开花调控机制。
乙烯是一种小分子气体植物激素,可调控植物生长发育的多个方面(Müller and Munné-Bosch 2015)。目前已研究发现,部分响应乙烯及其信号通路调控凤梨科植物开花的基因,如花器官决定基因(AfAPI)、1-氨基环丙烷-1-羧酸氧化酶2基因(AfACO2)(Lei et al.,2016;Liet al.,2016a,2016b)。利用外源乙烯可促进成花的方法很早就被应用,如乙烯熏蒸结合高温处理能提高水仙的成花率(姜琳等,2021)。申艳红等(2019)研究发现,外源乙烯处理提高了中国水仙鳞茎盘中NtFT基因的表达量,与本研究结果一致,推测AfFT3基因参与调控乙烯信号转导途径,同时受到温度途径诱导,从而影响蜻蜓凤梨开花。本研究酵母单杂交试验结果显示,AfEIN3基因可直接结合AFT3基因启动子,初步推测AfEIN3基因通过调控AfFT3基因表达从而影响蜻蜓凤梨开花,而酵母单杂交实验存在假阳性的情况,因此后续还需通过凝胶迁移等试验进行验证,其调控机制也尚待探究。
4结论
高温、低温胁迫和乙烯均不同程度诱导AfFT3基因的高效表达,但在高温和低温条件下乙烯对AfFT3基因的表达诱导效果较常温有所降低,其转基因株系延迟抽墓,说明AFT3基因参与调控蜻蜓凤梨开花过程,且响应温度和乙烯信号。
参考文献(References):
陈锡,赵德刚,陈莹,李小冬,吴佳海,王小利.2017.高羊茅FaFT2基因克隆及表达分析[J].植物生理学报,53(8):1523-1531.[Chen X,Zhao DG,Chen Y,LiXD,WuJH,Wang XL.2017.Cloning and expression analysis of FaFT2 gene in tall fescue[J].Plant Physiology Journal,53(8):1523-1531.]doi:10.13592/j.cnki.ppj.2017.0223.
丛汉卿,信彩云,张银东,李志英,徐立.2013.‘阿蒂擎天’凤梨谷胱甘肽-S-转移酶基因的克隆与乙烯诱导表达特性的初步分析[J].分子植物育种,11(3):365-370.[Cong HQ,XinCY,ZhangYD,LiZY,Xu L.2013.Cloning of glutathione-s-transferase gene and primary expression"analysis in Guzmania witmackii‘Attila’induced by ethy-lene[J].Molecular Plant Breeding,11(3):365-370.]doi:10.3969/mpb.011.000365.
姜琳,孙兴,罗可欣,郭志雄,陈桂信,佘文琴,潘东明,潘腾飞.2021.多花水仙种球膨大期对乙烯的响应研究[J].核农学报,35(6):1300-1306.[Jiang L,Sun X,Luo KX,Guo ZX,Chen GX,She WQ,Pan DM,Pan TF.2021.Response of Narcissws tazetta to ehtylene during bulb swelling phase[J].Jourmal of Nuclear Agricultural Scien-ces,35(6):1300-1306.]doi:10.11869/j.issn.100-8551.2021.06.1300.
蒋甲福,杨一曼,王琦,陈素梅,陈发棣.2021.植物开花素FT的功能及其表观调控机制的研究进展[J].南京农业大学学报,44(5):805-811.[Jiang JF,Yang YM,Wang Q,Chen SM,Chen FD.2021.Progress in mechanism of the function of florigen FT and its epigenetic regulation[J].Journal of Nanjing Agricultural University,44(5):805-811.]doi:10.7685/jnau.202012016.
李文阳,马梦迪,郭红卫.2013.植物激素乙烯作用机制的最新进展[J].中国科学:生命科学,43(10):854-863.[LiW Y,Ma MD,Guo HW.2013.Advances in the action of plant hormone ethylene[J].Scientia Sinica(Vitae),43(10):854-863.]doi:10.1360/052013-284.
申艳红,姜涛,赵湾湾,阮蔚华,张寒,周斌,陈红梅,陈晓静.2019.乙烯处理水仙催多花技术和机理的研究[J].农业生物技术学报,27(6):1003-1015.[Shen YH,Jiang T,Zhao WW,Ruan WH,Zhang H,Zhou B,Chen HM,Chen XJ.2019.Study on technology and mechanism of ethylene treatment promotes the formation of more flowers"of Narcissws tazetta var.chinensis[J].Journal of Agricul-tural Biotechnology,27(6):1003-1015.]doi:10.3969/j.issn.1674-7968.2019.06.006.
赵赫,陈受宜,张劲松.2016.乙烯信号转导与植物非生物胁迫反应调控研究进展[J].生物技术通报,32(10):1-10[Zhao H,Chen SY,Zhang JS.2016.Ethylene signaling pathway in regulating plant response to abiotic stress[J]Biotechnology Bulletin,32(10):1-10.]doi:10.13560/j.cnki.biotech.bull.1985.2016.10.001.
Abe M,Kobayashi Y,Yamamoto S,Daimon Y,Yamaguchi A,Ikeda Y,IchinokiH,Notaguchi M,GotoK,Araki T.2005 FD,a bZIP protein mediating signalsfrom the floral path-way integrator FTat the shoot apex[J].Science,309(5737):1052-1056.doi:10.1126/science.1115983.
Abe M,Kosaka S,Shibuta M,Nagata K,Uemura T,Nakano A,Kaya H.2019.Transient activity of the florigen complex"during the floral transition in Arabidopsis thaliana[J].De-velopment,146(7):dev171504.doi:10.1242/dev.171504.
CloughSJ,Bent AF.1998.Floral dip:Asimplified method for Agrobacterium-mediated transformation of Arabidopsis"thaliana[J].The Plant Journal,16(6):735-743.doi:10.1046/j.1365-313x.1998.00343.x.
Coelho CP,Minow MA A,Chalfun-Júnior A,Colasanti J.2014.Putative sugarcane FT/TFL1 genes delay flowering time and alter reproductive architecture in Arabidopsis[J].Frontiers in Plant Science,5:221.doi:10.3389/fpls.2014.00221.
Fan CM,Hu RB,Zhang XM,Wang X,Zhang WJ,Zhang QH,Ma JH,FuYF.2014.Conserved CO-FT regulons con-tribute tothe photoperiod flowering control in soybean[J].BMC Plant Biology,14:9.doi:10.1186/1471-2229-14-9.
Guo HW,Ecker JR.2003.Plant responses to ethylene gas are mediatedby SCF(EBF1/EBF2)-dependent proteolysis of EIN3 transcription factor[J].Cell,115(6):667-677.doi:10.1016/s0092-8674(03)00969-3.
Halliday KJ,Salter MG,Thingnaes E,Whitelam GC.2003.Phytochrome control of flowering is temperature sensitive and correlates with expression of the floral integrator FT[J].The Plant Journal,33:875-885.doi:10.1046j.1365-313X.2003.01674.x.
Harig L,Beinecke FA,OltmannsJ,Muth J,Müller O,Riüping B,Twyman RM,Fischer R,PrüferD,Noll GA.2012.Pro-teins from the FLOWERING LOCUS T-like subclade of the PEBP family act antagonistically to regulate floral ini-tiation in tobaco[J].Plant Journal,72(6):908-921.doi:10.1111/j.1365-313X.2012.05125.x.
Hemming MN,Walford SA,Fieg S,Dennis ES,Trevaskis B."2012.Identification of high-temperature-responsive genes in cereals[J].Plant Physiology,158(3):1439-1450.doi:10.2307/41435338.
Ho WW,Weigel D.2014.Structural features determining flower-promoting activity of Arabidopsis FLOWERING LOCUS T[J].The Plant Cell,26(3):552-564.doi:10.1105/tpc.113.115220
Hong Z,Lv SX,Shuang L,Wu H,Xia Z.2014.GmFT4,a homolog of FLOWERING LOCUS T,is positively regu-lated by EI and functions as aflowering repressor in soy-bean[J].PLoS One,9(2):e89030.doi:10.1371/journal pone.0089030
Iqbal N,Khan NA,Ferrante A,Trivellini A,Francini A,Khan MIR.2017.Ethylene role in plant growth,development and senescence:Interaction with other phytohormones[J].Frontiers inPlant Science,8:475.doi:10.3389/fpls.2017.00475.
Jagadish SVK,Bahuguna RN,Djanaguiraman M,Gamuyao"R,Prasad PVV,Craufurd PQ.2016.Implications of high temperature and elevated CO₂on flowering time in plants[J].Frontiers in Plant Science,7:913.doi:10.3389/fpls 2016.00913.
Kinoshita A,Richter R.2020.Genetic and molecular basis"of floral induction in Arabidopsis thaliana[J].Journal of"Experimental Botany,71(9):2490-2504.doi:10.1093/jxb/eraa057.
Kobayashi Y,Kaya H,Goto K,Iwabuchi M,Araki T.1999.A pair of related genes with antagonistic roles in mediating flowering signals[J].Science,286(5446):1960-1962.doi:10.1126/science.286.5446.1960.
Kralemann LE M,Scalone R,Andersson L,Hennig L.2018.North European invasion by common ragweed is associa-ted with early flowering and dominant changes in FT/TFLI expression[J].Journal of Experimental Botany,69(10):2647-2658.doi:10.1093/jxb/ery100.
Leeggangers HACF,Rosilio-Brami T,Bigas-Nadal J,Rubin N,van Djk ADJ,Nunez de Caceres Gonzalez FF N,Saadon-Shitrit S,Nijveen H,Hilhorst HWM,Immink R
G H,Zaccai M.2018.Tulipagesneriana and Lilimm longi-florum PEBP genes and their putative roles in flowering time control[J].Plant and Cell Physiology,59(1):90-106.doi:10.1093/pcp/pcx164.
Lei M,LiZY,WangJB,Fu YL,AoMF,Xu L.2016.4fAP2-1,an age-dependent gene of aechmea fasciata,responds to exogenous ethylene treatment[J].International Journal of Molecular Sciences,17(3):303.doi:10.3390/ijms17030303.
Lei M,Li ZY,Wang JB,FuYL,Xu L.2019.Ectopic expres-sion of the Aechmea fasciata APETALA2 gene AfAP2-2reduces seed size and delays flowering in Arabidopsis[J].Plant Physiology and Biochemistry,139:642-650.doi:10.1016/j.plaphy.2019.03.034.
LiM Z,An FY,LiWY,Ma MD,Feng Y,Zhang X,Guo HW.2016a.DELLA proteins interact with FLC to repress flowering transition[J].Journal of Integrative Plant Bio-logy,58(7):642-655.doi:10.1111/jipb.12451.
LiYH,WuQS,Huang X,LiuS H,Zhang HN,Zhang Z,Sun GM.2016b.Molecular cloning and characterization of four genes encoding ethylene receptors associated with"pineapple(Ananas comosus L.)flowering[J].Frontiers"Plant Science,7:710.doi:10.3389/fpls.2016.00710.
Li ZY,Wang JB,Zhang XB,Zhu GP,FuY L,Jing YL,"Huang BL,Wang XB,Meng CY,YangQQ,Xu L.2022.The genome ofAechmea fasciataprovides insights into the evolution of tank epiphytic habits and ethylene-induced flowering[J].Communications Biology,5(1):920.doi:10.1038/s42003-022-03918-4.
Livak KJ,Schmittgen TD.2001.Analysis of relative gene expression data using real-time quantitative PCR and the"2-A^0method[J].Methods,25(4):402-408.doi:10.1006/meth.2001.1262.
Luo X,Chen T,Zeng XL,He DW,He YH.2019.Feedback"regulation of FLC by FLOWERING LOCUS Tand FD"through a 5FLC promoter region[J].Molecular Plant,12(3):285-288.doi:10.1016/j.molp.2019.01.013.
Müller M,Munné-Bosch S.2015.Ethylene response factors:A key regulatory hub in hormone and stress signaling[J] Plant physiology,169(1):32-41.doi:10.1104/pp.15.00677.Nakamura S,Abe F,Kawahigashi H,Nakazono K,Tagiri A, Matsumoto T,Utsugi S,Ogawa T,Handa H,Ishida H, Mori M,Kawaura K,OgiharaY,Miura H.2011.A wheat homolog of MOTHER OF FTAND TFL1 acts in the regu-lationof germination[J].The Plant Cell,23(9):3215-3229.doi:10.1105/tpc.111.088492.
Peng FY,Hu ZQ,Yang RC.2016.Bioinformatic prediction of transcription factor binding sitesat promoter regions of"genes for photoperiod and vernalization responses in model and temperate cereal plants[J].BMC Genomics,17:573.doi:10.1186/s12864-016-2916-7.
Schiessl SV,Huettel B,Kuehn D,Reinhardt R,Snowdon RJ.2017.Flowering time gene variation in Brassica species showsevolutionary principles[J].Frontiers in Plant Scien-ce,8:1742.doi:10.3389/fpls.2017.01742.
Shim JS,Jang G.2020.Environmental signal-dependent regu-lation of flowering time in rice[J].International Journal of Molecular Sciences,21(17):6155.doi:10.3390/ijms21176155.
Sun J,Cao PP,Wang LJ,Chen SM,Chen FD,Jiang JF.2018.The loss of asingle residue from CmFTL3 leads to the failure offlorigen to flower[J].Plant Science,276:99-104.doi:10.1016/j.plantsci.2018.08.005
Taoka K,Ohki I,Tsuji H,Furuita K,Hayashi K,Yanase T,Yamaguchi M,Nakashima C,Purwestri YA,Tamaki S,Ogaki Y,Shimada C,NakagawaA,Kojima C,Shimamoto K.2011.14-3-3 proteins act as intracellular receptors for-rice Hd3a florigen[J].Nature,476:332-335.doi:10.1038/nature10272.
Verhage L,Angenent GC,Immink RGH.2014.Research on floral timing by ambient temperature comes into blossom[J].Trends in Plant Science,19(9):583-591.doi:10.1016/j.tplants.2014.03.009.
Wu L,Li F,Den QH,Zhang SS,Zhou Q,Chen F,Liu BJ,Bao MZ,Liu GF.2019.Identification and characteriza-tion of the FLOWERING LOCUS T/TERMINAL FLOWER 1 gene family in Petumia[J].DNA and Cell Bio-logy,38(9):4720-4734.doi:10.1089/dna.2019.4720.
XiWY,Liu C,Hou XL,Yu H.2010.MOTHER OF FT AND TFLI regulates seed germination through anegative feed-back loop modulating ABA signaling in Arabidopsis[J].The Plant Cell,22(6):1733-1748.doi:10.1105/tpc.109.073072.
Yang FX,Zhu GF,Wei YL,Gao J,Liang G,Peng LY,LuC Q,Jin JP.2019.Low-temperature-induced changes in the transcriptome reveal amajor role of CgSVP genes in regu-lating flowering of Cymbidium goeringii[J].BMC Geno-mics,20(1):53.doi:10.1186/s12864-019-5425-7.
(责任编辑 陈燕)

