辣椒根际土壤细菌群落与理化性质互作分析





摘要:【目的】分析辣椒根际土壤细菌群落与理化性质的互作,为科学防治辣椒土传病害和辣椒高产优质栽培提 供参考依据。【方法】以辣椒苗期、花期和坐果期根际土壤(分别标记为SD、FR和FT)为研究对象,测定3组土壤样本中 pH、有机质、总氮、碱解氮、总磷、有效磷、总钾和有效钾含量,采用Illumina HiSeq2500测序平台进行高通量测序,分析辣椒不同生育期根际土壤细菌Alpha多样性指数及门和属分类水平上相对丰度,通过主坐标分析(PCoA)和基于Bray_Curtis距离的细菌群落不相似性检验,分析辣椒不同生育期根际土壤细菌与理化因子的相关性。【结果】随着辣椒生长,SD、FR和FT三者间的pH和碱解氮含量2个指标具有显著差异(Plt;0.05,下同);3个生育期土壤细菌的Alpha多样性指数和丰富度、Chao1指数均无显著差异(Pgt;0.05);SD中特有操作分类单元(OTUs)数目最多;3个生育期土壤中 变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)和蓝细菌门 (Cyanobacteria)均属于优势菌门;SD根际土壤中链霉菌属(Streptophyta)、嗜酸菌属(Acidovorax)、亚硝化球菌属(Nitrososphaera)和Gp6相对丰度较高,FR根际土壤中链霉菌属、亚硝化球菌属(Nitrososphaera)和红游动菌属(Rho- doplanes)的相对丰度较高,FT以链霉菌属和Trinickia为主。主坐标分析(PCoA)和不相似性检验结果显示,不同生育 期根际土壤样本细菌群落之间差异显著。相关分析结果显示,土壤pH和碱解氮与细菌群落呈极显著正相关(Plt;0.01)。【结论】辣椒根际土壤理化性质及细菌群落结构因生育期不同存在差异,pH和碱解氮是影响细菌群落变化的关 键因子。
关键词:生育期;根际;细菌群落;高通量测序
中图分类号:S641.3
文章编号:2095-1191(2024)04-0964-09
文献标志码:A
Interaction analysis of bacterial communities and physicochemi-cal properties in rhizosphere soil of pepper LUO Lu-yun1, WANG Dian-dong1, ZHAO Zhi-xiang2, LIAO Jing-jing1,JIANG Bo1, ZHANG Zhuo3*
(1School of Advanced Agriculture and Bioengineering, Yangtze Normal University, Chongqing 408100, China; 2Plant Protection Institute, Hainan Academy of Agricultural Sciences/Hainan Key Laboratory for Control of Plant Diseases and Insect Pests, Haikou, Hainan 571100, China; 3Institute of Plant Protection, Hunan Academy of Agricultural Sciences/ Key Laboratory of Pest Management of Horticultural Crop of Hunan Province, Changsha, Hunan 410125, China)
Abstract: [Objective] To analyze interaction between pepper rhizosphere soil bacterial community structure and physicochemical properties, which could provide reference for scientific prevention and control of soil-borne diseases and high yield and high quality cultivation of pepper. 【Method]In this study, the rhizosphere soils of pepper plants at seedling stage (SD), flowering stage (FR), and fruiting stage (FT) were investigated. The pH, organic matter, total nitrogen, al- kaline nitrogen, total phosphorus, available phosphorus, total potassium, and available potassium contents in three soil samples were determined. High-throughput sequencing using the Illumina HiSeq 2500 platform was performed to analyzethe bacterial Alpha diversity indexes, relative abundance at phylum and genus levels in the rhizosphere soils of pepper plants at different growth stages. Principal coordinate analysis (PCoA) and dissimilarity analysis based on Bray-Curtis distance was conducted to assess the bacterial communities among different growth stages and the correlation with physicochemical factors. 【Result ]The results showed significant differences in pH and alkaline nitrogen content among SD, FR and FT as pepper plants grew (Plt;0.05, the same below). The Alpha diversity indexes, richness and Chaol index of soil bacterial communities in the three growth stages showed no significant differences (Pgt;0.05). The SD soil had the highest number of unique operational taxonomic units (OTUs). Proteobacteria, Actinobacteria, Acidobacteria, Bacteroidetes, and Cyanobacteria were dominant phyla in the rhizosphere soils of the three growth stages. Streptophyta, Acidovorax, Ni- trososphaera and Gp6 had relatively high abundance in the SD rhizosphere soil. Streptophyta, Nitrososphaera and Rhodo- planes had relatively high abundance in the FR rhizosphere soil. Streptophyta and Trinickia were dominant genera in the FT rhizosphere soil. Principal coordinate analysis (PCoA) and dissimilarity analysis revealed significant differences among bacterial communities in rhizosphere soil samples from different growth stages. The correlation analysis showed ex- tremely significant and strong positive correlation between pH and alkaline nitrogen with bacterial communities (Plt;0.01).【Conclusion】 The physical and chemical properties of pepper rhizosphere soil and the structure of bacterial community vary with different growth stages. PH and alkaline nitrogen are key factors influencing the change in bacterial communi- ties.
Key words: growth stage; rhizosphere; bacterial community; high-throughput sequencing
Foundation items: National Natural Science Foundation of China (32272517) ; Chongqing Natural Science Foundation (CSTB2022NSCQ-MSX0307) ; Hunan Agricultural Science and Technology Innovation Fund Project (2022CX68) ; Scientific and Technological Research Project of Chongqing Education Commission (KJQN202001433)
0 引言
[研究意义]辣椒(Capsicum annuum L.)是起源于南美洲热带地区的一年生或多年生的草本植物(邹学校和朱凡,2020),既用作香料、烹饪材料,也因富含辣椒素、类胡萝卜素等成分用作传统草药治疗疾病(Sarpras et al.,2018)。目前,我国辣椒的种植面积、产量和产值分别占全国蔬菜的 9.28%、7.76%和 11.36%,且辣椒种植面积及产量均居世界第一(邹学校等,2020)。辣椒在全球广泛种植,我国主要在贵州、湖南、四川、新疆等地大量种植。近年来,随着辣椒产业规模扩大及种植品种单一等原因,辣椒病害发生日趋严重,产量和品质严重下降,制约了辣椒产业可持续发展。应用抗病品种和改良栽培环境是防治作物病害发生最有效方法。辣椒自明代传入我国,经长期栽培驯化,我国已成为辣椒次生起源中心,拥有大量优质且抗病的辣椒种质资源用来选育辣椒抗病品种(杨中周,2017;郑井元等,2018);在栽培环境影响辣椒病害发生的各种因素中,诸如根与叶表面寄居着的多种拮抗微生物具多样化功能(Schmidt et al.,2019),辣椒在生长发育的各个时期都可能遭到病原菌侵染而发病,土壤微生物群落结构可影响植物病害发生(韩凤等,2021)。根系渗出物可吸引有益微生物并影响根际微生物群的组装,从而提高植物适应环境的能力,影响植物的生长发育(Berendsen et al.,2012; Tkacz and Poole,2015)。根际微生物在土壤物质循环和作物生长发育中发挥着重要作用(刘福童等,2022),辣椒生长和健康也必然受根际微生物影响。根际土壤微生物群落组成亦受到植物种类、生长状态及生育期的调节,因此,分析辣椒根际土壤细菌群落与理化性质互作对科学防治辣椒土传病害及辣椒的高产优质栽培具有重要意义。【前人研究进展】不同植物的根际微生物群落结构和多样性在一定程度均受到生育期影响。祝明炜等(2011)研究发现刺萼龙葵从生长初期到开花期土壤真菌多样性显著增加,生长初期、四叶期、现蕾期和开花期真菌群落也发生显著变化。孙建波等(2016)的研究结果表明随着香蕉生长期增加,根际土壤细菌数量逐渐增加随后逐渐减少,而根际细菌多样性呈逐渐减少趋势。Wang等(2016)研究表明作物、施肥方案和植物发育阶段均影响小麦和水稻土壤微生物群落结构。Na等(2019)研究发现谷子不同发育阶段根际细菌群落的多样性和组成存在显著差异,随着植物成熟,根际细菌群落的丰富度和均匀度显著降低。李巧玲等(2021)发现辣椒各生育期土壤细菌多样性呈先升高后降低的变化趋势,在果实膨大期多样性最丰富。Sohn等(2021)发现根际和根瘤中的细菌群落因大豆品种和生长阶段不同而发生变化,放线菌在所有生长阶段的根际分布最为丰富,其次是α蛋白菌和酸杆菌,拟杆菌门(Bacte-roidetes)的变化最大。Ajilogba等(2022)发现在不同班巴拉花生的生长阶段,根际的细菌结构发生显著变化,具有更高丰度的潜在植物生长促进根际细菌,芽孢杆菌属(Bacillus)和酸杆菌属(Acidobacte-rium)数量显著增加。魏宇飞等(2023)发现不同生育期番茄根际土壤微生物群落结构和功能发生显著变化。土壤养分是植物生长的重要来源,根际微生物则参与养分的转化和供应。土壤养分也影响根际微生物的变化。Wu等(2018)利用高通量基因测序技术发现超级稻抽穗期的根际细菌群落与作物产量有显著相关,微生物与养分之间的正交互作用可能对产量有显著贡献。Wang等(2019)发现施用猪粪可降低氮磷钾肥对水稻抽穗期和成熟期细菌群落的影响,pH、有机质和有效钾是影响各阶段微生物群落变化的关键因素,土壤细菌及其功能在水稻关键生育期具有明显演化史。Jia等(2020)发现叶际和根际真菌群落结构在各个发育阶段均不同,分别受植物碳和土壤硫介导。陈秋圆等(2022)研究发现水稻分蘖期和拔节、孕穗期的土壤细菌群落结构存在差异,水稻产量与分蘖期土壤细菌数量呈显著负相关,而与拔节、孕穗期土壤细菌数量和全氮含量均呈显著正相关。【本研究切入点】目前,作物生长期对土壤微生物群落结构影响在其他园艺作物上研究较多,而有关辣椒不同生育期根际土壤微生物的研究鲜见报道。【拟解决的关键问题】通过温室试验采集辣椒不同生育期的根际土壤,利用高通量测序技术分析辣椒不同生育期对根际微环境的影响,以期揭示辣椒不同生育期根际微生物与土壤理化性质的动"态变化,为科学防治辣椒土传病害及辣椒高产优质栽培提供参考依据。
1 材料与方法
1.1试验材料
辣椒品种为湘研15号,种子购自湖南湘研种业有限公司。主要试剂:FastDNA® Spin Kit for Soil试剂盒(美国MP Biomedicals公司)。主要仪器设备:NanoDrop 2000微量分光光度计(美国赛默飞公司)
1.2试验方法
1.2.1样本采集及处理
试验土壤采集自重庆市涪陵区李渡镇种植基地,2021年4月23日于花盆中播种辣椒种子,共播种180粒种子,每花盆播种1株。分别于2021年5月7日、6月5日和7月9日的辣椒苗期、花期和坐果期采集辣椒根际土壤样本,3个时期土壤样本分别标记为SD、FR和FT,每生育期选择长势均匀并具代表性的30株辣椒植株,平均分成6组,每组1个生物学重复,将辣椒植株连同根部土壤一同拔出,采用抖根法抖去附着在根系的颗粒状土壤及杂质。将植株的根和茎分离后,选取同组5株辣椒根置于无菌袋中,收集根部黏附土壤,自然风干后过2mm筛,用于土壤理化性质测定。取辣椒根部于50mL离心管中,加入浓度为0.05mol/L的磷酸盐缓冲液45.0mL,摇晃使土壤从根部分离,然后用镊子
取出根,剩余液体于5000r/min离心10min后,放入 冷冻干燥机冷冻干燥,密封放入-20℃冰箱保存用于 高通量测序。
1.2.2土壤理化指标测定
采用pH计(土水比为1:2.5)测定土壤pH。采用重铬酸钾容量法测定有 机质含量,碱解法测定总氮和碱解氮含量,钼锑抗比 色法测定总磷和有效磷含量,硝酸一盐酸提取一火 焰光度法测定总钾和有效钾含量(鲁如坤,2000)。
1.2.3总DNA提取
称取土样0.5g,用FastDNA® Spin Kit for Soil 试剂盒提取土壤总DNA,用Nano- Drop2000微量分光光度计测定总DNA浓度和纯 度。将检测合格样本的DNA进行扩增前基因组DNA浓度定量。定量后终浓度稀释为30 ng/uL备用。以样本DNA为模板,使用通用引物515F(5'-GT GCCAGCMGCCGCGGTAA-3')和806R(5'-GGACT ACHVGGGTWTCTAAT-3')进行PCR扩增,反应体 系和扩增程序参照罗路云等(2017)。每条引物5端 使用12 bp的Barcode序列区分各样本。将纯化后 PCR产物送至北京新科开源基因科技有限公司采用 Illumina HiSeq 2500测序平台进行高通量测序。
1.2.4序列处理与分析
原始测序经过双端拼接、 过滤和去除嵌合体后,得到优化序列。然后在相似 性97%的水平下使用Uparse软件对优化序列聚类 获得操作分类单元(OTU),保留在所有样本中总数大于1的OTUs,经过标准化后生成Resample_OTU 表,计算样本Alpha多样性指数(Shannon、Simpson、丰富度和Chao1指数)。采用主坐标分析(PCoA)、非参数多反应置换法(MRPP)、相似性分析(ANOSIM)和非参数多变量置换法(Adonis)方差分析鉴定比较组间(SD vs FR、SD vs FT和FR vs FT)细菌群落结构差异。采用冗余分析法(RDA)分析细菌群落和 理化性质之间相关性。原始测序处理及后续分析在 中国科学院生态环境研究中心Galaxy分析平台上 进行。
1.3统计分析
使用SPSS20.0对土壤理化性质、多样性指数和 排名前15优势属的相对丰度进行单因素方差分析(One-way ANOVA)及Duncan's新复极差法进行多重比较,并以Graphpad 8.0制图。
2结果与分析
2.1辣椒不同生育期根际土壤理化分析结果
由辣椒不同生育期根际土壤理化性质结果(图1)可知,随着辣椒生长,根际土壤pH和养分含量呈不同的变化趋势,pH、总磷、有效磷和碱解氮含量逐渐降低,其中SD、FR和FT三者间的pH和碱解氮含量具有显著差异(Plt;0.05,下同);随着辣椒生育 期延长,3组样本的有效钾、总钾、总氮含量呈先降低 后升高的变化趋势,土壤有机质含量则逐渐升高。 辣椒生长的根际土壤为偏酸性环境,pH为4.64~ 6.70。从苗期到花期,土壤中有效磷和碱解氮含量 显著降低;从花期到坐果期,土壤中有效钾含量显著 升高,碱解氮浓度显著降低,有效磷无显著变化。
2.2辣椒不同生育期根际土壤细菌Alpha多样性 指数及OTU分析结果
对3个生育期18份辣椒根际土壤样本进行高通 量测序,原始序列经过滤、双端拼接获得有效序列 997495条,平均每个样本的有效序列数为55417条。 在97%的相似度水平下进行OTU分类获得6235个OTUs,样本OTUs数为1848~2979。
对辣椒SD、FR和FT根际细菌群落进行Alpha 多样性分析,各样本中的多样性指数结果(表1)显 示,3个生育期土壤细菌的Shannon和Simpson指数均无显著差异(Pgt;0.05,下同);丰富度和Chao1指数也无显著差异;FR多样性和物种丰富度较高。
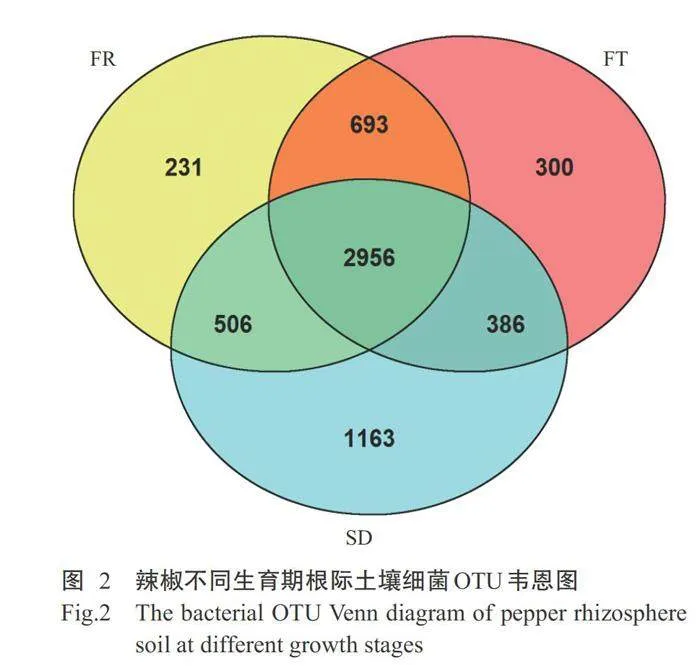
从图2可知,3组样本共有的OTUs2956个,SD、FR和FT特有的OTUs数目分别为1163、231和300个,其中SD中特有OTUs数目最多;SD和FR共有3462个OTUs,其次FR和FT共有3649个OTUs,SD和FT共有3342个OTUs。
2.3辣椒不同生育期根际土壤优势细菌在门和 属分类水平上相对丰度分析结果
在门分类水平对辣椒不同生育期根际土壤细菌 种群进行分析,结果(图3)显示,3个生育期土壤中 变形菌门(Proteobacteria)、放线菌门(Actinobacte- ria)、酸杆菌门(Acidobacteria)、拟杆菌门和蓝细菌门(Cyanobacteria)均属于优势菌门,5个门相对丰度 占比69.85%~81.24%。3个生育期细菌门组成基本 一致,但相对丰度存在差异,其中变形菌门相对丰度 最高,占比36.96%~48.99%,SD变形菌门相对丰度最高,FR相对丰度最低;其次为放线菌门,相对丰度为7.97%~12.81%,SD放线菌门相对丰度最低,FR的 相对丰度最高。
在属分类水平上,将相对丰度排名前15的细菌进行单因素方差分析(图4)可知,从辣椒苗期到坐果期,链霉菌属(Streptophyta)、Trinickia和放射土壤杆菌属(Agrobacterium)相对丰度逐渐增加;嗜酸菌属(Acidovorax)和Gp6相对丰度逐渐减少;亚硝化螺菌属(Nitrososphaera)、红游动菌属(Rhodoplanes)、鞘脂单胞菌属(Sphingomonas)、慢生根瘤菌属(Brady-rhizobium)、 Spartobacteria genera incertae sedis、Subdivision3 genera incertae sedis和亚硝化螺旋菌属相对丰度先增加后减少;马赛菌属(Massilia)和黄杆菌属(Flavobacterium)相对丰度先显著减少后显著增加。辣椒不同生育期根际细菌丰度各不相同,辣椒SD根际土壤细菌相对丰度大于3%的优势属包括链霉菌属、嗜酸菌属、亚硝化球菌属和Gp6,FR的链霉菌属、亚硝化球菌属和红游动菌属的相对丰度较高,FT中链霉菌属和Trinickia相对丰度较高。
2.4辣椒不同生育期根际土壤细菌群落结构
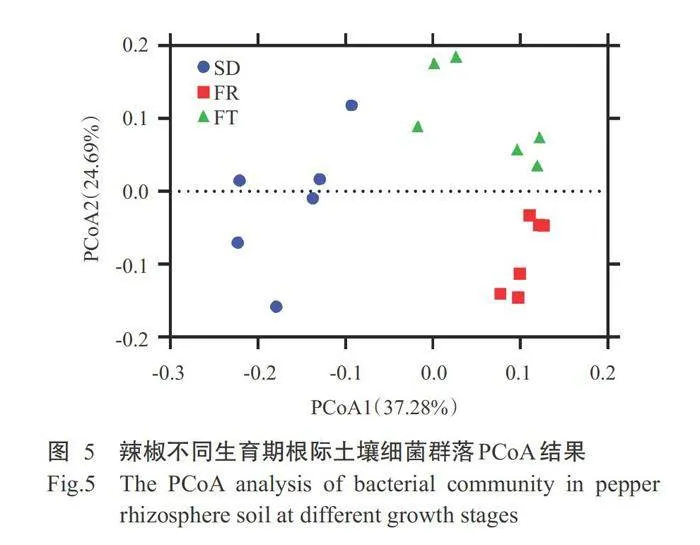
由图5可知,不同生育期根际土壤样本明显分 开,土壤样本分布在坐标轴上的不同区间,第一主坐 标(PCoA1)解释细菌群落37.28%差异,第二主坐标(PCoA2)解释细菌群落24.69%差异,二者共解释辣 椒不同生育期根际土壤细菌群落总差异的61.97%。
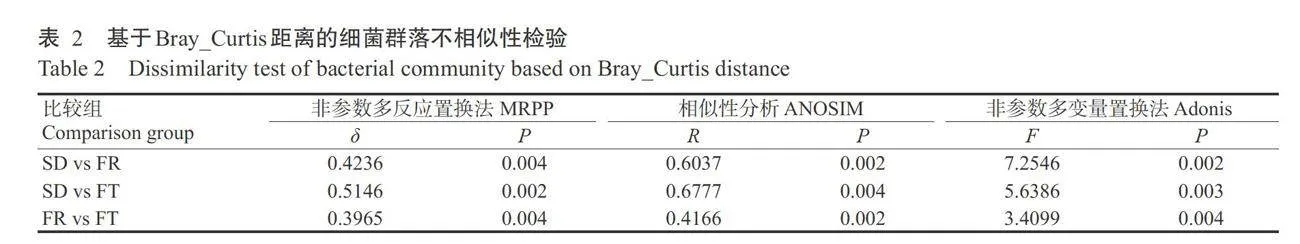
相似性分析结果(表2)表明,不同生育期根际土 壤样本细菌群落之间差异显著,与非参数多反应置 换法和非参数多变量置换法结果一致。
2.5辣椒不同生育期根际土壤细菌与理化因子相关 分析结果
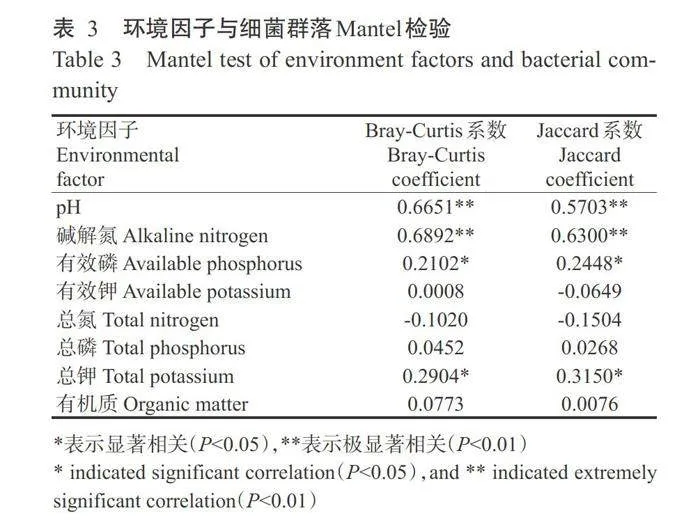
通过RDA可进一步了解环境因子和细菌群落 结构之间的关系(图6),2个坐标轴共解释55.3%的 细菌群落变异,其中第一轴(RDA1)解释47.2%的细菌群落变异,第二轴(RDA2)解释8.1%的细菌群落变异。此外,Mantel检验结果(表3)表明,pH、碱解氮、有效磷和总钾均与细菌群落显著或极显著(Plt;0.01)正相关,其中pH和碱解氮与细菌群落相关系 数较高,是影响细菌群落变化的关键因子。
3讨论
植物生长所需养分直接来自土壤,土壤理化性 质直接影响作物生长发育。Wang等(2019)研究发 现施用猪粪可降低氮磷钾肥对水稻抽穗期和成熟期 细菌群落的影响,pH、有机质和有效钾是影响各阶 段微生物群落变化的关键因素。李巧玲等(2021)研 究发现栀子根际土壤养分、酶活性及根际细菌组成 均随生育期改变发生动态变化。本研究中对辣椒不 同生育期根际土壤pH和养分进行分析,发现根际土 壤pH和养分含量随着辣椒生长演替而出现不同程 度变化,有效磷、碱解氮浓度随着辣椒生长逐渐降 低,有效钾先降低后升高,表明随着辣椒生长,植株 对土壤氮、磷元素的吸收更加活跃,花期植株对钾元 素的吸收高于其他生育期;同时辣椒根际土壤有机 质浓度逐渐升高,pH逐渐降低,表明随着辣椒生长, pH逐渐降低促进有机质降解从而使养分更容易被 植株吸收利用。因此,辣椒不同生育期根际土壤pH 和养分含量均不同,与前人研究发现根际土壤理化 性质受植物生育期影响的结果一致(Zhai et al.,2018;Guo et al.,2020)。
生物物种丰富度是农业生态系统恢复力、可持续性和生产力的关键(Mace et al.,2012)。孙建波等(2016)研究发现,随着香蕉生长,根际土壤细菌数量先增加后逐渐减少,但根际细菌多样性逐渐减少。Dong等(2018)发现,相较幼龄人参,成年人参根际土壤中细菌多样性降低,真菌多样性增加,说明微生物群落与人参植株的不同年龄和发育阶段有关。李巧玲等(2021)研究发现栀子各生育期土壤细菌多样性呈先升高后降低的变化趋势,其中果实膨大期细菌群落多样性最为丰富。本研究中根际细菌群落Alpha多样性指数(Shannon和Simpson指数)和丰富度指数(Chao1和丰富度指数)在辣椒3个生育期差异均不显著,但总体呈现先升高后降低的变化趋势。与佘冬立等(2007)研究认为花期时植株生长代谢旺盛,分泌物和代谢物较多,有利于各种细菌生长的结论一致。同时作物不同生育期富集的微生物也有一定差异。魏宇飞等(2023)发现不同生育期番茄植株根际土壤富集了种类与功能相异的微生物。本研究采集的辣椒3个生育期土壤样本最丰富的为变形菌类群,不同生育期、同一细菌门类的相对丰度存在一定差异。变形菌被认为是富营养菌,具有相对较快的生长速度和利用各种底物的能力,参与养分的再循环与氮代谢(Sun et al.,2019)。Akifumi等(2014)发现在土豆各个生长阶段,芽孢杆菌、缓生根瘤菌和根瘤菌等潜在植物促生菌的相对丰度较高,且具有阶段特异性。转基因抗虫棉及其不同生育期根际土壤变形菌门、酸杆菌门、芽单胞菌门、蓝细菌门和绿弯菌门的相对丰度存在显著差异(王甜甜等,2021)。本研究中辣椒根际细菌相对丰度在各个生育期各不相同,进一步证实辣椒对其根际定殖的土壤细菌具有选择性,每个生育期的根际细菌种群在一定程度上受植物发育阶段的显著影响(Li et al.,2014;Yuanet al.,2015)。本研究中辣椒不同生育期根际土壤样本明显分开,根际土壤样本细菌群落之间差异显著,说明辣椒不同生育期影响土壤结构并表现出显著的根际效应,这些细菌在根际能够大量定殖可能与该生育期植株的生理功能有关,猜测是根系分泌物促使某些细菌在土壤中富集。
土壤微生态环境会影响植物生长,土壤微生物作为影响土壤肥力的重要因素参与土壤物质循环调节,根系分泌物可刺激或抑制土壤微生物释放营养物质、感染根系或通过信号改变植物生长(Watt etal.,2016)。Zhai等(2018)研究发现,水稻分蘖期根际微生物群落组成与NH+、总氮、pH、微生物量和生物碳的相关性最强,而成熟期微生物群落组成与磷、碳/氮、总碳和有效钾相关。根系分泌物是促进根际效应的主要成分,改变了细菌群落(Li et al.,2019)。陈秋圆等(2022)也发现土壤细菌群落构成及生态功能在分蘖期和拔节至孕穗期间存在明显差异,并受到氮肥施用比例影响。本研究中相关分析结果显示,pH和碱解氮与细菌群落呈极显著正相关,说明辣椒根际细菌群落结构组成受土壤环境因子影响,其中pH与碱解氮是影响细菌群落变化的关键因子。碱解氮是土壤微生物最主要氮源,氮增加会刺激磷酸酶活性,有研究表明长期氮输入会降低土壤pH,抑制微生物生长,改变微生物群落组成(Rousk etal.,2010;Blanes et al.,2012)。在实际生产中,可通过适当调整辣椒根际土壤微环境改善土壤质量,进而促进辣椒生长和防治病害。
4 结论
辣椒根际微生物群落结构因生育期不同存在 差异,土壤pH和碱解氮是影响细菌群落变化的关键因子。
参考文献(References):
陈秋圆,赵帅兵,梁贺,刘晔,崔燕妮,彭廷,赵全志,张静.
2022.不同生育时期水稻土壤细菌群落特征与生态功能 预测[J].华北农学报,37(5):140-149.[Chen QY,Zhao S B,Liang H,Liu Y,Cui Y N,Peng T,Zhao Q Z,Zhang J. 2022. Soil bacterial community characteristics and ecologi- cal function prediction at different rice growth stages [J]. Acta Agriculturae Boreali-Sinica, 37 (5) : 140-149.] doi:10.7668/hbnxb.20193000.
韩凤,林茂祥,章文伟,李巧玲,肖忠,谭秋生,杨毅,李品明.
2021.多花黄精根腐病对根际土壤酶活性及真菌群落变 化的影响[J].西南大学学报(自然科学版),43(4):53- 61. [Han F,Lin M X,Zhang W W,Li Q L,Xiao Z, Tan Q S, Yang Y, Li P M. 2021. Effects of polygonatum cyrto- nema root rot on rhizosphere soil enzyme activity and fun- gal community[J]. Journal of Southwest University (Natu- ral Science Edition), 43 (4) : 53-61.] doi: 10.13718/j.cnki.xdzk.2021.04.007.
李巧玲,肖忠,任明波,韩凤,胡开治.2021.栀子不同生育期 根际土壤细菌群落结构的动态变化[J].土壤通报,52(2):346-354. [Li Q L, Xiao Z,Ren M B,Han F,Hu K Z.
2021. Variation of bacterial community structure in gardenia jasminoides rhizosphere at different growth stages [J].Chinese Journal of Soil Science, 52(2) : 346-354.] doi: 10.19336/j.cnki.trtb.2020050801.
刘福童,李茂森,陈敏,张赛,张福建,王生才,赵培炎,宋安 东,方明,任天宝,刘国顺.2022.高碳基土壤修复肥对烤 烟根际土壤细菌群落结构及烟叶产值的影响[J].河南农业大学学报,56(5):724-731.[Liu F T,Li M S,Chen M, Zhang S,Zhang F J,Wang S C,Zhao P Y,Song A D,Fang M, Ren T B, Liu G S. 2022. Effects of high carbon-based soil remediation fertilizer on bacterial community structure and output value of tobacco leaves in flue-cured tobacco rhizosphere soil [J]. Journal of Henan Agricultural Univer- sity,56(5):724-731.] doi: 10.16445/j.cnki.1000-2340.20220825.001.
鲁如坤.2000.土壤农业化学分析方法[M].北京:中国农业科技出版社.[Lu R K.2000.Methods of soil agrochemi- cal analysis [M]. Beijing: China Agricultural Science and Technology Press.]
罗路云,金德才,左晖,张卓,谭新球,张德咏,卢向阳,刘勇.
2017.沼泽红假单胞菌PSB06对辣椒根际微生物群落结构的影响[J].环境科学,38(2):735-742.[LuoLY,Jin D C,Zuo H, Zhang Z,Tan X Q,Zhang D Y,Lu X Y, Liu Y.2017. Effects of rhodopseudomonas palustris PSB06 on pepper rhizosphere microbial community structure[J]. Environmental Science,38(2): 735-742.] doi: 10.13227/j.hjkx.201606059.
佘冬立,王凯荣,谢小立,彭英湘,陈敏.2007.稻草还田与施 氮水平对土壤氮素供应和水稻产量的影响[J].土壤通报,38(2):296-300.[She DL,Wang KR,Xie XL,Peng Y X, Chen M. 2007. Impact of rice straw incorporation and N rates on soil nitrogen supply and rice yield[J]. Chi- nese Journal of Soil Science, 38 (2) : 296-300. ] doi : 10.19336/j.cnki.trtb.2007.02.019.
孙建波,邹良平,李文彬,王宇光,彭明.2016.香蕉不同生育 期根际土壤细菌群落变化研究[J].热带作物学报,37(6):1168-1171.[Sun J B,Zou L P,Li W B,Wang Y G, Peng M. 2016. The variation of bacterial community in the banana rhizosphere soil at different growth stages[J]. Chinese Journal of Tropical Crops,37(6):1168-1171.] doi: 10.3969/j.issn.1000-2561.2016.06.019.
王甜甜,闫冰,陈彦君,关潇,李俊生.2021.不同生育期转基因抗虫棉根际土壤细菌群落特征[J].环境科学研究,34(7):1728-1736.[Wang TT,Yan B,Chen YJ,Guan X,LiJ S. 2021. Characteristics of bacterial community of rhizo-sphere soil of transgenic insectresistant cotton at differentgrowth stages[J]. Research of Environmental Sciences, 34(7):1728-1736.]doi:10.13198/j.issn.1001-6929.2021.04.11.
魏宇飞,覃仁柳,丁点草,黎永斌,谢源源,屈达才,赵天义,杨尚东.2023. 不同生育期番茄植株根际土壤微生物群落结构特征[J/OL].华中农业大学学报.http://kns.cnki.net/
kcms/detail/42.1181.S.20230928.1303.002.html. [Wei Y F,Qin R L,Ding D C,Li Y B,Xie Y Y,Qu D C,Zhao T Y, Yang S D. 2023. Structural characteristics of soil microbial community in rhizospheres of tomatoes during different growth periods [J/OL]. Journal of Huazhong Agricultural
University. http://kns.cnki.net/kcms/detail/42.1181.S.20230928.1303.002.html.]
杨中周.2017.我国辣椒品种选育进展与展望[J].中国瓜菜,
30(5): 1-6. [Yang Z Z. 2017. Research progress and prospect in pepper breeding in China [J]. China Cucurbits and Vegetables, 30 (5) : 1-6. ] doi: 10.16861/j.cnki.zggc.2017.0081.
郑井元,李雪峰,周书栋,马艳青.2018.2017年度辣椒科学研 究进展[J].中国蔬菜,(5):9-15.[ZhengJY,LiXF, Zhou S D, Ma Y Q. 2018. Research progress in scientific research on capsicum in 2017[J]. China Vegetables, (5) : 9-15.] doi:10.19928/j.cnki.1000-6346.2018.05.002.
祝明炜,曲波,杨红,陈旭辉,王承旭,付卫东,张国良.2011.
刺萼龙葵不同生育期根际土壤酶活性和真菌多样性变 化[J].生态学杂志,30(3):448-452.[Zhu M W,Qu B, Yang H,Chen X H,Wang C X,Fu W D,Zhang G L. 2011. Changes of soil enzyme activities and fungal diversity in rhizosphere soil of solanum rostralum at different develop- ment stages [J]. Chinese Journal of Ecology, 30 (3) : 448-452.] doi: 10.13292/j.1000-4890.2011.0081.
邹学校,朱凡.2020.辣椒传入中国的途径与传播路径[J].湖南农业大学学报(自然科学版),46(6):629-640.[ZouXX, Zhu F. 2020. The path of pepper introduction into China and its spreading route in China[J]. Journal of Hunan Agricultural University (Natural Sciences) , 46(6) :629-640.] doi:10.13331/j.cnki.jhau.2020.06.001.
邹学校,马艳青,戴雄泽,李雪峰,杨莎.2020.辣椒在中国的 传播与产业发展[J].园艺学报,47(9):1715-1726.[Zou X X, Ma Y Q, Dai X Z, Li X F, Yang S. 2020. Spread and industry development of pepper in China[J]. Acta Horti- culturae Sinica, 47 (9) : 1715-1726. ] doi: 10.16420/j.issn.0513-353x.2020-0103.
Ajilogba C F, Olanrewaju O S, Babalola O O. 2022. Plant growth stage drives the temporal and spatial dynamics of the bacterial microbiome in the rhizosphere of Vigna subterranea[J]. Frontiers in Microbiology, 13: 825377. doi:10.3389/fmicb.2022.825377.
Berendsen R L,Pieterse C M J,Bakker P A H M. 2012. The rhizosphere microbiome and plant health [J]. Trends in Plant Science , 17 ( 8) : 478-486. doi : 10.1016/j.tplants.2012.04.001. Blanes M C, Viñegla B, Salido M T, Carreira J A. 2012. Coupled soil-availability and tree-limitation nutritional shifts induced by N deposition: Insights from N to P rela- tionships in abies pinsapo forests[J]. Plant and Soil, 366(1-2):67-81. doi:10.1007/s11104-012-1397-y.
Dong L L,Xu J,Zhang L J,Cheng R Y,Wei G F,Su H, YangJ, Qian J, Xu R, Chen S L. 2018. Rhizospheric microbial communities are driven by Panax ginseng at different growth stages and biocontrol bacteria alleviates replanting mortality[J]. Acta Pharmaceutica Sinica B, 8(2): 272-282.
doi: 10.1016/j.apsb.2017.12.011.
Guo Z B,Wan S X,Hua,K K,Yin Y,Chu H Y,Wang D Z, Guo X S. 2020. Fertilization regime has a greater effect on soil microbial community structure than crop rotation and growth stage in an agroecosystem[J]. Applied Soil Ecology, 149:103510. doi: 10.1016/j.apsoil.2020.103510.
Jia T,Yao Y H,Wang R H,Wu T H,Chai B F. 2020. Dynamics relationship of phyllosphere and rhizosphere bacterial communities during the development of Bothriochloa ischaemum in copper tailings[J]. Frontiers in Microbiology,11: 869. doi:10.3389/fmicb.2020.00869.
Li H, Su J Q, Yang X R, Zhu Y G. 2019. Distinct rhizosphere effect on active and total bacterial communities in paddy soils [J]. Science of the Total Environment, 649: 422-430.
doi: 10.1016/j.scitotenv.2018.08.373.
Li X Z, Rui J P, Mao Y J, Yannarell A C, Mackie R. 2014. Dynamics of the bacterial community structure in the rhizosphere of a maize cultivar[J]. Soil Biology and Biochemistry,68:392-401. doi:10.1016/j.soilbio.2013.10.017.
Mace G M, Norris K,Fitter A H. 2012. Biodiversity and ecosys-tem services:A multilayered relationship[J]. Trends in Ecology amp; Evolution, 27 (1) : 19-26. doi: 10.1016/j.tree.2011.08.006.
Na X F,Cao X N,Ma C X,Ma S L,Xu P X,Liu S C,Wang J J, Wang H G, Chen L, Qiao Z J. 2019. Plant stage, not drought stress, determines the effect of cultivars on bacterial community diversity in the rhizosphere of broomcorn millet (Panicum miliaceum L.)[J].Frontiers in Microbiology, 10:828. doi: 10.3389/fmicb.2019.00828.
Rousk J, Bảảth E, Brookes P C, Lauber C L, Lozupone C, Caporaso J G, Knight R, Fierer N. 2010. Soil bacterial and fungal communities across a pH gradient in an arable soil [J]. The ISME Journal, 4: 1340-1351. doi: 10.1038/ismej.2010.58.
Sarpras M,Chhapekar S S,Ahmad I,Abraham S K,Ramchiary
N. 2018. Analysis of bioactive components in ghost chili (Capsicum chinense) for antioxidant, genotoxic,and apoptotic effects in mice[J]. Drug and Chemical Toxicology,43
(2):182-191. doi:10.1080/01480545.2018.1483945.
Schmidt T M, Thomé A H E, Sperotto R A, Granada C E. 2019. Effect of rhizobia inoculation on the development of soil- borne pathogens infecting common bean plants [J]. Euro- pean Journal of Plant Pathology, 153 (3) :687-694. doi: 10.1007/s10658-018-1600-y.
Sohn S I, Ahn J H, Pandian S, Oh Y J, Shin E K, Kang H J, Cho W S, Cho Y S,Shin K H. 2021. Dynamics of bacterial community structure in the rhizosphere and root nodule of soybean: Impacts of growth stages and varieties[J]. International Journal of Molecular Sciences, 22 (11): 5577. doi :10.3390/ijms22115577.
Sugiyama A, Ueda Y, Zushi T, Takase H, Yazaki K. 2014. Changes in the bacterial community of soybean rhizospheres during growth in the field [J]. PLoS One, 9(6):e100709. doi: 10.1371/journal.pone.
Sun Y P, Guan Y T, Wang H Y, Wu G X. 2019. Autotrophic nitrogen removal in combined nitritation and anammox systems through intermittent aeration and possible microbial interactions by quorum sensing analysis[J]. Bioresource Technology,272: 146-155. doi:10.1016/j.biortech.2018.10.017. Tkacz A, Poole P. 2015. Role of root microbiota in plant productivity[J]. Journal of Experimental Botany,66(8) : 21672175. doi: 10.1093/jxb/erv157.
Wang J C, Xue C, Song Y, Wang L Huang Q, Shen Q. 2016. Wheat and rice growth stages and fertilization regimes alter soil bacterial community structure, but not diversity [J]. Frontiers in Microbiology,7:1207. doi: 10.3389/fmicb.2016.01207.
Wang W H,Luo X,Chen Y,Ye X F,Wang H,Cao Z,Ran W, Cui Z L. 2019. Succession of composition and function of soil bacterial communities during key rice growth stages [J]. Frontiers in Microbiology, 10:421. doi: 10.3389/fmicb.2019.00421.
Watt M, Silk W K, Passioura J B. 2006. Rates of root and organism growth, soil conditions, and temporal and spatial development of the rhizosphere [J]. Annals of Botany, 97(5):839-855. doi:10.1093/aob/mcl028.
Wu Z H, Liu Q S,Li Z Y, Cheng W,Sun J M, Guo Z H, Li Y M, Zhou J Q, Meng D L, Li H B, Lei P, Yin H Q. 2018. Environmental factors shaping the diversity of bacterial communities that promote rice production[J]. BMC Microbiology,18(1):1-11. doi:10.1186/s12866-018-1174-z.
Yuan J, Chaparro J M, Manter D K,Zhang R F, Vivanco J M, Shen Q R. 2015. Roots from distinct plant developmental stages are capable of rapidly selecting their own microbiome without the influence of environmental and soil edaphic factors[J]. Soil Biology and Biochemistry, 89:206-209.doi:10.1016/j.soilbio.2015.07.009.
Zhai Y M, Hou M M, Nie S A. 2018. Variance of microbial composition and structure and relation with soil properties in rhizospheric and non-rhizospheric soil of a flooded paddy[J]. Paddy and Water Environment, 16(1):163-172.doi:10.1007/s10333-017-0627-6.
(责任编辑李洪艳)

