中华鳖IGF2和IGF2R基因克隆及其功能研究





摘要:【目的】探索胰岛素样生长因子2基因(IGF2)和胰岛素样生长因子2受体基因(IGF2R)在中华鳖生长过程中发挥的作用,为揭示IGFs系统在中华鳖异速生长及两性生长差异中的作用机制打下基础。【方法】采用RACE克隆中 华鳖IGF2和IGF2R基因cDNA序列,利用BioEdit、ExPASy、TMHMM Server v2.0、SignalP及SMART等在线软件进行 生物信息学分析,并通过实时荧光定量PCR分析IGF2和IGF2R基因在雌雄中华鳖不同组织、不同表型及不同性类固醇激素处理下的表达变化。【结果】中华鳖IGF2基因cDNA序列全长1180bp,共编码222个氨基酸残基;IGF2蛋白相对 分子量为24.84kD,理论等电点(pI)为9.00,属于跨膜蛋白,含有1个IIGF结构域。中华鳖IGF2R基因cDNA序列全长8765bp,共编码2443个氨基酸残基;IGF2R蛋白相对分子量为271.92 kD,pI为5.64,属于跨膜蛋白,含有14个重复的CIMR结构域和1个FN2结构域。基于IGF2和IGF2R氨基酸序列相似性构建的系统发育进化树均显示,中华鳖与龟鳖类的亲缘关系最近,与鱼类和两栖动物的亲缘关系相对较远。IGF2和IGF2R基因在中华鳖体内具有广泛的组织表达谱,IGF2基因在精巢中的相对表达量显著高于卵巢(Plt;0.05,下同),IGF2R基因则恰好相反。IGF2基因在成年中华鳖生长快个体肝脏中的相对表达量显著高于生长慢个体,IGF2R基因的表达模式则相反。在雌二醇(E2)处理下,除雌性中华鳖肝脏中的IGF2R基因相对表达量在注射6h时显著升高外,IGF2和IGF2R基因在雌雄个体肝脏中的相对表达量整体上呈下降趋势;MT处理对雄性个体肝脏中IGF2基因的表达无显著影响(Pgt;0.05),但在注射48h后显著提高雌性个体肝脏中的IGF2基因相对表达量,且显著下调雌性中华鳖肝脏中的IGF2R基因相对表达量。【结论】IGF2和IGF2R基因参与调控中华鳖性腺的发育及成熟,且IGF2R可能通过内化降解IGF2而对中华鳖的生长起负调控作用。此外,IGF2和IGF2R基因会通过下调表达量来响应外源激素的刺激,进而实现对中华鳖生长的调控。
关键词:中华鳖;IGF2基因;IGF2R基因;生长差异;性类固醇激素
文章编号:2095-1191(2024)04-1181-13
中图分类号:S966.5
文献标志码:A
Cloning and functional analysis of IGF2 and IGF2R genes in Chinese soft-shelled turtle (Pelodiscus sinensis)
ZENG Dan1.2, LI Lin1, YAN Feng1, CHEN Xin-cheng1, WU Cheng-yao1, LI Jing-jing1,TU Yang-yang1, WANG Xiao-qing3*
(1College of Life and Environmental Sciences, Hunan University of Arts and Science, Changde, Hunan 415000, China; 2Hunan Provincial Collaborative Innovation Center for Efficient and Health Production of Fisheries/Hunan Engineering
Research Center of Aquatic Organism Resources and Environmental Ecology/Changde ResearchCenter for Agricultural Biomacromolecule, Changde, Hunan 415000, China; 3Fisheries College,Hunan Agricultural University, Changsha, Hunan 410128, China)
Abstract:【Objective】To explore the role of insulin-like growth factor 2 gene (IGF2) and insulin-like growth factor 2 receptor gene (IGF2R) in the growth of Pelodiscus sinensis, and to lay a foundation for revealing the mechanism of IGFssystem in the allometric growth and sexual growth difference of P. sinensis. 【Method】The cDNA sequences of IGF2 and IGF2R genes in P. sinensis were cloned by RACE. Bioinformatics analysis was performed using online softwares such as BioEdit, ExPASy, TMHMM Server v2.0, SignalP and SMART. The expression changes of IGF2 and IGF2R genes in dif- ferent tissues, different phenotypes and different sex steroid hormones of male and female P. sinensis were analyzed by real-time fluorescence quantitative PCR. 【Result】The total length of the cDNA sequence of IGF2 gene was 1180 bp, en- coding 222 amino acid residues. IGF2 protein, with a relative molecular weight of 24.84 kD and theoretical isoelectric point (pI) of 9.00, was a transmembrane protein and contained one IIGF domain. The total length of the cDNA sequence of IGF2R gene was 8765 bp, encoding 2443 amino acid residues. IGF2R protein had a relative molecular weight of 271.92 kD and a pI of 5.64. It was a transmembrane protein with fourteen repeated CIMR domains and one FN2 domain.Phylogenetic trees based on IGF2 and IGF2R amino acid sequence similarity showed that P. sinensis was most closely related to tortoises and far from fish and amphibians. IGF2 and IGF2R genes had a wide tissue expression profile in P. sinensis. The relative expression of the IGF2 gene in testis was significantly higher than that in the ovary (Plt;0.05, the same below), while the situation was the opposite for IGF2R gene. The relative expression of IGF2 gene in the liver of fast growing P. sinensis individuals was significantly higher than that in the slow-growing individuals, while the expression pattern of IGF2R gene was the opposite. Under estradiol(E2) treatment, except that the relative expression of IGF2R gene in the liver of female P. sinensis was significantly increased at 6 h after injection, the relative expression of IGF2 and IGF2R genes in the liver of male and female P. sinensis were decreased on the whole. MT treatment had no significant effect on IGF2 gene expression in male P. sinensis liver (Pgt;0.05), but significantly increased the relative expression of IGF2 gene in female P. sinensis liver 48 h after injection, and significantly decreased the relative expression of IGF2R gene in female P. sinensis liver. 【Conclusion ]IGF2 and IGF2R genes are involved in the regulation of the gonad develop- ment and maturation of P. sinensis, and IGF2R may negatively regulate the growth of P. sinensis by internalizing and de- grading IGF2. In addition, IGF2 and IGF2R genes regulate the growth of P. sinensis by down-regulating their expres- sion levels in response to exogenous hormone stimulation.
Key words: Pelodiscus sinensis; IGF2 gene; IGF2R gene; growth difference; sex steroid hormone
Foundation items: National Natural Science Foundation of China (31672640) ; Rural Science and Technology Special Correspodent Serving Rural Revitalization Project of Hunan Innovation Platform and Talent Plan (2022NK4150) ; Science Research Project of Hunan Education Department (22C0385) ; Doctoral Start-up Project of Hunan University of Arts and Sciences(21BSQD12)
0 引言
【研究意义】中华鳖(Pelodiscus sinensis)俗称甲 鱼、团鱼等,属于以肺呼吸的水陆两栖爬行动物。 21世纪初,鳖类养殖业得到迅速发展,2022年的年 产量已达37.37万t(农业农村部渔业渔政管理局等, 2023),成为我国重要的水产养殖品种之一。生长性能是水产养殖品种选育首要关注的目标性状,也是 进行遗传改良最有价值的经济性状之一。除个体间 的生长差异外,中华鳖还存在明显的两性生长差异, 即在相同养殖条件下,雄鳖较雌鳖生长快25%~30% (杨振才等,1999)。两性生长差异给水产养殖及品 种改良研究带来新的切入点:(1)通过发展性别控制 技术能实现单性养殖,有效提高养殖产量;(2)可致 力于解析异速生长和两性生长差异的形成机制与分 子基础,进而发展针对性的生长控制技术,为科学指 导育种提供新思路。因此,开展两性生长差异研究 可为中华鳖遗传育种、品种改良及健康养殖提供科 学依据。【前人研究进展】近年来,有关中华鳖的研究 主要集中在养殖模式(Li et al.,2016;Zhang et al.,2017)、营养调控(Sun et al.,2018a,2018b)、免疫抗 病(Lyu et al.,2020;Zhou et al.,2023)及性别决定与 分化机制(Zhou et al.,2022;Lei et al.,2023)等方面,而针对其发育生长的分子调控机制,特别是两性生长差异的研究相对较少。胰岛素样生长因子(Insulin-like growth factors,IGFs)系统在调控动物的发育、生长和代谢,以及细胞增殖、存活、迁移和分化等过程中发挥重要作用。胰岛素样生长因子2(IGF2)是IGFs系统的重要成员之一(Sélénou ct al.,2022),通过与IGF1受体(IGF1R)结合而激活下游磷脂酰肌醇3激酶/蛋白激酶B(PI3K/PKB)途径和丝裂原活化蛋白激酶(MAPK)途径,有效将信号传递到细胞核内(杨伟杰等,2022)。另一种受体——IGF2受体(IGF2R),也称为非阳离子依赖型甘露糖-6-磷酸受体,是一种无酪氨酸激酶活性的单链蛋白,也能特异性结合IGF2(Brown et al.,2008)。IGF2R是跨膜二聚体,其胞外结构域由1个与纤连蛋白胶原结合结构域同源的小区域和15个重复序列组成,其中1个重复序列介导其与IGF2结合(Morgan et al.,1987)。IGF2R通过内化降解细胞外的IGF2,达到抑制IGF2的促细胞分裂作用(Ghoshet al.,2003)。有研究表明,IGF2R基因缺失小鼠的血清IGF2水平较正常小鼠明显上升,小鼠胎儿体细胞生长呈现明显的增速(Brown et al.,2009)。此外,IGF2R还是重要的抑癌因子(Lemany et al.,2016),在哺乳动物中主要扮演生长抑制因子的角色(Schwartz and Bronikowski,2016),但在爬行动物中的功能尚未明确。[本研究切入点]IGFs是调节脊椎动物生长的关键因子,其表达水平与动物生长密切相关。IGFs基因表达性别偏向可能对动物性别二态性的发育和进化起重要促进作用(岳蒙蒙,2017),因此,明确IGF2 和IGF2R基因在中华鳖生长及两性生长差异中扮演的角色,可为解析中华鳖异速生长和两性生长差异的形成机制提供理论依据。[拟解决的关键问题]克隆中华鳖IGF2和IGF2R基因 cDNA全长序列,通过实时荧光定量 PCR检测 2 个基因在雌雄中华鳖不同组织、不同表型及不同性类固醇激素处理下的表达变化,探索IGF2 和IGF2R基因在中华鳖生长过程中发挥的作用,为揭示IGFs系统在中华鳖异速生长及两性生长差异中的作用机制打下基础。
1材料与方法
1.1 试验材料
供试中华鳖由常德河洲水产有限公司提供,挑 选无损伤、体质健康的成年鳖和稚鳖。动物试验 由湖南农业大学动物伦理委员会批准,批准号HUAS- 2020-0012。(1)组织表达谱检测取样:取成年鳖的肌 肉、肠道、肝脏、性腺、肾脏、脾脏、垂体、心脏及肺脏 等组织样品,经液氮速冻后,置于-80℃冰箱保存备 用。(2)差异生长个体取样:同批次孵化同池养殖,在 幼鳖期和成鳖期时分别选取生长差异显著的中华鳖 个体各5只(表1),解剖后取其肝脏组织,液氮速冻 后置于-80℃冰箱保存。(3)性类固醇激素处理试 验:设甲基睾丸酮(17a-Methyltestosterone,MT)组和 雌二醇(Estradiol,E2)组,每组45只中华鳖(平均体质量35.42±14.25g)。取15mgMT和15mgE2分别溶于0.5mL无水乙醇,加入4.5mL橄榄油稀释,4℃ 避光保存。注射前禁食1周,自由饮水。通过后肢 大腿部肌肉注射,每只中华鳖约注射0.1mL配制的 试剂,注射后自由饮水,不喂食。于注射后0、6、12、 24和48h,分别剖检采集MT组及E2组稚鳖的肝脏 组织样品,液氮速冻后置于-80℃冰箱保存备用;同 时剪取裙边组织,参照FastPure Cell/Tissue DNA Iso-lation Mini Kit(DC102)说明提取中华鳖基因组DNA,采用性别特异分子标记进行性别鉴定(曾丹 等,2022)。
1.2中华鳖IGF2和IGF2R基因克隆
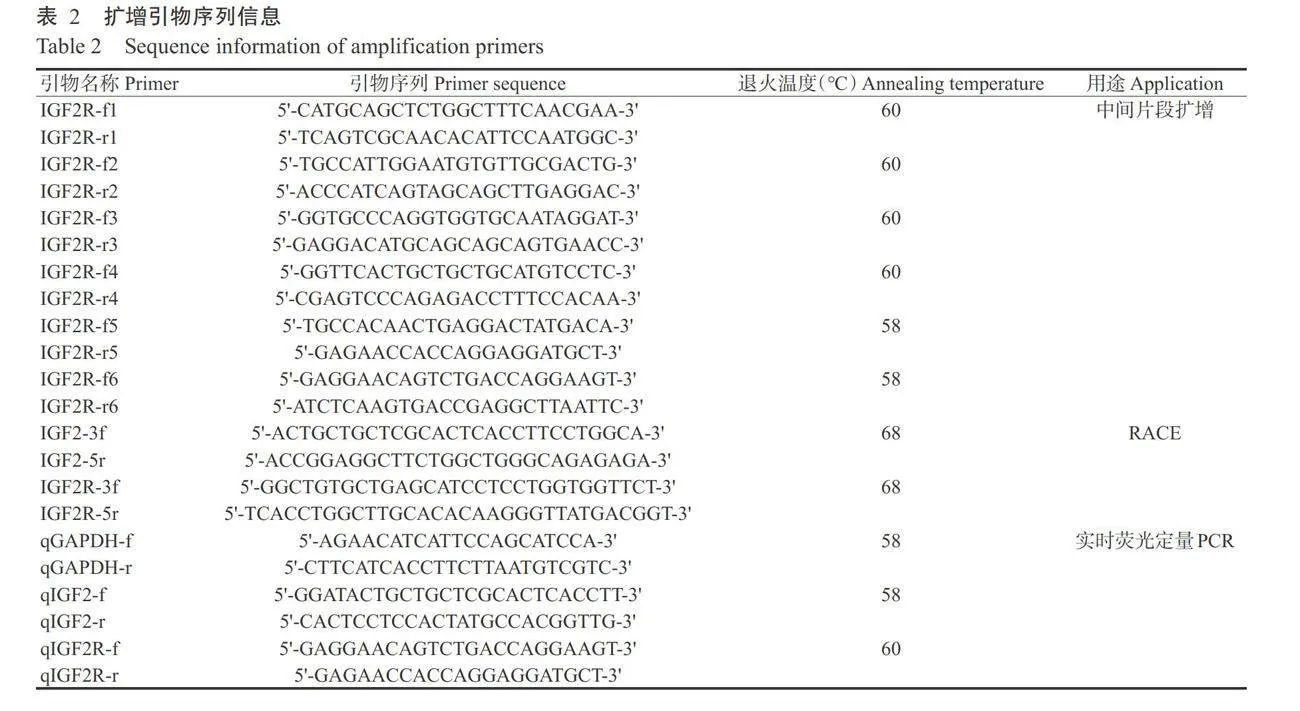
参照E.Z.N.A.®Total RNA Kit IⅡ(OMEGA)使用说明提取各组织总RNA,分别以1.5%琼脂糖凝胶电泳和超微量检测仪(BioSpectrometer)检测各组织总RNA的质量和完整性,并根据RevertAidTMFirstStrand cDNA Synthesis Kit(Fermentas)使用说明合成cDNA第一链。结合转录组测序数据和公共数据库其他物种的IGF2R基因序列信息,利用Primer Premier6.0设计IGF2R基因中间片段的扩增引物(表2);再根据PCR扩增获得的中间片段设计5'-RACE和3'-RACE扩增引物(表2),参照SMARTer®RACE5/3'Kit(TaKaRa)试剂盒说明完成5'-RACE和3'-RACE扩增。所有引物均委托铂尚生物技术(上海)有限公司合成。PCR扩增产物经切胶回收及连接转化后,挑选阳性克隆送至铂尚生物技术(上海)有限公司测序。测序结果经SeqMan拼接,即获得IGF2和IGF2R基因CDNA全长序列。
1.3中华鳖IGF2和IGF2R基因生物信息学分析
利用 NCBI 的 ORF Finder(http://www.ncbi.nlm.nih.gov/projects/gorf/orfig.cgi)检索目的基因开放阅读框(ORF),并预测其推导氨基酸序列;获得的氨基酸序列与NCBI 中已公布物种的相关氨基酸序列进行BLASTp同源比对分析;利用BioEdit分析编码蛋白理化性质,包括分子量、理论等电点(pI)及氨基酸组成;通过ExPASy预测蛋白亲/疏水性;使用TMHMMServer v2.0 预测蛋白序列跨膜结构;采用 SignalP 预测蛋白信号肽;运用SMART预测蛋白结构域;通过MEGA 11.0分析中华鳖IGF2 和IGF2R氨基酸序列同源性,并以邻接法(Neighbor-joining,NJ)构建系统发育进化树(Bootstrap设为1000次)。
1.4中华鳖IGF2和 IGF2R基因表达分析
根据实时荧光定量PCR扩增引物设计要求,设计检测IGF2和IGF2R基因表达的特异性引物(表2)。实时荧光定量PCR反应体系10.0μL:cDNA模板1.0μL,上、下游引物(10μmol/L)各0.25μL,SYBR®Premix Ex TaqTMⅡ 5.0 uL,Deionized H2O 3.5 uL。扩增程序:95℃预变性5min;95℃10s,58℃10s,72℃10s(延伸完成检测荧光信号)。为判断扩增产物专一性,是否含有引物二聚体,在扩增结束后进行熔解曲线分析,从65 C以 0.5 °℃/5 s的速率升至95 C。以GAPDH为内参基因,每个样本进行3次技术重复,并利用2-Ma法计算 IGF2和IGF2R基因的相对表达量。采用 SPSS 22.0 对目的基因在不同组织、不同表型及不同性类固醇激素处理下的相对表达量进行单因素方差分析(One-way ANOVA),通过Duncan’s 多重比较进行显著性检验,最后使用GraphPad Prism 8.0制图。
2结果与分析
2.1中华鳖IGF2 和IGF2R基因序列分析结果
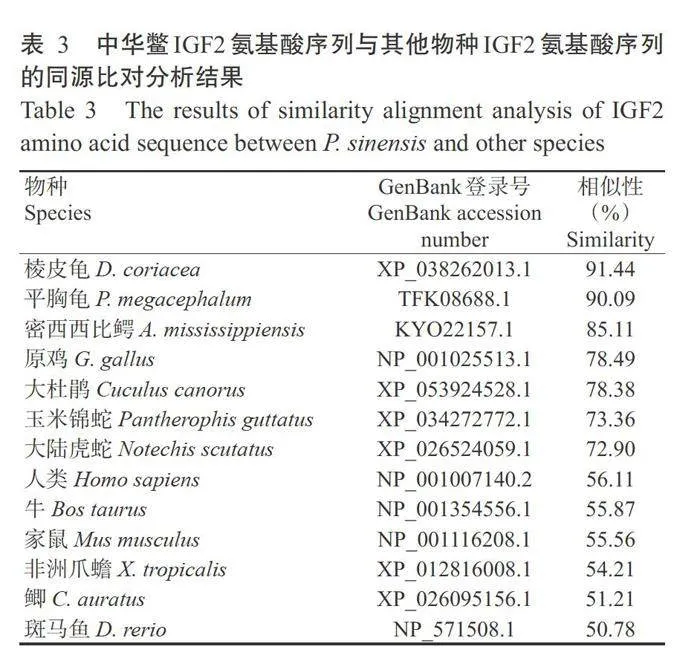
中华鳖IGF2基因 cDNA序列(GenBank登录号MH807577)全长1180bp,包含669 bp的ORF、232 bp的5'端非编码区(5'-UTR)和279bp的3'端非编码区(3'-UTR),且3'-UTR含有21 bp的poly(A)尾;共编码222个氨基酸残基。中华鳖IGF2蛋白相对分子量为24.84kD,pI为9.00,属于跨膜蛋白,含有1个IIGF结构域(位于第65~120位氨基酸处)。中华鳖IGF2成熟肽包含68个氨基酸,由B-C-A-D4个结构域组成。多序列比对分析结果(图1)显示,B-C-A-D4个结构域在不同物种间的相似性较高,包含6个高度保守的半胱氨酸残基,通过形成二硫键以加固蛋白分子的空间结构,维持蛋白稳定性。位于A和B结构域的IGF1R识别序列和结合蛋白识别位点在所有脊椎动物中高度保守,但位于A结构域的IGF2R结合位 点在两栖动物和鱼类中的保守性较差。多序列比对 分析结果还显示,酪蛋白激酶Ⅱ磷酸化位点的SERD 基序仅在两栖动物中存在差别,在其他物种中则高 度保守;另一酪蛋白激酶IⅡ磷酸化位点的SKYD基 序在爬行动物、两栖动物、鱼类中的保守性均高于鸟 类和哺乳动物。
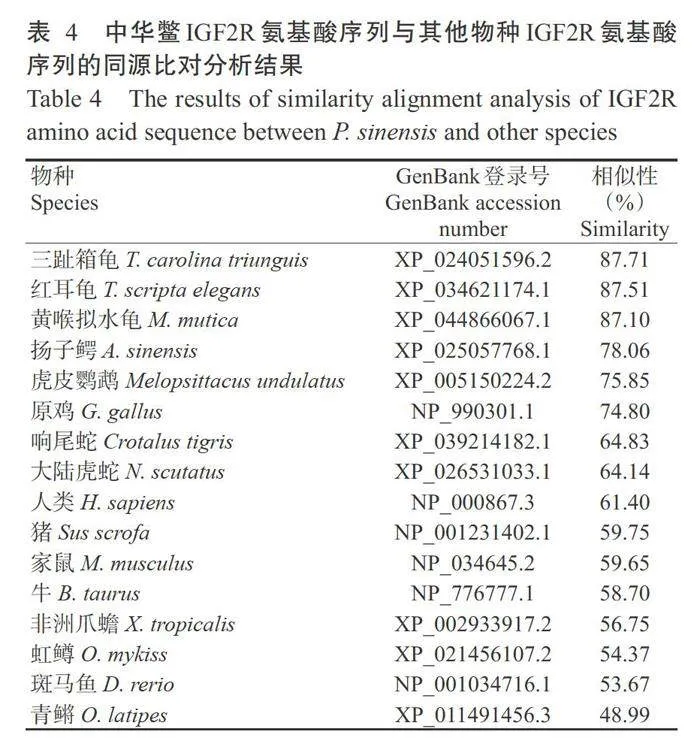
中华鳖IGF2R基因cDNA序列(GenBank登录号MW876202)全长8765bp,包含7332 bp的ORF、134 bp的5'-UTR和1299bp的3'-UTR,3'-UTR含有28 bp的poly(A)尾,且在其上游(17bp)处存在1个典型的多腺苷酸化信号序列AATAAA。中华鳖IGF2R基因编码2443个氨基酸残基,编码蛋白相对分子量为271.92kD,pI为5.64,属于跨膜蛋白,含有14个重复的CIMR结构域和1个FN2结构域。将中华鳖IGF2R氨基酸序列与其他脊椎动物的IGF2R氨基 酸序列进行比对分析,结果(图2)显示,中华鳖 IGF2R氨基酸序列中每个CIMR结构域均含有6~ 8个位置保守的半胱氨酸残基,表明中华鳖IGF2R蛋白结构在进化过程中具有一定的保守性,但 CIMR结构域中的其他序列在不同物种间存在明显 差异。中华鳖IGF2R氨基酸序列与爬行动物和鸟类的IGF2R氨基酸序列相似性较高,与哺乳动物、两栖动物和鱼类的相似性相对较低,暗示IGF2R在中华 鳖等爬行动物中的生理功能可能更接近于鸟类。
2.2中华鳖IGF2和IGF2R蛋白多序列比对及系统 进化分析结果
将NCBI已公布多个物种的IGF2氨基酸序列与 中华鳖IGF2氨基酸序列进行同源比对分析,结果(表3)显示,中华鳖与棱皮龟(Dermochelys coriacea)的IGF2氨基酸序列相似性最高,达91.44%;其次是平胸龟(Platysternon megacephalum),为90.09%;与 密西西比鳄(Alligator mississippiensis)和原鸡(Gal- lus gallus)的相似性分别为85.11%和78.49%;与斑 马鱼(Danio rerio)的相似性最低,仅50.78%。基于 IGF2氨基酸序列相似性构建的系统发育进化树 (图3)显示,中华鳖先与同为龟鳖目的棱皮龟和平 胸龟聚为一小分支,再与鳄目、鸟纲的物种聚类在一 起,最后与爬行动物、两栖纲的非洲爪蟾(Xenopus tropicalis)及哺乳动物汇聚成一分支;而鲫(Caras-sius auratus)和斑马鱼在系统发育进化树中聚为另 一分支。
在NCBI中搜索硬骨鱼纲、两栖纲、爬行纲、鸟纲及哺乳纲中代表物种的IGF2R氨基酸序列,与中华鳖IGF2R氨基酸进行同源比对分析,结果(表4)发现,中华鳖IGF2R氨基酸序列与三趾箱龟(Terra- pene carolina triunguis)IGF2R氨基酸序列的相似 性最高(87.71%);其次是红耳龟(Trachemys scripta elegans)和黄喉拟水龟(Mauremys mutica),对应的 IGF2R氨基酸序列相似性分别为87.51%和87.10%;与扬子鳄(A.sinensis)、原鸡的IGF2R氨基酸序列相 似性分别为78.06%和74.80%;与硬骨鱼类的相似性相对较低,其中与青鳉(Oryzias latipes)的IGF2R 氨基酸序列相似性仅为48.99%。基于16个物种的 IGF2R氨基酸序列相似性构建系统发育进化树,结 果(图4)显示,中华鳖与龟鳖目动物的亲缘关系最 近,在系统发育进化树中聚为一小分支,其次与扬子 鳄、虎皮鹦鹉(Melopsittacus undulatus)、原鸡、响尾 蛇(Crotalus tigris)、大陆虎蛇(Notechis scutatus)的 亲缘关系较近,再与以家鼠(Mus musculus)、人类 (Homo sapiens)、牛(Bos taurus)、猪(Sus scrofa)为代表的哺乳动物聚类在一起,最后与非洲爪蟾汇聚成一分支;青鳉、斑马鱼、虹鳟(Oncorhynchus mykiss)在系统发育进化树中则聚为另一分支。
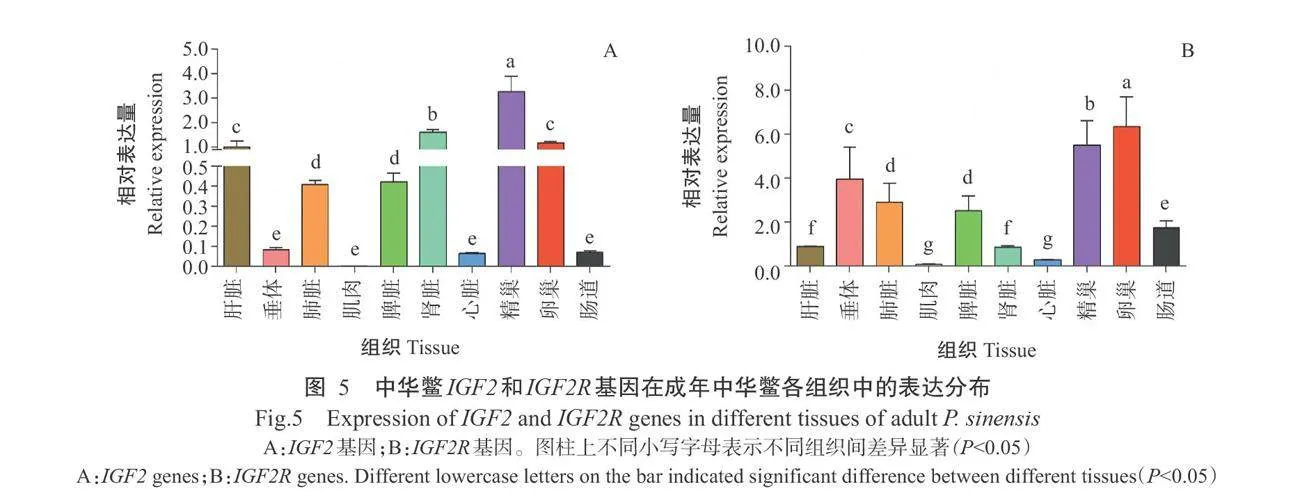
2.3中华鳖IGF2和IGF2R基因的组织特异性表达 分析结果
采用实时荧光定量PCR检测IGF2基因在成年 中华鳖各组织(心脏、肝脏、肠道、垂体、肌肉、卵巢、精 巢、肾脏、肺脏和脾脏)中的表达情况,结果(图5-A)显示,IGF2基因在检测的10个组织中均有表达,以 精巢中的相对表达量最高,显著高于其他组织中的 相对表达量(Plt;0.05,下同);其次是肾脏、卵巢、肝 脏、肺脏和脾脏;在垂体、心脏、肠道和肌肉组织中的 相对表达量较低,显著低于其他组织中的相对表达 量。中华鳖IGF2R基因也具有广泛的组织表达谱(图5-B)),在检测的10个组织中均有不同程度的表达。IGF2R基因在性腺中的相对表达量显著高于其 他组织中的相对表达量,且在卵巢中的相对表达量 显著高于精巢;在肌肉和心脏中的相对表达量较低, 二者间的差异不显著(Pgt;0.05,下同)。
2.4中华鳖IGF2和IGF2R基因在差异生长个体 肝脏中的表达情况
为探索IGF2和IGF2R基因在中华鳖生长过程 中的作用,采用实时荧光定量PCR检测IGF2和
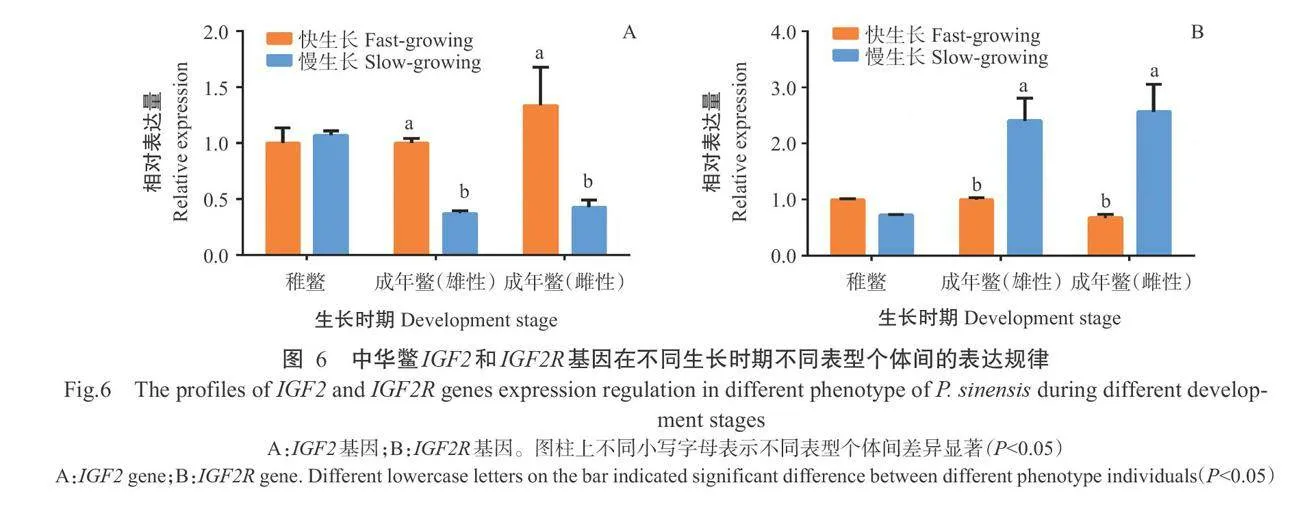
IGF2R基因在中华鳖不同生长时期[成年鳖(3龄) 和稚鳖(1龄)]不同表型个体间的表达模式。由图6 可看出,中华鳖IGF2和IGF2R基因相对表达量在稚 鳖期的差异生长个体间无显著差异。在成年鳖期,IGF2基因在雌雄性快生长个体肝脏中的相对表达 量均显著高于慢生长个体,表明IGF2基因表达水平 与中华鳖的快速生长呈正相关;IGF2R基因的表达 模式与IGF2基因相反,即IGF2R基因在雌雄性快 生长个体肝脏中的相对表达量均显著低于慢生长个体,提示其高表达水平可能与中华鳖生长的负调节相关。
2.5中华鳖IGF2 和 IGF2R基因在性类固醇激素处理后的表达变化
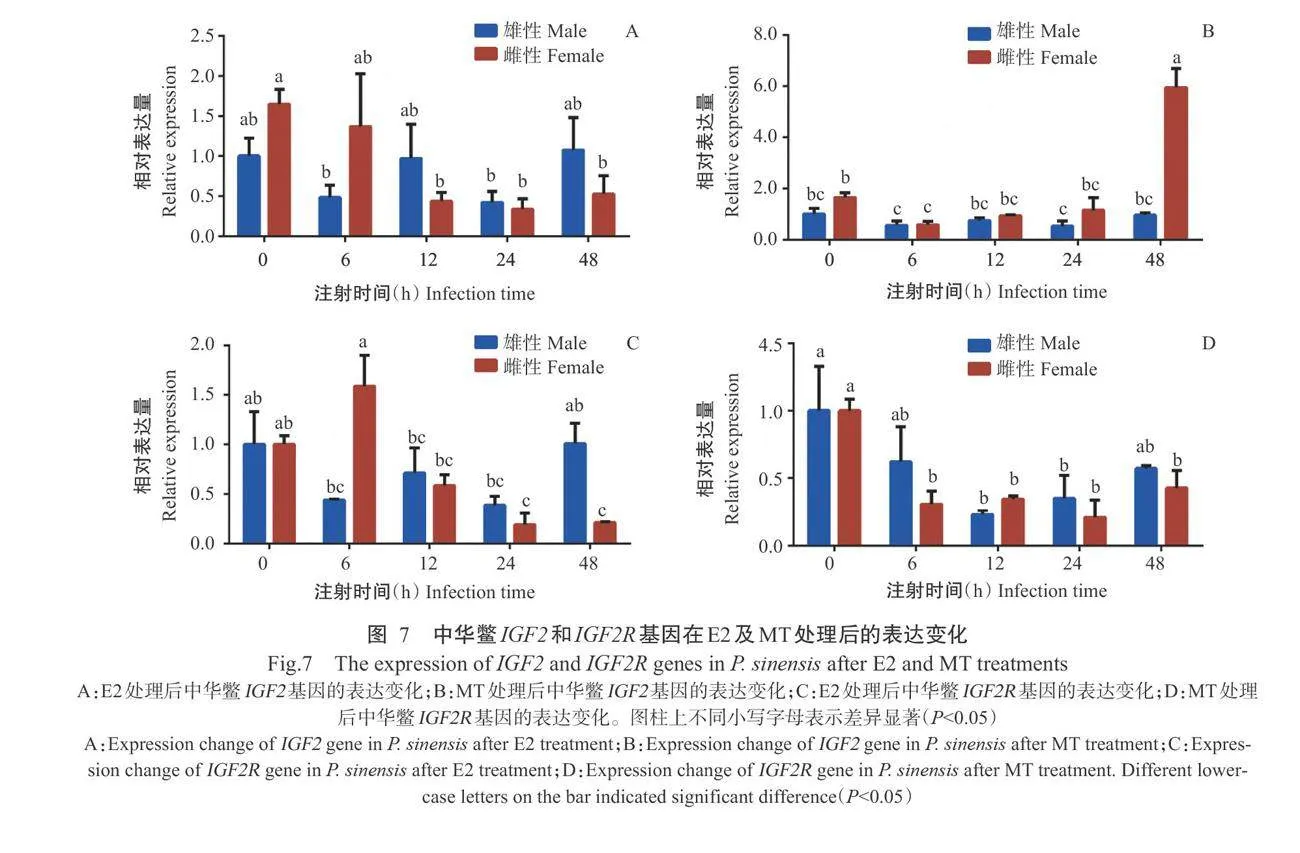
采用实时荧光定量PCR检测中华鳖IGF2 和IGF2R基因在不同性类固醇激素处理0、6、12、24和48h后雌雄个体肝脏中的表达变化,结果(图7)表明,注射E2后,除雌性个体肝脏中的IGF2R基因相对表达量在注射6h时显著升高外,IGF2和IGF2R基因在雌雄性个体肝脏中的相对表达量整体上呈下降趋势,但至注射48h后雄性个体肝脏中的相对表达量回升到注射前水平;注射MT对雄性中华鳖肝脏中的IGF2基因相对表达量影响不显著,但至注射48h后能显著提高雌性个体肝脏中的IGF2基因相对表达量,IGF2R基因则表现为注射MT后雌雄性个体肝脏中的相对表达量均低于注射前。
3讨论
IGFs是一类保守的单链多肽,在调控脊椎动物的生长发育过程中发挥重要作用(Ndandala et al.,2022)。与哺乳动物相比,爬行动物的生长会持续到成年期之后,暗示这些生长因子在爬行动物生长发育过程中的作用模式可能更特殊(Beatty and Schwartz,2020)。本研究从中华鳖肝脏中成功克隆出IGF2和IGF2R基因的cDNA序列,二者分别编码222和2443个氨基酸残基。多序列比对分析结果显示,中华鳖IGF2和IGF2R氨基酸序列中的半胱氨酸高度保守且位置相似,说明IGF2和IGF2R蛋白结构在进化过程中高度保守。IGFs系统基因正在物种间快速进化,有些因子显示出广泛的核苷酸变异,说明其功能作用可能在不同群体中存在差异(SchwartzandBronikowski,2016)。中华鳖IGF2含有保守的IGF1R识别序列和结合蛋白识别位点,但IGF2R结合位点在两栖动物和鱼类中的保守性较差。因此,后续研究应进一步对中华鳖IGF2和IGF2R进行建模分析,探索二者间是否也存在结合关系,并对结合位点进行验证。在物种进化上,龟鳖类有着漫长的演化历史,是形态学上最特化的爬行动物之一。基于IGF2和IGF2R氨基酸序列相似性构建的系统发育进化树均显示,中华鳖与龟鳖类的亲缘关系最近,其次为鳄类、鸟类和蛇类,与鱼类和两栖动物的亲缘关系相对较远。这与各物种在分类学的地位基本吻合,且与物种起源的进化地位相一致,其研究结果支持龟鳖类可能是鳄类和鸟类共同祖先姐妹群的假说(Wang et al.,2013)。
IGF2和IGF2R是影响动物胚胎发育和个体生长的重要因子。IGF2基因表达不受生长激素(Growthhormone,GH)的调控,且在不同物种中的表达模式存在差异(Annunziata et al.,2011)。在啮齿动物中的研究表明,IGF2被称为产前生长因子,仅在胚胎发育期间表达(Constância et al.,2002)。相比之下,在人类的整个生命周期中均能检测到IGF2基因表达(Fagerberg et al.,2014)。McGaugh等(2015)对爬行动物进行转录组学分析,结果发现美洲短吻鳄(A.mississippiensis)等14种爬行动物在出生后均能检测到IGF2基因表达。此外,鸟类、鱼类和两栖动物的代表性物种同样发现在成年期的多个组织中存在IGF2基因表达(Rotwein,2018)。IGF2R基因表达存在一定的组织特异性,在南江黄羊肺脏中IGF2R基因表达量极低,在肝脏中的表达量呈中等水平,动物肌肉组织和肌细胞中则处于较高水平表达(占思远等,2019)。目前,关于IGF2和IGF2R的研究主要集中在哺乳动物上,针对爬行动物,尤其是龟鳖类则鲜见报道。在哺乳动物中,与遗传印记使母体IGF2和IGF2R等位基因沉默相比,现有基于鸡、蛇和蜥蜴的研究显示爬行动物的IGF2和IGF2R是双等位基因表达(Beatty and Schwartz,2020)。本研究结果显示,IGF2和IGF2R基因在中华鳖体内具有广泛的组织表达谱,与在其他物种(Nipkow et al.,2018;韦云芳等,2022)上的研究结果相似,故推测IGF2和IGF2R基因参与调控中华鳖多种组织细胞的生命过程。IGFs是生长轴和生殖轴相关联的关键基因,在鱼类中的研究证实IGFs在其生殖调控中发挥重要作用,IGF2可能以自分泌调节、内分泌调节和旁分泌调节等多种方式调控性腺的发育及成熟(Nelsonand van Der Kraak,2010)。本研究在中华鳖性腺组织中检测到IGF2和IGF2R基因高表达,且IGF2基因在中华鳖精巢中的相对表达量显著高于卵巢中的相对表达量,IGF2R基因则恰好相反。可见,IGF2R主要与IGF2结合,对正性生长基因IGF2的降解起重要作用,说明IGF2和IGF2R基因可能共同参与调控中华鳖性腺的发育及成熟。
IGF2是IGFs家族中不可或缺的一员,可通过受体一配体结合的表达模式进行信号转导,而发挥其生理功能(Bella et al.,2020)。在幼鳖期,IGF2基因的相对表达量在中华鳖不同表型间无显著差异;但在成年鳖中,生长快个体肝脏中的IGF2基因相对表达量显著高于生长慢个体。这与易少奎等(2015)在团头鲂中的研究结果相似,在3月龄团头鲂生长差异个体中IGF2基因表达量无显著差异,但在6月龄时快生长个体肝脏中的IGF2基因表达水平显著高于慢生长个体。由此推测,IGF2基因在中华鳖不同生长发育时期的调控机制存在差异,且在成年鳖表现为促生长作用。IGF2R可靶向降解IGF2,从而影响胚胎或某些组织器官的大小(Zaina and Squire,1998)。中华鳖慢生长个体肝脏中的IGF2R基因相对表达量显著高于快生长个体,说明IGF2R可能是通过降低IGF2含量,而抑制中华鳖的生长发育。
中华鳖存在明显的两性生长差异现象,在相同 养殖条件下,雄性个体比雌性个体的生长速度快。 雌雄性个体生长差异可能与其体内性类固醇激素的 水平关系密切(高丽丽等,2019)。马文阁(2016)研 究证实,黄颡鱼(Pelteobagrus fulvidraco)两性生长 异形可能是雌雄性个体间性激素调节的GH/IGF信号表达差异所引起。为探索IGF2和IGF2R基因在 中华鳖两性生长差异中扮演的角色,本研究检测了 性类固醇激素(E,和MT)处理后IGF2和IGF2R基因在雌雄性中华鳖肝脏中的表达变化,结果发现,在E2处理下,中华鳖肝脏中IGF2和IGF2R基因的相对 表达量整体上呈下降趋势(除雌性个体肝脏中的 IGF2R基因在注射6h时显著升高外),与马细兰等(2015)对尼罗罗非鱼(Oreochromis niloticus)、高丹丹等(2021)对斑鳢(Channa maculata)的研究结果相似,即E,能抑制正向生长因子IGF1和GH的表达,可能是体内较高的雌激素抑制肝脏合成IGFs。外源 激素对动物生长的影响存在3种不同模式:促进、抑 制和无影响。申慧(2019)在性类固醇激素连续投喂 中华鳖稚鳖的试验中发现,不同浓度E2均表现出对稚鳖生长的抑制作用。本研究结果也显示,短期注 射E2后,IGF2和IGF2R基因在雌雄中华鳖肝脏中的相对表达量整体上呈下降趋势,表明IGF2和IGF2R 基因可能通过下调表达量来响应外源激素的刺激, 进而抑制稚鳖的生长,但具体作用机制还有待进一 步探究。在MT处理下,雄性中华鳖肝脏中的IGF2基因表达变化不显著,但在注射48h后显著提高雌 性中华鳖肝脏中的IGF2基因相对表达量,且显著下调雌雄中华鳖肝脏中的IGF2R基因相对表达量。鉴于IGF2R基因对IGF2基因存在负调控关系,故推测 MT对雌雄性中华鳖的生长调控功能是通过IGF2和 IGF2R的协调配合而实现,与岳蒙蒙(2017)在尼罗 罗非鱼中得到的结论存在差异,但具体作用机制还 需联合中华鳖血清内激素含量变化分析进行验证。
4结论
IGF2和IGF2R基因参与调控中华鳖性腺的发 育及成熟,且IGF2R可能通过内化降解IGF2而对中华鳖的生长起负调控作用。此外,IGF2和IGF2R基 因会通过下调表达量来响应外源激素的刺激,进而 实现对中华鳖生长的调控。
参考文献(References):
高丹丹,欧密,吴燕铎,陈昆慈,刘海洋,罗青,赵建.2021.斑 鳢生长激素基因的克隆及表达分析[J].农业生物技术学报,29(12):2328-2341.[Gao D D,Ou M,WuY D,Chen K C, Liu H Y, Luo Q, Zhao J. 2021. Gene cloning andexpression analysis of growth hormone gene from blotched snakehead (Channa maculata) [J]. Journal of Agricultural Biotechnology, 29 (12) : 2328-2341.] doi: 10.3969/j. issn.1674-7968.2021.12.007.
高丽丽,刁晓明,李云,翟旭亮,周春龙.2019.中华鳖Foxl2基因克隆及外源性激素对其表达的影响[J].水生生物学报,43(1):45-51.[Gao LL,Diao XM,LiY,Zhai XL, Zhou C L. 2019. Molecular cloning and expression of Foxl2 gene induced by exogenous hormone in the Pelodis- cus sinensis[J]. Acta Hydrobiologica Sinica,43(1) :45-51.]doi:10.7541/2019.006.
马文阁.2016.黄颡鱼GH/IGF生长轴基因的序列特征和两性表达差异分析[D].武汉:华中农业大学.[Ma WG.2016.Characterization and sex-dependent expression of GH/IGF axis genes in yellow catfish[D]. Wuhan: Huazhong Agricultural University.] doi: 10.7666/d.Y3052432.
马细兰,张勇,陈勇智,周立斌.2015.性类固醇激素E2、MT 对尼罗罗非鱼(Oreochromis niloticus)雌、雄生长差异的 影响[J].海洋与湖沼,46(6):1487-1493.[Ma XL,Zhang Y, Chen Z Y, Zhou L B, 2015, Steroid hormones (E2 and MT) displayed difference in sex for nile tilapia Oreo- chromis niloticus[J]. Oceanologia et Limnologia Sinica,46(6):1487-1493.] doi: 10.11693/hyhz20150900241.
农业农村部渔业渔政管理局,全国水产技术推广总站,中国 水产学会.2023.2022年中国渔业统计年鉴[M].北京: 中国农业出版社.[Fishery and Fishery Administration of the Ministry of Agriculture and Rural Affairs, National Fishery Technology Promotion Station, China Society of Fisheries. 2023. 2022 China fisheries statistica yearbook[M]. Beijing:China Agriculture Press.]
申慧.2019.饲喂类固醇激素对中华鳖稚鳖生长、血清性激素及性腺发育的影响[D].乌鲁木齐:新疆大学.[Shen H.2019. Effects of feeding steroid hormones on the growth,serum sex hormones and gonad development of Pelodiscussinensis juvenile[D]. Urumqi:Xinjiang University.]
韦云芳,李飞翔,星云,黄庆国,李居东,万九生,陈方良.2022.昆明犬IGF2基因克隆、生物信息学分析及其时空表达研究[J].中国畜牧兽医,49(3):866-875.[WeiYF,Li F X, Xing Y, Huang Q G, Li J D, Wan J S, Chen F L.2022. Study on cloning,bioinformatics analysis and spatio-temporal expression of IGF2 gene in Kunming dogs [J].China Animal Husbandry amp; Veterinary Medicine, 49 (3) :866-875.] doi:10.16431/j.cnki.1671-7236.2022.03.008.
杨伟杰,满初日嘎,吴慧,张振兴,何美荣,蒋俊明,陈巧玲,高宏岩,王凤阳,陈思.2022.海南黄牛IGF2R基因单核苷酸多态性及其生物信息学分析[J].南方农业学报,53(12):3520-3528. [Yang W J, Manchu R G,Wu H,Zhang Z X,He M R,Jiang J M,Chen Q L,Gao H Y,Wang F Y,ChenS. 2022. Single nucleotide polymorphism and bioinforma-tics analysis of IGF2R gene in Hainan cattle[J]. Journal ofSouthern Agriculture,53 (12): 3520-3528.] doi: 10.3969/j.issn.2095-1191.2022.12.023.
杨振才,牛翠娟,孙儒泳.1999.中华鳖生物学研究进展[J].动物学杂志,34(6):41-44.[Yang Z C,Niu CJ,Sun RY.1999. Advances in studies of the Chinese soft-shelled turtleTrionyx sinensis biology[J]. Chinese Journal of Zoology,34(6):41-44.] doi:10.13859/j.cjz.1999.06.016.
易少奎,高泽霞,赵鸿昊,赵玉华,王卫民.2015.团头鲂生长相关基因在不同发育时期生长轴组织的表达分析[J].水生生物学报,(1):101-109.[YiSK,GaoZX,Zhao HH,Zhao Y H, Wang W M. 2015. The expression analysis ofgrowth-related genes in growth-related tissues in differen-tial growth groups at different developmental stages ofMegalobrama amblycephala [J]. Acta Hydrobiologica Si-nica, (1):101-109.] doi:10.7541/2015.13.
岳蒙蒙.2017.性类固醇激素对尼罗罗非鱼雌雄生长差异与生长相关基因表达的影响[D].上海:上海海洋大学.[YueM M. 2017. Effects of sex steroid hormones on dimor-phism of growth and growth-related genes between femaleand male Nile tilapia Oreochromis niloticus[D]. Shanghai:Shanghai Ocean University.]
曾丹,王晓清,曾嘉伟,胡亚洲,秦溱,王佩,梁艺馨.2022.一种中华鳖遗传性别相关的SNPs标记及其引物和应用:CN202210725054.9[P]. 2022-09-02. [Zeng D,Wang X Q,Zeng J W, Hu Y Z, Qin Z, Wang P, Liang Y X. 2022. Asex-related SNPs marker and its primers and application inPelodiscus sinensis:CN202210725054.9[P]. 2022-09-02.]
占思远,丁雪,仲涛,王林杰,李利,张红平.2019.IGFIR和 IGF2R在南江黄羊不同组织和肌细胞中的表达模式比较 [J].畜牧兽医学报,50(4):701-711.[Zhan SY,Ding X, Zhong T, Wang L J,Li L,Zhang H P. 2019. Comparison of IGF1R and IGF2R expression patterns in different tissues and muscle cells of Nanjiang brown goats [J]. Acta Veterinaria et Zootechnica Sinica,50(4):701-711.] doi:10.11843/ j.issn.0366-6964.2019.04.003.
Annunziata M, Granata R, Ezio G. 2011. The IGF system [J].
Acta Diabetologica, 48 (1) : 1-9. doi: 10.1007/s00592-010-0227-z.
Beatty A E, Schwartz T S. 2020. Gene expression of the IGF hormones and IGF binding proteins across time and tissues in a model reptile[J]. Physiological Genomics,52(9) :423434. doi:10.1152/physiolgenomics.00059.2020.
Bella P, Farini A, Banfi S, Parolini D, Tonna N, Meregalli M, Belicchi M, Erratico S, D' Ursi P, Bianco F, Legato M, Ruocco C, Sitzia C, Sangiorgi S, Villa C, D'Antona G, Milanesi L, Nisoli E, Mauri P, Torrente Y. 2020. Blockade of IGF2R improves muscle regeneration and ameliorates Duchenne muscular dystrophy[J]. EMBO Molecular Medicine,12(1):e11019. doi:10.15252/emmm.201911019.
Brown J, Delaine C, Zaccheo O J, Siebold C, Gilbert R J, van Boxel G, Denley A, Wallace J C, Hassan A B, Forbes B E, Jones E Y. 2008. Structure and functional analysis of the IGF-II/IGF2R interaction[J]. The EMBO Journal, 27 (1): 265-76. doi : 10.1038/sj.emboj.7601938.
Brown J, Jones E Y, Forbes B E. 2009. Keeping IGF-IⅡ under control: Lessons from the IGF-IⅡ/IGF2R crystal structure [J]. Trends in Biochemical Sciences,34(12) :612-619. doi: 10.1016/j.tibs.2009.07.003.
Constância M, Hemberger M, Hughes J, Dean W, Ferguson- Smith A, Fundele R,Stewart F,Kelsey G, Fowden A, Sib- ley C, Reik W. 2002. Placental-specific IGF-II is a major modulator of placental and fetal growth [J]. Nature, 417(6892):945-948. doi: 10.1038/nature00819.
Fagerberg L,Hallström B M, Oksvold P,Kampf C,Djureinovic D, Odeberg J, Habuka M, Tahmasebpoor S, Danielsson A, Edlund K, Asplund A,Sjöstedt E,Lundberg E,Szigyarto C A K, Skogs M, Takanen J O, Berling H, Tegel H, Mulder J, Nilsson P, Schwenk J M, Lindskog C, Danielsson F, Mardinoglu A, Sivertsson Ả, von Feilitzen K,Forsberg M, Zwahlen M. 2014. Analysis of the human tissue-specific expression by genome-wide integration of transcriptomics and antibody-based proteomics [J]. Molecular amp; Cellular Proteomics, 13 (2) : 397-406. doi: 10.1074/mcp. M113.03
5600. Ghosh P, Dahms N M, Stuart K. 2003. Mannose 6-phosphate
receptors: New twists in the tale[J]. Nature Reviews Molecular Cell Biology,4(3): 202-213. doi: 10.1038/nrm1050.
Lei L,Zhu J X,Chen C,Wang Y C,Wu C C,Qi M,Wang Y K, Liu X L, Hong X Y, Yu L Y, Chen H G, Wei C Q, Liu Y H, Li W, Zhu X P. 2023. Genome-wide identification, evolution and expression analysis of bone morphogenetic protein (BMP) gene family in chinese soft-shell turtle (Pelodiscus sinensis)[J]. Frontiers in Genetics,14: 1109478. doi:10.3389/fgene.2023.1109478.
Lemany G J,Ndeboko B, Omouessi S T, Mouecoucou J. 2016.Mannose-6-phosphate/insulin-like growth factor 2 receptor (M6P/IGF2-R) in growth and disease:A review[M]. Maria del Carmen Cardenas- Aguayo. Restricted Growth—Clini- cal, Genetic and Molecular Aspects. doi: 10.5772/64810.
Li W,Ding H,Zhang F Y,Zhang T L, Liu J S, Li Z J. 2016. Effects of water spinach Ipomoea aquatica cultivation on water quality and performance of Chinese soft-shelled turtle Pelodiscus sinensis pond culture[J]. Aquaculture Environment Interactions, 8: 567-574. doi: 10.3354/aei00198.
Lyu S J,Yuan X M,Zhang H Q,Hang X Y,Li Y L,Shi W D, Liu L,Yu Z,Wu Y L. 2020. Transcriptome profiling analysis of lung tissue of Chinese soft-shell turtle infected by Trionyx sinensis Hemorrhagic Syndrome Virus[J]. Fish amp; Shellfish Immunology,98:653-660. doi:10.1016/j.fsi.2019.10.061.
McGaugh S E, Bronikowski A M, Kuo C H, Tonia S S. 2015. Rapid molecular evolution across amniotes of the ⅡS/TOR network[J]. Proceedings of the National Academy of Scien- ces of the United States of America, 112 (22) : 7055-7060.doi:10.1073/pnas.1419659112.
Morgan D O, Edman J C, Standring D N, Fried V A, Smith M C, Roth R A, Rutter W J. 1987. Insulin-like growth factor II receptor as a multifunctional binding protein[J]. Nature,329(6137):301-307. doi:10.1038/329301a0.
Ndandala C B, Dai M, Mustapha U F, Li X M, Liu J L,Huang H, Li G L, Chen H P. 2022. Current research and future perspectives of GH and IGFs family genes in somatic growth and reproduction of teleost fish[J]. Aquaculture Reports, 26: 101289. doi:10.1016/j.aqrep.2022.101289.
Nelson S N, van Der Kraak G. 2010. The role of the insulinlike growth factor (IGF) system in zebrafish (Danio rerio) ovarian development [J]. General and Comparative Endocrinology, 168(1): 103-110. doi: 10.1016/j.ygcen.2010.04.
021. Nipkow M, Wirthgen E, Luft P, Rebl A, Hoeflich A, Goldammer T. 2018. Characterization of igfl and igf2 genes during maraena whitefish (Coregonus maraena) ontogeny and the effect of temperature on embryogenesis and igf expression [J]. Growth Hormone amp; IGF Research, 40: 32-43. doi:
10.1016/j.ghir.2018.04.003.
Rotwein P. 2018. The insulin-like growth factor 2 gene and locus in nonmammalian vertebrates: Organizational simplicity with duplication but limited divergence in fish [J].
Journal of Biological Chemistry, 293 (41) : 15912-15932.
doi:10.1074/jbc.RA118.004861.
Schwartz T S, Bronikowski A M. 2016. Evolution and function of the insulin and insulin-like signaling network in ectothermic reptiles: Some answers and more questions[J]. In-tegrative and Comparative Biology, 56 (2) : 171-184. doi: 10.1093/icb/icw046.
Sélénou C, Brioude F, Giabicani E, Laure M L, Netchine I.
2022. IGF2: Development, genetic and epigenetic abnormalities[J]. Cells, 11 (12): 1886. doi: 10.3390/cells11121
886. Sun C X,Xu W N,Zhang D D,Li X F,Li P F,Jiang G Z,Liu W B. 2018a. Different preference is modulated by the feeding stimulants supplementation in different Chinese softshelled turtle (Pelodiscus sinensis) basic diets [J]. Aquaculture Nutrition,24(1): 195-203. doi:10.1111/anu.12547.
Sun C X,Zhang D D,Liu W B,Cai W C,Qian Y,Wang K Z, Li X F,Jiang G Z,Xu W N. 2018b. Growth performance, digestion and metabolism to fish meal replacement by rice protein concentrate in Chinese soft-shelled turtle Pelodiscus sinensis [J]. Aquaculture,492: 321-326. doi: 10.1016/j.
aquaculture.2018.04.032.
Wang Z,Pascual-Anaya J,Zadissa A, Li W, Niimura Y,Huang Z Y, Li C Y, White S, Xiong Z Q, Fang D M, Wang B, Ming Y, Chen Y, Zheng Y, Kuraku S, Pignatelli M, Herrero J, Beal K, Nozawa M, Li Q Y, Wang J, Zhang H Y, Yu L L, Shigenobu S, Wang J Y, Liu J N, Flicek P, Searle S,Wang J,Kuratani S, Yin Y,Aken B,Zhang G J, Irie N.
2013. The draft genomes of soft-shell turtle and green sea turtle yield insights into the development and evolution of the turtle-specific body plan [J]. Nature Genetics, 45 (6):701-706. doi:10.1038/ng.2615.
Zaina S, Squire S. 1998. The soluble type 2 insulin-like growth factor (IGF-IⅡ) receptor reduces organ size by IGF-IⅡ- mediated and IGF-II-independent mechanisms[J]. Journal of Biological Chemistry, 273 (44) : 28610-28616. doi: 10.1074/jbc.273.44.28610.
Zhang J,Wang F,Jiang Y L,Hou G J,Cheng Y S, Chen H L, Li X. 2017. Modern greenhouse culture of juvenile softshelled turtle, Pelodiscus sinensis[J]. Aquaculture International,25:1607-1624. doi: 10.1007/s10499-017-0137-y.
Zhou X W,Luo H,Zeng D,Hu Y Z,Wang P,Xiong G,Wang
X. Q. 2022. Sex-relevant genes in the embryo stage of Chinese soft-shelled turtles as revealed by RNA-Seq analysis [J]. Animal Biology, 72 (2) : 72. doi: 10.1163/15707563-bja10073.
Zhou X W,Tian Y,Liu L,Ge L R,Zhang H,Liang Y X,Wang X Q, Hu Y Z. 2023. Pathologic, transcriptomic and microbiomic insight into the pathogenesis of intestinal parasitic tapeworm in cultured Chinese soft-shelled turtle (Pelodiscus sinensis) [J]. Aquaculture,562:738788. doi: 10.1016/j.aquaculture.2022.738788.
(责任编辑兰宗宝)

