山葡萄VaERF095基因表达及其启动子功能分析
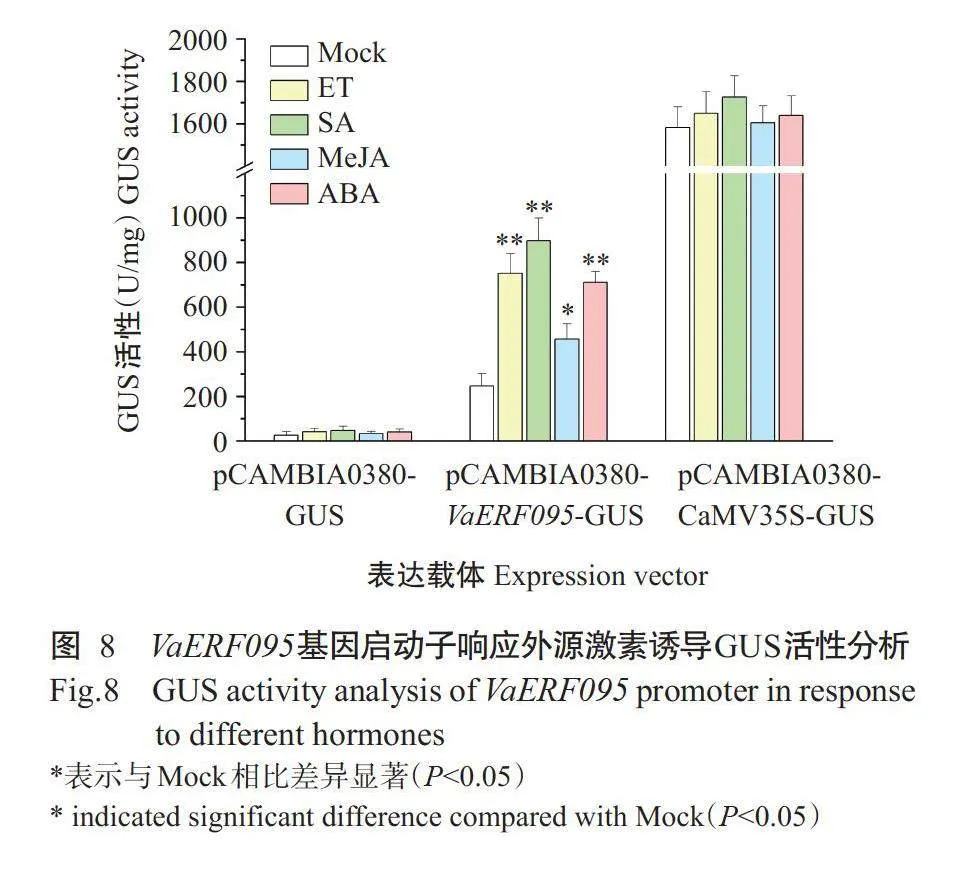



摘要:[目的】克隆山葡萄乙烯响应因子基因VaERF095及其启动子序列,分析在低温和外源激素诱导下该基因的表达模式和启动子活性,为深入探究VaERFO95基因参与低温胁迫响应机理提供理论依据。【方法】采用同源克隆方法从山葡萄品种左山-1中获得VaERFO95基因及其启动子,并通过实时荧光定量PCR检测VaERF095基因在低温(4℃)胁迫和外源激素诱导下及不同组织中的表达情况。同时构建VaERF095基因启动子融合GUS蛋白表达载体,瞬时转化葡萄叶片,通过β-葡萄糖苷酸酶(GUS)活性定量分析VaERF095基因启动子受低温胁迫和外源激素诱导的表达情况。【结果】从山葡萄克隆获得VaERF095基因,编码区(CDS)全长393bp,编码130个氨基酸残基,该蛋白含有1个保守的AP2/ERF结构域,与欧洲葡萄和河岸葡萄的亲缘关系较近,氨基酸序列相似性分别为100.00%和93.08%。VaERF095基因可响应低温和外源激素乙烯(ET)、水杨酸(SA)、茉莉酸甲酯(MeJA)和脱落酸(ABA)的诱导,呈现出不同的表达模式。VaERF095基因在老叶、茎、花序、卷须和果实均有表达,其中在卷须中的表达量最高,在幼叶中的表达量极低或几乎不表达。克隆获得长度为1360bp的VaERF095基因启动子,含有2个低温响应元件(LTR)、1个ET响应元件(ERE)、1个SA响应元件(TCA-element)、2个MeJA响应元件(CGTCA-motif和TGACG-motif)、1个ABA响应元件(ABRE)、1个GA响应元件(P-box)和1个防御和胁迫响应元件(TC-rich repeats)。在低温胁迫及外源激素(ET、SA和ABA)诱导下,VaERF095基因启动子活性较对照极显著升高(Plt;0.01),在MeJA诱导下,VaERF095基因启动子活性显著增强(Plt;0.05)。【结论】VaERF095基因及其启动子正向响应低温(4℃)及外源激素(ET、SA、ABA和MeJA)的诱导,具有明显的组织表达特异性。
关键词:山葡萄;ERF转录因子;基因表达;启动子;功能分析
中图分类号:S663.103.6文献标志码:A文章编号:2095-1191(2024)01-0037-10
Gene expression of VaERF095and functional analysis of its promoter from Vitis amurensis
WANG Lan',XU Jian-ren²
('College of Enology and Horticulture,Ningxia University,Yinchuan,Ningxia750021,China;²College of Bioscience and Engineering,North MinzuUniversity,Yinchuan,Ningxia750021,China)
Abstract:[Objective]In this study,the transcription factor gene VaERF095and its promoter were cloned from Chi-nese Vitis amwrensis.The gene expression and promoter activity under the induction of low temperature and exogenous hormones were analyzed,so as to provide theoretical basis for the regulation mechanism of VaERF095gene inresponse to low temperature stress.【Method]The VaERF095gene from Vamurensis variety Zuoshan-1and its promoter were cloned by homology-based cloning.The expressions of VaERF095gene induced by low temperature(4℃)and exogenous hor-mones and in different tssues were analyzed by real-time fluorescence quantitative PCR.The GUS protein expression vec-tor inserted with VaERF095gene promoter was constructed and transiently transformed into grape leaves.The β-glucuroni-dase(GUS)activity assay was performed to analyze the expression of VaERF095gene promoter induced by low tempera-ture and exogenous hormones.[Result]The VaERF095gene was cloned from V.amurensis and the total length of the co-ding sequence(CDS)was393bp,encoding130amino acid residues.The protein contained aconserved AP2/ERF do-main,which was closely related to V.vinifera L.and V.riparia,with amino acid sequence similarity of100.00%and93.08%,respectively.The VaERF095gene showed different expression patterns in response to low temperature and induc-tion ofexogenous hormones ethylene(ET),salicylic acid(SA),methyl jasmonate(MeJA)and abscisic acid(ABA).VaERFO95gene was expressed in mature leaf,stem,inflorescence,tendril and berry,with the highest expression in ten-dril and very low or almost no expression in young leaf.The VaERF095gene promoter with alength of1360bp was cloned.The sequence analysis indicated that VaERF095gene promoter containing two low temperature responsive ele-ment(LTR),one ETresponsive element(ERE),one SA responsive element(TCA-element),two MeJA responsive ele-ments(CGTCA-motif and TGACG-motif),one ABA responsive element(ABRE),one GA responsive element(P-box)and one defense and stress responsive element(TC-rich repeats).The activity of VaERF095gene promoter was extremely enhanced in response to low temperature and exogenous hormonesET,SA and ABA(Plt;0.01).Meanwhile,the activity of VaERF095gene promoter was significantly enhanced in response to MeJA induction(Plt;0.05).【Conclusion】VaERF095gene and its promoter positively respond to the induction of low temperature(4℃)and exogenous hormones such asET,SA,ABAand MeJA,and has obvioustissue expression specificity
Keywords:Vitis amurensis;ERF transcription factor;gene expression;promoter;funcional analysis
Foundation items:Ningxia Natural Science Foundation(2021AAC03092);Ningxia Key Research and Develop-ment Plan Project(2020BEB04024)
0引言
【研究意义】欧洲葡萄(Vitis vinifera L.)在葡萄的栽培生产中应用最为广泛,虽然其果实品质优良,但抗寒性较差,在我国北方进行葡萄栽培生产时,需采取冬季埋土防寒、春季出土上架的措施,耗费大量人力和物力,增加了生产成本。而我国拥有丰富的野生葡萄种质资源,其中山葡萄(Vitis amurensis)起源于我国东北,具有较强的抗寒性,能耐受-40℃的低温,作为葡萄属中最抗寒的种,是探究葡萄抗寒机理的常用材料(贺普超和晁无疾,1982)。乙烯响应因子(Ethylene responsive factor,ERF)作为植物中重要的一类转录因子,具有响应生物和非生物胁迫、调控初级和次级代谢、参与植物生长发育等功能(Licausi et al.,2013)。因此,克隆山葡萄VaERF095基因及其启动子,分析基因表达模式和启动子功能,以期深入探究VaERF095基因响应低温胁迫的作用机理,对葡萄种质抗寒性状改良具有重要的指导意义。【前人研究进展】ERF家族转录因子是一类主要存在于植物体内的转录因子,调控高等植物的多种环境胁迫响应过程,如低温、高温、干旱等(Feng et al.,2020)。该家族转录因子首先在拟南芥中发现,均含有AP2结构域(Jofuku et al.,1994)。随后在烟草中发现4个ERF蛋白,能特异结合GCC-box元件(Ohme-Takagi and Shinshi,1995)。近年来,在葡萄(Licausi et al.,2010)、油菜(Ghorbani et al.,2020)、玉米(Hao et al.,2020)、红薯(He et al.,2021)等植物中也陆续发现了ERF转录因子家族基因,并开展了相关功能研究。在不同植物中,ERF转录因子对低温胁迫的响应方式不同,如白桦BplERF1基因正向调控抗寒性(Lv et al.,2021),而水稻OsBIERF3基因能响应水杨酸(SA)、茉莉酸甲酯(MeJA)、脱落酸(ABA)和低温诱导,负调控抗寒性(Hong et al., 2022)。拟南芥抗寒相关转录因子AtERF105在冻害的耐受性中发挥重要作用,正向调控转基因植株的抗寒性(Bolt et al.,2017)。山葡萄ERF转录因子基因VaERF080和VaERF087能响应低温和乙烯的诱导,过量表达可提高植株的抗寒性(Sun et al.,2019b)。在拟南芥中过量表达山葡萄VaERF057基因,也可增强植株的抗寒性(Sun et al.,2016)。山葡萄VaERF092基因响应低温胁迫,该转录因子蛋白通过结合VaWRKY33基因的启动子,增强对低温胁迫的抗性(Sun et al.,2019a)。低温是影响植物生长发育的主要环境因素之一,植物细胞通过一系列信号通路调控相关基因表达形成信号调控网络,参与低温胁迫应答(Gong et al.,2020)。已有文献报道,不同物种ERF转录因子的启动子序列中,含有多个与低温及激素响应有关的顺式作用元件,常为诱导型启动子。玉米低温响应ZmERFs基因启动子中高度富集多种逆境相关元件,包括ABA响应元件(ABRE)、厌氧响应元件(ARE)、低温响应元件(LTR)和干旱响应元件(MBS)(王雪贺缘等,2021)。水稻OsERF096基因启动子中含有多个低温响应元件(MYC-CONSENSUSAT)、ABA响应元件(ABRERATCAL)、SA响应元件(WBBBOXATNPR1)、赤霉素(GA)响应元件(HVAL21)等,推测该基因响应低温和激素胁迫(陈悦等,2022)。【本研究切入点】基因的转录表达与其启动子密切相关,继续挖掘葡萄中低温胁迫相关ERF转录因子,并探究其启动子响应外界环境信号诱导的功能,有助于完善葡萄中低温胁迫应答调控网络。目前葡萄中仍有许多ERF转录因子家族成员的功能未深入研究,未见山葡萄VaERF095基因表达及其启动子功能分析的研究报道。【拟解决的关键问题】采用同源克隆方法从山葡萄品种左山-1中获得VaERF095基因及其启动子,并通过实时荧光定量PCR检测VaERF095基因在低温胁迫和不同外源激素诱导及不同组织中的表达情况。同时构建VaERF095基因启动子融合β-葡萄糖苷酸酶(GUS)表达载体,瞬时转化葡萄叶片,GUS定量分析VaERF095基因启动子响应低温胁迫和不同外源激素诱导的表达情况,为VaERF095基因参与低温胁迫响应机理提供理论参考。
1材料与方法
1.1试验材料
中国野生山葡萄品种左山-1(Vitis amurensis accession‘Zuoshan-1’)和欧洲葡萄品种赤霞珠(Vitis vinifera cv.Cabernet Sauvignon)均来源于西北农林科技大学园艺学院葡萄种质资源圃,采集左山-1的幼叶、老叶、茎、卷须、花序和果实进行组织特异性表达分析。克隆载体pMD19-T、GUS表达载体pCAM-BIA0380-GUS和pCAMBIA0380-CaMV35S-GUS为宁夏大学葡萄酒与园艺学院实验室保存;大肠杆菌Topl0感受态细胞、DNA回收试剂盒、反转录试剂盒和Bradford蛋白质定量试剂盒购自天根生化科技(北京)有限公司;农杆菌(Agrobacterium tumefa-ciens)GV3101感受态细胞购自北京擎科生物科技股份有限公司;大肠杆菌质粒提取试剂盒和植物总RNA提取试剂盒购自广州欧米伽(Omega)生物科技有限公司;实时荧光定量PCR试剂盒购自北京全式金生物技术有限公司;限制性内切酶、PrimeSTAR Max DNA聚合酶和T4DNA连接酶购自宝生物工程(大连)有限公司;乙烯(ET)、SA、MeJA和ABA购自上海希格玛(Sigma)高技术有限公司;其他常规化学试剂均为分析纯。主要仪器设备:低温培养箱(上海一恒科技有限公司)、光照培养箱(宁波东南仪器有限公司)、qTOWER³G定量PCR仪(AnalytikJena,德国)、循环水式多用真空泵(郑州长城科工贸有限公司)、PCR仪[伯乐生命医学产品(上海)有限公司]和分光光度计(北京普析通用仪器有限责任公司)。
1.2材料处理
选取长势一致的2年生左山-1盆栽扦插苗,分别进行低温处理和外源激素处理。低温处理时植株置于4℃低温培养箱,在0、1.0、3.0、6.0、12.0、24.0和48.0h取样收集叶片,液氮速冻后于-80℃保存。外源激素处理时,植株叶片分别均匀喷施0.5g/L的ET溶液和100μmol/L的SA、MeJA、ABA溶液(Wang et al.,2020),置于光照培养箱,设光周期为16h光照/8h黑暗进行培养,分别在0、0.5、1.0、2.0、6.0和10.0h取样,液氮速冻,-80℃保存。试验共使用45株盆栽扦插苗,每处理均设3个生物学重复,每个重复3株。
1.3RNA提取及反转录
保存于-80℃的葡萄叶片和其他组织材料,使用液氮充分研磨至粉末状,按照植物总RNA提取试剂盒(E.Z.N.A.Total RNA KitⅡ)说明进行RNA提取。按照反转录试剂盒(FastKing RT Kit With gDNase)说明反转录合成cDNA第一链,cDNA稀释5倍后保存于-20℃,用于后续VaERF095基因克隆和实时荧光定量PCR。
1.4VaERF095基因克隆及序列分析
从NCBI数据库获得ERF095基因序列(XM_002284724.4),利用Primer Premier5.0设计试验所需的引物(VaERF095-F和VaERF095-R)(表1),引物由北京奥科鼎盛生物科技有限公司合成。VaERF095基因克隆以稀释后的cDNA为模板,反应体系30.0μL:2×PrimeSTAR Max Premix15.0μL,正、反向引物(10μmol/L)各1.0μL,100ng/pL cDNA模板1.0μL,ddH₂O补充至30.0μL。扩增程序:95℃预变性3min;98℃10s,55℃20s,72℃1min,进行35个循环;72℃延伸10min。PCR产物以1%琼脂糖凝胶电泳进行检测,使用DNA回收试剂盒回收目的片段并测序,测序正确的序列命名为VaERF095。使用NCBI数据库的BLAST功能,查找与VaERF095氨基酸序列相近的其他物种ERF转录因子氨基酸序列,使用DNAMAN9.0进行氨基酸序列比对,使用MEGA5.0构建系统发育进化树。
1.5VaERF095基因表达分析
以不同处理的cDNA为模板,RT-VaERF095-F和RT-VaERF095-R为定量引物,通过实时荧光定量PCR检测VaERF095基因在低温胁迫和不同外源激素诱导及不同组织中的表达情况,以GAPDH基因为内参,其引物为RT-GAPDH-F和RT-GAPDH-R。反应体系20.0μL:2×PerfectStart Green qPCR Super-Mix10.0μL,100ng/μL cDNA模板1.0μL,10μmol/L正、反向引物各0.8μL,ddH₂O补充至20.0μL。PCR反应在qTOWER'G定量PCR仪中进行,扩增程序:94℃预变性3min;94℃5s,60℃15s,72℃20s,进行40个循环;通过熔解曲线(94℃15s,60℃
1min,94℃15s)分析引物的特异性。使用2-~法计算目的基因的相对表达量,取3次生物学重复的平均值,使用SPSS24.0对其进行t检验。
1.6VaERF095基因启动子克隆及序列分析
使用CTAB法提取左山-1叶片基因组DNA,1%琼脂糖凝胶电泳检测DNA质量。利用葡萄基因组网站(https://www.genoscope.cns.fr/externe/Genome-Browser/Vitis/)检索VaERF095基因上游启动子序列,设计启动子扩增引物proVaERF095-F和proVaERF095-R(表1),分别插入BamHI和SalI酶切位点。以基因组DNA为模板,克隆VaERF095基因启动子,PCR反应体系与1.4相同。扩增程序:95℃预变性3min;98℃10s,55℃20s,72℃2min,进行35个循环;72℃延伸10min。PCR扩增产物进行1%琼脂糖凝胶电泳检测,使用DNA回收试剂盒回收目的片段,连接至pMD19-T载体,转化大肠杆菌Top10感受态细胞,在含100mg/L氨苄青霉素的LB固体培养基上进行筛选,挑取单克隆进行菌液PCR检测,对阳性菌株进行测序,测序正确的启动子序列命名为proVaERF095,并提取阳性质粒pMD19-T proVaERF095。将VaERF095基因的启动子序列提交至PlantCARE网站(htp:/bioinformatics.psb.ugent be/webtools/plantcare/html/)进行顺式作用元件分析。
1.7启动子融合GUS蛋白表达载体构建
对pMD19-TproVaERF095和pCAMBIA0380-GUS表达载体进行BamHI和SalI双酶切,回收目的片段后使用T4DNA连接酶连接,转化大肠杆菌Top10感受态细胞,在含有50mg/L卡那霉素的LB固体培养基上筛选阳性克隆,并提取重组质粒。通过重组质粒双酶切检测,从而获得构建正确的启动子融合GUS蛋白表达载体pCAMBIA0380-proVaERF095-GUS。通过电击转化法将pCAMBIA0380-GUS、pCAM-BIA0380-proVaERF095-GUS和pCAMBIA0380-CaMv35S-GUS转化农杆菌GV3101菌株。
1.8VaERF095基因启动子瞬时转化葡萄叶片的GUS荧光定量分析
活化含不同质粒的农杆菌GV3101菌株,25℃4000r/min离心5min收集菌体,加入重悬液(配方为10mmol/LMESpH5.8、10mmol/LMgCl₂和200μmol/L乙酰丁香酮)轻微涡旋混匀,调整OD为0.4后室温静置1~3h。采集生长势一致赤霞珠叶片,置于重悬液中,叶片近轴面向上,使用循环水式多用真空泵,抽真空30min,设置压力为0.07MPa。将叶柄包裹浸润蒸馏水的脱脂棉,置于塑料托盘中,覆盖保鲜膜保湿,23℃光照培养箱中培养2d。将叶片分为6组,一组喷施ddH₂O为对照(Mock),一组转移至4℃低温培养箱,其余4组分别均匀喷施0.5g/L的ET溶液和100μmolL的SA、MeJA、ABA溶液,与Mock一起置于23℃光照培养箱中正常培养,继续培养1d后收集叶片,用于GUS荧光定量分析。将收集的叶片样品置于液氮中充分研磨,加入GUS提取缓冲液提取GUS蛋白,使用Bradford蛋白质定量试剂盒测定GUS提取液蛋白含量,配制含有1mmol/L4-甲基伞形酮β-D葡萄糖苷(4-MUG)的反应缓冲液,加入GUS蛋白提取物,经30min酶反应后,使用分光光度计(北京普析通用仪器有限责任公司)测定荧光强度,根据测定的GUS蛋白含量和荧光强度计算GUS蛋白活性,具体方法参考徐伟荣(2010)的研究报道。
2结果与分析
2.1VaERF095基因克隆结果
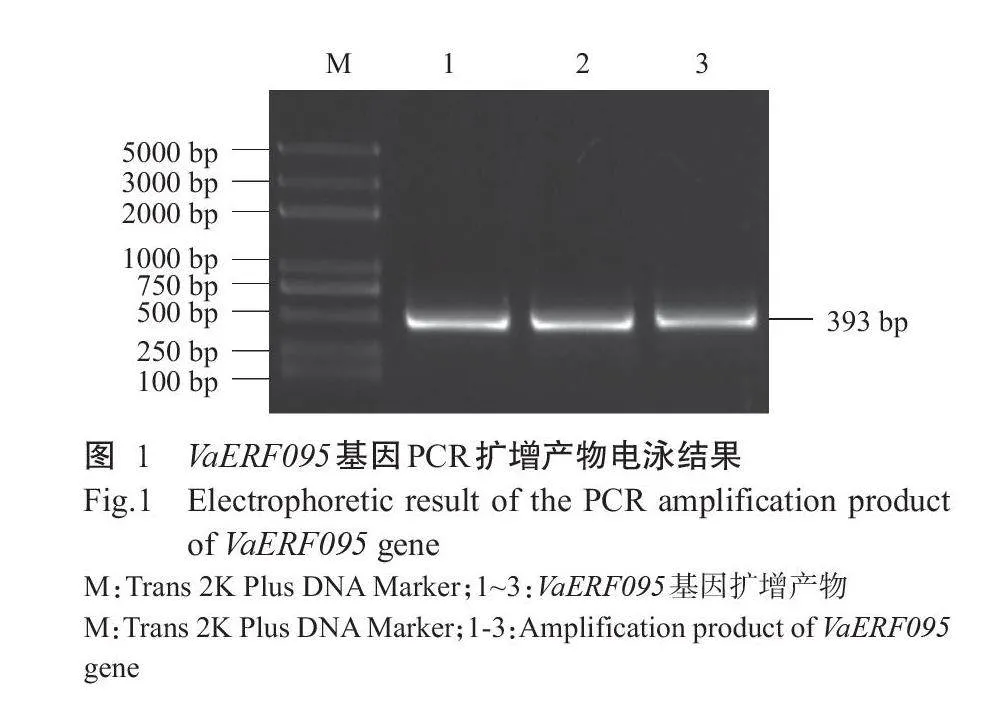
以左山-1的cDNA为模板,以VaERF095-F和VaERF095-R为引物进行PCR扩增,获得大小约为400bp的特异条带(图1),纯化回收后进行测序,结果显示该基因编码区(CDS)全长393bp,与参考序列(XM_002284724.4)的相似性达100%,无内含子,将该基因命名为VaERF095。
2.2VaERF095蛋白同源比对及系统发育分析结果
VaERF095基因编码130个氨基酸残基,选取该基因编码蛋白的10个同源序列进行多重序列比对和系统发育分析,包括欧洲葡萄(Vitis vinifera)VvERF095(XP_002284760.3)、河岸葡萄(Vitis riparia)VrERF095-like(XP_034686807.1)、毛白杨(Populus tomentosa)PtPOTOM_030295(KAG6766224.1)、木薯(Manihot esculenta)MeERF096(XP_021608692.2)、椰子(Cocos nucifera)CnERF096-like(KAG1361391.1)、狭叶羽扇豆(Lupinus angustifolius)LaERF096-like(XP_019439145.1)、黄瓜(Cucumis sativus)CsERF098(XP_004145711.1)、欧洲苹果(Malus sylvestris)MsERF096-like(XP_050131490.1)、大豆(Glycine max)GmERF095(XP_003553492.1)和拟南芥(Arabidop-sis thaliana)AtERF95(AT3G23220.1)。氨基酸序列比对结果显示,这11个物种ERF转录因子均含有1个保守的AP2/ERF结构域(图2),属于ERF家族的B3类。系统发育分析结果显示,VaERF095与欧洲葡萄VvERF095和河岸葡萄VrERF095-like的亲缘关系较近(图3),氨基酸序列相似性分别为100.00%和93.08%
2.3VaERF095基因表达分析结果
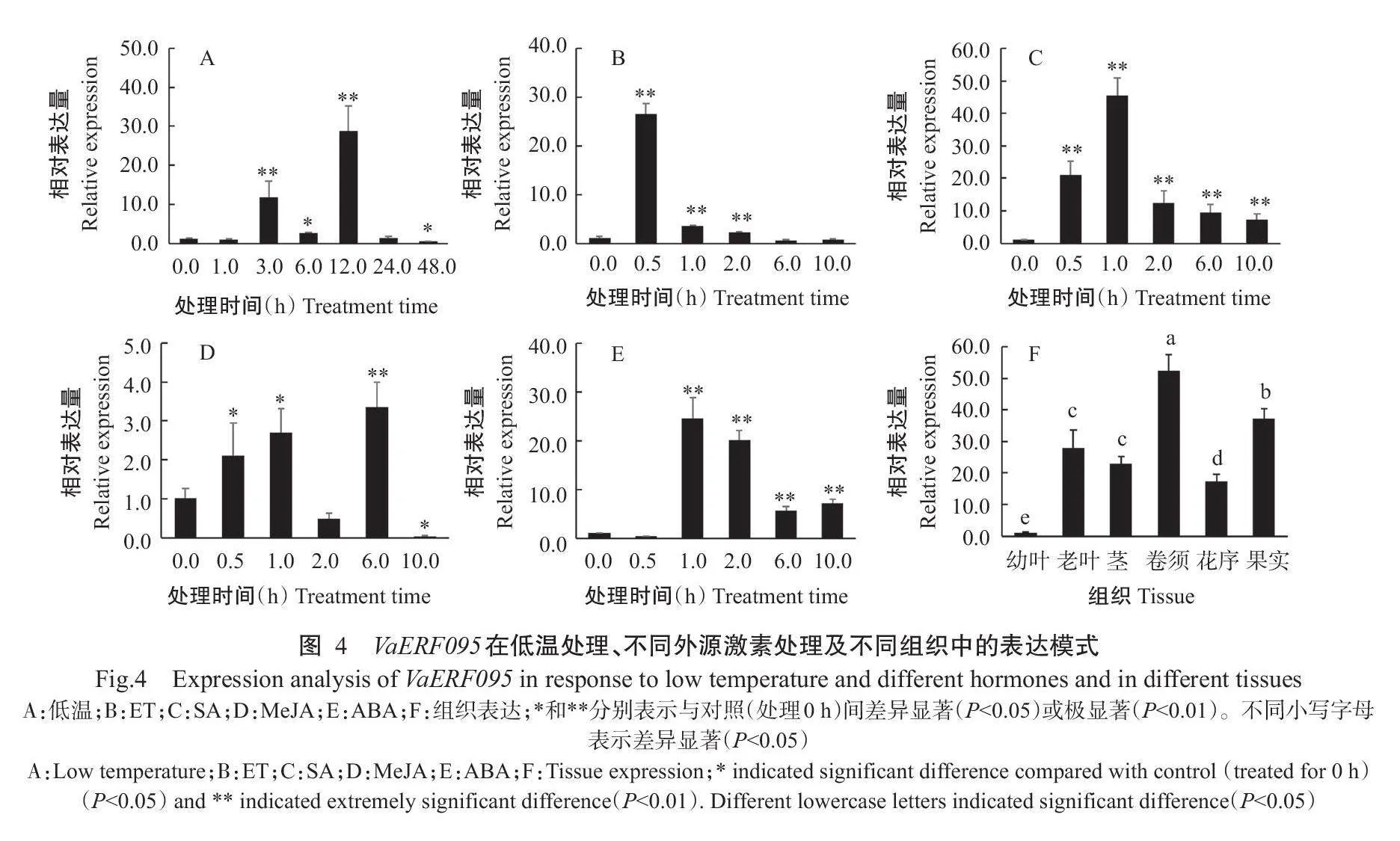
对山葡萄品种左山-1盆栽苗进行低温处理(4℃)及外源激素(ET、SA、MeJA和ABA)诱导,并在不同时间点取集叶片,以处理0h为对照,实时荧光定量PCR检测VaERF095基因的相对表达量,结果如图4所示。在低温处理下,VaERF095基因的相对表达量呈波动式变化,在处理3.0h较对照极显著升高(Plt;0.01,下同),处理6.0h又下降,处理12.0h相对表达量极显著上升至峰值,随后又下降(图4-A);ET处理下,VaERF095基因在处理0.5h的相对表达量达峰值,极显著高于对照,随后相对表达量逐渐降低(图4-B);SA处理下,VaERF095基因在处理0.5~10.0h的相对表达量较对照极显著升高,但整体呈先升高后降低的变化趋势,在处理1.0h极显著升至峰值(图4-C);MeJA处理下,VaERF095基因在处理1.0h的相对表达量较对照显著升高(Plt;0.05,下同),处理6.0h的相对表达量较对照极显著升高,处理2.0和10.0h的相对表达量均低于对照(图4-D);ABA处理下,VaERF095基因在处理1.0~10.0h的相对表达量较对照极显著升高,在处理1.0h的相对表达量达峰值,随后呈下降趋势(图4-E)。以上结果表明,VaERF095基因可响应低温处理和外源激素(ET、SA、MeJA和ABA)的诱导。
选取山葡萄的幼叶、老叶、茎、花序、卷须和果实,利用实时荧光定量PCR对VaERF095基因进行组织特异性表达分析,结果发现VaERF095基因在卷须中的相对表达量最高,但在果实、老叶、茎和花序中的相对表达量显著减少,在老叶和茎中的相对表达量无显著差异(Pgt;0.05),在幼叶中极低或几乎不表达(图4-F),表明该基因具有明显的组织表达特性。
2.4VaERF095基因启动子克隆结果
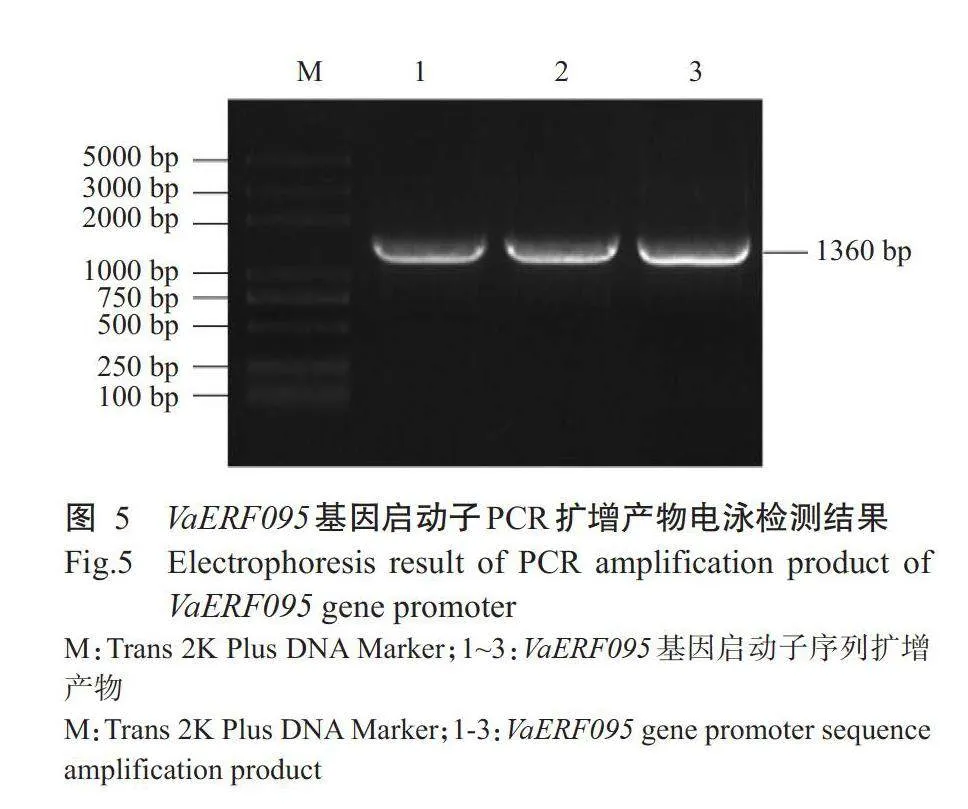
以山葡萄品种左山-1的基因组DNA为模板,proVaERF095-F和proVaERF095-R为引物进行PCR扩增,扩增产物用1%琼脂糖凝胶电泳检测,如图5所示。扩增条带长度约1300bp,与预期结果相符。经测序验证,该条带长度为1360bp,为VaERF095基因启动子片段,命名为proVaERF095。将扩增产物连接至pCAMBIA0380-GUS表达载体获得pCAMBIA0380-proVaERF095-GUS重组质粒,然后转化农杆菌GV3101菌株。
2.5VaERF095基因启动子顺式作用元件分析结果
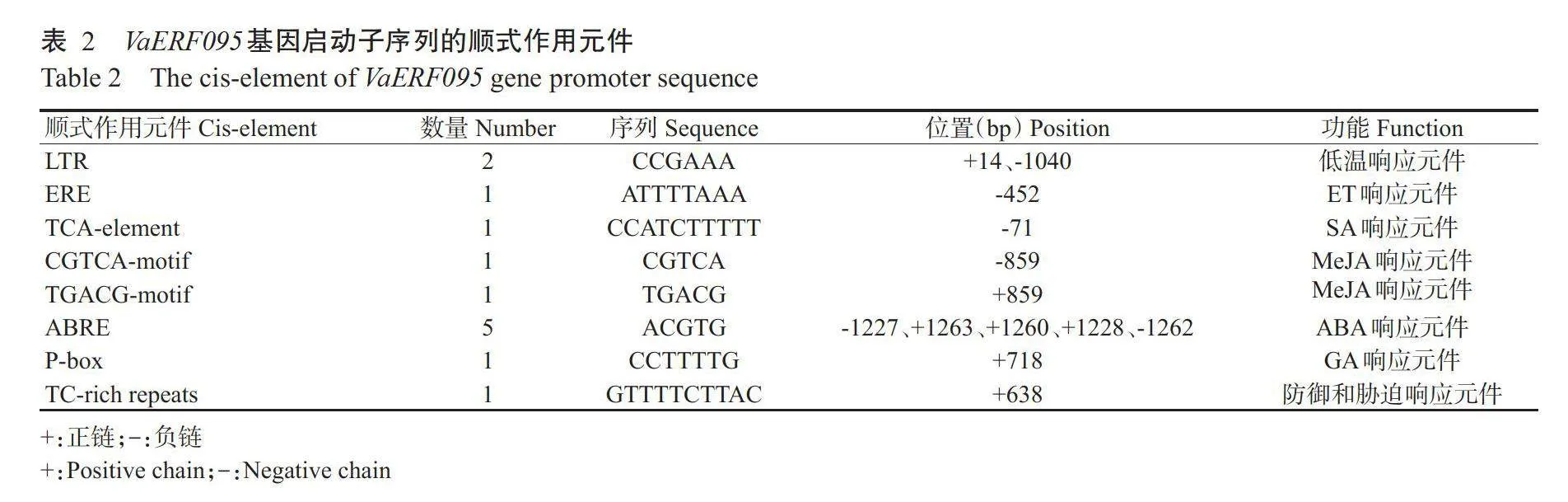
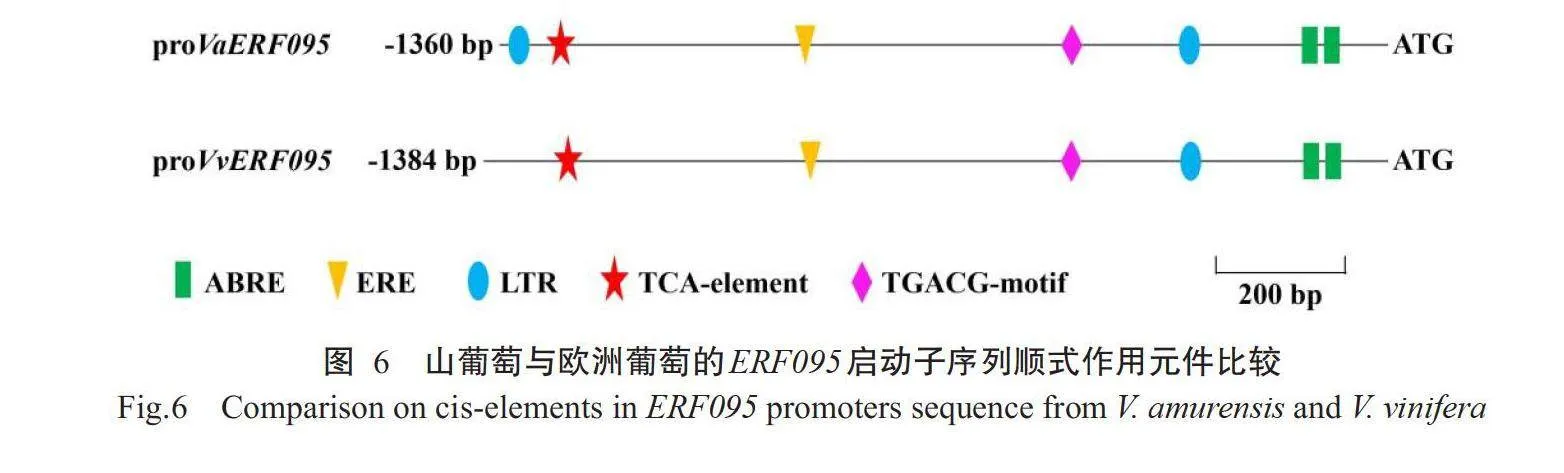
使用PlantCARE进行启动子序列顺式作用元件分析,结果发现VaERF095基因启动子序列中,含有2个低温响应元件(LTR)、1个ET响应元件(ERE)、1个SA响应元件(TCA-element)、2个MeJA响应元件(CGTCA-motif和TGACG-motif)、1个ABA响应元件(ABRE)、1个GA响应元件(P-box)和1个防御和胁迫响应元件(TC-rich repeats)(表2)。以上结果表明,VaERF095基因可能参与低温胁迫响应和多种植物激素响应。
对山葡萄VaERF095基因启动子和欧洲葡萄VvERF095基因启动子序列中的主要顺式作用元件进行比对分析,结果发现VaERF095基因启动子中含有2个低温响应元件,而VvERF095基因启动子中仅含有1个低温响应元件(图6)。由于山葡萄的抗寒性强于欧洲葡萄,故推测葡萄的抗寒性与其ERF095基因启动子区域的低温响应元件数量密切相关。
2.6 VaERF095基因启动子响应低温胁迫GUS表达分析结果
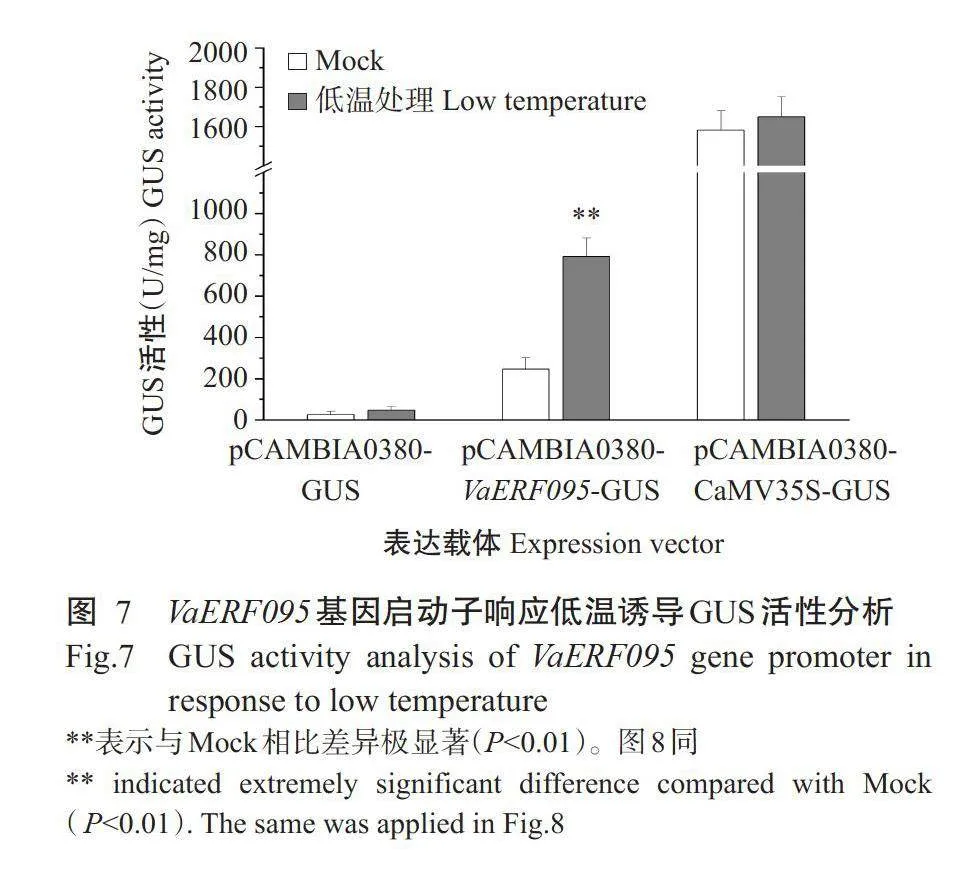
为了进一步探究VaERF095基因启动子响应低温诱导GUS表达情况,构建启动子融合GUS表达载体,并分别以pCAMBIA0380-GUS和pCAMBIA0380-CaMV35S-GUS为阴性对照和阳性对照,通过农杆菌GV3101介导的真空渗透法,将不同的GUS表达载体在赤霞珠叶片中瞬时表达,并进行低温胁迫,通过GUS活性检测分析启动子的表达情况。GUS荧光定量分析结果如图7所示。与Mock相比,VaERF095基因启动子在低温胁迫下,GUS活性是Mock的3.2倍,存在极显著差异,说明VaERF095基因启动子能正向响应低温的诱导。
2.7VaERF095基因启动子响应外源激素诱导GUS表达分析结果
VaERF095基因启动子具有响应植物激素的顺式作用元件,为了进一步探究VaERF095基因启动子响应外源激素(ET、SA、MeJA和ABA)诱导的表达情况,通过农杆菌介导的真空渗透法,将不同的GUS"""" 表达载体在欧洲葡萄品种赤霞珠叶片中瞬时表达,并进行外源激素诱导处理,通过GUS活性检测分析启动子的表达情况。GUS荧光定量分析结果如图8所示。与Mock相比,VaERF095基因启动子在ET、SA和ABA诱导下,GUS活性分别为Mock的3.1、3.6和2.9倍,存在极显著差异;VaERF095基因启动子在MeJA诱导下,GUS活性为Mock的1.9倍,存在显著差异,说明VaERF095基因启动子能正向响应外源激素的诱导。
3讨论
冬季低温胁迫引起植物生理、形态、生化、表型和分子水平等方面的变化(Ritonga et al.,2021),在我国北方葡萄栽培生产过程中,为抵御冬季低温进行埋土防寒,造成生产成本的增加。与常规杂交育种相比,通过基因工程手段改良欧洲葡萄抗寒性,可有效提高育种效率。因此,解析抗寒相关的ERF转录因子功能和作用机制,有助于进一步挖掘山葡萄中的抗寒基因,为葡萄抗寒育种提供潜在靶标基因。ERF转录因子与植物激素间存在复杂的低温胁迫应答机理。本研究从山葡萄中克隆获得VaERF095基因,在低温胁迫及外源激素(ET、SA、MeJA和ABA)的诱导下,VaERF095基因的相对表达量呈不同程度的升高,均为正向响应。Sun等(2016,2019a,2019b)研究也发现,山葡萄ERF家族基因VaERF080、VaERF087、VaERF057和VaERF092均能正向响应低温(4℃)胁迫,且VaERF080和VaERF087基因还可正向响应乙烯诱导。在其他植物中也有相似的研究报道,例如山荆子MbERF12基因过量表达时,通过乙烯信号通路可增加拟南芥的抗寒性(Han et al., 2021);低温胁迫和茉莉酸(JA)诱导番茄SIERFB8基因的表达,正向调控抗寒性(Ding et al.,2022);香蕉MaERF110参与乙烯诱导的抗寒性(Xiao et al.,2023);欧洲葡萄赤霞珠中VvERF63基因的表达受到低温和ABA的诱导,正向调控拟南芥和葡萄叶片的抗寒性(Liet al.,2023)。然而除正向响应之外,也有部分植物中的ERF转录因子负调控抗寒性,例如水稻OsERF096基因通过抑制茉莉酸介导的低温信号通路,负调控对低温胁迫的耐受性(Sun et al.,2022)。上述结果表明,ERF转录因子作为家族基因,在各个物种中成员众多,在响应低温和激素应答调控方面也具有多样性。本研究山葡萄VaERF095基因表达模式分析结果显示,该基因响应低温胁迫可能与ET、SA、MeJA和ABA4种植物激素信号通路有关,为葡萄抗寒相关ERF转录因子基因。氨基酸序列比对结果发现,VaERF095与欧洲葡萄VvERF095的氨基酸序列一致,说明VaERF095基因参与低温胁迫应答,可能与其启动子功能相关。
基因启动子中存在各种顺式作用元件,参与调控基因功能。已有文献报道不同植物ERF转录因子启动子中含有胁迫和激素响应元件。番茄ERF家族基因启动子序列含有ARE、TC-rich repeats、MBS、LTR等胁迫响应元件(Zhu et al.,2020);棉花GhERF14基因启动子中含有ABA响应元件ABRE和ET响应元件(ERE),在受ET、JA和SA诱导时,该基因出现上调表达的趋势(赵龙飞等,2022);桑树MaERF105-Like基因启动子中含有ET、ABA、MeJA相关顺式作用元件(黄仁维等,2022);中国樱桃PpcERF5基因启动子中含有低温响应元件(LTR)、ABA响应元件(ABRE)等,启动子受低温和ABA诱导表达(高玉迪等,2021)。在本研究中,也发现了VaERF095基因启动子序列中含有低温响应元件(LTR)、乙烯响应元件(ERE)、SA响应元件(TCA-element)、MeJA响应元件(CGTCA-motif和TGACG-motif)及ABA响应元件(ABRE),与其他物种ERF转录因子基因启动子中含有的顺式作用元件相似。对山葡萄VaERF095基因启动子和欧洲葡萄VvERF095基因启动子序列中的主要顺式作用元件进行比对分析,结果发现VaERF095基因启动子比VvERF095基因启动子中多1个低温响应元件(LTR)。本研究GUS活性分析结果显示,在低温胁迫和外源激素(ET、SA和ABA)诱导下,VaERF095基因启动子活性较对照极显著升高,在MeJA诱导下,VaERF095基因启动子活性显著增强,说明VaERF095基因的启动子为诱导型启动子,序列中含有的低温和激素响应元件参与调控VaERF095基因表达,启动子活性变化与VaERF095基因表达模式一致,均为正向响应,后续需进一步深入探究VaERF095基因及其启动子参与低温胁迫的具体调控机制,可重点关注上游调控因子对VaERF095基因启动子的表达调控,利用酵母单杂交等试验筛选与VaERF095基因启动子互作的转录因子,完善VaERF095基因参与山葡萄抗寒性的调控网络。
4结论
山葡萄品种左山-1中VaERF095基因及其启动于正向响应低温(4℃)以及外源激素(ET、SA、MeJA和ABA)的诱导,具有明显组织表达特异性。
参考文献:
陈悦,陈茜,董伟峰,才晓溪,沈阳,杨…凯,贾博为,孙明哲,孙晓丽.2022.水稻AP2/ERF转录因子基因OsERF096启动子克隆及活性分析[J].土壤与作物,11(2):159-169.[Chen Y,Chen X,Dong WF,CaiXX,Shen Y,Yang JK,Jia BW,Sun MZ,Sun XL.2022.Cloning and activity analysis of promoer of an AP2/ERF transcription factor gene OsERF096in rice[J].Soils and Crops,11(2):159-169.]doi:10.11689/j.issn.2095-2961.2022.02.005.
高玉迪,李可,朱友银,刘向蕾,尹亚红,王月,郭卫东.2021.中国樱桃乙烯响应因子PpcERF5基因克隆与功能分析[J].植物生理学报,57(1):59-68.[Gao YD,LiK,Zhu YY,Liu XL,Yin YH,Wang Y,Guo WD.2021.Cloning and functional analysis of ethylene responsive factor gene PpcERF5from Chinese cherry[J].Pant Physiology Jour-nal,57(1):59-68.]doi:10.13592/j.cnki.ppj.2020.0486.
贺普超,晁无疾.1982.我国葡萄属野生种质资源的抗寒性分析[J].园艺学报,9(3):17-21.[He PC,Chao WJ.1982.Studies on the cold hardiness of eight species of Vitis Lgrowing wild in China[J].Acta Horticulturae Sinica,9(3):17-21.]
黄仁维,任迎虹,祁伟亮,曾睿,刘欣宇,邓彬艳.2022.桑树MaERF105-Like的克隆及其在干旱胁迫下的表达分析[J].园艺学报,49(11):2439-2448.[Huang RW,Ren YH,QiWL,Zeng R,Liu XY,Deng BY.2022.Cloning of mulberry MaERF105-like gene and its expression under drought stress[J].Acta Horticulturae Sinica,49(11):2439-2448.]doi:10.16420/j.issn.0513-353x.2021-0543.
王雪贺缘,郭耀祖,陈桂森,张苗苗,吴紫璇,左丁卉,谢鑫爽,贺琳.2021.玉米中低温应答ERF基因鉴定及表达分析[J/OL].分子植物育种.https:/kns.cnki.net/kcms/detail/461068.S.20210809.1656.021.html.[Wang XHY,Guo YZ,Chen GS,Zhang MM,WuZX,Zuo DH,Xie XS,He L.2021.Identification and expression analysis of low tem-perature response ERF genes in maize[J/OL].Molecular Plant Breeding.https:/kns.cnki.net/kcms/detail/46.1068.S.20210809.1656.021.html.]
徐伟荣.2010.中国华东葡萄抗白粉病芪合成酶基因及启动子克隆与功能分析[D].杨凌:西北农林科技大学,[Xu WR.2010.Cloning and functional analysis of stilbene synthase and its promoter from powdery mildew-resistant Chinese Vitis psendoreticulata[D].Yangling:Northwest Aamp;FUniversity.]
赵龙飞,明聪,张中荣,袁玥,刘戈辉,张薇.2022.棉花AP2/ERF-B3亚组转录因子基因GhERF₁4的克隆与表达分析[J].分子植物育种,20(9):2804-2811.[Zhao LF,Ming C,Zhang ZR,Yuan Y,Liu GH,Zhang W.2022.Cloning and expression analysis of atranscription factor gene GhERF14from cotton AP2/ERF-B3subgroup[J].Molecu-lar Plant Breeding,20(9):2804-2811.]doi:10.13271j mpb.020.002804Bolt S,Zuther E,Zintl S,Hincha DK,Schmülling T.2017.
ERF105is atranscription factor gene of Arabidopsis tha-liana required for freezing tolerance and cold acclimation[J].Plant,Cell and Environment,40(1):108-120.doi:10.1111/pce.12838.
Ding F,Wang C,Xu N,Wang ML.2022.The ethylene response Factor SIERE.B8triggers jasmonate biosynthesis"to promote coldtolerance in tomato[J].Environmental and Experimental Botany,203:105073.doi:10.1016/j.envexp-bot.2022.105073.
FengK,Hou XL,Xing GM,Liu JX,Duan AQ,Xu ZS,LiM Y,Zhuang J,Xiong AS.2020.Advances inAP2/ERF super-familytranscription factors in plant[J].Critical Reviews in Biotechnology,40(6):750-776.doi:10.1080/07388551.2020.1768509.
Ghorbani R,Zakipour Z,Alemzadeh A,Razi H.2020.Genome-wide analysis of AP2/ERF transcription factors family in Brassica napus[J].Physiology and Molecular Biology of Plants,26:1463-1476.doi:10.1007/s12298-020-00832-z.
Gong ZZ,Xiong LM,Shi HZ,Yang SH,Herrera-Estrella LR,Xu GH,Chao DY,LiJR,Wang PY,Qin F,Li JG,Ding YL,ShiYT,Wang Y,Yang YQ,Guo Y,Zhu JK.2020.Plant abiotic stress response and nutrient use effi-ciency[J].Science China Life Sciences,63(5):635-674.doi:10.1007/s11427-020-1683-x.
Han DG,Han JX,Xu TL,Li XG,Yao CY,Li TM,Sun XH,Wang XH,Yang GH.2021.Overexpression of"MbERF12,an ERF gene from Malus bacata(L.)Borkh,increases cold and salt tolerancein Arabidopsis thaliana associated with ROS scavenging through ethylene signal transduction[J].In Vitro Cllularamp;Developmental Bio-logy-Plant,57(5):760-770.doi:10.1007/s11627-021-10199-9.
Hao LD,ShiS B,Guo HB,Li M,Hu P,Wei YD,Feng YF.2020.Genome-wide identification and expression profiles of ERF subfamily transcription factors in Zea mays[J]PeerJ,8:e9551.doi:10.7717/peerj.9551.
He ST,Hao XM,He SL,Hao XG,Zhang P,Chen XN.2021.Genome-wide identification,phylogeny and expres sion analysis of AP2/ERF transcription factors family in sweet potato[J].BMC Genomics,22(1):748.doi:10.1186/s12864-021-08043-w.
Hong YB,Wang H,Gao YZ,Bi Y,Xiong XH,Yan YQ,Wang JJ,LiDY,Song FM.2022.ERF transcription fac-tor OsBIERF3positively contributes to immunity against fungal and bacterial diseases but negatively regulates cold tolerance in rice[J].International Journal of Molecular Sciences,23(2):606.doi:10.3390/jms23020606.
Jofuku KD,den Boer BG,Van Montagu M,Okamuro JK.1994.Control of Arabidopsis flower and seed development by the homeotic gene APETALA2[J].The Plant Cell,6(9):1211-1225.doi:10.1105/tpc.6.9.1211.
Li BB,Wang XH,Wang XF,Xi ZM.2023.An AP2/ERF transcription factor VvERF63positively regulates cold tole-rance in Arabidopsis and grape leaves[J].Environmental"and Experimental Botany,205:105124.doi:10.1016/j.en-vexpbot.2022.105124.
Licausi F,Giorgi FM,Zenoni S,Osti F,Pezzotti M,Perata P.2010.Genomic and transcriptomic analysis of theAP2/ERF superfamily in Vitis vinifera[J].BMC Genomics,11:719.doi:10.1186/1471-2164-1-719.
Licausi F,Ohme-Takagi M,Perata P.2013.APETALA/ethy-lene responsive factor(AP2/ERF)transcription factors:Mediatorsof stress responses and developmental programs[J].New Phytologist,199(3):639-649.doi:10.1111/nph.12291.
Lv KW,Wu WQ,WeiHR,Liu GF.2021.A systems biology approach identifies aregulator,BpIERFI,of cold toerance in Betula platyphylla[J].Forestry Research,1(1):96-105.doi:10.48130/FR-2021-0011.
Ohme-Takagi M,Shinshi H.1995.Ethylene-inducible DNA binding proteinsthat interact with an ethylene responsive element[J].Plant Cell,7(2):173-182.doi:10.2307/3869993.
Ritonga FN,Ngatia JN,Wang Y,KhosoMA,FarooqU,Chen"S.2021.AP2/ERF,an important cold stress-related tran-scription factor family in plants:A review[J].Physiology and Molecular Biology of Plants,27:1953-1968.doi:10.1007/s12298-021-01061-8.
Sun MZ,Shen Y,Chen Y,Wang Y,Cai XX,Yang JK,Jia BW,DongWF,Chen X,Sun XL.2022.Osa-miR1320tar-gets the ERF transcription factor OsERF096to regulate cold tolerance via JA-mediated signaling[J].Plant Physio-logy,189(4):2500-2516.doi:10.1093/plphys/kiac208.
Sun XM,Zhang LL,WongDCJ,Wang Y,Zhu ZF,Xu GZ,Wang QF,LiS H,Liang ZC,Xin HP.2019a.The ethy-lene response factor VaERF092from Amur grape regulates the transcription factor VaWRKY33,improving cold tole-rance[J].Plant Journal,99(5):988-1002.doi:10.1111/tpj.14378.
Sun XM,Zhao TT,Gan SH,Ren XD,Fang LC,Karungo SK,Wang Y,Chen L,LiS H,Xin HP.2016.Ethylene posi-tively regulates cold tolerance in grapevine by modulating the expression of ETHYLENE RESPONSE FACTOR057[J].Scientific Reports,6:24066.doi:10.1038/srep24066.
SunXM,Zhu ZF,Zhang LL,FangLC,Zhang JS,Wang QF,LiS H,Liang ZC,Xin HP.2019b.Overexpression of ethylene response factors VaERF080and VaERF087from
Vitis amurensis enhances cold tolerance in Arabidopsis[J]."ScientiaHorticulturae,243:320-326.doi:10.1016/j.scienta.2018.08.055.
Wang L,Liu WD,Wang YJ.2020.Heterologous expression of Chinese wild grapevine VqERFs in Arabidopsis thaliana"enhance resistance to Pseudomonas syringae pv.tomato"DC3000andto Botrytis cinerea[J].Plant Science,293:110421.doi:10.1016/j.plantsci.2020.110421.
XiaoXM,SiJ,WeiW,Yang YY,Shan W,Kuang JF,Lu WJ,Chen JY,Chen JW.2023.Banana ERF transcription factor MaERF110is involved in ethylene-induced chilling tolerance by regulating ROS accumulation[J].Postharvest Biology and Technology,197:112218.doi:10.1016/j.post-harvbio.2022.112218.
Zhu XL,Wei XH,Wang BQ,Wang X,Zhang MJ.2020.Identification and analysis of AP2/ERF gene family in tomato under abiotic stress[J].Biocell,44(4):777-803.doi:10.32604/biocell.2020.010153.
(责任编辑 陈燕)

