缺氧H9c2来源外泌体对HUVEC增殖、迁移和成管能力的影响
杨睿 魏琼 孙逸坤 赵梦竹 程序 刘梦华 张冬梅

基金项目:国家自然科学基金资助项目(81973780)
作者单位:北京中医药大学东直门医院/中医内科学教育部和北京市重点实验室(邮编100700)
作者简介:杨睿(1993),女,主治中医师,主要从事中医药防治心血管疾病方面研究。E-mail:Reyoung12@126.com
△通信作者 E-mail:chaweto@126.com
摘要:目的 探讨缺氧状态下大鼠心肌细胞H9c2来源外泌体对血管新生的影响。方法 采用混合气体法制备H9c2细胞缺氧模型,以正常培养细胞为对照。分别提取2组细胞分泌的外泌体,采用纳米颗粒跟踪分析检测外泌体的浓度和粒径,透射电子显微镜观察外泌体的形态和大小,Western blot验证外泌体标志蛋白。制备人脐静脉内皮细胞(HUVEC)缺氧模型,并与H9c2外泌体共同孵育,分为常氧组、缺氧组、缺氧+正常H9c2外泌体(EXO-C)组和缺氧+缺氧H9c2外泌体(EXO-M)组。通过CCK-8法、细胞划痕实验、Matrigel体外三维成形实验分别检测HUVEC增殖、迁移、成管能力。结果 外泌体鉴定结果显示常氧组和缺氧组H9c2外泌体样本颗粒浓度均处于1×107~1×1012/mL,粒径大小40~160 nm;形态特征均为球形或茶托状结构,大小均一,形态完整;外泌体标志蛋白肿瘤易感基因101(TSG101)、CD63、CD9均有表达,无阴性蛋白钙联蛋白(Calnexin)的表达。与常氧组比,缺氧组HUVEC增殖能力、迁移面积、迁移率均显著下降,参与成管的长度及分支数、节点数均减少(P<0.01);与缺氧组比,EXO-M组HUVEC细胞增殖能力下降,迁移面积减少、迁移率下降,参与成管长度及分支数进一步减少(P<0.05);与EXO-C组相比,EXO-M组增殖能力下降,细胞迁移面积减少,迁移率下降(P<0.01)。结论 缺氧H9c2来源的外泌体对HUVEC增殖、迁移、成管能力有一定程度的抑制作用。
关键词:外泌体;心肌梗死;内皮细胞;低氧;血管新生
中图分类号:R54,R363文献标志码:ADOI:10.11958/20231930
Effects of hypoxia H9c2 exosome on proliferation,migration and tube formation of HUVEC
YANG Rui, WEI Qiong, SUN Yikun, ZHAO Mengzhu, CHENG Xu, LIU Menghua, ZHANG Dongmei△
Dongzhimen Hospital, Ministry of Education and Beijing Key Laboratory of Traditional Chinese Medicine
Internal Medicine, Beijing University of Chinese Medicine, Beijing 100700, China
△Correspongding Author E-mail: chaweto@126.com
Abstract: Objective To investigate the role of H9c2-derived exosomes in regulating angiogenesis in rat cardiomyocytes under hypoxia. Methods The hypoxia model of H9c2 cells was prepared by mixed gas method (the hypoxia model group), and the normal cultured cells were used as the control group. The exosomes secreted by the two groups of cells were extracted respectively. The concentration and particle size of exosomes were detected by nanoparticle tracking analysis. The morphology and size of exosomes were detected by transmission electron microscopy. Western blot assay was used to verify the exosome marker proteins. The hypoxia model of human umbilical vein endothelial cells (HUVEC) was established. HUVECs were incubated with H9c2 exosomes and divided into the normoxia group, the hypoxia group, the hypoxia + normal H9c2 exosomes (EXO-C) group and the hypoxia + hypoxia H9c2 exosomes (EXO-M) group. The proliferation, migration and tube formation of HUVECs were detected by CCK-8 method, cell scratch test and Matrigel in vitro three-dimensional forming test. Results The results of exosome identification showed that the particle concentration of H9c2 exosome samples was 1×107-1×1012 particles/mL and the particle size was 40-160 nm in the normoxia group and the hypoxia group. The morphological characteristics were spherical or saucer-like structure, uniform in size and complete in shape. Exosome marker proteins TSG101, CD63 and CD9 were expressed, and there was no expression of negative protein Calnexin. Compared with the normoxic group, the proliferation ability, migration area and migration rate of HUVEC were significantly decreased in the hypoxic group, and the length of tube, the number of branches and the number of nodes were decreased (P<0.01). Compared with the hypoxia group, the proliferation ability of HUVEC cells was decreased, the migration area was decreased, the migration rate was decreased and the length and number of branches involved in tube formation were further decreased in the EXO-M group (P<0.05). Compared with the EXO-C group, the proliferation ability of the EXO-M group decreased, the cell migration area decreased and the migration rate decreased (P<0.01). Conclusion Exosomes derived from hypoxic H9c2 can inhibit the proliferation, migration and tube formation of HUVEC.
Key words: exosomes; myocardial infarction; endothelial cells; hypoxia; angiogenesis
急性心肌梗死(AMI)具有高发病率和高死亡率,为心血管系统的危急重症[1]。其发病机制主要是心脏冠状动脉血供急剧减少或中断而导致相应区域心肌细胞的氧气和营养物质供应不足,进而引发部分心肌坏死。治疗性血管新生作为AMI后的一种特殊治疗手段,可在原有的受阻血管基础上,通过刺激新生血管网的生成来建立有效的侧支循环,以弥补原本动脉供血的不足,重新恢复心脏缺血区氧气和营养供应,从而达到治疗的目的[2]。研究表明,外泌体可通过调节心肌梗死(MI)后血管生成相关因子的表达,调控内皮细胞增殖、迁移和管腔形成,从而促进或抑制血管新生[3-4]。作为细胞间通讯的重要载体,外泌体对微环境的改变响应迅速,是血管新生调控过程中的重要因素。但目前缺氧条件下心肌细胞来源外泌体对血管新生的影响尚存争议。心肌细胞缺氧模型和内皮细胞缺氧模型是体外模拟AMI的常用模型,而血管内皮细胞的增殖、迁移、成管能力是血管新生过程中的关键环节。因此,本研究采用混合气体法制备细胞缺氧模型并提取细胞外泌体,通过人脐静脉内皮细胞(HUVEC)增殖、迁移、成管实验,探讨缺氧状态下大鼠心肌细胞H9c2来源外泌体对血管新生的影响。
1 材料与方法
1.1 实验材料 (1)细胞。大鼠心肌细胞H9c2来源于大鼠胚胎心肌细胞系,购于国家生物医学实验细胞资源库(编号:1101RAT-PUMC000219)。HUVEC购于中乔新舟生物科技(上海)有限公司。(2)主要试剂及仪器。ECM培养基购自中乔新舟生物(上海)有限公司;胎牛血清购于Gibco公司;CD9抗体、CD63抗体购于安诺伦(北京)生物科技有限公司,TSG101抗体购于Abcam公司,Calnexin抗体购于圣克鲁斯生物技术(上海)有限公司;CCK-8试剂盒购自日本同仁化学研究所;外泌体提取试剂盒、外泌体专用培养基购自宇玫博生物科技(上海)有限公司;胰酶中和液、牛源纤维黏连蛋白购自美国Sciencell研究实验室;Matrigel基底胶、磷酸盐缓冲液(PBS)、DMEM高糖培养基购自索莱宝科技(北京)有限公司;HRP-山羊抗小鼠IgG(H+L)、HRP-山羊抗兔IgG(H+L)购自博士德生物(中国)有限公司。MCO-20AIC二氧化碳细胞培养箱购于日本SANYO公司;MiniGalaxy A缺氧培养箱购于英国RS biotech公司;IMT-2倒置相差显微镜购于日本Olympus公司;纳米颗粒跟踪分析仪购于德国Particle Metrix公司;透射电子显微镜购于北京中榆科技有限公司。
1.2 研究方法
1.2.1 H9c2缺氧模型建立及分组 将H9c2细胞分为正常对照组和模型组。模型组采用混合气体法制备H9c2细胞缺氧模型。细胞置于缺氧培养箱(37 ℃、1%O2、5%CO2、94%N2)中分别培养0、24、30、48、54 h,建立缺氧H9c2细胞模型;正常对照组细胞置于常规培养箱(37 ℃、5%CO2)中培养相应时间。向2组细胞中加入CCK-8工作液,取空白孔加入等量CCK-8工作液作为空白对照组,避光孵育1.5 h,检测各组光密度(OD)值,计算H9c2细胞存活率。细胞存活率=(模型组OD值-空白对照组OD值)/(正常对照组OD值-空白对照组OD值)×100%。根据细胞存活率确定最佳缺氧干预时间。
1.2.2 外泌体的提取 选择最佳缺氧干预时间造模,分别收集模型组和正常对照组H9c2细胞上清样品,向上清液中加入外泌体浓缩液,4 ℃静置2 h以上。静置后采用4 ℃、10 000×g离心60 min,保留沉淀为外泌体粗品。外泌体粗品用PBS重悬,4 ℃、12 000 ×g离心2 min,保留上清液。将上清液转入外泌体纯化柱上室中,4 ℃、3 000×g离心10 min,离心后收集外泌体纯化柱管底的液体,即纯化后的外泌体悬液。
1.2.3 纳米颗粒跟踪分析(NTA)检测外泌体的浓度和粒 径 用去离子水清洗样本池,以聚苯乙烯微球标准品110 nm校准;再次以1×PBS buffer清洗样本池,用粒子矩阵ZetaView PMX 110在405 nm发射光下对分离得到的外泌体进行浓度测定;PBS稀释2组外泌体(约1×107~1×109/mL为宜),测定其大小及质量。每个样本重复检测3次。
1.2.4 透射电子显微镜观察外泌体的形态和大小 将8 μL外泌体悬液加到载样铜网上,静置1 min;滤纸吸去多余的外泌体样品后滴加15 μL 2%醋酸双氧铀,室温染色1 min,干燥 5 min后,100 kV下拍摄电镜照片。
1.2.5 Western blot检测外泌体标志蛋白表达 将提取纯化后的外泌体加入等量的外泌体专用裂解液,冰上裂解10 min;BCA法测定蛋白浓度。根据蛋白定量结果,向提取的外泌体样品中加入SDS-PAGE蛋白上样缓冲液,100 ℃煮样20 min,电泳1 h,200 mA恒流条件下转膜100 min;5%脱脂奶粉的TBST溶液室温封闭1 h,孵育一抗TSG101(1︰1 000)、CD63(1︰1 000)、CD9(1︰1 000)、Calnexin(1︰200),4 ℃冰箱孵育过夜;TBST洗涤后用二抗(1∶5 000)孵育1 h;TBST再次洗涤,置于发光液中避光反应1~5 min后曝光,根据蛋白预染Marker位置判断目标条带的位置。
1.2.6 CCK-8法检测不同浓度外泌体对HUVEC增殖的影响 HUVEC分为常氧H9c2外泌体干预组(EXO-C组)和缺氧H9c2外泌体干预组(EXO-M组),分别用含外泌体终质量浓度为0、5、10、20、30 mg/L的专用培养基培养24 h,加入CCK-8工作液避光孵育3 h,检测并确定外泌体干预的最佳浓度。
1.2.7 CCK-8法检测H9c2外泌体对缺氧HUVEC增殖的影响 将HUVEC分为常氧组、缺氧组、EXO-C组、EXO-M组。常规培养待细胞融合率>70%时换含0.5%胎牛血清的ECM培养基同步化24 h。缺氧组、常氧组换外泌体专用培养基,EXO-C组换含合适浓度常氧H9c2外泌体的专用培养基,EXO-M组换含对应浓度缺氧H9c2外泌体的专用培养基。缺氧组、EXO-C组、EXO-M组置于缺氧培养箱中培养24 h,常氧组置于正常培养箱中培养24 h。按1.2.6中CCK-8法检测HUVEC增殖情况,每个样本均设6个复孔,重复6次取均值。
1.2.8 细胞划痕实验检测H9c2外泌体对缺氧HUVEC迁移的影响 取对数期生长期的HUVEC,均匀接种于提前包被好的6孔板(6孔板底部划线,使得每孔有3条平行线穿过),每孔加入2.5 mL细胞悬液,按照1.2.7所述方法造模及分组;待细胞融合成片且无较大细胞空隙时,用200 ?L枪头垂直于标记线在底部划线;吸弃培养基后用PBS冲洗细胞,去除划下和凋亡的细胞;各组均换用基础ECM培养基,培养0 h、12 h后于倒置显微镜下拍照,每个样本均设6个复孔,重复6次取均值。使用Image J软件对2次照片之间划痕面积进行统计分析,计算迁移率。迁移率(%)=(A0-AX)/A0×100%,A0表示初始划痕面积,AX表示测量时的残留面积。
1.2.9 Matrigel基质胶检测H9c2外泌体对缺氧HUVEC成管能力的影响 取50 ?L Matrigel基质胶,平铺于4 ℃预冷的96孔板内,37 ℃孵育30 min使其凝固;按照1.2.7所述方法造模及分组;胰酶消化后收集各组细胞悬液,离心后加入基础ECM培养基重悬,按2×105 个/mL将细胞接种于含凝固Matrigel基质胶的96孔板中,每孔100 ?L,37 ℃培养箱中孵育6 h后,倒置显微镜下观察各组HUVEC成管情况并拍照记录,每个样本均设6个复孔,重复6次取均值。使用Image J软件对成管情况进行统计分析。
1.3 统计学方法 采用SPSS 22.0软件进行数据分析,GraphPad Prism8、Photoshop进行绘图。计量资料以均数±标准差([x] ±s)表示,2组比较用独立样本t检验,多组间比较用单因素方差分析,多重比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 不同缺氧时间对H9c2心肌细胞存活率的影响 缺氧24、30、48、54 h时细胞存活率较缺氧0 h下降,缺氧48 h时细胞存活率较缺氧24、30 h均下降(P<0.05),见图1。为保证既能成功制备心肌细胞缺氧模型,又能提取较多的外泌体以顺利开展后续研究,本研究选取缺氧48 h作为造模条件。
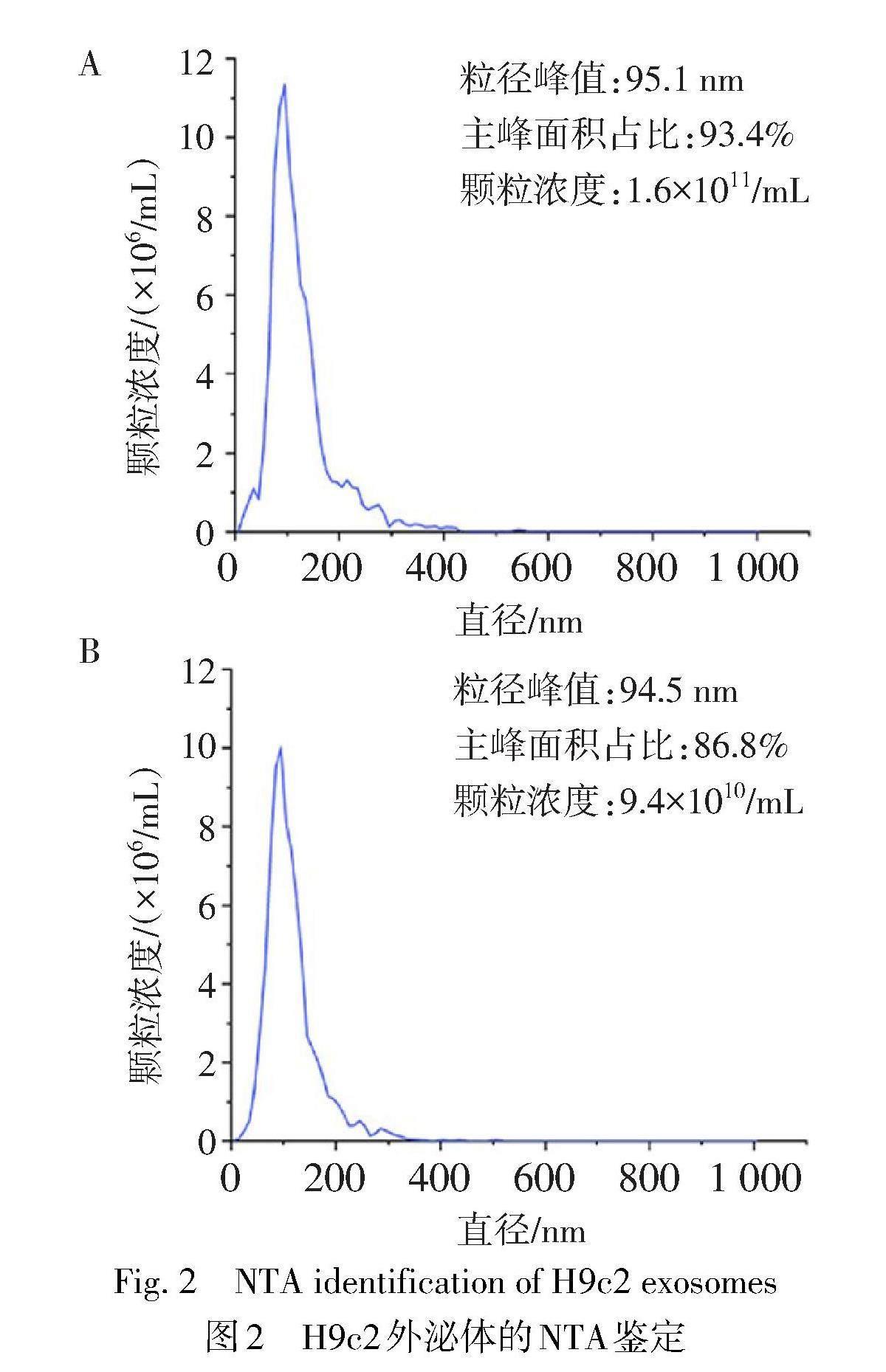
2.2 NTA检测血清外泌体的颗粒浓度和粒径 常氧组H9c2外泌体样本的颗粒浓度为1.6×1011/mL,粒径峰值95.1 nm,峰面积占比93.4%,峰形尖锐,无杂峰(图2A);缺氧组H9c2外泌体样本的颗粒浓度为9.4×1010/mL,粒径峰值94.5 nm,主峰面积占比86.8%,且峰形尖锐,无杂峰(图2B)。本实验所提取的常氧组和缺氧组H9c2外泌体的样本颗粒浓度在1×107~1×1012/mL,粒径大小40~160 nm。
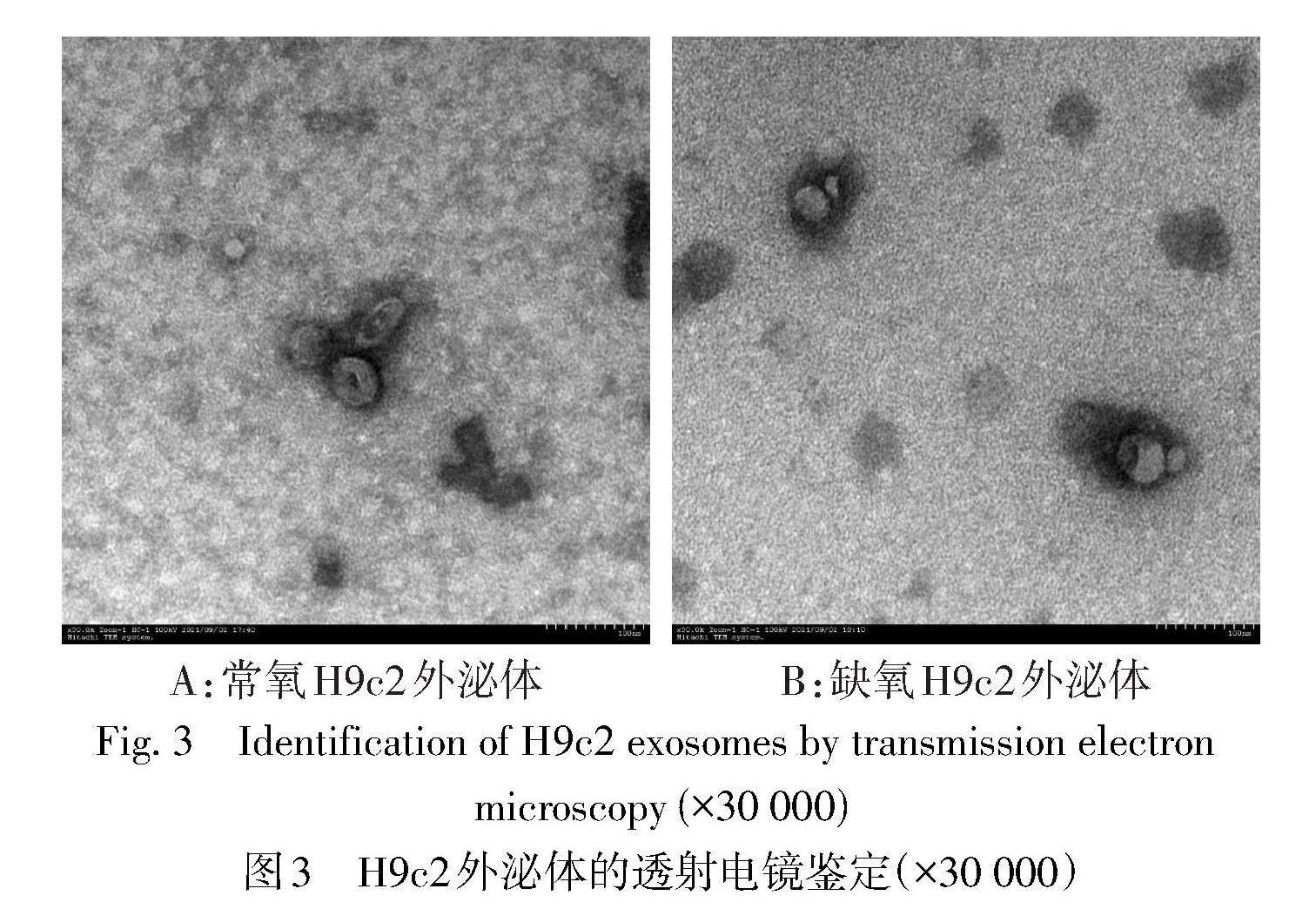
2.3 透射电子显微镜检测血清外泌体的形态和大小 透射电子显微镜下常氧组H9c2外泌体样本(图3A)和缺氧组H9c2外泌体样本(图3B)的形态特征均为典型的球形或茶托状结构,直径在100 nm左右,大小均一,形态完整。
2.4 外泌体的标志蛋白表达 外泌体阳性标志蛋白TSG101、CD63、CD9在常氧/缺氧H9c2外泌体样本(图4A、B)和H9c2细胞(图4C、D)中均有表达,外泌体阴性蛋白Calnexin在细胞样本中有少量表达,在外泌体样本中未见表达。
2.5 不同浓度H9c2外泌体对HUVEC细胞活力的影响 用不同浓度的2组H9c2外泌体分别与正常HUVEC共孵育24 h后,与对照组(0 mg/L EXO-C组)相比,常氧H9c2外泌体浓度为20 mg/L、30 mg/L时,HUVEC细胞活力下降(F=5.016,P<0.05);与对照组(0 mg/L EXO-M组)相比,各浓度的缺氧H9c2外泌体均能显著抑制HUVEC的活力(F=7.682,P<0.01)。外泌体浓度相同时进行比较,当外泌体浓度为10 mg/L时,EXO-M组对HUVEC活力的抑制程度大于EXO-C组(t=3.041,P<0.05),故后续实验选择10 mg/L为外泌体干预浓度。见图5。
2.6 各组HUVEC增殖情况 与常氧组比,缺氧组HUVEC增殖率显著下降;与缺氧组比,EXO-C组和EXO-M组HUVEC增殖率均下降;与EXO-C组比,EXO-M组增殖率进一步下降(P<0.05),见图6。
2.7 各组HUVEC迁移能力情况 与常氧组比,缺氧组HUVEC细胞迁移面积减小,迁移率下降(P<0.05);与缺氧组比,EXO-M组HUVEC迁移面积进
3 讨论
3.1 缺氧诱导心肌细胞来源的外泌体抑制血管新生 外泌体可以来源于多种类型的细胞,包括一般不被认为是典型分泌细胞的心肌细胞。在AMI造成的缺氧环境诱导下,心肌细胞可以释放大量外泌体。研究表明,暴露于中度缺氧2 h可使心肌细胞释放的外泌体数量增加2倍[5]。但缺氧条件诱导心肌细胞分泌的外泌体对血管新生的调控作用尚未达成一致。有研究表明,心肌梗死后的心肌细胞外泌体中富含的miR-19a-3p能减弱心肌梗死后小鼠的心脏功能,并通过缺氧诱导因子-1α抑制内皮细胞的增殖和血管生成[6]。另有研究表明心肌细胞在低氧情况下释放含有高表达CircHIPK3的外泌体,可以通过抑制miR-29a活性来促进血管内皮生长因子表达,进而促进心肌内皮细胞的细胞周期进程和增殖,并减少梗死面积[7]。为了进一步探索心肌细胞来源的外泌体与AMI后血管新生的关系及其作用机制,本研究采用缺氧培养模拟体外心肌梗死后心脏环境,造模成功后提取心肌细胞外泌体并进行鉴定,再观察不同组别外泌体对HUVEC细胞的影响。结果显示,H9c2心肌细胞来源的外泌体均对HUVEC细胞增殖、迁移、成管能力有一定程度的抑制作用,其中,缺氧诱导H9c2心肌细胞来源外泌体的抑制作用更明显。由此,笔者认为缺氧诱导心肌细胞来源的外泌体可以抑制血管新生。
3.2 缺氧H9c2来源的外泌体可能通过其内载物调控血管新生 张春祥等[8]认为MI后心肌细胞来源的外泌体可以部分反映心脏的病理状态,其可能会加重心脏损伤,也可能具有一定的治疗作用。既往也有实验证明外泌体治疗可改善MI动物模型心功能、减轻炎症反应、减少细胞凋亡和自噬等[9]。因此,在本实验的基础上进一步深入研究缺氧H9c2心肌细胞来源外泌体抑制血管新生的具体机制有助于实现在分子水平上的精准调控,对推进外泌体治疗AMI进程具有重要意义。
外泌体被称为“细胞间信息传递的使者”,可以直接与邻近细胞相互作用,也可以间接通过体循环与遥远的受体细胞相互作用。作为生物体中天然存在且可以提取的一种内源性物质,外泌体具有靶向特异性、良好的生物相容性、不易被免疫清除以及易通过多种生物屏障等特点,是机体内重要的信息运载体。外泌体主要通过携带的内容物包括脂质、代谢物、蛋白质、microRNAs、mRNAs、LncRNAs和DNA等[10]来发挥作用,其特有的双层脂质膜结构使得被包裹物不受外界酶解物影响,可以更稳定高效地远距离输送内容物到受体细胞发挥生物学作用。因而,当微环境变化后,外泌体数量改变或内容物成分改变均可能引起一系列生物学反应。有研究表明,在缺氧处理的心肌细胞分泌的外泌体中,miRNAs表达谱出现显著差异,许多与血管新生相关的miRNAs,如miR-211、miR-143等被高度选择性地分选入外泌体[11]。侯永波等[12]也认为不同微环境下的心肌细胞分泌的外泌体由于内容物有所差异,因而会发挥出不同的心肌修复能力。因此,既往已知的关于缺氧后心肌细胞分泌的外泌体与血管新生关系的研究结果之所以存在不一致性,也可能与其重点研究的外泌体内容物不同有关,这提示研究外泌体内容物对深入了解外泌体如何在细胞通讯间发挥作用具有重要意义。
基于本次研究发现缺氧H9c2心肌细胞来源的外泌体对HUVEC细胞增殖、迁移、成管能力具有抑制作用,笔者认为缺氧环境下外泌体可能参与介导心肌细胞与内皮细胞之间的信息传递,缺氧H9c2来源外泌体中可能存在抗血管新生的调控分子,但其具体调控机制尚不清楚,有待后续研究进一步探讨。
参考文献
[1] 中国心血管健康与疾病报告编写组. 中国心血管健康与疾病报告2022概要[J]. 中国循环杂志,2023,38(6):583-612. The Writing Committee of the Report on Cardiovascular Health and Diseases in China. Summary of China Cardiovascular Health and Disease Report 2022[J]. Chinese Journal of Circulation,2023,38(6):583-612. doi:10.3969/j.issn.1000-3614.2023.06.001.
[2] WU X K,REBOLL M R,KORF-KLINGEBIEL M,et al. Angiogenesis after acute myocardial infarction[J]. Cardiovasc Res,2021,117(5):1257-1273. doi:10.1093/cvr/cvaa287.
[3] YUSUF A M,HAGEMANN N,ZHANG X N,et al. Acid sphingomyelinase deactivation post-ischemia promotes brain angiogenesis and remodeling by small extracellular vesicles[J]. Basic Res Cardiol,2022,117(1):43. doi:10.1007/s00395-022-00950-7.
[4] ZHANG Q,CHEN L,HUANG L,et al. CD44 promotes angiogenesis in myocardial infarction through regulating plasma exosome uptake and further enhancing FGFR2 signaling transduction[J]. Mol Med,2022,28(1):145. doi:10.1186/s10020-022-00575-5.
[5] GUPTA S,KNOWLTON A A. HSP60 trafficking in adult cardiac myocytes: role of the exosomal pathway[J]. Am J Physiol Heart Circ Physiol,2007,292(6):H3052-H3056. doi:10.1152/ajpheart.01355.2006.
[6] GOU L,XUE C,TANG X,et al. Inhibition of Exo-miR-19a-3p derived from cardiomyocytes promotes angiogenesis and improves heart function in mice with myocardial infarction via targeting HIF-1α[J]. Aging,2020,12(23):23609-23618. doi:10.18632/aging.103563.
[7] WANG Y,ZHAO R,SHEN C,et al. Exosomal CircHIPK3 Released from hypoxia-induced cardiomyocytes regulates cardiac angiogenesis after myocardial infarction[J]. Oxid Med Cell Longev,2020,2020:8418407. doi:10.1155/2020/8418407.
[8] 张春祥,刘屿暢,李春红,等. 心肌梗死后心肌细胞来源的外泌体对心脏的影响[J]. 西南医科大学学报,2023,46(4):277-280. ZHANG C X,LIU Y C,LI C H,et al. Effects of cardiomyocyte derived exosomes on the heart after myocardial infarction[J]. Journal of Southwest Medical University,2023,46(4):277-280. doi:10.3969/j.issn.2096-3351.2023.04.001.
[9] ZHENG Y L,WANG W D,CAI P Y,et al. Stem cell-derived exosomes in the treatment of acute myocardial infarction in preclinical animal models:a Meta-analysis of randomized controlled trials[J]. Stem Cell Res Ther,2022,13(1):151. doi:10.1186/s13287-022-02833-z.
[10] KALLURI R,LEBLEU V S. The biology,function,and biomedical applications of exosomes[J]. Science,2020,367(6478):eaau6977. doi:10.1126/science.aau6977.
[11] RIBEIRO-RODRIGUES T M,LAUNDOS T L,PEREIRA-CARVALHO R,et al. Exosomes secreted by cardiomyocytes subjected to ischaemia promote cardiac angiogenesis[J]. Cardiovasc Res,2017,113(11):1338-1350. doi:10.1093/cvr/cvx118.
[12] 侯永波,余骏马,朱海娟. 外泌体在心肌梗死治疗中的研究新进展[J]. 天津医药,2023,51(9):1016-1020. HOU Y B,YU J M,ZHU H J. New research progress of exosomes in the treatment of myocardial infarction[J]. Tianjin Med J,2023,51(9):1016-1020. doi:10.11958/20230440.
(2024-01-10收稿 2024-03-05修回)
(本文编辑 李鹏)

