GABA信号通路对脓毒症大鼠急性肺损伤内质网应激和线粒体自噬的影响
钟敏 施震 周劲松 李晋杰

基金项目:湖北省卫生健康委2019-2020年度科研立项项目(WJ2019F162)
作者单位:1湖北中医药大学第一临床医学院(邮编430000);2湖北省中医院(光谷院区)疼痛科
作者简介:钟敏(1994),女,硕士在读,主要从事急慢性疼痛的中西医临床方面研究。E-mail:isk1ud4x@163.com
△通信作者 E-mail:anbair3359@163.com
摘要:目的 探讨γ-氨基丁酸(GABA)信号通路对脓毒症大鼠急性肺损伤(ALI)内质网应激(ERS)和线粒体自噬的影响。方法 SD大鼠分为CON组、Model组、GABA信号通路激活剂巴氯芬组(巴氯芬组)、GABA信号通路抑制剂荷包牡丹碱(BIC)组(BIC组),每组6只。巴氯芬组腹腔注射5 mg/kg的巴氯芬,BIC组腹腔注射1 mg/kg BIC,每日1次,连续处理2周。CON组、Model组腹腔注射等量生理盐水。酶联免疫吸附试验检测血清中超氧化物歧化酶(SOD)、丙二醛(MDA)水平及支气管肺泡灌洗液(BALF)中细胞色素C(Cyt.C)、烟酰胺腺嘌呤二核苷酸磷酸(NADPH)水平;透射电子显微镜(TEM)观察肺组织细胞超微形态;HE染色观察肺组织病理形态;TUNEL染色观察肺组织细胞凋亡;Western blot检测肺组织GABAAR、GRP78、CHOP蛋白表达。结果 与Model组相比,巴氯芬组肺肿胀、充血、炎性细胞浸润现象改善,肺损伤评分、MDA含量、凋亡指数、Cyt.C和NADPH水平、GRP78和CHOP蛋白水平降低(P<0.05),吞噬线粒体的自噬性空泡数量、SOD含量、GABAAR蛋白水平增加(P<0.05),而BIC组以上指标结果与巴氯芬组趋势相反。结论 活化GABA信号通路可改善脓毒症大鼠ALI。
关键词:脓毒症;急性肺损伤;内质网应激;线粒体自噬;γ-氨基丁酸
中图分类号:R563文献标志码:ADOI:10.11958/20231352
Effects of GABA signaling pathway on endoplasmic reticulum stress and mitochondrial autophagy in septic rats with acute lung injury
ZHONG Min1, SHI Zhen2△, ZHOU Jinsong2, LI Jinjie2
1 The First Clinical College of Hubei University of Traditional Chinese Medicine, Wuhan 430000, China;
2 Department of Pain, Hubei Hospital of Traditional Chinese Medicine
△Corresponding Author E-mail: anbair3359@163.com
Abstract: Objective To investigate the effect of γ-aminobutyric acid (GABA) signaling pathway on endoplasmic reticulum (ER) stress and mitochondrial autophagy in septic rats with acute lung injury (ALI). Methods SD rats were randomly grouped into the control (CON) group, the model group, the GABA signaling pathway activator Baclofen group (the Baclofen group), the GABA signaling pathway inhibitor dicentrine group (the BIC group), with 6 rats in each group. The Baclofen group received intraperitoneal injection of 5 mg/kg Baclofen, and the BIC group received intraperitoneal injection of 1 mg/kg BIC, once a day, for two consecutive weeks. The CON group and the model group were injected with an equal amount of physiological saline via intraperitoneal injection. Enzyme linked immunosorbent assay was applied to detect serum levels of superoxide dismutase (SOD) and malondialdehyde (MDA) and levels of cytochrome C (Cyt.C) and Nicotinamide adenine dinucleotide phosphate (NADPH) in bronchoalveolar lavage fluid (BALF). Transmission electron microscopy (TEM) was applied to observe the ultrastructure of lung tissue cells. HE staining was applied to observe the pathological morphology of lung tissue. TUNEL staining was applied to observe the apoptosis of lung tissue. Western blot assay was applied to detect expression levels of GABAAR, GRP78 and CHOP proteins in lung tissue. Results Compared with the model group, the lung swelling, congestion and inflammatory cell infiltration were improved in the Baclofen group, and the lung injury score, MDA content, apoptosis index, Cyt.C and NADPH levels, GRP78, and CHOP protein levels were reduced (P<0.05). The number of autophagic vacuoles in phagocytic mitochondria, SOD content and GABAAR protein level were increased (P<0.05), however, the trend of above indicators in the BIC group was opposite to that in the Baclofen group. Conclusion Up-regulation of GABA signaling pathway may have an improvement effect on ALI in sepsis rats.
Key words: sepsis; acute lung injury; endoplasmic reticulum stress; mitophagy; gamma-aminobutyric acid
脓毒症是一种临床常见的急性危重疾病,主要表现为持续性低血压、代谢性酸中毒和全身炎症反应综合征,可导致患者多个器官功能损伤甚至死亡[1]。急性肺损伤(ALI)是脓毒症常见的致死性并发症[2]。目前,针对脓毒症诱发ALI的治疗方案仍然有限。一些研究显示,降低脓毒症诱导的内质网应激(ERS)可以改善肺部炎症和ALI,同时抑制ERS能够提高脂多糖(LPS)处理的肺泡上皮细胞活力,并抑制其凋亡[3-4]。因此,ERS可能是脓毒症及其并发症临床治疗的新靶点。也有研究显示,增强线粒体自噬可以减轻脓毒症诱导的ALI[5]。γ-氨基丁酸(GABA)是哺乳动物中枢神经系统中最重要的抑制性神经递质,但在呼吸系统中GABA信号通路却是抵抗外来损伤和炎性反应的兴奋性介质,增加GABA A型受体(GABAAR)可降低ALI[6]。目前,鲜见有关GABA信号通路对于脓毒症大鼠ALI影响的研究。本研究旨在探讨GABA信号通路对脓毒症大鼠ALI后ERS和线粒体自噬的影响。
1 材料与方法
1.1 主要材料 7周龄SPF级雄性SD大鼠33只,体质量250~270 g,购自湖北贝恩特生物科技有限公司,生产许可证号:SCXK(鄂)2021-0027。本实验获得湖北中医药大学第一临床医学院动物伦理委员会的批准。GABA信号通路抑制剂荷包牡丹碱(BIC)、GABA信号通路激活剂巴氯芬、兔抗鼠GABAAR抗体、兔抗鼠葡萄糖调节蛋白78(GRP78)抗体、兔抗鼠C/EBP环磷酸腺苷反应元件结合转录因子同源蛋白(CHOP)和兔抗鼠GAPDH抗体购自英国Abcam公司;大鼠超氧化物歧化酶(SOD)酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒、大鼠丙二醛(MDA)ELISA试剂盒、大鼠细胞色素C(Cyt.C)ELISA试剂盒购自上海酶联生物科技有限公司;烟酰胺腺嘌呤二核苷酸磷酸(NADPH)ELISA试剂盒购自上海韵泰信息科技有限公司。
1.2 研究方法
1.2.1 造模及分组 随机抽取9只大鼠作为CON组,余大鼠参照文献[7],通过盲肠结扎和穿刺构建脓毒症大鼠模型。戊巴比妥钠麻醉大鼠,剃掉腹部毛发,通过腹部中线切口2 cm暴露盲肠。将盲肠分离并结扎在回盲瓣下方,使用21号针刺穿2次。将粪便挤出穿刺伤口。最后,将盲肠放回腹腔,缝合腹部切口。CON组和造模组各随机抽取3只大鼠进行HE染色,参照文献[8]模型评判标准,将剩余造模成功的18只大鼠随机均分为Model组、巴氯芬组、BIC组。CON组大鼠仅接受剖腹手术和远端盲肠分离。巴氯芬组腹腔注射5 mg/kg的巴氯芬[9],每日1次,连续处理2周。BIC组腹腔注射1 mg/kg BIC[10],CON组和Model组腹腔注射等量生理盐水,每日1次,连续处理2周。
1.2.2 ELISA法检测血清中氧化S因子 药物治疗结束后,腹腔注射1%戊巴比妥钠麻醉大鼠,腹主动脉采血3 mL, 3 000 r/min离心10 min,取上清液,按照ELISA试剂盒说明书检测大鼠血清SOD、MDA水平。
1.2.3 ELISA法检测大鼠支气管肺泡灌洗液(BALF)中Cyt.C、NADPH水平 药物治疗结束后,收集BALF,并在4 ℃下以 3 000 r/min离心10 min,按照ELISA试剂盒说明书检测大鼠BALF中Cyt.C和NADPH水平。处死大鼠,分离肺组织,一部分肺组织透射电子显微镜(TEM)观察及HE染色、TUNEL染色,余肺组织于-80 ℃中冻存。
1.2.4 TEM观察肺组织细胞超微形态 3%戊二醛固定肺组织后,1%四氧化锇再固定,丙酮脱水,Epon812包埋,半薄切片定位后制备70 nm超薄切片,醋酸铀及枸橼酸铅双重染色,每组随机读取3个视野,观察大鼠组织显微照片。
1.2.5 HE染色观察肺组织损伤情况 取肺组织,在4%多聚甲醛中浸泡24 h 并用磷酸盐缓冲液(PBS)洗涤,制备石蜡切片4 μm并经苏木精染色5 min,自来水冲洗3 s,1%盐酸乙醇分化,5%伊红染色3 min,二甲苯处理后中性树脂封片,在光镜下观察肺组织病理变化。根据水肿、中性粒细胞浸润、出血、细支气管上皮脱屑和透明膜形成进行肺损伤评分。肺损伤严重程度评分参照文献[11-12],评分范围为0~4分,评分越高损伤越重。
1.2.6 TUNEL染色检测肺组织细胞凋亡情况 取固定在4%多聚甲醛中的肺组织切片,常规脱蜡、脱水,3%过氧化氢处理切片,蛋白酶K分离,放入湿盒中室温标记2 h,在37 ℃与1% Tris缓冲盐溶液(TBS)反应60 min。TUNEL标记后,用二氨基联苯胺(DAB)作为显色剂对肺组织进行复染。光学显微镜下凋亡细胞染色为深棕色和黄棕色。凋亡指数=凋亡细胞数/细胞总数×100%。
1.2.7 Western blot检测肺组织GABAAR、GRP78、CHOP蛋白表达 收集每组大鼠的肺组织样品。使用RIPA裂解液从肺组织中提取总蛋白。蛋白质浓度通过BCA方法测定。将蛋白质样品经8%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳分离,并转移到硝酸纤维素膜上,分别加入GABAAR、GRP78、CHOP和GAPDH(均1∶1 000)一抗,4 ℃孵育过夜,将膜与辣根过氧化物酶标记的IgG二抗(1∶5 000)在室温孵育2 h。ECL化学发光试剂显色,Image J软件分析灰度值。
1.3 统计学方法 采用GraphPad Prism 8.0软件进行数据分析。符合正态分布的计量资料用[x] ±s表示,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
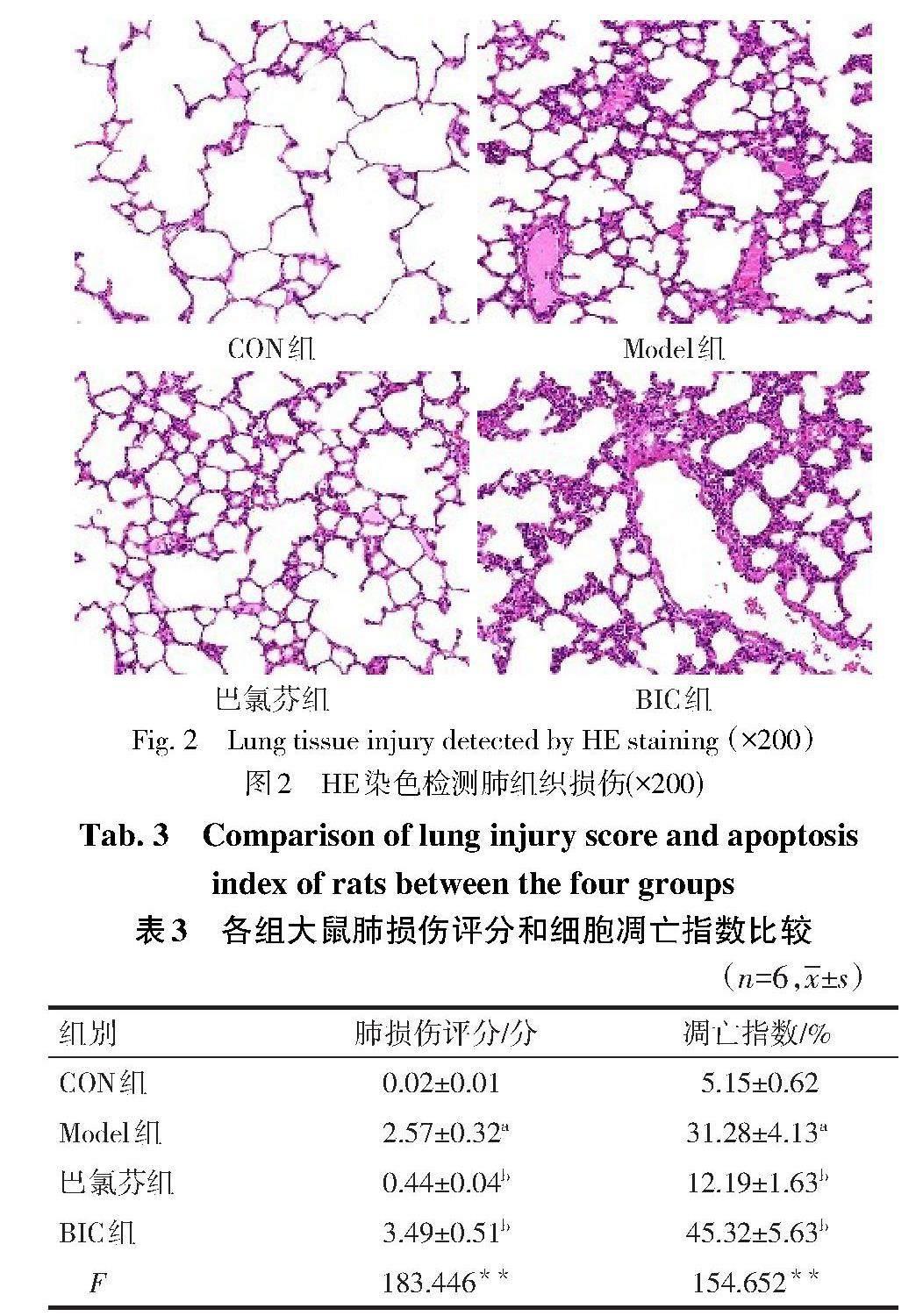
2.1 各组大鼠氧化应激指标水平比较 与CON组比较,Model组大鼠SOD水平降低,MDA水平增加(P<0.05);与Model组比较,巴氯芬组SOD水平增加,MDA水平降低(P<0.05),而BIC组SOD水平降低,MDA水平增加(P<0.05),见表1。
2.2 各组大鼠BALF中Cyt.C和NADPH水平的比较 与CON组相比,Model组BALF中Cyt.C和NADPH水平增加(P<0.05);与Model组相比,巴氯芬组BALF中Cyt.C和NADPH水平降低,而BIC组BALF中Cyt.C和NADPH水平增加(P<0.05),见表2。
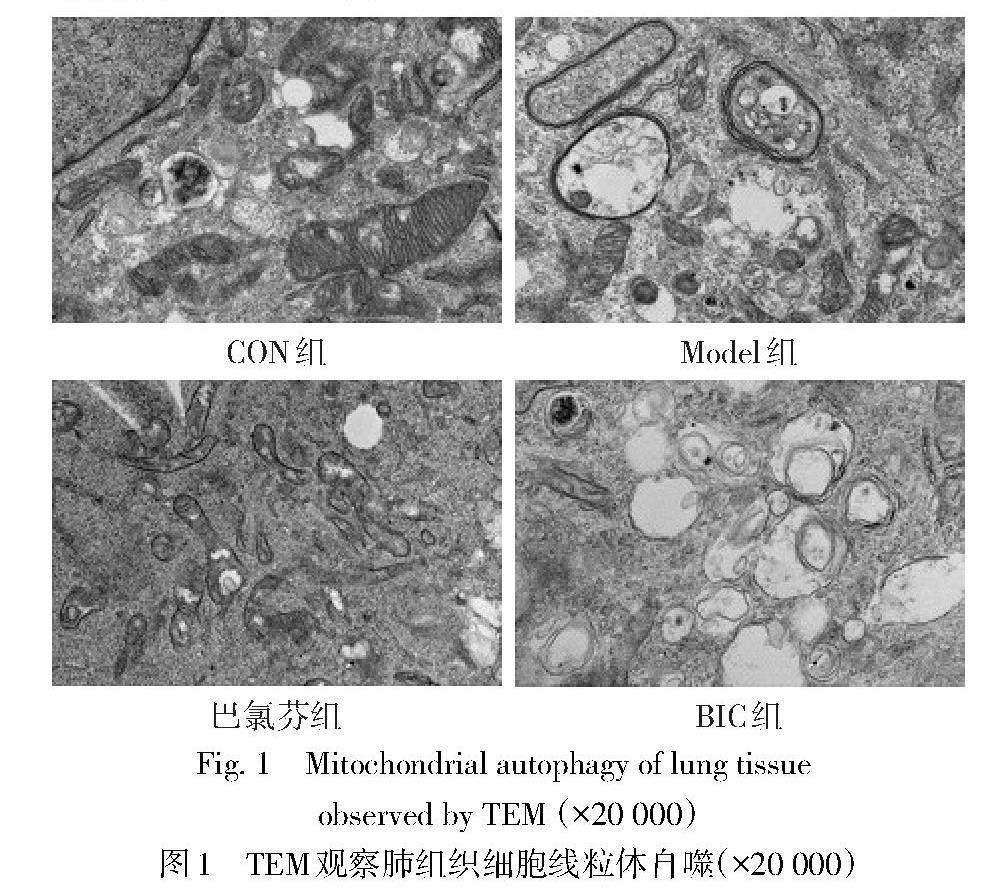
2.3 各组大鼠肺损伤比较 CON组肺组织结构正常;与CON组相比,Model组肺组织炎性细胞浸润严重,有明显的肺泡充血、肺泡隔增厚、结构损伤和间质性中性粒细胞渗透现象,肺损伤评分增加(P<0.05),吞噬线粒体的自噬性空泡数量降低;与Model组相比,巴氯芬组肺组织肿胀、充血、炎性细胞浸润现象改善,肺损伤评分降低(P<0.05),吞噬线粒体的自噬性空泡数量增加;而BIC组肺损伤加重,肺损伤评分增加(P<0.05),吞噬线粒体的自噬性空泡数量降低,见图1、2,表3。
2.4 各组大鼠肺组织细胞凋亡比较 与CON组相比,Model组大鼠细胞凋亡指数增加(P<0.05);与Model组相比,巴氯芬组细胞凋亡指数降低,BIC组细胞凋亡指数增加(P<0.05),见表3、图3。
2.5 各组大鼠肺组织GABAAR、GRP78、CHOP蛋白水平比较 与CON组相比,Model组GABAAR蛋白水平降低,GRP78、CHOP蛋白水平增加(P<0.05);与Model组相比,巴氯芬组GABAAR蛋白水平增加,GRP78、CHOP蛋白水平降低(P<0.05),而BIC组GABAAR蛋白水平降低,GRP78、CHOP蛋白水平增加(P<0.05),见图4、表4。
3 讨论
脓毒症引发的ALI具有肺部炎症反应和肺泡损伤等一系列病理特征[13-14]。本研究结果发现,Model组肺组织较CON组有明显的肺泡充血、肺泡隔增厚、结构损伤和间质性中性粒细胞渗透现象,且肺损伤评分显著高于CON组,具有ALI的典型表征。
研究显示过度氧化应激和ERS在ALI发病机制中起关键作用[15]。氧化应激可以增强促炎基因的表达,炎性细胞可以诱导ROS的过度生成,从而形成恶性循环,促进包括ALI在内的多种疾病的发生和发展。本研究发现,ALI大鼠SOD水平显著下降,MDA水平显著增加,表明ALI大鼠存在氧化应激。ERS是由内质网(ER)中未折叠或错误折叠的蛋白质积累引起,是细胞对ER紊乱的适应性反应,但持续的ERS可能会诱发细胞损伤及凋亡[16]。GRP78在正常生理条件下可结合ERS传感器,在增强的ERS过程中以更稳定的方式与错误折叠或未折叠的蛋白质相互作用。因此,GRP78的增加通常被用作ERS标志分子[17]。CHOP是评估ERS的另一个标记分子,在ERS中作为一种凋亡转录因子[18]。在本研究中,ALI大鼠凋亡指数、GRP78、CHOP蛋白水平相较CON组显著增加,证实了ALI大鼠存在ERS和细胞凋亡。
当ALI发生后,线粒体受损会释放出大量的氧化酶,由此会导致更严重的氧化应激和线粒体损伤[19]。当线粒体受损时,线粒体呼吸链产物,如Cyt.C和NADPH会被释放出来。因此,Cyt.C和NADPH水平的增加反映了线粒体损伤[20]。线粒体自噬是线粒体损伤自我修复的机制。增加线粒体自噬会降低线粒体呼吸链产物(如Cyt.C和NADPH)的水平,而Cyt.C和NADPH是线粒体自噬的生物标志物[21]。Zhao等[22]发现,调节线粒体自噬来降低肺组织和肺泡上皮细胞的炎症和线粒体损伤可以防止LPS诱导的ALI。本研究中,Model组的Cyt.C和NADPH水平较CON组显著增加,且吞噬线粒体的自噬性空泡数量显著降低,与上述研究一致,证实了ALI大鼠线粒体自噬被抑制。
GABA信号通路是研究ALI的常见通路,GABA仅由大鼠肺中的肺神经内分泌细胞产生[23]。激活GABA信号通路和增加GABAAR蛋白水平可改善肺功能,减轻肺损伤[6]。本研究结果亦显示,Model组大鼠肺组织GABAAR蛋白低表达,推测降低GABA信号通路可能促进了脓毒症大鼠ALI。为了验证该推测,笔者团队使用GABA信号通路激活剂巴氯芬以及抑制剂BIC处理ALI大鼠,结果发现,巴氯芬可促进线粒体自噬功能及降低ERS,改善ALI大鼠肺损伤,而BIC结果与巴氯芬组的相反,BIC加重了肺损伤。因此,笔者推测GABA信号通路可能为线粒体自噬与ERS的调控机制,GABA信号通路可通过调控ERS与线粒体自噬的平衡来减轻脓毒症引发的ALI。
综上所述,激活GABA信号通路可能通过促进线粒体自噬及降低ERS,进而对脓毒症大鼠ALI起到治疗作用。然而本研究缺少对药物剂量的探究,这将是后续研究的重点。
参考文献
[1] CINAR I,SIRIN B,AYDIN P,et al. Ameliorative effect of gossypin against acute lung injury in experimental sepsis model of rats[J]. Life Sci,2019,221:327-334. doi:10.1016/j.lfs.2019.02.039.
[2] LIU F,PENG W,CHEN J,et al. Exosomes derived from alveolar epithelial cells promote alveolar macrophage activation mediated by mirR-92a-3p in sepsis-induced acute lung injury[J]. Front Cell Infect Microbiol,2021,11:646546. doi:10.3389/fcimb.2021.646546.
[3] CHEN X,WANG Y,XIE X,et al. Heme oxygenase-1 reduces sepsis-induced endoplasmic reticulum stress and acute lung injury[J]. Mediators Inflamm,2018,2018:9413876. doi:10.1155/2018/9413876.
[4] JIANG L,XU L,ZHENG L,et al. Salidroside attenuates sepsis-associated acute lung injury through PPP1R15A mediated endoplasmic reticulum stress inhibition[J]. Bioorg Med Chem,2022,71:116865. doi:10.1016/j.bmc.2022.116865.
[5] CHEN H,LIN H,DONG B,et al. Hydrogen alleviates cell damage and acute lung injury in sepsis via PINK1/Parkin-mediated mitophagy[J]. Inflamm Res,2021,70(8):915-930. doi:10.1007/s00011-021-01481-y.
[6] HUANG T,ZHANG Y,WANG C,et al. Propofol reduces acute lung injury by up-regulating gamma-aminobutyric acid type a receptors[J]. Exp Mol Pathol,2019,110:104295. doi:10.1016/j.yexmp.2019.104295.
[7] LI R,REN T, ZENG J. Mitochondrial coenzyme q protects sepsis-induced acute lung injury by activating PI3K/Akt/GSK-3β/mTOR pathway in rats[J]. Biomed Res Int,2019,2019:5240898. doi:10.1155/2019/5240898.
[8] SHEN K,WANG X,WANG Y,et al. miR-125b-5p in adipose derived stem cells exosome alleviates pulmonary microvascular endothelial cells ferroptosis via Keap1/Nrf2/GPX4 in sepsis lung injury[J]. Redox Biol,2023,62:102655. doi:10.1016/j.redox.2023.102655.
[9] 周正,宋美慧,褚光辉,等. GABA_(B)受体激动剂巴氯芬对小鼠空间识别记忆能力的影响[J]. 生命科学研究,2022,26(3):213-218. ZHOU Z,SONG M H,CHU G H,et al. Effect of GABAB receptor agonist baclofen on spatial cognition in mice[J]. Life Science Research,2022,26(3):213-218. doi:10.16605/j.cnki.1007-7847.2021.02.0123.
[10] 刘乃红,王佃卿,彭志锋. 荷包牡丹碱联合早期跑步运动对大鼠脑损伤恢复的协同效应[J]. 中国应用生理学杂志,2022,38(6):700-704. LIU N H,WANG D Q,PENG Z F. Synergistic effect of dicentime combined with early running on brain injury recovery in rats[J]. Chinese Journal of Applied Physiology,2022,38(6):700-704. doi:10.12047/j.cjap.6379.2022.127.
[11] WANG Y,YANG Y,CHEN L,et al. Death-associated protein kinase 1 mediates ventilator-induced lung injury in mice by promoting alveolar epithelial cell apoptosis[J]. Anesthesiology,2020,133(4):905-918. doi:10.1097/ALN.0000000000003464.
[12] 虢强,朱美意,张杰,等. 红景天苷调节CLP诱导的脓毒症小鼠肺纤维化及JAK2/STAT3的活化[J]. 中国免疫学杂志,2022,38(10):1196-1200. GUO Q,ZHU M Y,ZHANG J,et al. Salidroside regulates pulmonary fibrosis and JAK2/STAT3 activation in CLP-induced sepsis mice[J]. Chinese Journal of Immunology,2022,38(10):1196-1200. doi:10.3969/j.issn.1000-484X.2022.10.008.
[13] 张昊,苏乾,史佳,等. 电针通过NLRP3/caspase-1通路介导的细胞焦亡途径减轻脓毒症大鼠急性肺损伤[J]. 中国中西医结合外科杂志,2023,29(6):814-818. ZHANG H,SU Q,SHI J,et al. Electroacupuncture attenuates acute lung injury induced by sepsis via NLRP3/caspase-1 pathway mediated pyrocytosis pathway[J]. Chinese Journal of Surgery of Integrated Traditional and Western Medicine,2023,29(6):814-818. doi:10.3969/j.issn.1007-6948.2023.06.017.
[14] 吴海涛,周洪礼,宋玉,等. 穿心莲内酯对盲肠结扎穿孔诱导的脓毒症大鼠心肺功能和炎症损伤的保护作用[J]. 天津医药,2022,50(1):67-73. WU H T,ZHOU H L,SONG Y,et al. Protective effects of andrographolide on cardiopulmonary function and inflammatory damage in sepsis rats induced by cecal ligation and perforation[J]. Tianjin Med J,2022,50(1):67-73.doi:10.11958/20210462.
[15] YOUSSEF N S,ELZAITONY A S,ABDEL BAKY N A. Diacerein attenuate LPS-induced acute lung injury via inhibiting ER stress and apoptosis: impact on the crosstalk between SphK1/S1P, TLR4/NFκB/STAT3,and NLRP3/IL-1β signaling pathways[J]. Life Sci,2022,308:120915. doi:10.1016/j.lfs.2022.120915.
[16] PAO H P,LIAO W I,TANG S E,et al. Suppression of endoplasmic reticulum stress by 4-PBA protects against hyperoxia-induced acute lung injury via up-regulating claudin-4 expression[J]. Front Immunol,2021,12:674316. doi:10.3389/fimmu.2021.674316.
[17] ZHANG Z K,ZHOU Y,CAO J,et al. Rosmarinic acid ameliorates septic-associated mortality and lung injury in mice via GRP78/IRE1α/JNK pathway[J]. J Pharm Pharmacol,2021,73(7):916-921. doi:10.1093/jpp/rgaa033.
[18] AHMAD S,ZAKI A,MANDA K,et al. Vitamin-D ameliorates sepsis-induced acute lung injury via augmenting miR-149-5p and downregulating ER stress[J]. J Nutr Biochem,2022,110:109130. doi:10.1016/j.jnutbio.2022.109130.
[19] SANG A,WANG Y,WANG S,et al. Quercetin attenuates sepsis-induced acute lung injury via suppressing oxidative stress-mediated ER stress through activation of SIRT1/AMPK pathways[J]. Cell Signal,2022,96:110363. doi:10.1016/j.cellsig.2022.110363.
[20] WANG T,ZHANG J,WEI H,et al. Matrine-induced nephrotoxicity via GSK-3β/nrf2-mediated mitochondria-dependent apoptosis[J]. Chem Biol Interact,2023,378:110492. doi:10.1016/j.cbi.2023.110492.
[21] LIU W,LI C C,LU X,et al. Overexpression of transcription factor EB regulates mitochondrial autophagy to protect lipopolysaccharide-induced acute lung injury[J]. Chin Med J(Engl),2019,132(11):1298-1304. doi:10.1097/CM9.0000000000000243.
[22] ZHAO R,WANG B,WANG D,et al. Oxyberberine prevented lipopolysaccharide-induced acute lung injury through inhibition of mitophagy[J]. Oxid Med Cell Longev,2021,2021:6675264. doi:10.1155/2021/6675264.
[23] JULIANA B,ALVIN T K,LINH A,et al. Pulmonary neuroendocrine cells secrete γ-Aminobutyric Acid to Induce Goblet Cell Hyperplasia in Primate Models[J]. Am J Respir Cell Mol Biol,2019,60(6):687-694. doi:10.1165/rcmb.2018-0179OC.
(2023-09-05收稿 2023-11-22修回)
(本文编辑 陆荣展)

