敲除大肠杆菌Lpp基因对动脉粥样硬化的抑制作用研究
王珍珍 童凌琳 杨帅 李欣 陈阳 张贺 朱作斌 陈仁金
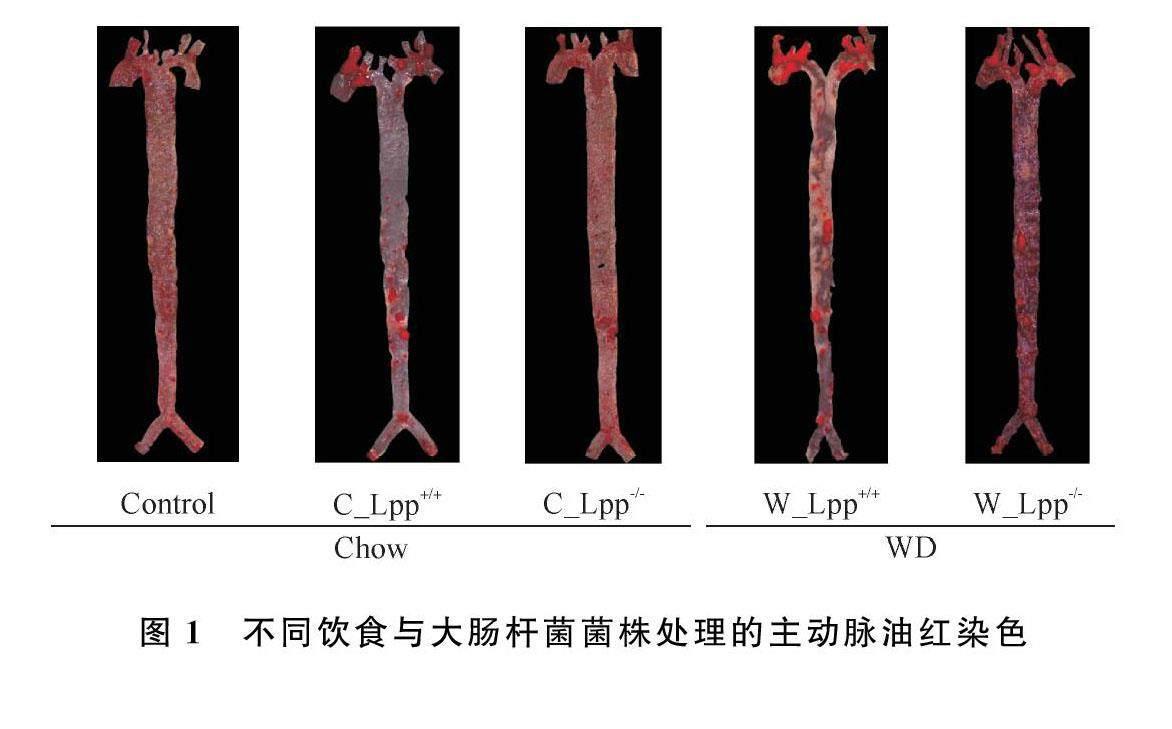

摘要:为探究大肠杆菌Lpp基因敲除对动脉粥样硬化作用,取8周龄ApoE-/-小鼠分为Control组、Chow_Lpp+/+(C_Lpp+/+)组、Chow_Lpp-/-(C_Lpp-/-)组、Western Diet_Lpp+/+(W_Lpp+/+)组和Western Diet Lpp-/-(W_Lpp-/-)组,每周灌胃3次,持续16周后,取小鼠心脏与主动脉;油红及H&E染色主动脉及心脏,观察脂质沉积及炎性变化。研究结果显示,成功构建了动脉粥样硬化小鼠模型;相较于W_Lpp+/+组,W_Lpp-/-组动脉粥样硬化斑块的面积显著减少;小鼠主动脉根部脂质及炎性细胞浸润程度显著降低。这表明敲除Lpp基因后的大肠杆菌对小鼠动脉粥样硬化具有缓解作用。
关键词:大肠杆菌Lpp基因;动脉粥样硬化;ApoE-/-小鼠
中图分类号:
R363.1+5
文献标志码:A
心脑血管疾病致死人数约占全球总体死亡人数的1/3,严重危害人类健康,因此防治心血管疾病及寻找新治疗思路已刻不容缓。动脉粥样硬化是众多心血管疾病的共同发病基础,表现为动脉内膜有黄色粥样脂质聚集。肠道微生物作为人体内最庞大、最复杂的微生态系统,具有维持肠道健康、调节免疫系统、帮助消化和营养吸收等重要功能[1]。肠道菌群产生的活性代谢物以及宿主本身产生的分子在动脉粥样硬化发生与发展中起重要作用[2]。大肠杆菌中有多种蛋白参与并执行维系外膜结构稳定性,如Lipoprotein(Lpp)这类脂蛋白,当该基因缺失不会影响菌株正常生存,但大肠杆菌细胞壁功能会受损,细胞周质空间稳定性会降低[3],部分菌敲除Lpp基因后可作为减毒活疫苗使用[4]。大肠杆菌敲除Lpp基因后是否在动脉粥样硬化中发挥重要作用目前未见有任何报道。因此,本研究通过动物实验,探讨大肠杆菌Lpp基因在动脉粥样硬化发生、发展中的作用,为动脉粥样硬化预防和治疗提供新思路与方案。
1 材料与方法
1.1 实验动物
用8周龄ApoE-/-基因敲除雄性鼠,分为5组,每组实验鼠为8只。高脂喂养ApoE-/-鼠16周后,建立动物粥样硬化模型。该模型鼠购买于南京模式动物研究所,实验期间于徐州医科大学的SPF级动物房内饲养,本实验经由徐州医科大学动物伦理委员会批准(202205A053)。
1.2 大肠杆菌
实验所用大肠杆菌为BW25117工程菌株,Lpp基因敲除大肠杆菌菌株由徐州医科大学朱作斌老师惠赠。模型鼠每周灌胃3次,不同大肠杆菌菌株每次灌胃剂量为20×109 CFU。
1.3 主动脉油红O染色
解剖后的主动脉置于4%多聚甲醛溶液中固定过夜。固定后,用纯水冲洗主动脉,重复3次。用60%异丙醇浸润2 min,移入新配置的油红O工作液中,避光染色1 h。染色完毕的主动脉置于75%酒精中分化,直至血管壁无斑块处变为乳白色,置于4%多聚甲醛中保存。基于Image J软件分析红色动脉粥样硬化斑块面积所占比例。
1.4 心脏油红O染色及H&E染色
心脏从包埋盒中取出,固定于冰冻切片机,快速切除包埋剂直至镜下可观察3个主动脉瓣膜同时出现。玻片上滴加4%多聚甲醛固定组织,用1×PBST清洗3次。弃去异丙醇,滴加油红O工作液浸没组织,染色10 min。弃去油红O工作液,加入60%异丙醇分化至背景无浮色。用1×PBST清洗3次载玻片,加入苏木素染色(注意不可染色超过1 min),用流水冲洗。滴加1%盐酸酒精分色,流水冲洗后,用甘油明胶封片。基于Image J软件分析心脏斑块面积及炎性细胞所占比例。
1.5 统计学分析
基于Image J软件统计主动脉大体和主动脉根部的染色照片,通过GraphPad Prism统计软件分析处理,结果以“均数±标准差”(means±SD)柱状图表示。实验结果中两组及多组比较使用One way ANOVA的分析方法,P<005具有统计学意义。
2 结果
2.1 敲除Lpp基因抑制主动脉斑块增加
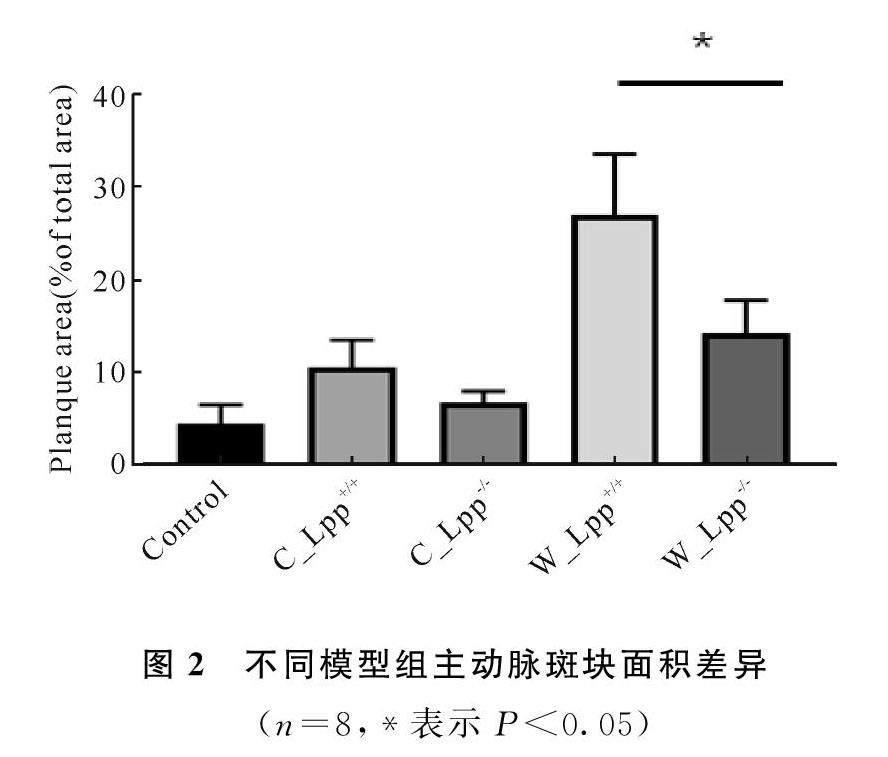
通过油红O染色,检测主动脉内膜面动脉粥样硬化的斑块面积。由图1可知,Control组的病变面积为(4432±2004)%;C_Lpp+/+组为(1052±2961)%;C_Lpp-/-组为(6716±1192)%;W_Lpp+/+组为(2698±6452)%;W_Lpp-/-组为(1422±3580)%。由图2可知,Control组和C_Lpp+/+组的动脉粥样硬化斑块面积有显著差异(P<005);W_Lpp-/-组小鼠动脉粥样硬化斑块面积显著低于W_Lpp+/+组(P<005),相较于野生型大肠杆菌,敲除Lpp基因大肠杆菌显著抑制斑块的增加。
2.2 敲除Lpp基因降低主动脉根部斑块形成
由图3可知,5组小鼠主动脉根部均有不同程度的动脉粥样硬化斑块形成,Control组为(9766±09267)%,C_Lpp+/+组为(2299±01630)%,C_Lpp-/-组为(1326±03145)%,W_Lpp+/+组为(3820±01337)%,W_Lpp-/-组为(19±03750)%。结果显示,野生型大肠杆菌灌胃后主动脉根部动脉粥样硬化斑块面积增加,但敲除Lpp基因后高脂组小鼠动脉粥样硬化斑块面积减少(P<005),正常饮食组斑块面积也有下降趋势。这说明,敲除Lpp基因的大肠杆菌灌胃可减少主动脉根部动脉粥样硬化斑块面积,抑制动脉粥样硬化发展。
2.3 敲除 Lpp基因缓解主动脉根部炎症
小鼠主动脉根部H&E染色切片可反映小鼠局部炎症情况。取小鼠主动脉根部制成冰冻切片,通过H&E染色,镜下观察小鼠主动脉根部炎细胞浸润程度。研究发现,5组小鼠主动脉根部均有不同程度的炎细胞浸润,其中W_Lpp+/+组炎细胞浸润程度最高;普通饲料组和高脂组中,Lpp基因敲除大肠杆菌(Lpp-/-)灌胃相较于野生型大肠杆菌(Lpp+/+)灌胃均能降低小鼠主动脉根部炎细胞浸润程度,且差异具有统计学意义(P<005)。Lpp基因敲除大肠杆菌灌胃可降低主动脉根部炎细胞浸润,说明Lpp基因敲除大肠杆菌可通过缓解小鼠体内炎症反应以改善小鼠动脉粥样硬化。
3 讨论
动脉粥样硬化是冠心病、脑梗死、外周血管病的主要原因,而肠道菌群作为人体重要的组成之一,研究发现其与动脉粥样硬化密切相关[5-6]。人类动脉粥样斑块中有细菌DNA的存在,且发现斑块中Chlamydia pneumoniae丰度较高[7]。相较于健康对照者,动脉粥样硬化患者肠道中大肠杆菌、克雷伯菌和产气肠杆菌丰度更高,拟杆菌和普氏菌含量也显著升高[8]。给予动脉粥样硬化患者阿克曼菌灌胃,能显著降低炎症及动脉粥样硬化的形成[9-10]。大肠杆菌作为一种广谱菌,除极少数菌株为致病性外,其他均为有益菌种。当心血管病人感染大肠杆菌致病菌后,对心血管疾病无影响[11]。敲除大肠杆菌菌株其中一个基因能对该菌控制代谢的调控结构产生影响[12]。目前,已知人体内有Clostridium、Edwardsiellatarda等9种菌可通过转化胆碱为其他物质从而降低血TMAO水平[6]。通过补充益生菌,利用其调节脂质代谢,降低血液中TMAO水平,进而减少患动脉粥样硬化风险。本研究发现,敲除Lpp基因的大肠杆菌灌胃对动脉粥样硬化模型小鼠的斑块有明显的抑制作用。敲除Lpp基因后,有利于大肠杆菌囊泡的形成[3],促进了活性氧产生[13];敲除Lpp基因菌株灌胃后,相较于未敲除Lpp基因组,显著降低了动脉粥样硬化的斑块面积和炎性细胞比例。革兰氏阳性细菌中,Lpp基因触发TLR2-MyD88 信号通路,而TLR2则激活NF-кB信号通路进而触发炎症[14-15]。这可能是由于大肠杆菌Lpp基因敲除后,阻碍了TLR2-MyD88信号通路转导,减缓了炎症的发生与发展,进而抑制动脉粥样硬化发展。
4 结论
本文通过对动脉粥样硬化小鼠模型进行Lpp基因敲除的大肠杆菌灌胃发现,Lpp基因敲除的大肠杆菌显著减少了动脉粥样硬化的斑块面积及炎性细胞的浸润程度;还可通过抑制炎症反应,进而抑制动脉粥样硬化的发生与发展。今后将深入探究Lpp基因敲除大肠杆菌缓解和影响动脉粥样硬化机制。
参考文献
[1]XIAO W P,SU J B, GAO X J, et al. The microbiota-gut-brain axis participates in chronic cerebral hypoperfusion by disrupting the metabolism of short-chain fatty acids[J]. Microbiome, 2022, 10(1):62.
[2]FAN Y, PEDERSEN O. Gut microbiota in human metabolic health and disease[J]. Nature Reviews Microbiology, 2021, 19(1): 55-71.
[3]MATHELIE-GUINLET M, ASMAR A T, COLLET J, et al. Lipoprotein Lpp regulates the mechanical properties of the E. coli cell envelope[J]. Nature Communications, 2020, 11(1): 1789.
[4]GAO W, YIN J, BAO L C, et al. Engineering extracellular expression systems in Escherichia coli based on transcriptome analysis and cell growth state[J]. Acs Synthetic Biology, 2018, 7(5): 1291-1302.
[5]JONSSON A L, BACKHED F. Role of gut microbiota in atherosclerosis[J]. Nature Reviews Cardiology, 2017, 14(2): 79-87.
[6]MA S R, TONG Q, LIN Y, et al. Berberine treats atherosclerosis via a vitamine-like effect down-regulating Choline-Tma-Tmao production pathway in gut microbiota[J]. Signal Transduction and Targeted Therapy, 2022, 7(1): 207.
[7]SHOR A, KUO C C, PATTON D L. Detection of Chlamydia pneumoniae in coronary arterial fatty streaks and atheromatous plaques[J]. South African Medical Journal, 1992, 82(3): 158-161.
[8]JIE Z Y, XIA H H, ZHONG S, et al. The gut microbiome in atherosclerotic cardiovascular disease[J]. Nature Communications, 2017, 8(1): 845.
[9]BAVINENI M, WASSENAAR T M, AGNIHOTRI K, et al. Mechanisms linking preterm birth to onset of cardiovascular disease later in adulthood[J]. European Heart Journal, 2019, 40(14): 1107-1112.
[10] WU R R, KUMAWAT A K, DEMIREL I. Trimethylamine N-Oxide (Tmao) mediates increased inflammation and colonization of bladder epithelial cells during a uropathogenic E. coli infection in Vitro[J]. Pathogens, 2023, 12(4): 523.
[11] HIZO-ABES P, CLARK W F, SONTROP J M, et al. Cardiovascular disease after Escherichia coli O157: H7 gastroenteritis[J]. Canadian Medical Association Journal, 2013, 185(1): E70-77.
[12] MCCLOSKEY D, XU S B, SANDBERG T E, et al. Evolution of gene knockout strains of E. coli reveal regulatory architectures governed by metabolism[J]. Nature Communications, 2018, 9(1): 3796.
[13] ZHANG X W, AN M X, HUANG Z K, et al. Lpp of Escherichia coli K1 inhibits host ROS production to counteract neutrophil-mediated elimination[J]. Redox Biology, 2023, 59: 102588.
[14] ALIPRANTIS A O, YANG R B, MARK M R, et al. Cell activation and apoptosis by bacterial lipoproteins through toll-like receptor-2[J]. Science, 1999, 285: 736-739.
[15] NORGARD M V, ARNDT L L, AKINS D R, et al. Activation of human monocytic cells by Treponema pallidum and Borrelia Burgdorferi lipoproteins and synthetic lipopeptides proceeds via a pathway distinct from that of lipopolysaccharide but involves the transcriptional activator NF-κB[J]. Infection and Immunity, 1996, 64(9): 3845-3852.
Research on the Inhibitory Effect of Knocking out
the Escherichia Coli Lpp Gene on Atherosclerosis
WANG Zhen-zhena,TONG Ling-linb,YANG Shuaib,LI Xinb,CHEN Yangb,
ZHANG Heb,ZHU Zuo-binb,CHEN Ren-jinb
(a. Cancer Institute, Xuzhou Medical University; b. College of Life Sciences,
Xuzhou Medical University, Xuzhou 221004, China)
Abstract:
To investigate the effect of knocking out the Escherichia coli Lpp gene on atherosclerosis, an experiment involving 8-week-old ApoE-/- mice were divided into Control group, Chow_Lpp+/+ (C_Lpp+/+) group, Chow_Lpp-/- (C_Lpp-/-) group, Western Diet_Lpp+/+ (W_Lpp+/+) group, and Western Diet Lpp-/- (W_Lpp-/-) group. The mice were orally gavaged three times per week for sixteen weeks and their hearts and aortas were extracted. Oil red and H&E staining were performed to analyze lipid deposition and inflammatory changes in the aorta and heart. The research results show that experiment successfully establishes a mouse model of atherosclerosis. The area of atherosclerotic plaque in W_Lpp-/- group is significantly reduced compared with W_Lpp+/+ group. Lpp gene knockout reduces the degree of inflammatory cell infiltration. Therefore, the knockout of the Lpp gene in Escherichia coli has a mitigating effect on atherosclerosis in mice.
Keywords:
Escherichia coli Lpp gene;atherosclerosis;ApoE-/- mice

