马冈鹅和泰州鹅粪便微生物区系分析及潜在功能预测
吴云飞 涂远璐 马曦 闫俊书 奚雨萌

摘要:为分析马冈鹅和泰州鹅种鹅粪便微生物组成差异,探究粪便微生物区系对宿主生理功能调节的潜在影响。试验选取体重相似、日龄相仿、饲养环境相同的健康种鹅17羽(泰州鹅8羽+马冈鹅9羽),利用16S rDNA高通量测序技术分析种鹅粪便菌群多样性、种属差异及其对宿主生理功能的潜在影响。结果表明,在多样性分析上,2个品种粪便微生物菌群Chao1指数、Simpson指数和Shannon指数品种间无显著差异,主坐标分析聚类不明显。分析粪便菌群结构组成发现,在门水平上,厚壁菌门、拟杆菌门和变形菌门是种鹅粪便中的优势菌群;在属水平上,罗氏菌属、拟杆菌属、普雷沃氏菌属_9、乳酸杆菌属等是优势菌群种属。同时,泰州鹅粪便中厚壁菌门细菌CAG:822、苯基杆菌属和漫游菌属细菌平均丰度显著高于马冈鹅;但固氮螺菌属Blvii28_wastewater-sludge_group、Ezakiella、默多克菌属、假谷氨酸菌属和斯内菌属平均丰度显著低于马冈鹅(P<0.05)。KEGG功能预测提示,马冈鹅与泰州鹅粪便差异菌群可能影响宿主碳水化合物代谢、糖基化合物合成、能量代谢等生理过程。综上,在相同饲养条件下,马冈鹅和泰州鹅种鹅粪便微生物区系总体上受其遗传背景影响较小,但也在菌群组成上表现出一定差异,可能影响宿主环境适应、碳水化合物代谢、氨基酸代谢等生理功能的调节。
关键词:鹅;品种;粪便微生物;16S rDNA;菌群结构;功能预测
中图分类号:S852.2文献标志码:A
文章编号:1002-1302(2024)09-0226-06
鹅是我国传统的经济水禽,近年来养殖规模持续扩大。据国家水禽产业技术体系统计,2021年底我国肉鹅年出栏量为5.7亿羽,占世界总出栏量的94%,发展潜力巨大。然而,与鸡、鸭相比,鹅相关研究起步较晚,有关鹅消化生理、饲料营养、遗传选育等方面的研究不够系统,行业总体饲养管理水平落后于其他畜禽,有待提高。
肠道菌群是指肠道内丰富的微生物群落结构,包含细菌、真菌、原生动物、古菌等,可直接或间接参与宿主胃肠道乃至整个机体健康的调节,与代谢、消化、免疫等生理过程密切相关[1-2]。健康的肠道微生态环境是提高家禽生产性能的关键[3-4];肠道菌群失衡,不仅会影响肠道内营养物质的消化吸收,还会损伤肠黏膜屏障功能,导致疾病发生[5]。在鹅上,肠道菌群受到多种因素的调节,饲养环境、营养水平、添加剂使用等均可显著影响肠道菌群组成,进而影响宿主生理机能[6-9]。值得注意的是,不同鹅种间的肠道菌群存在显著差异,这可能是导致品种间消化代谢和生理调节差异的主要原因之一。研究发现,四川白鹅、扬州鹅、浙东白鹅和霍尔多巴吉鹅在28日龄时,盲肠菌群多样性、种属组成等存在显著差异[10]。其中,霍尔多巴吉鹅的肠道菌群多样性最优,其次为浙东白鹅、扬州鹅、四川白鹅;进一步发现,纤维降解菌群的丰度差异也导致了不同鹅种间纤维消化能力的差别[10]。因此,研究品种对鹅肠道菌群的影响有助于深入了解鹅的消化生理机能。
泰州鹅和马冈鹅均为我国代表性地方特色品种。其中,马冈鹅原产于广东省开平市马冈镇,体型适中,羽毛灰黑色;母鹅单羽重2.5~3.0 kg,公鹅单羽重3.5~4.0 kg,粗食、早熟、易长,产蛋较多,是华南地区主要养殖的肉鹅品种[11]。泰州鹅主要在华东地区饲养,近年来由莱茵鹅和太湖鹅杂交育成,体型中等,羽毛白色,肉质细腻,具有较高的经济价值,深受消费者喜爱[12]。此外,当前不同品种间鹅肠道菌群的研究多集中在雏鹅和肉鹅上,对种鹅关注较少。为此,本研究拟利用16S rDNA测序技术,研究马冈鹅和泰州鹅种鹅肠道菌群区系组成与潜在功能预测,以期为完善肠道菌群与与宿主生理功能调节间的互作理论提供科学支撑。
1 材料与方法
1.1 试验动物与样品收集
试验于2023年6月在江苏省农业科学院六合实验禽场展开。选取体重相似、日龄相仿、饲养环境相同的健康泰州鹅和马冈鹅种鹅各20羽,执行常规饲养管理、消毒防疫流程,不同品种种鹅饲养条件一致。试验饲喂商品种鹅饲料,日粮组成及营养水平满足肉鹅饲料营养标准。在180日龄时,随机选取泰州鹅8羽,马冈鹅9羽,收集新鲜粪便,用液氮速冻后,保存于-80 ℃备用。
1.2 粪便DNA的提取、扩增与测序
参照PowerSoilDNA Isolation kit试剂盒说明提取样品微生物DNA,并利用琼脂糖凝胶电泳和NanoDrop 2000分光光度计(赛默飞世尔科技公司)检测DNA浓度。选择通用引物(343F:5′-TACGGRAGGCAGCAG
-3′;798R:5′-AGGGTATCTAATCCT
-3′)扩增16S V3-V4高变区。PCR反应体系:5×FastPfu Buffer 4 μL、2.5 mmol/L dNTPs 2 μL、模板DNA 10 ng、引物F(5 μmol/L)0.8 μL、引物R(5 μmol/L)0.8 μL、FastPfu Polymerase(5 U/μL)0.4 μL,补纯水至20 μL。扩增程序:95 ℃预变性 5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸 45 s,27个循环;72 ℃延伸10 min。利用Illumina PE250测序平台进行16S rDNA测序,委托上海欧易生物医学科技有限公司开展。
1.3 生物信息学处理
下机后,使用Trimmomatic软件对原始双端序列去杂,利用Flash软件进行拼接,并通过UCHIME检测并去除嵌合体序列,得到优质序列。首先,以序列相似度大于或等于97%为依据,利用Vsearch软件将序列聚类生成多个操作分类单元(operational taxonomic units,OTU)。使用QIIME软件包挑选出OTU代表序列,并与Greengenes或Silva(version.123)数据库比对注释,物种比对注释使用RDP classifier软件。随后,通过韦恩图计算组间共享和唯一的OTU数量,并将OTU按照相对丰度大小进行排序,以OTU由大到小的排序编号为横坐标,OTU相对丰度为纵坐标,绘制等级聚类曲线,评估物种丰度与分布均匀度。接着,通过计算Chao1、Shannon和Simpson指数分析样本α多样性,Chao1指数表示菌群丰度,Shannon和Simpson指数表示菌群多样性。利用β多样性距离矩阵,使用非加权组平均算法构建树状结构,通过主坐标分析可视化展示样本间差异。在门和属水平上,利用SPSS 22.0软件中的T-test分析比较细菌种属平均丰度差异。利用LEfSe(LDA Effect Size)分析生物标记物,采用线性判别分析(linear discriminant analysis,LDA)来估算标记物对差异效果影响的大小。最后,利用PICRUSt2软件进行京都基因与基因组百科全书数据库(Kyoto Encyclopedia of Genes and Genomes,KEGG)微生物群落功能预测。
2 结果与分析
2.1 测序分析结果
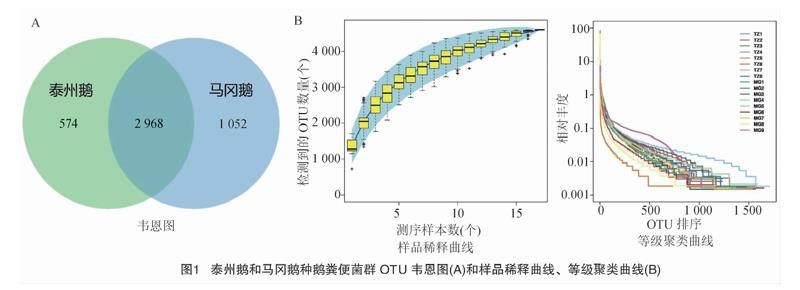
经测序,质控后的高质量测序标签数据量分布在44 577~76 767之间,经嵌合体去除得到最终用于分析的数据标签,其数据量分布在32 083~66 191 之间,序列长度分布在403.42~419.48 bp之间。各样本OTU个数分布在732~1 707个之间。如图1-A所示,泰州鹅粪便样品测得OTU为3 542个,马冈鹅为4 020个,共有OTU数量为 2 968 个。如图1-B所示,样品稀释曲线和等级聚类曲线均随数据量增大而逐渐趋于平坦,这表明测序数据量合理,各试验组样本中物种丰富,具有代表性。
2.2 α多样性分析结果
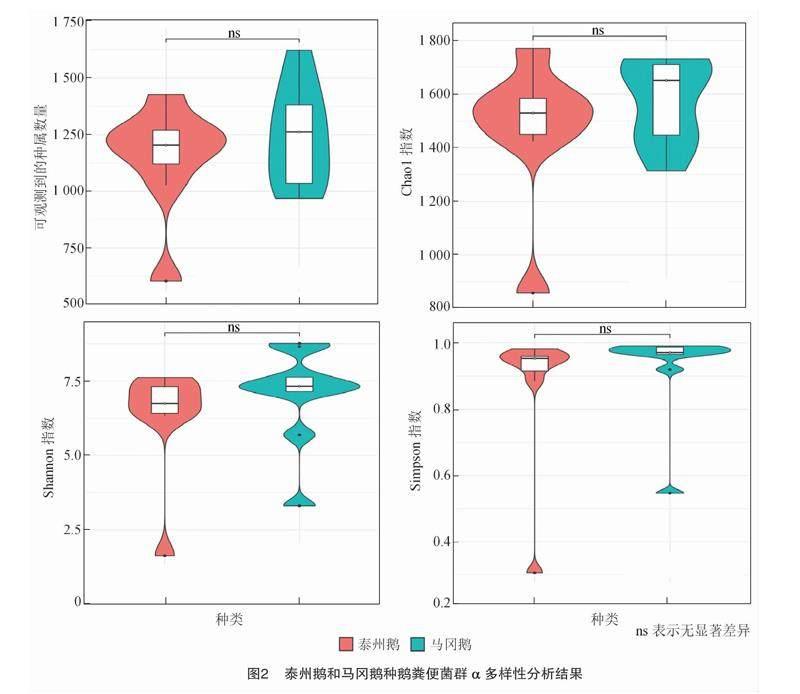
如图2所示,泰州鹅和马冈鹅粪便菌群中观测到物种数量、Chao1指数、Shannon指数和Simpson指数均无显著差异(P>0.05),提示相同饲养条件下2个品种种鹅粪便菌群多样性近似。
2.3 主坐标分析结果
对泰州鹅和马冈鹅种鹅粪便样品测序结果进行主坐标分析。如图3所示,第1主坐标数据差异的贡献度为31.43%;第2主坐标数据差异的贡献度为23.47%,表明该分析反映了原始数据样品间54.90%的变异性。泰州鹅和马冈鹅在β多样性分析中聚类不明显,微生物区系组成相近。
2.4 菌群组成结构分析结果
菌群组成结构分析表明,泰州鹅和马冈鹅种鹅粪便菌群组成存在差异(图4)。在门水平上, 厚壁菌门、拟杆菌门、变形菌门和放线菌门是种鹅粪便微生物中的优势菌门,其在泰州鹅粪便中平均丰度分别为44.61%、35.11%、15.06%和3.73%,在马冈鹅样品中平均丰度分别为36.48%、39.01%、16.23%和4.27%。在属水平上,罗氏菌属、拟杆菌属、普雷沃氏菌属_9和乳酸杆菌属为种鹅粪便微生物优势菌属,其在泰州鹅粪便中平均丰度分别为21.84%、12.49%、3.02%和2.66%,在马冈鹅粪便中平均丰度分别为12.22%、12.85%、4.24%和2.61%。
2.5 粪便菌群差异种属分析结果
对泰州鹅和马冈鹅粪便样品菌群组成进行统计分析发现:在门水平上,2个品种种鹅粪便菌群无显著差异(表1);在属水平上,2个品种种鹅粪便菌群有9个种属差异显著(表2)。由表2可知,泰州鹅种鹅粪便样品中厚壁菌门细菌CAG:822、苯基杆菌属和漫游菌属平均丰度显著高于马冈鹅(P<0.05);而马冈鹅种鹅粪便样品中固氮螺菌属、Blvii28_wastewater-sludge_group、Ezakiella、默多克菌属、假谷氨酸菌属和斯内化菌属平均丰度显著高于泰州鹅(P<0.05)。
2.5 多级物种层级树图(LEfSe)分析结果
基于粪便微生物OTU矩阵,对泰州鹅和马冈鹅种鹅粪便菌群做LEfSe分析,明确标志种属。由图5可知,马冈鹅组粪便菌群在进化分支图中存在一支相对独立的分类,无壁菌门。在LDA评分中,马冈鹅组粪便中的无壁菌门和柔膜细菌纲得分最高;泰州鹅组粪便中细小棒状菌科、细小棒状菌属和细小棒状菌目得分最高。
2.6 KEGG功能预测结果分析
为进一步了解差异种属对宿主生理功能调节的潜在影响,试验对种鹅粪便菌群做KEGG功能预测。由图6可见,粪便差异菌群可能影响种鹅以下生理功能的调节,主要包括:环境适应、碳水化合物代谢、脂质代谢、糖基化合物的生物合成和代谢、萜类和多酮类代谢、氨基酸代谢、其他氨基酸代谢、核苷酸代谢、代谢性疾病等过程。
3 讨论与结论
试验利用16S rRNA高通量测序技术分析了泰州鹅和马冈鹅种鹅粪便微生物区系,并探究了菌群差异与宿主生理功能调节间的联系。笔者所在课题组发现,在相同饲养条件下,马冈鹅和泰州鹅种鹅粪便微生物区系总体上受其遗传背景影响较小,主要表现在菌群多样性无显著差异和菌群组成总体上相似。家禽肠道菌群组成与遗传背景、日粮营养、养殖环境等因素有关,其中饲粮组成是对肠道菌群影响最显著的,而遗传背景导致菌群组成差异一般也是由饮食驱动的[10,13-14]。Wang等研究了同地域黑颈鹤、 白鹤和斑头鹅肠道菌群变化与遗传背景间的关系,发现高淀粉饮食的黑颈鹤和白鹤在代谢和合成功能上的富集程度相似,与高纤维饮食的斑头鹅有显著差异;3种鸟类之间菌群代谢的差异是由食物驱动的[15]。Gao等描述了包括家鹅和野鹅在内的7种鸟类的肠道菌群进化关系,发现肠道菌群的差异与酵解/糖异生、淀粉和蔗糖代谢、丙酸代谢、柠檬酸循环等过程有关,认为鹅独特的生理能力得益于宿主基因组的适应性进化及其与肠道微生物的共生作用[16]。因此,泰州鹅和马冈鹅可能因其不同的饮食类型导致肠道菌群的差异,但将其饲养在相同环境中、饲喂一段时间相同日粮后,其肠道菌群区系组成应具有逐渐相似的特点。
当然,尽管泰州鹅和马冈鹅粪便菌群组成总体上相似,但也在菌群组成上表现出一定差异。无璧菌门是泰州鹅和马冈鹅的主要差异菌门,它是一类潜在的有益菌,某些无璧菌门的微生物可以抵抗病原微生物的感染,保护宿主的健康。脱铁杆菌门等这些成员参与了复杂碳水化合物的降解。在属水平上,细小棒状菌在2个品种间也存在差异,其主要功能是参与机体有机物的分解和循环。此外,CAG:822是厚壁菌门中的一些成员可以帮助维持代谢和免疫健康[17]。厚壁菌门中的一些成员还可以分解肠道中无法被机体酶消化的碳水化合物,如膳食纤维和抗性淀粉,从而产生短链脂肪酸,如丁酸,这有助于维持肠道健康[18-19]。
微生物菌群间的差异可能影响宿主环境适应、碳水化合物代谢、氨基酸代谢等生理功能的调节[20]。肠道微生物产生的短链脂肪酸可以通过调节能量代谢、改善肠道屏障功能、调节免疫反应等机制影响宿主代谢[14]。本研究中,KEGG分析发现,马冈鹅和泰州鹅粪便差异菌群可能参与环境适应、碳水化合物代谢、糖基化合物的生物合成和代谢、萜类和多酮类代谢、氨基酸代谢、核苷酸代谢等生理过程。这意味着在长期的人类对家鹅的驯化过程中,马冈鹅和泰州鹅肠道菌群的差异仍主要源于环境适应及碳水化合物、氨基酸、脂类等营养物质代谢。
本研究结果表明,在相同饲养条件下,马冈鹅和泰州鹅种鹅粪便微生物区系总体上受其遗传背景影响较小,但也在菌群组成上表现出一定差异,可能影响宿主环境适应、碳水化合物代谢、氨基酸代谢等生理功能的调节。
参考文献:
[1]Vighi G,Marcucci F,Sensi L,et al. Allergy and the gastrointestinal system[J]. Clin Exp Immunol,2008,153(1):3-6.
[2]Yitbarek A,Taha-Abdelaziz K,Hodgins D C,et al. Gut microbiota-
mediated protection against influenza virus subtype H9N2 in chickens is associated with modulation of the innate responses[J]. Sci Rep,2018,8(1):13189.
[3]Liu M,Uyanga V A,Cao X,et al. Regulatory effects of the probiotic Clostridium butyricum on gut microbes,intestinal health,and growth performance of chickens[J]. J Poult Sci,2023,60(2):2023011.
[4]Bortoluzzi C,Vieira B S,Hofacre C,et al. Effect of different challenge models to induce necrotic enteritis on the growth performance and intestinal microbiota of Broiler chickens[J]. Poult Sci,2019,98(7):2800-2812.
[5]郑家宽. 饲喂绿原酸对肉鸡生产性能、肠道抗氧化性能及肠道菌群的影响[D]. 青岛:山东农业大学,2022.
[6]许云鹏. 中草药添加剂对不同鹅种生长发育及肠道菌群影响的研究[D]. 长春:吉林农业大学,2022.
[7]王俊花. 复合酶制剂对新疆伊犁鹅繁殖性能、盲肠微生物菌群和代谢组学的影响[D]. 乌鲁木齐:新疆农业大学,2022.[HJ2.1mm]
[8]颜怡超. 辣木果荚对鹅饲用价值的研究[D]. 广州:华南农业大学,2020.
[9]温 康. 鹅肠道菌群的宏基因组学分析及其与肥肝形成关系的研究[D]. 扬州:扬州大学,2020.
[10]李 筝,吴 家,周贝贝,等. 不同品种鹅肠道发育及肠道微生物菌群结构的比较[J]. 中国家禽,2022,44 (11):17-25.
[11]张锐毅. 全程旱养马冈鹅早期生长性能测定与分析[D]. 湛江:广东海洋大学,2020.
[12]牛加兴. 饲粮蛋白水平对生长期泰州鹅生产性能、肉品质和肠道发育的影响[D]. 泰安:山东农业大学,2023.
[13]黄 强,文超良,孙从佼,等. 鸡肠道微生物组成及其影响因素[J]. 中国家禽,2021,43(8):96-105.
[14]Ghosh T S,Shanahan F,OToole P W. The gut microbiome as a modulator of healthy ageing[J]. Nat Rev Gastroenterol Hepatol,2022,19(9):565-584.
[15]Wang Y Y,Long Z M,Zhang Y,et al. Host genetic background rather than diet-induced gut microbiota shifts of sympatric black-necked crane,common crane and bar-headed goose[J]. Front Microbiol,2023,14:1270716.
[16]Gao G L,Zhao X Z,Li Q,et al. Genome and metagenome analyses reveal adaptive evolution of the host and interaction with the gut microbiota in the goose[J]. Sci Rep,2016,6:32961.
[17]Lin L M,Lai Z,Yang H S,et al. Genome-centric investigation of bile acid metabolizing microbiota of dairy cows and associated diet-induced functional implications[J]. ISME J,2023,17:172-184.
[18]韩浩月,陈建康,Pedroso A A,等. 鸡消化道微生物菌群的组成及作用机理[J]. 国外畜牧学(猪与禽),2018,38(5):47-49.
[19]Murphy E F,Cotter P D,Healy S,et al. Composition and energy harvesting capacity of the gut microbiota:relationship to diet,obesity and time in mouse models[J]. Gut,2010,59(12):1635-1642.
[20]郑金蕾. “料中宝”复方中草药添加剂对籽鹅生长性能及肠道菌群的影响[D]. 长春:吉林大学,2023.
收稿日期:2023-12-15
基金项目:国家自然科学基金青年科学基金(编号:31902190)。
作者简介:吴云飞(1999—),男,河南开封人,硕士研究生,主要从事家禽肠道营养与微生物方面的研究。E-mail:wuyunfei990902@163.com。
通信作者:奚雨萌,博士,副研究员,主要从事家禽肠道营养与微生物方面的研究。E-mail:xiyumeng@jaas.ac.cn。

