响应面法优化酶解辅助-超声提取菥蓂中的黑芥子苷
刘东玲 司皓 郑宝江 张玉红

摘要:为从菥蓂种子中高效提取高得率的目的活性成分黑芥子苷,采用酶解辅助-超声提取法,并利用高效液相色谱测定其含量。在单因素试验的基础上,以酶添加量、酶解温度和酶解时间为关键因素,以黑芥子苷得率为响应值,应用DesignExpertV11软件,BoxBehnkenDesign响应面法优化菥蓂种子中黑芥子苷酶解辅助-超声提取工艺;并与单独超声、索氏提取2种提取法的黑芥子苷得率进行比较。结果表明,采用Agilent HCC18柱(25 mm×4.6 mm×5 μm),流动相A和B分别为甲醇和0.5%磷酸水溶液,检测波长215 nm,柱温25 ℃,流速1 mL·min-1,进样量10 μL,在等度洗脱10 min下,获得的分离效果和峰型较好。以筛选出的碱性蛋白酶为酶制剂,最佳提取工艺条件为:酶解温度49 ℃,酶用量2.90%,酶解时间18 min;在此条件下,菥蓂种子中黑芥子苷得率为2.679 mg·g-1,经方差分析与理论值(2.687 mg·g-1)差异不显著,但显著高于单独超声提取(2.036mg·g-1)和索氏提取(1.702 mg·g-1)(P<0.05)。优化得到的菥蓂中黑芥子苷酶解辅助-超声提取工艺,方法简单、节能、环保、高效,目的活性成分得率高,可应用于菥蓂中黑芥子苷的生产实践,为菥蓂的深度开发奠定了理论基础。
关键词:菥蓂;黑芥子苷;酶解辅助-超声提取;响应面法
doi:10.13304/j.nykjdb.2022.0964
中图分类号:S377;R284 文献标志码:A 文章编号:10080864(2024)04022509
菥蓂(Thlaspi arvense L.)是1 年生十字花科(Cruciferae)菥蓂属(Thlaspi)草本植物,别名败酱草、遏蓝菜、犁头草等[1],广泛分布于全国各地,集中生长在沟边、山地路边和村落周边。除我国外,在欧洲、美洲、非洲北部也有分布[2]。研究表明,菥蓂全草富含黄酮类化合物、芥子油苷类、芥子酶、挥发油、有机酸、糖类、吲哚、微量元素等化学成分[3];味辛,微寒,具有清肝明目、和中利湿、解毒消肿等功效,被历版中国药典所收录[4]。菥蓂种子中含有较高的脂肪油,且含有黑芥子苷[5]。至今,发现的芥子油苷有120多种,而黑芥子苷是此类物质中具有代表性的芥子油苷类化合物[6]。黑芥子苷是一种硫代葡萄糖苷,具有抗脂肪生成作用,能通利内脏、发汗散寒、温和开胃、增进食欲、化痰利气、促进消化、抗炎、有效抗氧化活性[78]、抑制肿瘤细胞的增殖[910]等作用,对高甘油三酯血症也有抑制作用,且影响脂肪细胞的分化[11]。黑芥子苷通过抑制蛋白酶表现出直接抗SARSCOV2活性,被认为是可能抗冠状病毒(COVID19)的潜在候选物质[12]。
目前,黑芥子苷的常用提取方法为传统的超声波辅助提取法(ultrasound-assisted extraction,UAE)[1314]。超声波辅助提取法是在超声波作用下使有效成分等进入溶剂中,得到含有多种成分的提取液后,再对提取液分离、精制、纯化,进而得到目标化合物[15]。该方法具有提取效率高、提取时间短等优点,但在实验室仍为小规模使用,由于设备问题无法应用于大规模生产。酶解法(enzymatichydrolysis,EH)是新兴的一种植物成分提取方法,通过破坏植物细胞壁和脂多糖、脂蛋白等,从而更完全彻底地获得植物中的有效成分[16]。该方法操作便捷、提取率高、工艺条件温和、符合绿色可持续发展要求,且避免了对目的化合物的破坏,近年来得到了更多研究者的关注。尽管酶解法能促使细胞壁降解,增大细胞膜透性,促使目标成分有效渗出,但只利用酶解法目标化合物的得率依然低于常规提取技术[17]。将超声波提取法和酶解法结合起来,首先利用酶破坏植物细胞壁结构,再利用超声波在物料中迅速聚集和分散,使液体产生空化效果,提高渗透性,从而提高目目标化合物的得率[18]。目前,尚未有利用酶解法提取黑芥子苷的研究报道。因此,本研究以菥蓂种子为原料,将超声辅助提取法和酶解法结合用于提取菥蓂子中的黑芥子苷,探究酶解作用结合超声对黑芥子苷提取得率的影响,并运用响应面设计优化酶解工艺参数,同时采用高效液相色谱法(highperformance liquid chromatography,HPLC)测定菥蓂种子中的黑芥子苷含量。
1 材料与方法
1.1 试验材料
选用采后自然干燥的菥蓂种子,使用前在60 ℃烘箱中烘干24 h,粉碎,过40目筛后置于封口袋中保存备用。黑芥子苷标准品购于上海源叶生物科技有限公司,色谱甲醇购于Sigma公司,色谱磷酸、果胶酶(分解细胞壁和细胞间层中的果胶物质)、纤维素酶(分解细胞中纤维素、半纤维素成分)、碱性蛋白酶(水解细胞中的丝氨酸型、肽键等碱性环境下的蛋白)、酸性蛋白酶(水解细胞酸性环境下的蛋白)和中性蛋白酶(催化中性或弱酸、弱碱性环境中蛋白质肽键水解)购于上海麦克林生化科技有限公司。
试验设备主要包括数显恒温水浴锅(SYG-2,常州朗越)、电子天平(BSA224S-CW,赛多利斯)、高功率数控超声波清洗机(KQ-400KDE,昆山超声)、高效液相色谱仪(1260型,美国安捷伦)、恒温箱(HN36-BS,力辰科技)等。
1.2 黑芥子苷的HPLC 的测定
1.2.1 液相色谱条件
色谱柱:Agilent HC-C18柱(25 mm×4.6 mm×5 μm)。黑芥子苷的色谱检测条件:流动相A和B分别为甲醇和0.5%磷酸水溶液,检测波长215 nm,柱温25 ℃,流速1 mL·min-1,进样量10 μL,等度梯度洗脱10 min。
1.2.2 标准曲线的绘制
精密称取对照品适量,用超纯水配制黑芥子苷标准品贮备溶液2 mg·mL-1,将黑芥子苷标准品贮备溶液分别稀释为1.00、0.50、0.25、0.12、0.05 mg·mL-1,然后分别进行HPLC检测,每次进样10 μL。以峰面积为纵坐标(y)、质量浓度为横坐标(x)进行线性回归,得到黑芥子苷的线性回归方程(式1)(R2=0.999 6),线性范围为0.05~1.00 mg·mL-1。标准品和样品色谱图如图1所示。
y = 8 751.1x + 275.62 (1)
1.3 不同酶制剂的筛选
称取同一批菥蓂种子粉6份,各1.00 g,采用料液比1∶15(g·mL-1),酶添加量30 mg·g-1(对照加蒸馏水),酶反应时间20 min。不同酶控制条件如下,果胶酶:pH=3,反应温度为50 ℃;纤维素酶:pH=5,反应温度为50 ℃;中性蛋白酶:pH=7,反应温度为45 ℃;碱性蛋白酶: pH=10,反应温度为50 ℃;酸性蛋白酶:pH=3,反应温度为45 ℃。反应结束后立即用80 ℃水浴灭活3~5 min;然后超声提取(超声功率320 W、超声时间25 min、超声温度30 ℃);将超声后的提取液过滤后吸取5 mL到容量瓶中用超纯水定容至10 mL,用HPLC进行黑芥子苷得率检测。所有试验均3次重复。
1.4 优化试验
1.4.1 单因素试验
采用单一控制变量的方法,黑芥子苷得率为评价指标,以酶解温度50 ℃、酶添加量30 mg·g-1、酶解pH 10、酶解时间20 min为基本试验条件,改变其中某一变量时,其他保持不变,考察酶添加量(10、20、30、40和50 mg·g-1)、酶解pH(7、8、9、10和11)、酶解时间(10、15、20、25和30 min)、酶解温度(40、45、50、55、60 ℃)对黑芥子苷得率的影响。
1.4.2 响应面法优化试验
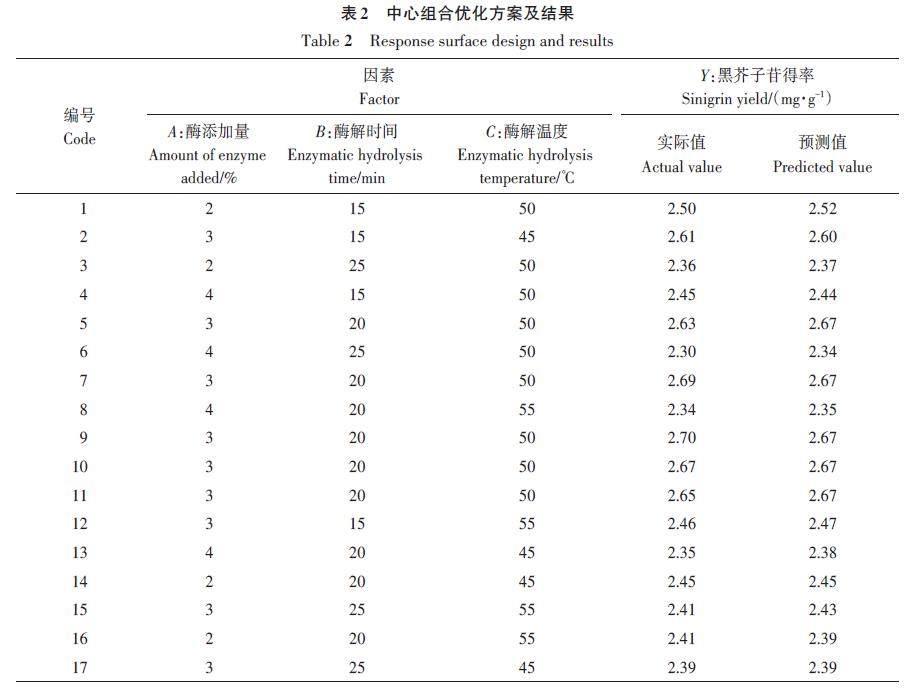
参考单因素试验结果,利用DesignExpertV11软件,运用BoxBehnken(BBD)的中心组合设计试验,选取对黑芥子苷得率影响较高的3 个因素:酶添加量(A)、酶解时间(B)、酶解温度(C)作为自变量,以黑芥子苷得率为评价指标,优化黑芥子苷的提取条件。响应面法试验的因素与水平详见表1。
1.5 提取方法比较
超声辅助提取法:取1.00 g菥蓂种子粉,超声25 min,360 W,30 ℃,料液比1∶15(g·mL-1)。过滤后取5 mL 提取液加入超纯水定容至10 mL。取1 mL过滤液过0.22 μm水系滤膜,进行HPLC检测。索氏提取法(soxhlet extraction,SE):取10 g菥蓂种子粉放入滤纸包中,料液比1∶15(g·mL-1),温度105 ℃,提取时间6 h。后续样品的处理步骤同超声提取法。所有试验均3次重复。
1.6 数据统计与处理
使用Microsoft Excel 2007软件对试验数据进行整理,利用SPSS 18.0 软件对数据进行统计分析,采用单因素方差分析(One-way ANOVA)进行差异显著性检验,利用Origin 2021绘制图。
2 结果与分析
2.1 不同酶制剂的筛选
由图2可知,加入不同酶制剂后,除中性蛋白酶外,其他4种酶的加入都提高了黑芥子苷的得率,其中碱性蛋白酶(2.615 mg·g-1)最高,与对照(1.784 mg·g-1)差异极显著(P<0.01);其次是纤维素酶,与对照差异显著(P<0.05);果胶酶和酸性蛋白酶处理虽高于对照,但与对照差异不显著。由于菥蓂种子含油量高(20%~36%),黑芥子苷属于脂肪族硫代葡萄糖苷,在提取过程中会随着油脂类成分一起溶出。单一的纤维素酶只能破坏细胞壁结构,不影响脂质复合体的稳定性,导致油脂相对较难释放[19]。而碱性蛋白酶处理能使细胞团成“镂空”形态[20],更有利于油脂和黑芥子苷的析出。虽然使用纤维素酶与碱性蛋白酶的黑芥子苷得率差异不显著,但碱性蛋白酶处理的黑芥子苷得率较纤维素酶高0.146 mg·g-1。因此,选择碱性蛋白酶进行后续研究。
2.2 酶解单因素试验结果
2.2.1 酶添加量对黑芥子苷含量的影响
由图3可知,黑芥子苷得率随酶添加量的增多而升高,当酶的添加量为30 mg·g-1 时黑芥子苷的得率达到峰值;而后继续增加酶量,黑芥子苷得率呈下降趋势。这可能是由于在一定范围内增加酶量,对细胞壁结构的破坏力越强,对脂蛋白、脂多糖等复合体酶解更充分,进而促进了目的成分的释放;然而当酶使用量超过了一定剂量时,会因酶过量而限制酶解反应[17]。故30 mg·g-1为最优酶添加量。
2.2.2 酶解温度对黑芥子苷含量的影响
随着酶解温度的增加,黑芥子苷的得率逐渐提高;当温度高于50 ℃时,得率明显下降。这可能是由于在酶的最适反应温度范围内,升高温度会使酶活性增强;但温度过高,超过酶的最适反应温度后会导致酶失活。因此,酶解最适温度为50 ℃。
2.2.3 酶解pH对黑芥子苷含量的影响
由于碱性蛋白酶能够获得更高的黑芥子苷得率。当酶提取液pH为7~10时,黑芥子苷得率随pH的增大而增加;当pH 为10 时,得率达到最高;当pH 为11时,黑芥子苷得率急剧下降。这可能是碱性环境有利于黑芥子苷的稳定,但强碱性环境又会导致黑芥子苷降解。因此,碱性蛋白酶提取黑芥子苷最适pH为10。
2.2.4 酶解时间对黑芥子苷含量的影响
当酶和样品含量一定时,酶解速率不变,反应时间越长,样品分解越充分,当达到一定时间时,样品反应完全,酶解反应终止。由图3可知,黑芥子苷得率随酶解时间的增加而增大,当反应时间为20 min时,含量不再增加,因此确定最优酶解反应时间为20 min。
2.3 响应面优化黑芥子苷提取工艺
2.3.1 响应面优化结果及拟合模型的建立
试验设计方案与结果如表2所示。利用响应面软件对数据进行多元回归和拟合,得到黑芥子苷含量(Y)对酶添加量 (A)、酶解时间 (B)、酶解温度 (C) 的二次多项回归方程模型,如下所示。
Y=2.670 0-0.035 0A-0.070 0B-0.023 0C-0.002 5AB+0.007 5AC-0.042 0BC-0.170 0A2-0.093 0B2-0.110 0C2(2)
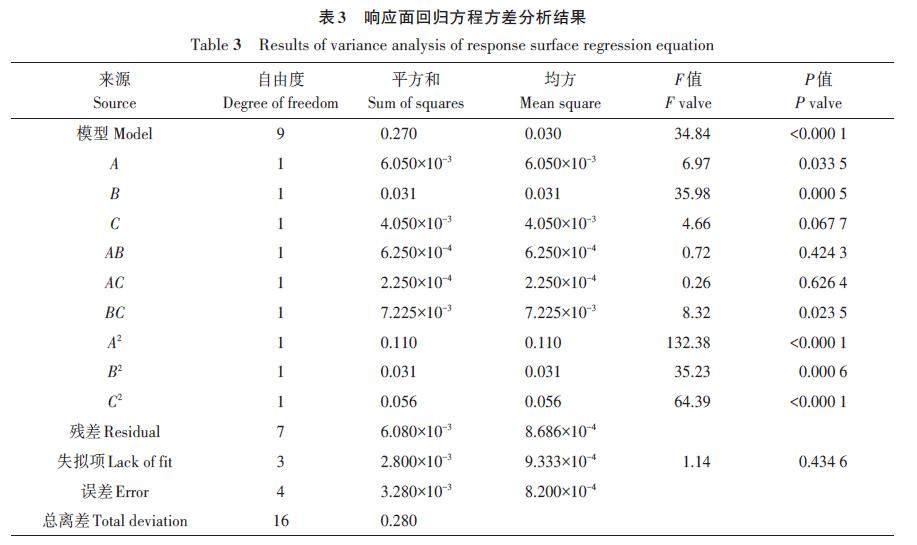
由表3可知,模型方程的F 值为34.84,P 值小于0.01,表明模型方程差异极显著,具有统计学意义;失拟项P 值为0.434 6,大于0.05,说明差异不显著,表明模型拟合度较好,试验误差小。在各影响因素中,一次项B(酶解时间)对黑芥子苷得率有极显著影响,A(酶添加量) 对黑芥子苷得率有显著影响,C(酶解温度)对黑芥子苷得率影响不显著;组合因素中,BC 对黑芥子苷的得率有显著影响;二次项A2、B2、C2对黑芥子苷得率有极显著影响。
由表4 可知,CV=1.18%,小于5%,说明模型的可信度较高。回归决定系数R2=0.978 2,说明97.82% 的变异可以由这3 个因素解释。R2Adj=0.950 1,说明95.01%黑芥子苷含量可由该模型解释。Adeq Precision 值较高,为19.013。因此,该模型可用于预测酶解对黑芥子苷含量的影响。
由黑芥子苷模型的残差正态分布图(图4)可以看出,各点集中于直线上,分布均匀,呈正态分布;实际值与预测值较集中,显示出良好的一致性,表明本模型分析目标产物随条件变化的可信度高。
2.3.2 提取因素的响应面分析
响应面的交互作用如图5所示。根据三维伞状图的坡度和与之相对应的二维等高线的形状,可以判断出各因素之间的交互作用是否显著[21]。黑芥子苷得率随着B(酶解时间)和C(酶解温度)的增加先逐渐升高而后逐渐下降,且B、C 间间交互作用显著;A(酶添加量)及A 与B、C 间交互作用均不显著。各因素的影响强度为B>A>C。
2.3.3 最佳提取工艺及验证
由模型得到酶法辅助超声提取黑芥子苷最佳工艺条件为:酶添加量2.90%,酶解时间17.90 min,酶解温度49.05 ℃,在此基础上,菥蓂种子中黑芥子苷含量预测值为2.687 mg·g-1。考虑到实际操作可行性,将工艺条件校正为酶用量2.90 %,酶解时间18 min,酶解温度49 ℃,在此条件下,3次重复得到菥蓂种子中黑芥子苷得率为(2.679±0.026) mg·g-1,与模型预测值差异不显著,说明结果可信。
2.3.4 不同提取工艺比较
利用超声辅助(UAE)、索氏(SE)提取及本试验优化后的酶解-超声提取(EH-UAE)工艺对同一批菥蓂种子中黑芥子苷进行提取和得率检测,结果(图6)表明,本试验优化后提取方法的黑芥子苷得率为2.679 mg·g-1,显著高于超声辅助提取(2.036 mg·g-1)和索氏提取(1.702 mg·g-1)。
3 讨论
黑芥子苷是菥蓂种子中重要的有效活性成分。黑芥子苷作为一种主要的芥子油苷,是十字花科蔬菜(如卷心菜、花椰菜、西蓝花等)中的常见成分[22],通常被用作食品或与其他草药结合用于治疗各种疾病[7, 23]。本研究在单因素试验的基础上,利用Design-Expert软件的Box-Behnken 方法进行了优化,优化后该工艺的最优参数为:超声预处理25 min,功率360 W,料液比1∶15(g·mL-1);酶添加量2.9%,酶解时间18 min,酶解温度49 ℃,酶解pH 10。在此条件下,黑芥子苷得率为2.679 mg·g-1,显著高于超声辅助提取和索氏提取,为菥蓂中黑芥子苷的提取和菥蓂产业化生产提供了思路和基础数据支撑。
柯秀梅等[24]利用热回流法,以水为提取溶剂,对同一批菥蓂粉料分别采用120 ℃灭活40 min、未灭活的菥蓂粉料和以乙醇提取菥蓂3种方法提取黑芥子苷,黑芥子苷得率分别为0.365、0.526和0.830 mg·g-1;黄志慧等[25]以40%乙醇研磨匀浆后置于4 ℃冰箱静置30 min,而后以功率250 W,超声提取1.5 h,黑芥子苷得率为1.725 mg·g-1。上述研究所得的黑芥子苷得率均极显著低于本研究利用酶解-超声辅助提取方法所得到的菥蓂中黑芥子苷得率(2.679 mg·g-1)。由于活性酶破坏了植物细胞壁,扩大了细胞内有效成分向提取介质扩散的传质面积,减少了传质阻力;结合超声波的空化作用、机械效应和热效应等,加速了胞内有效物质的释放、扩散,更利于目的物与溶剂的充分混合、溶解,从而利于提取,能够显著提高提取效率和产量。因此,酶解-超声辅助提取是一种绿色环保、高效、高得率的提取工艺,利用酶解-超声辅助提取法从菥蓂中提取黑芥子苷具有降低成本、节省时间的优点,这为菥蓂的深度开发利用提供了科学依据,该方法具有广阔的应用前景。
参考文献
[1] 刘静果,张宝山,张玉红,等. 中草药菥蓂的研究现状及展望[J].江苏农业科学,2020,48(22):15-21.
LIU J G, ZHANG B S, ZHANG Y H, et al .. The research statusand prospect of Chinese herbal medicine Thlaspi arvense [J].Jiangsu Agric. Sci., 2020, 48(22):15-21.
[2] 中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1987:80-84.
[3] MALIHEH E, TARA J N, FMEGHAN M, et al .. Generatingpennycress (Thlaspi arvense) seed triacylglycerols and acetyltriacylglycerolscontaining medium-chain fatty acids [J/OL].Front. Energy Res., 2021, 9:620118 [2022-10-03]. https:/doi.org/10.3389/fenrg.2021.620118.
[4] 国家药典委员会.中国药典(一部)[M].北京:中国医药科技出版社,2020:321.
[5] LIU J G, CHEN M, ZHANG Y H, et al .. Analyses of the oilcontent, fatty acid composition, and antioxidant activity inseeds of Thlaspi arvense L. from different provenances andcorrelations with environmental factors [J/OL]. Chem. Biol.Technol. Agric, 2022, 9(1): 11 [2022-10-03]. https:/doi.org/10.1186/S40538-021-00276-X.
[6] CHEN S X, ERIK A. Update on glucosinolate metabolism andtransport [J]. Plant Physiol. Biochem., 2001, 39(9):743-758.
[7] MAZUMDER A, DWIVEDI A, DU PLESSIS J. Sinigrin and itstherapeutic benefits [J/OL]. Molecules, 2016, 21(4):416 [2022-10-03]. https:/doi.org/10.3390/molecules21040416.
[8] DRVENICA I, BLAZEVIC I, BOSKOVIC P, et al .. Sinigrinencapsulation in liposomes: influence on in vitro digestion andantioxidant potential [J]. Polish J. Food Nutr. Sci., 2021,71(4):441-449.
[9] LOZANO-BAENA M D, TASSET I, OBREGON-CANO S,et al .. Antigenotoxicity and tumor growing inhibition by leafyBrassica carinata and sinigrin [J]. Molecules, 2015, 20(9):15748-15765.
[10] LI S Q, LIN J W, WEI J F, et al .. Sinigrin impedes the breastcancer cell growth through the inhibition of PI3K/AKT/mTORphosphorylation-mediated cell cycle arrest [J]. J. Environ.Pathol. Tox., 2022, 41(3):33-43.
[11] ABBAS Q, HASSAN M, RAZA H, et al .. In vitro, in vivo and insilico anti-hyperglycemic inhibition by sinigrin [J]. Asian Pac.J. Trop. Med., 2017, 10(4):352-358.
[12] NAZEAM J, MOHAMMED E Z, RAAFAT M, et al .. Based onprinciples and insights of COVID-19 epidemiology, genomesequencing, and pathogenesis: retrospective analysis ofsinigrin and prolixinRX (Fluphenazine) provides off-label drugcandidates [J]. SLAS Discov., 2020, 25(10):1123-1140.
[13] 黄文红,冯玉红,李嘉诚,等.Plackett-Burman设计和响应面法优化芥子中硫苷的超声波提取工艺[J]. 中国粮油学报,2016,31(7):76-81.
HUANG W H, FENG Y H, LI J C, et al .. Optimization ofultrasound extraction of sinigrin from mustard seed by Plackett-Burman design and response surface methodology [J]. J. Chin.Cereals Oils Assoc., 2016, 31(7):76-81.
[14] WANG T, LIANG H, YUAN Q. Optimization of ultrasonicstimulatedsolvent extraction of sinigrin from Indian mustardseed (Brassica juncea L.) using response surface methodology [J].Phytochem. Analysis, 2011, 22:205-213.
[15] 张佳杰,薛敏,魏天晔,等.烟碱提取方法研究进展[J].食品安全质量检测学报,2018,9(10):11-16.
ZHANG J J, XUE M, WEI T Y, et al .. Research progress ofextraction methods of nicotine [J]. J. Food Saf. Qual., 2018,9(10):11-16.
[16] 吴非,李钊,周琪,等.超声波辅助水酶法提取米胚油及其成分分析[J].食品科学,2020,41(24):233-241.
WU F, LI Z, ZHOU Q, et al .. Ultrasonic-assisted aqueousenzymatic extraction and chemical composition of rice germ oil [J].Food Sci., 2020, 41(24):233-241.
[17] 高淼,马晓军.超声波辅助水酶法提取棕榈油工艺优化及其成分分析[J].天津科技大学报,2021,36(4):14-19.
GAO M, MA X J. Optimization of ultrasound-assisted enzymaticaqueous extractionof palm oil and its composition analysis [J].J. Tianjin Univ. Sci. Technol., 2021, 36(4):14-19.
[18] WEI C, XIAO K, LI H L, et al .. Optimization of ultrasoundassisted aqueous enzymatic extraction of oil from Cinnamomumcamphora seeds [J/OL]. LWT-Food Sci. Technol., 2022, 164:113689 [2022-10-03]. https://doi.org/10.1016/j.lwt.2022.113689.
[19] 靳俊莹.水酶法提取油莎豆油及其副产物的开发利用[D].郑州:河南工业大学,2021.
JIN J Y. Studies on aqueous enzymatic extraction of Cyperusesculentus oil and its byproduct application [D]. Zhengzhou:Henan University of Technology, 2021.
[20] 赵自通,陈复生,张丽芬,等.酶制剂在植物油脂与蛋白质提取过程中应用的研究进展[J].食品研究与开发,2017,38(19):201-210.
ZHAO Z T, CHEN F S, ZHANG L F, et al .. Advances inapplication of enzyme preparations in the extraction ofvegetable oils and protein [J]. Food Res. Dev., 2017, 38(19):201-210.
[21] 张庆芬,李占君,李晓雪,等.匀浆结合超声-微波协同提取桔梗中桔梗皂D和党参炔苷工艺研究[J].森林工程,2022,38(5):110-120.
ZHANG Q F, LI Z J, LI X X, et al .. Homogenate pretreatmentfollowed by ultrasonic-microwave synergisticextraction ofplatycodin D and lobetyolin from the Platycodon radix [J]. For.Eng., 2022, 38(5):110-120.
[22] AWASTHI S, SARASWATHI N T. Sinigrin, a majorglucosinolate from cruciferous vegetables restrains nonenzymaticglycation of albumin [J]. Int. J. Biol. Macromol.,2016, 83:410-415.
[23] TEKLEHAYMANOT T, WANG H J, LIANG J L, et al ..Variation in plant morphology and sinigrin content in ethiopianmustard (Brassica carinata L.) [J]. Hortic. Plant J., 2019, 5(5):205-212.
[24] 柯秀梅,杨荣平,王云红,等.藏药菥蓂中黑芥子苷对黄嘌呤致小鼠高尿酸作用的研究[J].天然产物研究与开发,2015,27(8):1407-1410.
KE X M, YANG R P, WANG Y H, et al .. Effect of sinigrin onhigh uric acid in mice induced by xanthanine [J]. Nat. Prod.Res. Dev., 2015, 27(8):1407-1410.
[25] 黄志慧,张一宁,李娜娜,等.增补UV-B辐射对菥蓂生理特性及次生代谢产物的影响[J].植物研究,2022,42(6):1079-1087.
HUANG Z H, ZHANG Y N, LI N N, et al .. Responses ofsupplemental UV-B radiation to physiological properties andsecondary metabolites of Thlaspi arvense [J]. Bull. Bot. Res.,2022, 42(6):1079-1087.
(责任编辑:张冬玲)
基金项目:全国第四次中药资源普查黑龙江专项(2018HLJZYZYPC-16)。

