玉屏风加味鼻喷剂改善变应性鼻炎大鼠鼻腔水液代谢的作用及机制
刘玉崟 习媛 田理
【摘 要】 目的:观察玉屏风加味鼻喷剂对变应性鼻炎大鼠鼻腔水液代谢的作用,探讨其改善变应性鼻炎大鼠流涕症状的相关机制。方法:采用卵清蛋白(OVA)与氢氧化铝[Al(OH)3]联合致敏建立变应性鼻炎大鼠模型,随机分为模型组、玉屏风加味鼻喷剂组(YPF+,50μg/侧滴鼻,每日2次)及阳性对照组(糠酸莫米松,50μg/侧滴鼻,每日1次),另设空白组。空白组和模型组给予等量生理盐水(50μg/侧滴鼻,每日2次),连续4周。对比各组大鼠行为学评分、鼻黏膜HE染色病理并量化评分、PAS染色后计数杯状细胞、蛋白免疫印迹及免疫荧光法检测水通道蛋白5(AQP5)的表达情况。结果:与空白组相比,模型组大鼠行为学总评分及流涕症状评分均显著升高(P<0.05),鼻黏膜腺体增生及黏膜下层水肿明显,病理评分及杯状细胞计数显著升高(P<0.05),AQP5荧光表达明显减弱,蛋白水平显著降低(P<0.05);与模型组相比,YPF+组大鼠行为学评分及流涕症状评分均显著降低(P<0.05),鼻黏膜结构修复、炎性浸润改善、腺体增生好转,病理评分下降及杯状细胞计数显著减少(P<0.05),鼻黏膜AQP5蛋白荧光标记重现,蛋白水平显著回升(P<0.05)。结论:YPF+可缓解大鼠流涕,改善变应性鼻炎大鼠鼻腔水液代谢,其机制可能与抑制变应性鼻炎大鼠鼻黏膜杯状细胞增生及上调AQP5的表达相关。
【关键词】 玉屏风加味鼻喷剂;变应性鼻炎;杯状细胞;水通道蛋白5
【中图分类号】R285.5 【文献标志码】 A【文章编号】1007-8517(2024)10-0032-07
DOI:10.3969/j.issn.1007-8517.2024.10.zgmzmjyyzz202410008
Effect and Mechanism of Modified Yupingfeng Nasal Spray on Improving Nasal
Fluid Metabolism in Rats with Allergic Rhinitis
LIU Yuyin XI Yuan TIAN Li
Affiliated Hospital of Chengdu University of Traditional Chinese Medicine,Otorhinolaryngology,Chengdu 610032,China
Abstract:Objective The study was aimed at observing the effect of Modified Yupingfeng nasal spray (YPF+) on nasal fluid metabolism in rats with allergic rhinitis (AR)and exploring the related mechanism of YPF+ to improve the symptoms of runny nose in AR rats.Methods The AR rat model was sensitized by Ovalbumin (OVA) and aluminum hydroxide[Al (OH)3], which was randomly divided into model group, Yupingpeng nasal spray group (YPF+, 50μg/side nasal drip, twice a day), positive control group (Mometasone furoate, 50μg/side nasal drip, once a day), and blank group.The blank group and the model group were given the same amount of normal saline (50μg/side nasal drops, twice a day) for 4 weeks.The behavioral scores, pathological and quantitative scores of HE staining in nasal mucosa, goblet cell counting after PAS staining, and aquaporin 5 (AQP5) expression detected by Western blot and immunofluorescence were compared in each group.Results Compared with the blank group, the total behavioral score and runny nose symptom score of rats in model group were significantly increased (P<0.05).Meanwhile,the mucosal glandular hyperplasia and submucosal edema, the pathological score and goblet cell counts were significantly increased (P<0.05).On the contrary,the fluorescence expressionand the protein level of AQP5 was significantly decreased, (P<0.05).Compared with the model group, total behavioral score and single symptom score of runny nose in YPF+ group were significantly decreased (P<0.05).Structural repair, inflammatory infiltration and glandular hyperplasia of nasal mucosa were improved.Pathological score and goblet cell counts were decreased significantly (P<0.05).Meanwhile,the fluorescence labeling of AQP5 protein appeared in nasal mucosa,and the protein level increased significantly (P<0.05).Conclusion YPF+ can relieve runny nose and improve nasal fluid metabolism in AR rats.Its mechanism may be connectedwith inhibiting goblet cell proliferation and up-regulating AQP5 expression in AR rats nasal mucosa.
Key words:Modified Yupingfeng nasal spray;Allergic rhinitis;Goblet Cell;Aquaporin 5
变应性鼻炎(allergic rhinitis,AR)是一种以鼻塞、流涕、鼻痒、喷嚏为主要症状的鼻黏膜慢性非感染性炎性疾病[1],其全球的患病率在1.0%~54.5%,且仍不断上升[2]。研究[3-4]显示,AR患者流涕发生率达86.1%,95%的患者认为流涕对其日常生活造成困扰并需要治疗[5],由此可见,流涕在AR治疗中亟需被重视。在AR发病过程中,机体接触变应原后释放出组胺,诱导炎症介质、细胞因子、免疫细胞和腺体周围神经递质刺激鼻黏膜,导致腺体高分泌,同时增加血管通透性及血浆渗出,造成鼻腔水液代谢失衡,最终引发鼻黏膜病理变化和大量水样涕[6]。研究证实,在此过程中负责分泌鼻腔黏液毯的杯状细胞[7]和位于细胞膜上介导水液转运的水通道蛋白5(aquaporin 5,AQP5)[8]与AR流涕症状及机制密切相关,且目前已有多项研究[9-10]
将杯状细胞、AQP5用作评估AR黏液高分泌药物治疗的关键指标。四川省名中医田理教授基于20余年临证经验创新研发玉屏风加味鼻喷剂(Modified Yupingfeng nasal spray,YPF+, 原名:克敏芪丹)治疗AR,前期临床研究[11]证实,相较于AR鼻痒、喷嚏等症,YPF+在改善流涕、鼻塞症状的表现更优,但其作用机制尚不明确,故本研究拟通过建立AR大鼠模型,观察YPF+对鼻腔水液代谢的影响,探寻其改善流涕的作用机制,为临床运用玉屏风加味鼻喷剂外治AR流涕显著的患者提供实验依据。
1 材料
1.1 实验动物 SPF级雄性大鼠 40只,体质量 160 ~ 190 g,6~8周龄,购自北京华阜康生物科技股份有限公司[动物生产许可证号SCXK(京)2019-0008]。饲养环境通风、光线良好且温、湿度适宜。大鼠自由饮水,摄食普通饲料。本实验经成都中医药大学附属医院实验动物伦理委员会审核并通过(伦理审查编号:2022DL-010),整个实验过程中对动物的各种处理均遵照科技部2006年颁布的有关动物的使用及伦理学规定[12]。
1.2 主要药物及试剂 YPF+(规格每支装10mL,对应生药量1.05 g/mL)由成都中医药大学附属医院药剂科据已知YPF+制备工艺制备,以蜜炙黄芪、生白术、防风、酒川芎、牡丹皮等5味中药煎煮并浓缩而得,质量浓度为1.05 g/mL(以生药总量计);糠酸莫米松鼻喷剂(mometasone furoate,MF,货号U025821,规格:每瓶60揿,每揿含糠酸莫米松50μg,药物浓度0.05%),比利时Schering-Plough labo N.V公司生产;卵清蛋白(Ovalbumin,OVA)、氢氧化铝[Al(OH)3][西格玛奥德里奇(上海)贸易有限公司生产,货号M0228A、MKCM1237];苏木素染液(上海懿洋仪器有限公司生产,批号201901);兔源AQP5单克隆抗体(武汉三鹰生物技术有限公司生产,货号20334-1-AP);抗体GAPDH(武汉三鹰生物技术有限公司生产,货号60004-1-Ig);HRP-山羊抗兔IgG(成都正能生物技术有限责任公司生产,货号511203);PBS缓冲液(广州赛国生物科技有限责任公司生产,货号G4202);BSA(广州赛国生物科技有限责任公司生产,货号4240GR250);DAPI(塞维尔生物科技有限公司生产,货号G1012)。其余试剂均为实验室常用规格,水为蒸馏水。
1.3 主要仪器 Ministar型低温离心机(湖南恒诺仪器设备有限公司生产);DNM9602G型酶标仪(成都普朗医疗设备有限公司生产);TSJ-Q型全自动封闭式组织脱水机(常州中威电子仪器厂生产); BMJ-III型包埋机(常州中威电子仪器厂生产);HM325型切片机(赛默飞世尔科技公司生产);CX31型光学显微镜(日本OLYMPUS公司生产);Pannoramic SCAN Ⅱ型病理切片扫描仪(3DHISTECH Kft);Chemiscope 6100型显影仪(上海勤翔科学仪器有限公司生产)等。
2 方法
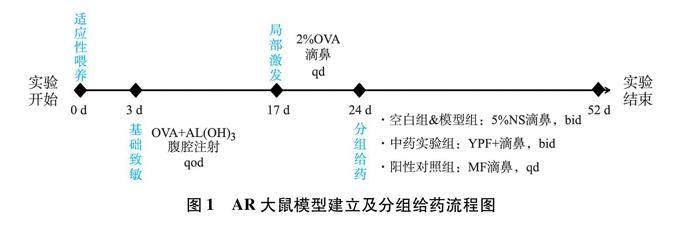
2.1 实验动物模型制备及分组给药 将实验大鼠进行适应性喂养3 d后制备AR大鼠模型,具体分为两个阶段。①全身致敏阶段:将0.3 mgOVA和30 mgAl(OH)3溶于1 mL生理盐水配成混悬液,对大鼠进行腹腔注射,隔日1次,一共7次,共14 d;②局部激发阶段:第14天开始,大鼠以2% OVA溶液滴鼻局部激发,每侧鼻孔50 μL,每日1次,连续7 d。经21 d造模结束后通过行为学评分评价造模情况。造模成功后按随机数字表法分为模型组、YPF+组和阳性对照组,每组10只,另设空白组10只。YPF+组予该药物滴鼻(每侧50μg,每日2次);阳性对照组给予糠酸莫米松鼻喷剂滴鼻(每侧50μg,每日1次);空白组及模型组以生理盐水(每侧50μg,每日2次)滴鼻,连续4周。如图1。
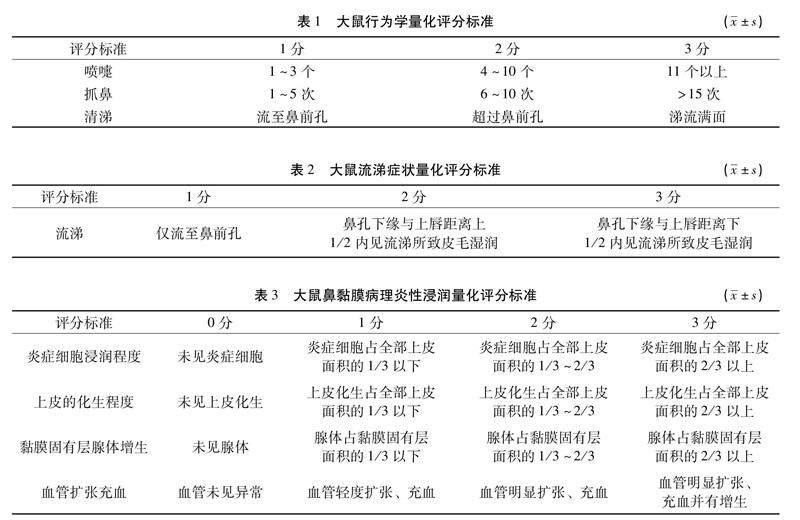
2.2 大鼠行为学评分 末次造模及用药结束后30 min参考文献[13]对大鼠行为学进行评分,以判定造模情况和治疗情况。见表1、表2。
2.3 大鼠鼻粘膜病理观察 各组大鼠麻醉后处死取鼻黏膜,置于4%多聚甲醛中固定48 h后脱水、包埋、切片(厚度3 μm),进行HE 染色,光镜下任选10个200倍视野观察黏膜上皮层、固有层、基底膜、和黏膜下层的状况,并将各组大鼠鼻黏膜炎性浸润情况按如下标准量化评分,叠加各项评分即为总评分[14]。见表3。
2.4 大鼠鼻黏膜杯状细胞计数 取“2.3”项下剩余大鼠鼻黏膜部分组织,经分级乙醇脱水、二甲苯透明、石蜡浸蜡、包埋后连续切片(厚度3 μm),将脱片进行脱蜡至水后,先后采用Schiff氏液、苏木素染色后梯度乙醇脱水,透明及封片,在光学显微镜下随机取3个400倍视野计数杯状细胞数量,取平均值。
2.5 大鼠鼻黏膜AQP5蛋白表达
2.5.1 免疫荧光法实验 取“2.3”项下大鼠鼻黏膜石蜡切片脱蜡至水后行抗原修复,待切片稍干行自发荧光淬灭后以BSA进行血清封闭。随后在切片上滴加AQP5多克隆抗体(稀释比例为1∶[KG-*3/5]200)于4 ℃孵化过夜,PBS洗涤10 min/次,共3次;再加入HRP-山羊抗兔IgG(稀释比例1∶[KG-*3/5]500),室温避光孵育50 min后,PBS洗涤10 min/次,共3次。经DAPI复染细胞核后进行封片,后置于荧光显微镜下观察并采集图像。
2.5.2 免疫印迹法(Western blot)实验 取“2.3”项下剩余大鼠鼻黏膜组织,放入离心管中并加入RIPA裂解液进行充分裂解后离心,取上清液并稀释以进行蛋白定量。按照10%分离胶进行SDS-PAGE分析,以80V恒定电泳。待电泳完成后用恒流300 mAh转膜80 min将凝胶上的蛋白转印到PVDF上,放入5%脱脂牛奶中封闭1 h后,进行AQP5一抗(稀释度为1∶[KG-*3/5]1000)4 ℃孵育过夜,PBS洗涤10 min/次,共3次;再加入二抗(稀释比例1∶[KG-*3/5]10000的HRP-山羊抗兔IgG),避光孵育45 min后,PBS洗涤10 min/次,共3次。采用ECL显影并观察,最后采用Image J软件各条带灰度,以GAPDH作为内参来反应蛋白表达水平。
2.6 统计学分析 采用 SPSS 26.0统计软件进行数据分析。计量资料以均数加减标准差(x±s)表示,组间比较采用单因素ANOVA方差分析,进一步两两比较采用LSD检验,以P<0.05为具有统计学意义。
3 结果
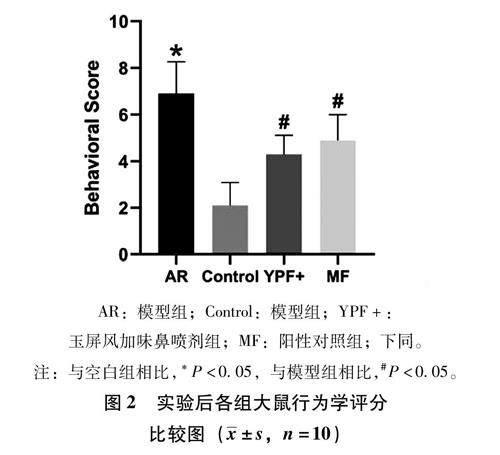
3.1 变应性鼻炎 大鼠模型构建及YPF+对大鼠行为学评分的影响造模结束后,除空白组外,各组行为学评分均大于5分,且与空白组相比,各组行为学评分升高(P<0.05),提示造模成功。治疗结束后,与模型组相比,YPF+组和阳性对照组行为学评分降低(P<0.05),如图2;同时,单独对各组大鼠治疗结束后流涕症状进行评分显示,与模型组相比,YPF+组和阳性对照组流涕症状评分降低(P<0.05),如图3。
3.2 YPF+对大鼠鼻黏膜组织形态学的影响 空白组大鼠鼻黏膜上皮连续、整齐;模型组大鼠鼻黏膜纤毛倒伏、脱落,黏膜下层水肿明显,腺体增生伴腺腔扩张,分泌旺盛,并有大量炎性细胞浸润,整个黏膜层增厚、结构紊乱。YPF+组大鼠鼻黏膜上皮结构完整性修复,纤毛排列整齐,黏膜下层水肿减轻,腺体增生减少,分泌亢进缓解,炎性细胞浸润减少。如图4。
与空白组比较,模型组大鼠鼻黏膜病理评分显著升高(P<0.05);与模型组比较,YPF+组和阳性对照组大鼠鼻黏膜病理评分均显著下降(P<0.05)。如图5。
3.3 YPF+对大鼠鼻黏膜杯状细胞的影响 鼻黏膜经PAS染色后,杯状细胞呈现为紫红色颗粒。与空白组相比,模型组大鼠鼻黏膜组织上皮内见杯状细胞肥大、密集分布、化生明显且分泌旺盛;与模型组相比,YPF+组鼻黏膜上皮杯状细胞肥大、化生情况明显减轻。如图6所示。同时,对鼻黏膜杯状细胞进行定量分析,与空白组相比,模型组大鼠鼻黏膜杯状细胞计数显著升高(P>0.05);与模型组相比,YPF+组杯状细胞计数显著下降(P<0.05)。如图7所示。
3.4 YPF+对大鼠鼻黏膜AQP5表达的影响 免疫荧光下AQP5蛋白阳性表达在相应荧光素标记下呈现为红色荧光。从空白组大鼠鼻黏膜AQP5红色荧光标记位置来看,AQP5主要表达于鼻黏膜上皮细胞、腺体及部分炎症细胞的胞浆中。与空白组相比,模型组大鼠鼻黏膜上皮细胞及腺腔红色荧光标记明显减少;与模型组相比,YPF+组及阳性对照组大鼠鼻黏膜上皮及腺体周围红色荧光标记重现。如图8所示。
3.5 YPF+对大鼠鼻黏膜AQP5蛋白表达的影响 与空白组对比,模型组大鼠鼻黏膜AQP5蛋白水平显著降低(P<0.05);而与模型组相比较,YPF+组AQP5蛋白水平升高(P<0.05)。如图9。
4 讨论
中医学中AR属“鼻鼽”范畴。《素问玄机原病式·六气为病》曰:“鼽者,鼻出清涕也。”鼻流清涕是古人认为鼻鼽最突出的症状,为津液代谢失调的病理表现,其发病以肺脾气虚为本,肺气不足、卫表不固而易受外邪侵袭,邪犯鼻窍致气滞津停,脾气不足而气不摄津,故见鼻流清涕,涓涓而下,即《诸病源侯论》所言:“肺气通于鼻,其脏有冷,冷随气入乘于鼻,故使津液不能自收。”从病机出发辨治鼻鼽流涕,其核心在于治气,当以益气摄津、行气散津为法,气充则表固,气行则津行。YPF+由玉屏风散化裁而成,方中黄芪益肺气而固卫表,白术益脾气兼能燥湿,两药相配,肺脾气充,则津行通畅,行于体内而无外漏;防风祛风逐饮,川芎行气散津;上述诸药配伍,共奏益气摄津、行气散津之效。
AR流涕与鼻黏膜慢性低度炎症环境引发腺体高分泌状态、组织结构重塑密切相关[15]。祝婉婷等[16]研究显示AR患者鼻分泌物中嗜酸性粒细胞阳离子蛋白(eosinophil cationic protein,ECP)、白介素5(interleukin-5,IL-5)、干扰素γ(IFN-γ)等炎症细胞因子明显升高,且治疗前后IL-5水平差值及IFN-γ百分比变化均与流涕症状评分差值呈正相关。刘书芹等[7]研究发现AR大鼠鼻分泌物量的多少与鼻黏膜白介素4(interleukin-4,IL-4)、IL-5等炎症因子水平成正相关,且在鼻黏膜病理中观察到间质水肿、腺体增生。本实验中,与空白组相比,模型组大鼠行为学评分>5分,鼻黏膜病理提示上皮结构损伤,黏膜下层水肿明显,腺体增生伴腺腔扩张,分泌旺盛,并有大量炎性细胞浸润,病理评分显著升高(P<0.05),提示造模成功。经YPF+干预治疗后,与模型组对比,YPF+组大鼠行为学及流涕症状评分降低(P<0.05),病理提示鼻黏膜上皮结构完整性修复,黏膜下层水肿减轻,腺体增生减少,分泌亢进缓解,炎性细胞浸润减少,病理评分显著下调(P<0.05),提示YPF+可缓解AR大鼠流涕症状、减轻鼻黏膜炎症及控制腺体高分泌状态。
杯状细胞作为黏液纤毛系统的重要部分,是分泌鼻腔黏液毯的主要细胞。AR发生时,变应原侵袭鼻黏膜刺激多种免疫炎症、细胞因子(尤其是Th2淋巴细胞来源,如IL-4)产生,激活表皮生长因子受体(EGFR)、丝裂原活化蛋白激酶(MAPK)、NF-κB等信号通路,导致鼻黏膜纤毛细胞产生黏蛋白且纤毛逐渐脱落,逐渐化生为能产生黏蛋白的杯状细胞[17]。AR患者鼻黏膜杯状细胞明显增生[18],而杯状细胞的数量、分泌活性与黏液分泌量关系紧密[19],其产生的过量黏液是鼻腔水液代谢失衡的重要表现,故本研究通过观察AR大鼠鼻黏膜杯状细胞来反映YPF+干预AR高分泌状态的效果。本研究发现,与空白组相比,模型组上皮内见杯状细胞肥大、密集分布、化生明显且分泌旺盛,杯状细胞计数显著增加(P<0.05);与模型组对比,YPF+组上皮杯状细胞肥大、化生明显减轻,杯状细胞计数显著降低(P<0.05),提示YPF+可抑制杯状细胞增生而减少黏液分泌。
AQP5是大量分布于鼻黏膜中介导水液运输的主要跨膜蛋白[20],主要参与调控机体水液转运平衡及腺体分泌,在过敏性炎症期间发挥关键的限速屏障作用[21]。AR发生时,AQP5的表达可能受NF-κB[22]和cAMP-PKA/CREB[23]等途径以及细胞因子(如IL-13、TNF-α)[24]的影响而下调,导致水液转运失代偿引起腺体分泌增多而表现为流涕;采用药物治疗后[25-26],大鼠鼻黏膜AQP5表达上调,鼻分泌物量明显减少,鼻腔局部水液平衡得到改善。YPF+组方中的多味药已经证实可发挥调节AQP5的作用,如黄芪多糖可通过上调AQP5的表达促进水的吸收,减轻组织水肿[27];防风中的防风石油醚部位可调节大鼠颌下腺组织中AQP5而发挥抑制腺体分泌的作用[28];白术燥湿利水功效可能与其水洗组分和醇洗调节AQPs有关[29]。本研究通过检测各组大鼠鼻黏膜AQP5蛋白水平来反映YPF+干预AR大鼠鼻腔水液代谢失衡的状态。本研究中,与模型组对比,YPF+组大鼠鼻黏膜AQP5在鼻黏膜上皮细胞、腺体等部位表达的荧光标记重现,蛋白表达水平显著升高(P<0.05),提示YPF+可上调AQP5的表达来调控鼻黏膜腺体的分泌。
综上所述,本研究初步探索出YPF+改善AR流涕的作用机制可能与抑制AR大鼠鼻黏膜杯状细胞增生及上调AQP5的表达相关,同时为YPF+治疗临床中以流涕为主症的AR患者提供实验证据支持,后续将以AQP5为靶点对YPF+调节鼻腔水液代谢的具体作用机制进行探索。
参考文献
[1]顾瑜蓉,李华斌.中国变应性鼻炎诊断和治疗指南(2022年,修订版)解读 [J]. 中国眼耳鼻喉科杂志,2022,22(2):209-211.
[2]LIU Y,LIU Z. Epidemiology,Prevention and Clinical Treatment of Allergic Rhinitis: More Understanding, Better Patient Care[J]. J Clin Med, 2022,11(20):6062.
[3]KEITH PK,DESROSIERS M,LAISTER T,et al. The burden of allergic rhinitis (AR) in Canada: perspectives of physicians and patients[J]. Allergy Asthma Clin Immunol, 2012,8(1):7.
[4]WONG Q Y A,LIM J J,NG J Y,et al. Allergic rhinitis in Chinese young adults from the Singapore/Malaysia cross-sectional genetics epidemiology study (SMCGES)cohort:Prevalence,patterns,and epidemiology of allergic rhinitis[J]. World Allergy Organ J,2022,15(10):100704.
[5]KAISER H B,FINDLAY S R,GEORGITIS J W,et al. The anticholinergic agent,ipratropium bromide,is useful in the treatment of rhinorrhea associated with perennial allergic rhinit-is[J]. Allergy Asthma Proc,1998,19(1):23-29.
[6]郭志强,赵仁伍,章如新,等.PM 2.5对变应性鼻炎模型鼻黏膜黏液分泌功能及超微结构的影响[J].临床耳鼻咽喉头颈外科杂志,2018,32(21):1632-1635, 1640.
[7]刘书芹,李桂华,赵娜,等.黄连解毒汤对变应性鼻炎大鼠TLR4/NF-κB信号通路及黏膜杯状细胞的影响[J].中国病理生理杂志,2021,37(1):140-145.
[8]WU N,ZHANG X L,HOU Y,et al.Effect of methyl eugenol on nasal mucosal aquaporin 5 in rats with allergic rhinitis[J]. Beijing Da Xue Xue Bao Yi Xue Ban,2019,51(6):1036-1041.
[9]HUANG Y,YAN S,SU Z,et al. Aquaporins: A new target for traditional Chinese medicine in the treatment of digestive system diseases[J].Front Pharmacol,2022 (13):1069310.
[10]冯小聪,黄唯,周世卿,等.鼻敏方通过NF-κB信号通路对肺脾气虚变应性鼻炎大鼠鼻黏膜水通道蛋白5的影响[J].中国实验方剂学杂志,2020,26(8):81-88.
[11]李茜. 基于“肺心同治”法治疗鼻鼽(变应性鼻炎)气虚血瘀证患者的安慰剂平行对照临床疗效观察[D]. 成都:成都中医药大学,2020.
[12]中华人民共和国科学技术部.关于善待实验动物的指导性意见[EB/OL].[2006-09-30].https://www.most.gov.cn/xxgk/xinxifenlei/fdzdgknr/fgzc/gfxwj/gfxwj2010before/201712/t20171222_137025.html.
[13]赵秀杰,董震,杨占泉,等.鼻超敏反应实验模型的建立[J].中华耳鼻咽喉科杂志,1993,28(1):17-18.
[14]吉晓滨,杜洪,臧林泉,等.豚鼠变应性鼻炎模型鼻黏膜的病理改变[J].山东大学耳鼻喉眼学报,2007(4):312.
[15]SHIMIZU S,HATTORI R,MAJIMA Y,et al. Th2 cytokine inhibitor suplatast tosilate inhibits antigen-induced mucus hypersecretion in the nasal epithelium of sensitized rats[J]. Ann Otol Rhinol Laryngol,2009 ,118(1):67-72.
[16]祝婉婷,余文婷,高培,等.变应性鼻炎局部炎症客观指标初探[J].临床耳鼻咽喉头颈外科杂志,2021,35(4):306-311, 315.
[17]雷霏,董震.鼻黏液与鼻部炎症[J].中华耳鼻咽喉头颈外科杂志,2007,42(9):707-710.
[18]孙柳,焦沃尔,孔勇刚,等.GATA3~+Treg细胞在变应性鼻炎中的表达及意义[J].南方医科大学学报,2023,43(2):280-286.
[19]BOUCHERAT O,BOCZKOWSKI J,JEANNOTTE L,et al. Cellular and molecular mechanisms of goblet cell metaplasia in the respiratory airways[J].Exp Lung Res,2013,39(4-5):207-16.
[20]朱建国,赵小冬,雷菲,等.水通道蛋白亚型1~5在人鼻黏膜中定位及意义[J].中国老年学杂志,2009,29(2):226-228.
[21]ARAUJO M V T,SPADELLA M A,CHIES A B,et al. Effect of low radiation dose on the expression and location of aquaporins in rat submandibular gland[J]. Tissue Cell,2018(53):104-110.
[22]WANG W,ZHENG M. Nuclear factor kappa B pathway down-regulates aquaporin 5 in the nasal mucosa of rats with allergic rhinitis[J].Eur Arch Otorhinolaryngol,2011,268(1):73-81.
[23]WOO J,CHAE Y K,JANG S J,et al. Membrane trafficking of AQP5 and cAMP dependent phosphorylation in bronchial epithelium[J].Biochem Biophys Res Commun,2008,366(2):321-7.
[24]武楠,张秀丽,候赟,等.甲基丁香酚对变应性鼻炎大鼠鼻黏膜水通道蛋白5的影响[J].北京大学学报(医学版),2019,51(6):1036-1041.
[25]沈明,黄小强.苍耳子散对变应性鼻炎小鼠炎症及AQP5蛋白表达的影响[J].中国民族民间医药,2021,30(21):19-24.
[26]CHANG Y L,LIN C S,WANG H W,et al.Chlorpheniramine attenuates histamine-mediated aquaporin 5 downregulation in human nasal epithelial cells via suppression of NF-κB activation[J]. Int J Med Sci,2017,14(12):1268-1275.
[27]吕琴,赵文晓,孔祥琳,等.黄芪利水功效药理机制研究进展[J].中成药,2021,43(3):729-732.
[28]梁瑞峰,李兵杰,葛文静,等.防风不同提取部位的燥性差异及其对胶原诱导性关节炎大鼠滑膜水通道蛋白的影响[J].中草药,2021,52(11):3312-3320.
[29]陈静,李斌,孙云超,等.白术对脾虚水湿内停大鼠的利水药效物质研究[J].辽宁中医杂志,2016,43(10):2210-2213.
(收稿日期:2023-08-06 编辑:陶希睿)
基金项目:省级财政中医药发展专项补助资金川派耳鼻喉中医学术传承中心(No.2100601)。
作者简介:刘玉崟(1998—),女,汉族,硕士研究生在读,研究方向为中医药防治变态反应性耳鼻咽喉疾病。E-mail:782859970@qq.com
作者简介:田理(1963—),女,汉族,教授,主任医师,研究方向为中医药防治变态反应性耳鼻咽喉疾病。E-mail:ctcmdan@stu.cdutcm.edu.cn

