福建猕猴桃细菌性枯萎病的病原菌鉴定
季梦婷 陈长江 罗流河 林志坚 詹梦琳 杨丙烨 胡方平 蔡学清

摘要:为明确近年来在福建省宁德市蕉城区石后乡猕猴桃苗圃新发生的一种细菌性病害病的原菌,并进一步探讨其发生流行规律,采用稀释分离法对采集病株进行病原菌的分离和纯化,对获得的细菌菌株进行致病性测定,通过柯赫氏法则验证、常规的细菌生物学特性、生理生化反应、Biolog 鉴定、16S rDNA和内切葡聚糖酶基因(egl)序列分析对病原菌进行分类鉴定。结果表明,从发病猕猴桃病株上获得9株细菌菌株,将其接种在健康的猕猴桃植株后,其发病症状与田间自然发病症状基本一致,且从接种后病株的茎秆和根部又重新分离到与原菌落形态相同的细菌。柯赫氏法则证实这9株细菌菌株为猕猴桃细菌性枯萎病的致病菌。这9株菌株在NA培养基上的菌落形态一致,均呈不规则型、扁平,并逐渐向四周扩散,不产生粘稠状物质,不会使培养基变色;在TTC培养基上,菌落颜色呈暗红色,产生可扩散至培养基中的红褐色色素,其流动性较差;在YDC培养基上,菌落呈乳白色。经综合分析,这9株细菌菌株均被鉴定为假茄科雷尔氏菌(Ralstonia pseudosolanacearum),生化型Ⅲ和演化型Ⅰ(亚洲组),序列变种14。这是首例青枯菌侵染猕猴桃的报道。以上研究结果为制定猕猴桃细菌性枯萎病精准有效的综合防控提供了理论依据。
关键词:猕猴桃;细菌性枯萎病;病原菌鉴定;生理生化测定;假茄科雷尔氏菌;16S rDNA
doi:10.13304/j.nykjdb.2022.1058
中图分类号:S663.4;S436.634.1 文献标志码:A 文章编号:10080864(2024)04014409
猕猴桃(Actinidia)含有丰富的维生素C、矿物质及膳食纤维,营养价值高,被誉为“水果之王”。中国是猕猴桃原产地和主要生产国之一,近年来,猕猴桃产业发展迅速,种植面积逐年增加,猕猴桃病害的种类也逐渐增加。据报道,猕猴桃病害有40多种,主要有:细菌病害,如猕猴桃细菌性溃疡病(Pseudomonas syringae pv. actinidiae)、猕猴桃根癌病(Agrobacterium tumefaciens)、猕猴桃花腐病(P.viridiflava);真菌病害,如猕猴桃褐斑病(Alternariatenuissima)、猕猴桃软腐病(Botryosphaeriadothidea)、猕猴桃灰霉病(Botrytis cinerea)、猕猴桃黑斑病(A. alternata)等[1];病毒病害,约有15种,如柑橘叶斑驳病毒(Citrus leaf blotch virus)[2];以及营养缺乏[3]和药害[4]等非侵染性病害。
假茄科雷尔氏菌Ralstonia pesudosolanacearum又名茄雷尔氏菌(R. solanacearum),由其引起的作物细菌性枯萎病是一种毁灭性的土传病害,病菌具有丰富的寄主多样性,可侵染45科540多种的寄主植物,包括一年生或多年生的草本、藤本或木本植物,如番茄、马铃薯、烟草、辣椒、茄子、花生、生姜、芝麻、甘薯、桉树、桑树、星油藤和玫瑰等[5-8]。该病菌为土壤习居菌,且近年来随着土壤复种指数的增加以及全球气候变暖,其病害发生面积不断增加,且有由南向北扩展的趋势。作物细菌性枯萎病在一般年份的发病率为10%~20%,严重年份可达50%~80%,甚至绝收,严重威胁农业生产[9]。近年来,在福建省宁德市蕉城区石后乡猕猴桃苗圃发现一种新的病害,发病初期植株叶片出现萎蔫,后整株全部枯死,茎部维管束出现黑褐色病斑;镜检发病组织有明显的喷菌现象,说明该病害由细菌引起,但目前尚未见引起猕猴桃细菌性枯萎病病因的相关研究报道。因此,本研究对该病害的病原菌进行分离,通过常规的细菌学方法及分子生物学技术进行鉴定,明确该病害的病原菌及其分类地位,以便对该病害采取有效的预防及防控措施。
1 材料与方法
1.1 供试材料及菌株
1.1.1 供试菌株
供试9株(MHRS1~MHRS9)细菌菌株均从福建省宁德市蕉城区石后乡发病的猕猴桃植株上分离纯化后保存,对照菌株番茄青枯病菌(R. pesudosolanacearum )FQRS1、甘薯青枯病菌(R. pesudosolanacearum) GSRS1 由本实验室分离鉴定保存。
1.1.2 供试植物
供试猕猴桃树品种为‘中华猕猴桃,由安发(福建)生物有限公司提供;供试番茄苗品种为‘新中蔬四号。
1.2 试验方法
1.2.1 病原菌的分离、纯化
参照方中达[10]的方法分离、纯化病原菌。用灭菌解剖刀切取病健交界部组织,经无菌水冲洗后置于灭菌的培养皿内,加少量无菌水捣烂;然后用接种环蘸取该组织浸出液在NA培养基平板上划线,置于恒温培养箱28 ℃培养48 h,挑取单菌落;按常规方法纯化,纯化后的菌株保存在-75 ℃低温冰箱中。
1.2.2 致病性测定
将分离获得的菌株在NB(nutrient broth)培养基中振荡(28 ℃、180 r·min-1)培养24~36 h,将培养好的菌液调至108 CFU·mL-1(OD600=0.8)备用。
针刺接种:用无菌的大头针蘸取准备好的菌悬液针刺接种到健康的猕猴桃苗茎秆,3次重复。
伤根接种:用无菌的小刀将猕猴桃两侧根系切断,每株浇灌50 mL准备好的菌液,3次重复。
以接种无菌水为对照。保湿48 h,观察发病情况,然后将发病的植株进行细菌的再分离。
1.2.3 细菌的形态观察、培养性状和生理生化测定
供试菌株的培养性状、形态特征观察参照东秀珠等[11]方法;淀粉水解、明胶液化、果胶酶水解、果聚糖、H2S试验、精氨酸水解、氧化酶试验、聚-β-羟基丁酸酯(poly-β-hydroxybutyrate,PHB)的积累、水解七叶灵、KB 培养基产荧光现象、YDC(yeastextract dextrose calcium carbonate)培养基生长情况、硝酸盐还原、耐盐性、生长温度、石蕊牛乳、吲哚反应、3% KOH等测定参照赵廷昌[12]的方法进行。
1.2.4 Biolog 测定
采用Gen Ⅲ Microstationbiolog自动微生物鉴定系统进行Biolog鉴定。
1.2.5 青枯菌特异性引物扩增鉴定、生化型及演化型测定
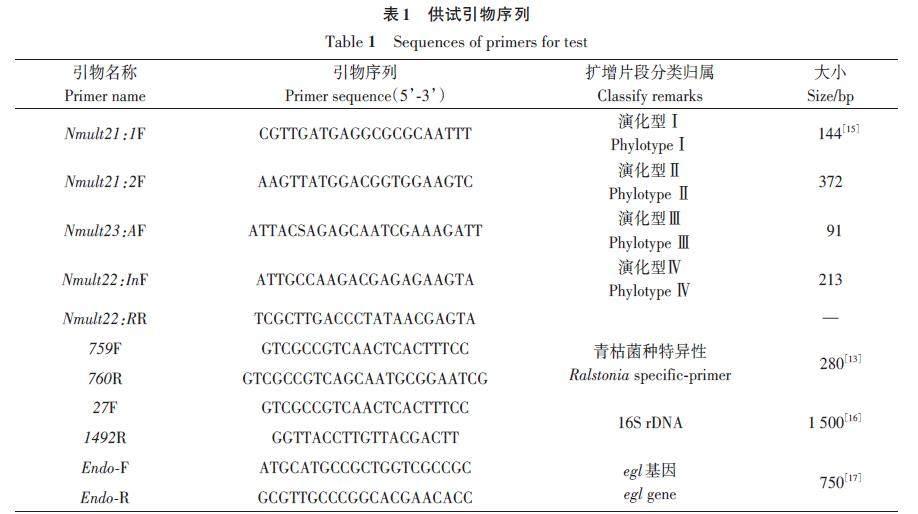
参照Opina等[13]方法采用青枯菌特异性引物(表1)对分离菌株进行扩增鉴定;参照Huang等[14]方法测定菌株对3种双糖(麦芽糖、乳糖、纤维二糖)和3种己醇(甘露醇、甜醇、山梨醇)的利用情况;参照Fegan等[15]的方法测定菌株的演化型。
1.2.6 16S rDNA基因和egl 基因鉴定
采用通用引物27F/1492R(表1)扩增16Sr DNA 和引物Endo-F/Endo-R扩增egl 基因,通过1%琼脂糖凝胶电泳验证后送上海生工生物工程公司测序,将所得序列输入NCBI数据库,并利用BLAST 软件进行比对分析,用MEGA 7.0 软件进行系统发育分析,采用邻接法(neighbor-joining method,NJ)构建系统发育树,自举分析为1 000次重复抽样检验得到的自举置信度。从GenBank 选取已确定序列变种归属的参考菌株序列作为参考,以确定供试菌株在系统发育树中的位置。
2 结果与分析
2.1 病害症状
猕猴桃细菌性枯萎病主要危害植株根部和茎秆。发病初期,植株上部或中部叶片的叶尖、叶缘处卷曲萎蔫,早晚恢复,后变褐干枯或扩展至全叶,靠近病叶部分的叶柄缢缩,或全株叶片同时出现失水凋萎,但仍保持绿色,呈青枯状(图1A);病茎表皮开裂(图1B),容易脱落,剖开根茎部皮层时,可见维管束褐变,发病后期植株死亡。横剖病茎或病根,切口处用手挤压,可见乳白色菌液溢出。切小块病部组织进行显微镜观察,可见大量细菌溢流从患病薄壁组织涌出。
2.2 病原菌的致病性测定
从福建省宁德市蕉城区石后乡发病的猕猴桃病株上分离纯化到9株细菌菌株,将其分别命名为MHRS1~MHRS9。致病性测定结果(图2)表明,供试菌株和对照菌株(番茄青枯菌)接种猕猴桃后均能发病,接种后的发病症状与田间自然发病症状相同。针刺接种后3 d,接种部位变褐色,后逐渐扩展,后期表皮开裂,维管束变色,接种部位上部新叶叶缘卷曲、焦枯,后期脱落,与田间症状基本一致。伤根接种后14 d,叶片边缘发黄变色,叶缘卷曲,叶柄处溢缩,植株青枯萎蔫,后期叶片干枯脱落,病害症状发展快;接种后21 d,植株开始死亡,与田间发病症状基本一致。从发病植株上再次分离得到与接种菌落形态一致的菌株,经再接种,这9株菌株均为该病的病原菌,且各菌株间的致病性无明显差异。另外,将这9株菌株伤根接种番茄后14 d,番茄出现萎蔫症状,与用番茄青枯菌灌根接种后番茄表现出的症状一致,发病的时间也相同。说明从猕猴桃病株上分离菌株的致病性与番茄青枯菌没有差异,而且能够侵染番茄。
2.3 病原细菌鉴定
2.3.1 培养性状
由图3可知,供试菌株在NA培养基上的菌落形态呈不规则型、扁平,并逐渐向四周扩散,不产生粘稠状物质,不会使培养基变色;在KB培养基平板上,菌落不会向四周扩散,流动性较差;在TTC培养基上,菌落颜色呈暗红色,产生的红褐色色素可扩散至培养基中,菌落表面较干燥,流动性差;在YDC培养基上,菌落呈白色,较为干燥,流动性差;而番茄青枯菌(FQRS1)在YDC培养基上菌落呈乳白色,湿润,流动性强,会向周围扩散。
2.3.2 细菌的形态特征
供试菌株的菌体呈短杆状,两端圆,大小为(0.40~0.90) μm×(1.10~2.80) μm,革兰氏染色反应阴性,极生1~2根鞭毛(图4)。
2.3.3 生理生化性状
生理生化测定结果(表2)表明,与对照菌株番茄青枯菌和甘薯青枯菌相同,供试菌株能积累聚-β-羟基丁酸盐(PHB),在40 ℃能生长,耐盐性为1.5%,果胶酶反应呈阳性,能还原硝酸盐并产生气体,3% KOH反应呈阳性,不产生吲哚,不能水解七叶灵和精氨酸,在YDC培养基上菌落呈白色,在KB培养基上生长后置260 nm紫外灯下无黄绿色荧光;与对照菌株番茄青枯菌和甘薯青枯菌不同,供试菌株氧化酶和H2S反应为阳性,不能使明胶液化,果聚糖反应为阴性。
2.3.4 Biolog 鉴定
由于9株供试菌株的17项生理生化指标的测试结果均表现一致,因此,随机挑选MHRS3和MHRS8这2株菌株进行71种碳源利用及23 种化学敏感性测试,经培育24 h 后,Microlog 软件读数结果(表3)显示,菌株 MHRS3和MHRS8与数据库中R. pseudosolanacearum 的相似度最高,为0.697。
2.3.5 青枯菌生化型和演化型测定结果
由表4可知,与对照番茄青枯菌和甘薯青枯菌一致,供试菌株能利用乳糖、麦芽糖、纤维二糖3种双糖和甘露醇、山梨醇和甜醇3种己醇。根据青枯菌生化型划分标准[18]将供试菌株鉴定为青枯菌生化型Ⅲ(表4)。根据青枯菌演化型分类体系,用青枯菌演化型复合引物进行PCR扩增,电泳结果(图5)显示,扩增得到2条条带;一条片段大小为280 bp;另一条片段大小为144 bp。其中,片段大小为280 bp的条带为青枯菌特异性扩增条带;片段大小为144 bp 的为演化型Ⅰ的特异性扩增条带。参照演化型划分标准[10]将供试菌株鉴定为演化型Ⅰ。
2.3.6 16S rDNA基因扩增
用16S rDNA的通用引物27F/1492R扩增后测序,测序结果通过NCBI在线比对,供试菌株的16S rDNA序列与假茄科雷尔氏菌(R. pseudosolanacearum)同源性最高,为99%;以大肠埃希氏菌(Escherichia coli)为外群(outgroup),构建系统发育树,结果(图6)显示,供试菌株与R. pseudosolanacearum 聚在一支,属于新分类命名的假茄科雷尔氏菌。
2.3.7 基于egl 基因的系统发育分析
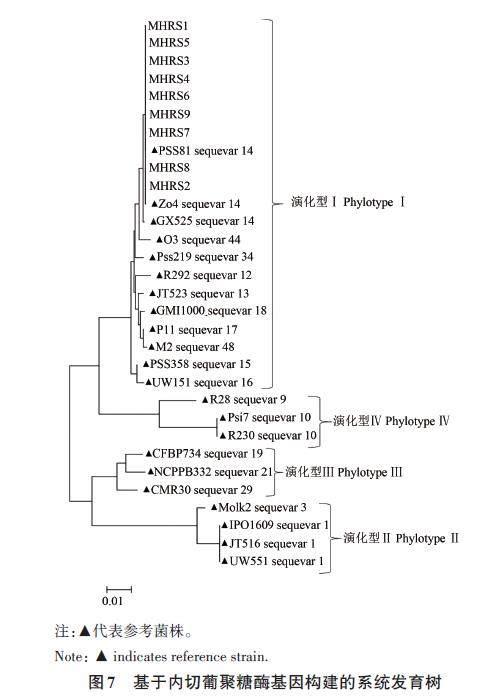
对9株供试菌株的egl 基因进行PCR后测序,将测序结果进行在线比对,采用已知序列变种的标准菌株序列作为参照,结果(图7)显示,9株供试菌株均属于演化型Ⅰ下的1个序列变种,即序列变种14。
3 讨论
本研究通过对福建省宁德猕猴桃苗圃细菌性枯萎病株病原菌的分离、致病性测定、生物学特征、生理生化和Biolog 测定、青枯菌特异性引物PCR 扩增、青枯菌生化型和演化型测定以及16S rDNA基因序列分析,根据Hayward [18]对青枯菌生化型的划分依据、Fegan等[15,17]对青枯菌演化型的分类依据和Safni等[19]提出的青枯菌新分类法,将宁德猕猴桃细菌性枯萎病的病原菌鉴定为茄假雷尔氏菌的生化型Ⅱ、演化型Ⅰ、序列变种14。这是第一次发现由茄假雷尔氏菌可自然侵染猕猴桃并引起枯萎病。
Hayward[18]提出了青枯菌生化型的划分标准,并将其生化型划分为生化型Ⅰ、生化型Ⅱ、生化型Ⅲ、生化型Ⅳ和生化型Ⅴ。研究显示,青枯菌生化型Ⅲ为侵染我国番茄[2021]、辣椒[21]、烟草[21]、笋瓜[22]、星油藤[7]、仙草[23]等作物的优势群体。本研究表明,供试菌株与对照番茄青枯菌和甘薯青枯菌一致,均可利用3种双糖和3种己醇;同时依据青枯菌生化型的划分标准,供试菌株属于青枯菌生化型Ⅲ,与已有报道的生化型Ⅲ为我国作物青枯菌优势群体的研究结果一致[7,20-23]。与番茄青枯菌和甘薯青枯菌不同,供试菌株的H2S反应呈阳性、果聚糖反应呈阴性;且供试菌株在TTC和YDC培养基上的菌落特征也与番茄青枯菌和甘薯青枯菌有所不同,是否与其寄主植物及来源地理位置不同有关这有待于进一步研究。
Fegan等[15]提出了以演化型分类框架来描述青枯菌种内的差异,将已报道的青枯菌划分为演化型Ⅰ、演化型Ⅱ、演化型Ⅲ和演化型Ⅳ 4个类型,其中,演化型I包含了所有来自亚洲的生化型Ⅲ、生化型Ⅳ和生化型Ⅴ。按此分类依据对我国侵染番茄[2021]、辣椒、茄子、马铃薯和姜[21]、笋瓜[22]、花生[21,24]、桑[21,25]、烟草[21,26]、星油藤[7]等作物的青枯病菌R. pseudosolanacearum 进行演化型分析,结果显示是以演化型Ⅰ为主。本研究对福建省宁德市蕉城区石后乡引起猕猴桃细菌性枯萎病的病菌进行鉴定,也是演化型Ⅰ(亚洲组),与前人研究结果一致。
根据其内切葡聚糖酶(endoglucanase)基因egl 序列,可以将每个演化型分为不同的序列变种,目前已经鉴定出的序列变种有59 个[20-22,27]。Xu等[21]对我国13省、17种寄主植物上的286个青枯菌以及潘哲超等[26]对福建、贵州及广西的62个烟草青枯病菌株进行了演化型及序列变种鉴定,结果表明,我国青枯菌属于演化型Ⅰ的 10个序列变种及演化型Ⅱ的 1 个序列变种,其中福建的演化型Ⅰ鉴定出 7个序列变种(变种14、15、16、17、18、34、44)。本研究显示,基于egl 基因分析,供试病原菌属于茄科雷尔氏菌演化型Ⅰ下的序列变种14。然而,猕猴桃细菌性枯萎病菌是否还存在其他演化型或其他序列变种需要广泛收集福建省不同地区的病菌进行测定和分析。
猕猴桃细菌性枯萎病主要发生在福建省宁德市蕉城区石后乡的猕猴桃苗圃,田间发病率约6%~10%。据报道,作物青枯病具有潜伏侵染现象,即植株受到病菌侵染但不表现出枯萎症状[28]。因此,一旦苗圃出现病株,病菌可随苗木调运进行远距离传播和扩散,造成病害的流行。再者,青枯菌是一种土壤习居菌,即使没有适当寄主,病菌在土壤中也可存活1年以上,因此,该病害一旦发生很难防治。本研究明确了猕猴桃是青枯菌的寄主之一,为该病害的流行及防控提供了重要的理论依据。
参考文献
[1] 肖蓉,石浩,卜范文,等.猕猴桃病害防治研究进展[J].湖南农业科学,2021(8):116-120.
XIAO R, SHI H, BU F W, et al .. Research progress of kiwifruitdisease control [J]. Hunan Agric. Sci., 2021(8):116-120.
[2] 王然,周丹,罗静,等.猕猴桃病毒病研究进展[J].果树学报,2017,34(8):1043-1050.
WANG R, ZHOU D, LUO J, et al .. Progress report on virusesof kiwifruit [J]. J. Fruit Sci., 2017, 34(8):1043-1050.
[3] 杨莉莉. 不同肥料对猕猴桃产量、品质及果园养分的影响[D].杨凌:西北农林科技大学,2016.
YANG L L. Effect of different fertilizer application on kiwifruityield, quality and the orchard nutrient [D]. Yangling:Northwest A&F University, 2016.
[4] 庄启国,李明章,王丽华,等.冬施矿物油对红阳猕猴桃桑白蚧防效及药害[J].农药,2011,50(2):146-149.
ZHUANG Q G, LI M Z, WANG L H, et al .. Control effect andphytotoxicity investigations of mineral oil to Hongyangkiwifruit in winter for the white peach scale [J]. Agrochemicals,2011, 50(2):146-149.
[5] 佘小漫,何自福. 作物青枯病研究进展[J]. 广东农业科学,2020,47(12):82-89.
SHE X M, HE Z F. Advances in studies on crop bacterial wiltcaused by Ralstonia solanacearum [J]. Guangdong Agric. Sci.,2020, 47(12):82-89.
[6] JIANG G F, WEI Z, XU J, et al .. Bacterial wilt in China:history, current status, and future perspectives [J/OL]. Front.Plant Sci., 2017, 8:1549 [2022-11-02]. https://doi.org/10.3389/fpls.2017.01549.
[7] 王国芬,李超萍,杨腊英,等.星油藤青枯病病原菌鉴定[J].植物病理学报,2019,49(5):602-611.
WANG G F, LI C P, YANG L Y, et al .. Pathogen identificationof Sacha inchi (Plukenetia volubilis L.) bacterial wilt [J]. ActaPhytopathol. Sin., 2019, 49(5):602-611.
[8] LEE I, KIM Y S, KIM J W, et al .. Genetic and pathogeniccharacterization of bacterial wilt pathogen, Ralstoniapseudosolanacearum (Ralstonia solanacearum Phylotype I), onroses in Korea [J]. Plant Pathol. J., 2020, 36(5):440-449.
[9] HAYWARD A C. Biology and epidemiology of bacterialwilt caused by Pseudomonas solanacearum [J]. Annu. Rev.Phytopathol., 1991, 29(1):65-87.
[10] 方中达. 植病研究方法[M]. 北京:中国农业出版社,1998:179-181.
FANG Z D. Plant Disease Research Methodology [M]. Beijing:China Agriculture Press, 1998:179-181.
[11] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社, 2001:353-398.
DONG X Z, CAI M Y. Manual for System Identification ofCommon Bacteria [M]. Beijing: Science Press, 2001:353-398.
[12] 赵延昌. 植物病原细菌鉴定实验指导[M].第三版.中国农业科学技术出版社, 2011:113-121.
ZHAO Y C. Laboratory Guide for Identification of PlantPathogenic Bacteria [M]. 3th edn. Beijing: China AgriculturalScience and Technology Press, 2011:113-121.
[13] OPINA N, TAVNER F, HOLLWAY G, et al .. A novel methodfor development of species and strain-specific DNA probes andPCR primers for identifying Burkholderia solanacearum(formerly Pseudomonas solanacearum) [J]. Asia-Pac. J. Mol.Bio. Biotech., 1997, 5:19-30
[14] HUANG Q, YAN X R, WANG J F. Improved biovar test forRalstonia solanacearum [J]. J. Microbiol. Meth., 2012, 88(2):271-274.
[15] FEGAN M, PRIOR P. How complex is the “Ralstoniasolanacearum species complex” [M]// Bacterial Wilt Diseaseand the Ralstonia Solanacearum Species Complex. ASP Press,2005:449-461.
[16] LANE D J. 16S/23S rRNA Sequencing. In: Stackebrandt E,Goodfellow M, editors. Nucleic Acid Techniques in BacterialSystematics [M]. New York: Wiley, 1991:115-175.
[17] FEGAN M, PRIOR P. Diverse members of the Ralstoniasolanacearum species complex cause bacterial wilts of banana [J].Australas. Plant Pathol., 2006, 35, 93-101.
[18] HAYWARD A C. Characteristics of Pseudomonassolanacearum [J]. J. Appl. Microbiol., 1964, 27 (2):265-277.
[19] SAFNI I, CLEENWERCK I, DE V P, et al .. Polyphasictaxonomic revision of the Ralstonia solanacearum speciescomplex: proposal to emend the descriptions of Ralstoniasolanacearum and Ralstonia syzygii and reclassify current R.syzygii strains as Ralstonia syzygii subsp. syzygii subsp.nov., R.solanacearum phylotype Ⅳ strains as Ralstonia syzygii subsp.indonesiensis subsp. nov., banana blood disease bacteriumstrains as Ralstonia syzygii subsp. celebesensis subsp. nov. andR. solanacearum phylotype Ⅰ and Ⅲ strains as Ralstoniapseudosolanacearum sp. nov.[J]. Int. J. Syst. Evol. Microbiol.,2014, 64(9):3087-3103.
[20] 陈媛媛. 广西植物青枯病菌的演化型和序列变种及葫芦科植物青枯病菌的特性[D].南宁:广西大学, 2018.
CHEN Y Y. The phylotype and sequevar of Ralstoniasolanacearum and characteristics of bacterial wilt pathogenisolated from Cucurbitaceae plants in Guangxi [D]. Nanning:Guangxi University, 2018.
[21] XU J, PAN Z C, PRIOR P, et al .. Genetic diversity of Ralstoniasolanacearum strains from China [J]. Eur. J. Plant Pathol.,2009, 125(4):641-653.
[22] SHE X M, YU L, LAN G B, et al.. Identification and geneticcharacterization of Ralstonia solanacearum species complexisolates from Cucurbita maxima in China [J/OL]. Front. Plant Sci.,2017, 8:1794 [2017-10-01]. https://doi:10.3389/fpls. 2017.01794.
[23] 吴水良,林可竟,张一帆,等.福建仙草细菌性枯萎病的病原菌鉴定[J].亚热带农业研究,2022,18(4):267-273.
WU S L, LIN K J, ZHANG Y F, et al .. Identification of anetiological bacterium causing grass jelly wilt in Fujian [J].Subtrop. Agric. Res., 2022, 18(4):267-273.
[24] 康彦平,雷永,万丽云,等.我国长江流域和南方地区花生青枯菌遗传多样性分析[J].植物保护学报,2019,46(2): 291-297.
KANG Y P,LEI Y,WAN L Y, et al .. Study on genetic diversityof bacterium Ralstonia solanacearum in peanut in YangtzeRiver Valley and southern China [J]. J. Plant Protect., 2019,46(2):291-297.
[25] 娄德钊,武华周,卢芙萍,等.海南桑树青枯病病原菌鉴定及其分子鉴定[J].热带作物学报,2021,42(11):3261-3268.
LOU D Z, WU H Z, LU F P, et al .. Pathogen and molecularidentification of mubbery (Morus alba L.) bacterial wilt inHainan [J]. Chin. J. Tropical Crops, 2021, 42(11):3261-3268.
[26] 潘哲超,徐进,顾钢,等.福建及贵州等地烟草青枯菌系统发育分析[J].植物保护,2012,38(1):18-23, 43.
PAN Z C, XU J, GU G, et al .. Phylogeny of tobacco Ralstoniasolanacearium strains from Fujian and Guizhou provinces [J].Pant Protect., 2012, 38(1):18-23, 43.
[27] LIU Y, WU D S, LIU Q P, et al .. The sequevar distribution ofRalstonia solanacearum in tobacco growing zones of China isstructured by elevation [J]. Eur. J. Plant Pathol., 2017, 147,541-551.
[28] CHEN Y J, LIN Y S, TSENG K J, et al .. Vine cuttings aspossible initial inoculum sources of Ralstonia solanacearumrace 1 biovar 4 on vegetable sweet potato in fields [J]. Eur. J.Plant Pathol., 2014, 140: 83-95.
(责任编辑:张冬玲)
基金项目:福建省引导性项目(2022N0004);安发(福建)生物有限公司项目(YCHX00011)。

