上海地方猪种抗腹泻基因与免疫相关因子分析
周金勇 孙玲伟 张克勤 戴建军 张德福 王振国 主性 吴彩凤
摘要:为鉴定上海地方猪种上海白猪、枫泾猪和沙乌头猪中抗腹泻基因抗原加工相关转运体1(transporterassociatedwith antigen processing 1, TAP1)、α(1, 2)岩藻糖转移酶1[α( 1, 2)-fucosyltransferase 1, FUT1]、天然抗性相关的巨噬细胞蛋白1(natural resistance-associated macrophage protein 1, NRAMP1)、黏蛋白4(mucin 4,MUC4)和黏蛋白13(mucin 13, MUC13)基因的有效遗传标记,为上海地方猪种资源特性提供参考,应用聚合酶链式反应-限制性片段长度多态性(polymerase chain reaction restriction fragment length polymorphism, PCRRFLR)和序列测序分析上述基因的多态性,结合部分免疫相关因子,探讨对3个上海地方猪种免疫力的影响。结果显示,3个猪种中TAP1 和MUC4 基因均具有抗腹泻基因型GG,而仅在枫泾猪和沙乌头猪中检测到MUC13基因抗腹泻基因型GG,在3个猪种中均未检测到FUT1 和NRAMP1 基因抗腹泻基因型AA。上海白猪、枫泾猪和沙乌头猪TAP1 基因处于中度多态,上海白猪的MUC4 基因处于低度多态,枫泾猪和沙乌头猪的MUC4 基因处于中度多态,上海白猪MUC13 基因处于中度多态,其中上海白猪和沙乌头猪的TAP1 基因不满足Hardy-Weinberg平衡,枫泾猪的MUC4 基因不满足Hardy-Weinberg平衡。上海白猪MUC13 基因AA型的白细胞介素12(interleukin-12, IL-12)水平显著高于AG 型,枫泾猪TAP1 基因AA 型的肿瘤坏死因子α(tumor necrosisfactor, TNF-α)指标显著高于GG和AG型,沙乌头猪TAP1 基因AG型的IL-12指标显著高于GG型。以上研究结果对上海白猪、枫泾猪和沙乌头猪的抗腹泻育种和分子选育具有一定指导意义,为今后上海各地方猪种抗腹泻育种工作奠定了基础。
关键词:上海白猪;枫泾猪;沙乌头猪;抗腹泻基因;免疫因子
doi:10.13304/j.nykjdb.2023.0229
中图分类号:S828.2 文献标志码:A 文章编号:10080864(2024)04012816
根据2022年10月国家统计局数据,我国生猪存栏44 394万头,拥有相当高的生猪存栏量,而猪腹泻病常年频发,致死率高,是严重制约我国乃至全世界养猪业发展的一大难题[1]。当前,对猪群的抗腹泻相关基因通过分子育种技术进行其等位基因频率的检测与分析,从而用于指导猪群育种,从育种角度提高猪群整体的抗腹泻能力,进而从根本上解决生猪腹泻病带来的经济损失。
产肠毒素大肠杆菌(enterotoxi-genic escherichiacoli, ETEC)F18的候选基因主要是α (1, 2)岩藻糖转移酶基因1[α (1, 2)-fucosyltransferase1, FUT1]和抗原处理相关转运体基因(transporter-associatedwith antigen processing 1, TAP1)[23]。Meijerink等[4]研究发现,瑞士长白猪FUT1 基因的A 型可抗ETEC F18的感染。Kim等[5]进一步证明,FUT1 基因的AA基因型个体的仔猪存活率几乎是GG个体的2倍。因此,FUT1 基因多态性可用作选择程序的有效标记,以提高断奶后仔猪的存活率。赵乔辉等[6]研究发现,在淮猪、荣昌猪和长白猪等猪种中TAP1 基因的GG型个体有更强的抗ETEC F18感染的能力,可将TAP1 基因作为猪抗腹泻育种的有效遗传标记之一。天然抗性相关的巨噬蛋白1(natural resistance-associated macrophage protein 1,NRAMP1)基因能够影响动物机体的抗病性能,猪NRAMP1 基因AA基因型为抗腹泻优势基因型[7]。刘艳冬等[8]通过观测记录哺乳仔猪的腹泻情况发现,NRAMP1 在各品种猪中表现出丰富的多态性,进一步证明NRAMP1 可作为猪抗病育种候选基因。粘蛋白4(mucin 4, MUC4)和粘蛋白13(mucin 13, MUC13)基因是ETEC F4ab/F4ac 受体的重要候选基因[9-11]。Peng 等[12]研究表明,猪对ETEC F4ab/ac 感染的易感性/抗性与MUC4 基因内含子17中的G243位点A→G突变显著相关,且GG 型是抗腹泻基因型。任军等[13] 也发现,MUC13 基因的rs319 699 771位点上存在G→A突变,GG型为抗腹泻基因型,且通过鉴定该位点突变能够鉴别抗腹泻个体。因此,MUC4 和MUC13基因被视为F4ab/F4ac 受体最有希望的候选基因。
本研究对上海白猪、枫泾猪和沙乌头猪部分抗腹泻基因(TAP1、FUT1、NRAMP1、MUC4 和MUC13)的基因多态性进行筛查,并结合部分血液免疫因子,如免疫球蛋白(immunoglobulin, IgG)、白细胞介素2(interleukin-2, IL-2)、白细胞介素6(interleukin-6, IL-6)、白细胞介素10(interleukin-10, IL-10)、白细胞介素12(interleukin-12, IL-12)、肿瘤坏死因子ɑ(tumor necrosis factor, TNF-ɑ)、干扰素γ(interferon γ, IFN-γ)等,进一步分析上述猪种的抗腹泻能力,以期为提高上述猪种抗腹泻育种工作提供数据支撑。
1 材料与方法
1.1 采样
本研究中使用的动物为90 头后备种公猪(200~300日龄),包括3种中国上海本土猪:上海白猪(30头)、枫泾猪(30头)和沙乌头猪(30头),分别来自上海农系白猪种原种场、上海金山枫泾猪保种场和上海崇明沙乌头农业科技有限公司。试验猪种围栏中单独饲养,每天按照标准饲喂,并随意饮用水,按照《中国猪饲喂标准指南》[14]进行病害控制。每个猪种分别采集血液样本各30份抗凝血用于提取DNA,30份未抗凝血用于测定部分免疫因子。采集的未抗凝血经4 000 r· min-1离心20 min后分离血清,置于-80 ℃冰箱保存。
1.2 DNA 提取
按照血液全基因组DNA提取试剂盒[天根生化科技(北京)有限公司]使用说明书,对猪血液样品进行DNA 提取。利用紫外分光光度计(eppendorf公司)对提取的DNA含量进行测定,选择含量在80~250 μg· μL-1的样品进行后续试验。用1.5% 琼脂糖凝胶电泳检测提取DNA 的质量,统一稀释至50 ng·μL-1,-20 ℃冰箱保存备用。
1.3 聚合酶链式反应-限制性酶切酶段长度多态性分析。
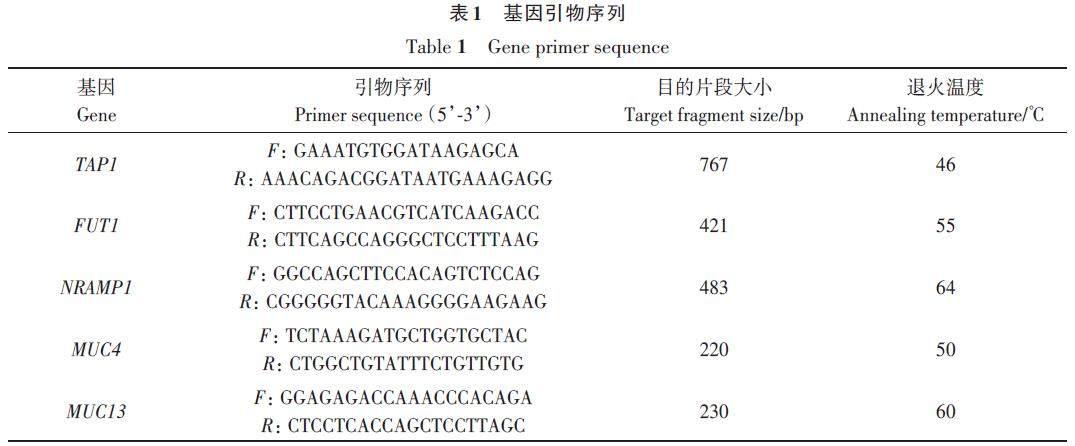
在NCBI 上查找相关序列,使用PrimerPremier 6.0 软件设计FUT1、NRAMP1、TAP1、MUC13 和MUC4 基因的引物(表1),由中国上海生工生物工程有限公司合成。
PCR 反应体系为20 μL,包含template DNA2μL,2× M5 Taq hifi PCR mix 10 μL,primer 1(10 μmol·L-1)0.5 μL,primer 2(10 μmol·L-1)0.5 μL,nuclease-free ddH2O 补充至20 μL。PCR 反应条件:预变性94 ℃ 4 min;94 ℃变性30 s,退火30 s,72 ℃延伸(TAP1 和FUT1 为60 s,循环30 次;NRAMP1 为45 s,循环29 次;MUC4 为15 s,循环34次;MUC13 为45 s,循环35次);72 ℃延伸5 min,并置于4 ℃保存待用(PCR仪购自美国ABI公司)。
TAP1 基因选用MboI [宝如亿(北京)生物技术有限公司]对PCR产物进行消化,酶切反应总体系为10 μL,包括PCR 扩增产物0.4 μL,restrictionenzyme 0.4 μL(10 U·μL-1),10× NE buffer 1 μL,ddH2O 8.2 μL,置37 ℃恒温反应2 h,65 ℃温育20 min后经1.5%的琼脂糖凝胶电泳后分析。
FUT1 与MUC4 基因选用HhaⅠ [宝如亿(北京)生物技术有限公司],NRAMP1 基因选用NdeⅠ[宝如亿(北京)生物技术有限公司]对PCR产物进行消化。酶切反应总体系为10 μL,包括PCR扩增产物1 μL(500 ng· μL-1),RE10× buffer 1 μL,acetylated BSA 0.1 μL(10 μg·μL-1),restrictionenzyme 0.25 μL(10 U·μL-1),ddH2O 7.65 μL,置37 ℃恒温反应2 h,后添加4 μL 6×加载缓冲液经1.5%的琼脂糖凝胶电泳后分析。由于MUC13 无特异性内切酶位点,故不进行酶切。
将上述PCR产物切胶回收纯化后,送至上海生工生物工程技术服务有限公司单向测序,测序结果用DNAstar软件分析。
1.4 血液免疫因子测定
采用ELISA免疫因子检测试剂盒(elabsciencebiotechnology Co., Ltd.)测定样品吸光度,吸光度值用于绘制标准曲线,用于测量以下免疫因子:IgG(DG50 132P-96T)、IL-2(DG50 032P-96T)、IL-6(DG50 031P-96T)、IL-10(DG50 034P-96T)、IL-12(DG50 055P-96T)、TNF- ɑ(DG50 014P-96T)和INF-γ(DG50 141P-96T)[15-17]。所测指标作为上海白猪、枫泾猪和沙乌头猪免疫应答和一般抗病力的评价。按照使用说明具体操作方法如下:首先,从室温平衡20 min后的铝箔袋中取出所需板条,剩余板条用自封袋密封放回4 ℃;设置标准品孔和样本孔,标准品孔各加不同含量的标准品50 μL;样本孔先加待测样本10 μL,再加样本稀释液40 μL;空白孔不加;除空白孔外,标准品孔和样本孔中每孔加入辣根过氧化物酶(horseradishperoxidase, HRP)标记的检测抗体100 μL,用封板膜密封反应孔,37 ℃水浴锅或恒温箱温育60 min;弃去液体,吸水纸上拍干,每孔加满洗涤液,静置1 min,甩去洗涤液,吸水纸上拍干,如此重复洗板5次(也可用洗板机洗板);每孔加入底物A、B各50 μL,37 ℃避光孵育15 min;每孔加入终止液50 μL,15 min内在450 nm波长处测定各孔的OD值。绘制标准曲线:在Excel工作表中,以标准品含量作横坐标,对应OD值作纵坐标,绘制标准品线性回归曲线,按曲线方程计算各样本含量(pg·mL-1)。所有免疫因子指标检测方法相同。
1.5 统计分析
测序结果利用NCBI 系统中BLAST 进行比对,鉴定SNP 位点,根据Hardy-Weinberg 平衡定律,计算基因的基因型频率。采用适合性检验法,进行Hardy-Weinberg 平衡状态、卡方(χ2)独立性检验分析,计算各基因的等位基因和基因型频率。群体内遗传变异和分化的相关参数通过popgene3.1 软件计算获得。采用cervus 3.0 软件计算基因的多态信息含量(polymorphism informationcontent, PIC)、观测杂合度(observed heterozygosity,Ho)和期望杂合度(expected heterozygosity, He);其中PIC≥0.50时为高度多态,0.25≤PlC<0.50时为中度多态,PIC<0.25时为低度多态。各性状值与基因型的关系采用SPSS 14.0软件进行最小二乘分析,其中P<0.05为显著相关。
2 结果与分析
2.1 基因PCR 扩增结果
根据TAP1、FUT1、NRAMP1、MUC4 和MUC13基因的引物对上海白猪、枫泾猪和沙乌头猪提取的DNA 进行扩增,PCR 产物用1.5% 的琼脂糖电泳检测。由图1 可见,TAP1、FUT1、NRAMP1、MUC4 和MUC13 基因在不同猪种中均扩增出清晰的特异性条带,片段大小分别为767、421、483、220和230 bp,与预测的扩增片段大小一致。
2.2 PCR 产物的酶切结果
由图2可知,上海白猪、枫泾猪和沙乌头猪的TAP1 基因PCR产物经限制性内切酶MboⅠ酶切,经过1.5%的琼脂糖凝胶电泳后得到上海白猪有2种不同基因型(AG和GG),枫泾猪和沙乌头猪有3种不同的基因型条带,分别为AA、GG和AG。根据酶切结果,对PCR产物进行测序发现,在测序峰图中部分猪种个体的TAP1 基因有1个G→A的单碱基突变,将该位点未突变呈现单峰的基因型定义为AA型,将该位点突变呈现单峰的基因型定义为GG型,呈现双峰的基因型定义为AG型(图2D)。GG 型个体的序列与NCBI 中AK396698.1的序列一致,定义为野生型,相比之下发现GG 型在第729位置有1个G→A 的单碱基突变,这与酶切结果一致(图2E)。
上述猪种FUT1 基因的PCR产物经限制性内切酶MboⅠ酶切,经1.5%的琼脂糖凝胶电泳后得到3个猪种的FUT1 基因都只有1种基因型条带,为GG表型(241/93/87 bp)(图3)。根据酶切结果对其进行验证,对PCR产物进行测序,对测序峰图分析发现,在测序峰图中所有猪种个体的FUT1 基因都不存在单碱基突变,将该位点未突变呈现单峰的基因型定义为GG型(图3D)。所有猪种GG型个体的序列与NCBI中U70 883.2的序列一致,这与酶切结果一致,没有发现突变的基因位点。
3个猪种NRAMP1 基因第6内含子的PCR产物经限制性内切酶NdeⅠ酶切,经过1.5%的琼脂糖凝胶电泳后得到3个猪种的NRAMP1 基因都只有1种基因型条带,为BB表型(373/110 bp)(图4)。根据酶切结果对其进行验证,对PCR产物进行测序发现,在测序峰图中所有猪种个体的NRAMP1基因都不存在单碱基突变,将该位点未突变呈现单峰的基因型定义为BB型(图4D)。所有猪种个体的序列与NCBI中上AY368 473.1的序列一致,这与酶切结果一致,没有发现突变的基因位点(图4E)。
对上海白猪、枫泾猪的MUC4 基因扩增得到的所有PCR产物进行测序分析,对所得测序峰图(图5)分析发现,部分猪种的MUC4 基因有1个G→A的单碱基突变,将该位点未突变呈现单峰的基因型定义为GG型,将该位点突变呈现单峰的基因型定义为AA型,呈现双峰的基因型定义为AG型(图5B)。对沙乌头猪的MUC4 基因的PCR产物经限制性内切酶HhaⅠ酶切后,经过1.5%的琼脂糖凝胶电泳后都得到了3种不同的基因型条带,分别命名为AA、GG和AG,抗性等位基因(A)不能被HhaI 消化,为AA型(367 bp),而敏感等位基因被消化成2个片段,为GG型(151/216 bp)。2个基因型同时存在时为AG型(151/216/367 bp),如图5所示。根据酶切结果,对PCR产物进行测序发现,在测序峰图中沙乌头猪部分猪种的MUC4 基因有1 个G→A 的单碱基突变。将上述猪种的MUC4 基因所测序列与NCBI中KT966 749的序列对比,AA型个体的序列与其一致,定义为野生型,相比之下发现GG型有1个G→A的单碱基突变,这与酶切结果一致。
对上述猪种的MUC13 基因扩增得到的所有PCR产物进行测序分析,得到测序峰图与基因序列,对所得的测序峰图进行分析发现,上海白猪中有部分猪种存在G→A的单碱基突变,枫泾猪和沙乌头猪的所有个体都存在G→A 的单碱基突变,将该位点未突变呈现单峰的基因型定义为AA型,将该位点突变呈现单峰的基因型定义为GG型,呈现双峰的基因型定义为AG型(图6A)。得到的序列与NCBI上JN613 418.1对比,所有个体的对比结果与测序峰图一致(图6B)。
2.3 TAP1、FUT1、NRAMP1、MUC4 和MUC13基因型和等位基因频率分析
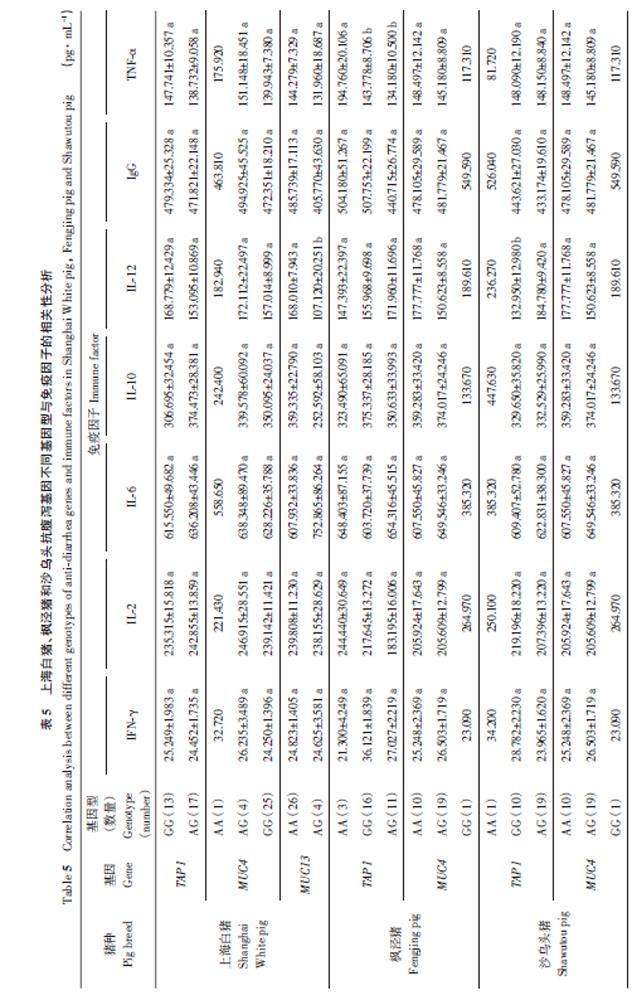
利用PCR-RFLP方法对3个猪群个体进行检验,分型后计算各猪群的基因型和等位基因频率,结果如表2所示。上海白猪中TAP1 基因有1个等位基因,2种基因型(AG和GG),其中AG、GG基因型数量和基因型频率分别为17、13和0.57、0.43;抗病等位基因G的频率为0.72,敏感等位基因A的频率为0.28。枫泾猪TAP1 基因的AA、AG、GG基因型数量及基因型频率分别为3、11、16 和0.10、0.37、0.53,抗病等位基因G和敏感等位基因A的频率分别为0.72和0.28。在检测的30个沙乌头猪样本中,TAP1 基因的AA、AG、GG 基因型数量分别为1、19、10,基因型频率分别为0.03、0.63、0.33,抗病等位基因G的频率为0.65,敏感等位基因A的频率为0.35。在3个猪群中,AA型的频率不高,总体上等位基因G为优势等位基因。
在检测的所有猪种的样本中,FUT1 基因只检测出敏感基因型GG型,等位基因G为优势等位基因。
对NRAMP1 基因的检测表明,3 个地方猪种中没有出现抗病基因型AA型,只检测出敏感基因型BB型,等位基因B为优势等位基因。
如表2所示,共检测出MUC4 基因的1对等位基因,3个猪种均检测出3种基因型,但在各个猪种中所含有的基因型和基因频率有差异;在上海白猪中,MUC4 基因的AA、GG、AG基因型数量及频率分别为1、25、4 和0.03、0.83、0.13,其中G 为优势等位基因。在枫泾猪中MUC4 基因的AA、GG、AG 基因型数量及频率分别为10、1、19 和0.33、0.03、0.63,其中A为优势等位基因。在沙乌头猪中MUC4 基因的AA、GG、AG 基因型数量及频率分别为6、10、14和0.20、0.33、0.47,其中G为优势等位基因。
3个地方猪种中MUC13 基因共检测出1对等位基因,检测出AA、GG和AG共3种基因型,上海白猪中检测出2种基因型(AA和AG),枫泾猪和沙乌头猪只检测出了1种基因型(GG),在上海白猪中AA和AG基因型频率分别为0.87和0.13,其中A为优势等位基因。
2.4 TAP1、FUT1、NRAMP1、MUC4 和MUC13基因的遗传多态性分析
由表3 可知,上海白猪、枫泾猪和沙乌头猪TAP1 基因的多态信息含量(PIC)处于0.25~0.50,都属于中度多态。沙乌头猪的Ho、He和PIC值均比上海白猪和枫泾猪高,表明其遗传多样性高于其他2个品种。上海白猪和沙乌头猪的χ20.05(1)<χ2<χ20.01(1)(χ20.05(1)=3.84,χ20.01(1)=6.63),0.010.05,差异不显著,满足Hardy-Weinberg平衡。
对上海白猪、枫泾猪和沙乌头猪FUT1 和NRAMP1 基因的酶切与测序结果显示,只有GG和BB 基因型,无法进行遗传多态性和Hardy-Weinberg平衡分析。
上海白猪的MUC4 基因的PIC<0.25,属于低度多态,枫泾猪和沙乌头猪的MUC4 基因PIC 处于0.25~0.50,属于中度多态。沙乌头猪的He 与PIC值均高于枫泾猪和沙乌头猪,表明沙乌头猪的遗传多态性高于其他2个品种,经过比对,3个品种中上海白猪遗传多态性最低。分析发现,上海白猪和沙乌头猪χ2<χ20.05(1),P>0.05,差异不显著,满足Hardy-Weinberg 平衡。枫泾猪χ20.05(1)<χ2<χ20.01(1),0.01
上海白猪MUC13 基因PIC<0.25,属于低度多态。χ2<χ20.05(1),P>0.05,差异不显著,满足Hardy-Weinberg平衡。然而,枫泾猪和沙乌头猪MUC13基因仅有GG基因型,无法继续进行遗传多态性和Hardy-Weinberg平衡分析。
2.5 上海白猪、枫泾猪和沙乌头猪免疫因子的测定分析
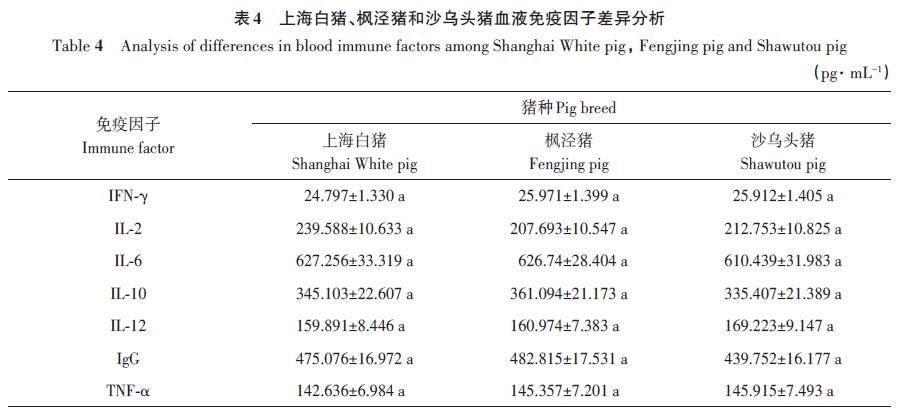
不同猪种免疫因子测定结果见表4,上海白猪、枫泾猪和沙乌头猪之间血液免疫因子平均水平无显著差异(P>0.05)。分析发现,沙乌头猪的IL-12和TNF-α免疫因子均比上海白猪和枫泾猪高。其中,IL-6免疫因子水平与其正好相反,上海白猪血液中IL-6水平高于枫泾猪和沙乌头猪。枫泾猪的IFN-γ、IL-10和IgG 的水平比上海白猪和枫泾猪高,其中IL-10和IgG的水平较低的是沙乌头猪。上海白猪IL-2的水平较高,枫泾猪IL-2的水平低于其他2个猪种。
2.6 TAP1、FUT1、NRAMP1、MUC4 和MUC13基因多态性与免疫因子相关性分析
由于FUT1 和NRAMP1 基因只检测出1种基因型,所以这2个基因不与免疫因子进行相关性分析。如表5所示,上海白猪的TAP1 基因各基因型个体表达的免疫因子的量差异不显著(P>0.05),但GG基因型的IFN-γ、IL-12、IgG、TNF-α免疫因子水平高于AG基因型,AG基因型的IL-2、IL-6和IL-10的免疫因子水平高于GG基因型。在上海白猪中,MUC4 基因由于AA 型只检测出1个,AA型免疫因子与GG和AG不作比较,通过最小二乘法分析,GG和AG型各免疫因子不存在显著差异(P>0.05)。MUC13 基因由于没有检测到GG 基因型,GG 型免疫因子与AA 和AG 不作比较,通过最小二乘法分析,AA型的IL-12水平显著高于AG型(P<0.05)。其他免疫因子AA和AG型之间不存在显著差异(P>0.05)。
对枫泾猪TAP1 基因的各基因型的免疫因子的分析可知,TNF-α在3个基因型猪中存在明显差异,其中AA 型的TNF-α 水平显著高于GG 和AG型(P<0.05)。其他免疫因子在各基因型间不存在差异,但从结果看,AA型中IL-2的水平高于GG和AG型,其中AG型IL-2水平较低。GG型中IFN-γ和IL-10水平高于AA和AG型,其中AA型的IFN- γ 和IL-10 水平较低。IL-6 水平AG 型较高,GG 型较低。AG 型的IL-12 水平高于AA 和GG,AA型的IL-12水平较低。还可以看出,GG的IgG 水平高于AA 和AG,其中AG 型水平相对较低。枫泾猪MUC4 基因由于GG型只检测出1个,GG型免疫因子与AA和AG不作比较,通过最小二乘法分析,GG 和AG 型免疫因子不存在差异(P>0.05)。
在沙乌头猪中,TAP1 基因由于AA型只检测出1个,AA型免疫因子与GG和AG不作比较,通过最小二乘法分析,GG 型的IL-12水平与AG 型之间存在显著差异(P<0.05),其他免疫因子的GG和AG型之间不存在显著差异。从表4可知,GG型的IFN-γ、IL-2和IgG高于AG型。AG型的IL-6和IL-12 高于GG 型。GG 型与AG 型的TNF-α 水平趋于一致。沙乌头猪中MUC4 各基因型的免疫因子没有显著差异(P>0.05)。
3 讨论
3.1 抗腹泻基因的多态性
本研究对上海地区上海白猪、枫泾猪和沙乌头猪3个地方猪种的TAP1 基因外显子3多态性分析发现,上海白猪检测到AG和GG型,枫泾猪和沙乌头猪都检测到AA、AG和GG 3种基因型,其中G为优势等位基因。赵乔辉等[6]研究发现,中国本地猪种与亚洲野猪及国外引进猪品种的基因频率存在明显差异,外来引进猪的等位基因G频率相对较高,而中国地方猪种(淮猪和荣昌猪等)的A频率相对较高,这与本研究结果一致,本研究中上海白猪没有检测出AA型基因,可能是因为上海白猪是与外国猪种培育的结果。Zhao 等[18]报道,苏太猪TAP1 基因G729A突变显著影响mRNA表达,且GG基因型个体抗腹泻能力显著高于其他2种基因型的个体。因此,TAP1 基因的GG基因型可作为抗腹泻感染的候选基因型。
本研究中,FUT1 基因M307位点结果显示,3个地方猪种均仅存在1 种不抗病基因型(GG)。张雄等[19]发现,国内地方品种只含有GG型,而国外及国内杂交培育品种猪FUT1 基因M307位点中含有AA、AG 和GG 基因型,其中GG 为绝对优势基因型。推测FUT1 基因抗病性等位基因A在中国地方猪种中呈极端偏态分布,AA抗病基因型可能来源于外国猪种。这一结果也与Yan等[20]和吴华莉等[21]的研究结果一致,可能是上海的几个地方猪种与国内外猪种基因交流较少,具有上海本地独特的遗传资源性。也有学者在中国上海的浦东白猪中检测出了抗病基因GG型[22],可能是由于浦东白猪作为本土种猪和国外猪种杂交,使AA抗病基因型得到遗传。
作为相对比较保守的基因,NRAMP1 基因会对动物自身免疫产生影响,且对沙门氏菌及多种胞内寄生病原菌具有抗病[23]。本研究利用PCRRFLP技术,在3个猪种中均未检测到AA型,只检测到BB 型。杨军等[24] 在多个猪种中检测到NRAMP1 基因的AB和BB型,均未检测到抗病基因型AA型。但刘艳冬[25]研究发现,贵州地方猪种NRAMP1 基因内含子6具有丰富多态性,其中香猪抗病基因型AA型比例为26%、糯米猪为20%、宗地花猪为7.5%、大约克猪为4.3%。其他学者在中国的其他地方猪种中也检测到有AA型[22]。可能是上海白猪、枫泾猪和沙乌头猪在长期的进化选择中,该基因的个体逐渐被淘汰,群体该位点的遗传平衡从而被打破。
研究表明,MUC4 基因可以作为F4ab/F4ac抗性的候选基因,且G为控制F4ac大肠菌抗性等位基因[2627]。本研究对上海地区3 个地方猪种的MUC4 基因第17 内含子243 位点多态性鉴定发现,在该位点共检测到了1 个等位基因及AA、AG、GG共3种基因型,其中上海白猪、枫泾猪和沙乌头猪中都检测到3种基因型。在上海白猪和沙乌头猪中G为优势等位基因,枫泾猪中A为优势等位基因。李聪聪等[28]研究表明,淮南猪和太白猪的MUC4 基因检测出3 种基因型AA、AG 和GG,这与本研究结果相似,在Liu 等[27]和李聪聪等[28]研究中,GG型个体对抗ETEC F4ab/F4ac感染能力高于其他基因型。本研究中,3个地方猪种都存在GG型抗病基因,可以通过选育来实现群体抗ETEC F4ab/F4ac感染。
MUC13 基因被定位于猪13号染色体长臂41区的Sw207和S0075之间,研究表明,MUC13 基因是决定仔猪F4ac腹泻易感/抗性的基因之一[29-31]。本研究对上海地区3个地方猪种的MUC13 基因第2内含子多态性研究发现,在该位点共检测到了1个等位基因和AG、GG 2种基因型。其中上海白猪检测到2种基因型,枫泾猪和沙乌头猪只检测出抗病基因型GG型,其中G为优势等位基因。与本研究的结果相似,杨明等[32]研究杜洛克猪和皮特猪中MUC13 基因的分子标记辅助选择发现,2个猪种中G为优势等位基因;任军等[13]发现,该基因在rs319699771 位点的GG 型为优势抗腹泻基因型,而AG型和AA型为易感腹泻基因型。本研究发现,枫泾猪和沙乌头猪只存在抗病基因型GG型,可能是这2个猪种在长期的进化选择中,该基因的个体逐渐被保留,形成了抗病基因型的种群。
3.2 遗传多态性分析
作为群体内遗传变异的检测参数,PIC、Ho和He 数值反映了群体内个体的均质度,其数值越高,说明遗传变异性就越大,对环境的适应能力越强,具有较大的选择潜力,应用于遗传育种效果越好,反之则说明该群体杂合度小、基因纯合度高,可以看作纯系加以利用[33-35]。上海白猪、枫泾猪和沙乌头猪TAP1 基因的PIC处于0.25~0.50,都属于中度多态。沙乌头猪的TAP1 基因Ho和He值高于上海白猪和枫泾猪,说明沙乌头猪遗传多样性丰富,对环境的适应能力较强,遗传潜力大。经过分析,TAP1 基因在上海白猪和沙乌头猪中不满足Hardy-Weinberg平衡,这一结果与在浦东白猪、皖南黑猪、霍寿黑猪和梅山猪等地方猪种中的研究结果一致,TAP1 基因偏离了Hardy-Weinberg 平衡[6, 22]。枫泾猪中满足Hardy-Weinberg平衡,说明TAP1 基因在枫泾猪中基本处于自由交配的状态,也就是群体的选育对TAP1 基因没有造成影响,对现在的选育性状没有作用。这与前人在杜洛克、大白和长白中的研究结果一致[6]。
上海白猪的MUC4基因属于低度多态(<0.25),而枫泾猪和沙乌头猪的MUC4 基因属于中度多态。沙乌头猪He值比其他2个猪种高,与PIC值的变化趋势一致,说明沙乌头猪的遗传多态性较高,可作为抗病育种的标记辅助性选择。上海白猪MUC4 基因的PIC较低,说明遗传变异性较低,但分析发现上海白猪和沙乌头猪满足Hardy-Weinberg平衡,枫泾猪不满足Hardy-Weinberg平衡。说明人工选择影响了MUC4 基因抗腹泻基因型在枫泾猪中的分布。上海白猪MUC13 基因属于低度多态,满足Hardy-Weinberg平衡。此外,本试验中有部分猪种基因位点偏离了Hardy-Weinberg平衡。可能是由于群体研究的样本量不够或者群体内近交积累过高[36]。本研究的上海白猪、枫泾猪和沙乌头猪品系样本量都达到了统计学意义,但分析3个品种的基因多态性以及杂合度,结果表明,群体中出现近交积累过高和部分等位基因缺失的问题。进一步分析群体出现连锁不平衡,主要是由于目前上海白猪、枫泾猪和沙乌头猪群体在保种过程中出现了高度近交或遗传漂变,而这与上述猪种后期的品种改良有关。
3.3 抗腹泻基因多态性与免疫因子相关性分析
IgG是在针对外来抗原的免疫应答过程中产生的主要免疫球蛋白类别,通过其双功能特性有效地提供保护,血清中IgG含量可以代表机体体液的免疫状态[37]。IL-2、IL-6、IL-10 和IL-12 在机体免疫系统中具有重要作用,其中IL-2主要是激活免疫,IL-6 和IL-10 主要参与炎症反应[38-40]。IL-12主要是促进T细胞和NK细胞的增殖,也被证明可以促进Thl细胞的分化和增殖,阻止疟疾的传播[4142]。作为一种强烈抗病毒、抗肿瘤和免疫调节作用的细胞因子,IFN-γ在机体免疫系统中具有重要作用[43]。TNF-α属于肿瘤坏死因子超家族的一员,在机体内可抑制病毒复制、病原体的扩散,并预防肿瘤发生,是重要的抗病因子[44]。上述血清学免疫因子,都是机体免疫不可缺少,它们之间互相影响、互相调节,存在密切联系。本研究对3个猪种的上述免疫因子分析显示,各猪种间的免疫因子水平均差异不显著,但在沙乌头猪中IL-6指标低于其他2个猪种。研究表明,低水平IL-6更具有抗病优势[45],说明沙乌头猪的抗病性可能更高。此外,对上海地区3个地方猪种的部分抗腹泻基因的基因型与部分免疫因子进行关联性分析,在上海白猪中仅有MUC13 基因AA型的IL-12免疫因子显著高于AG型;枫泾猪中TAP1 基因的AA基因型个体TNF-a表达水平显著高于GG和AG型,这与薛伟伟[15]对圩猪的研究结果一致。由于TNF-a不仅能够调控促炎细胞因子,也能控制趋化因子和黏附因子的活化和表达[46]。因此,推测在正常值范围内,AA型猪的抗病能力与AG利GG型存在差异。在沙乌头猪中,TAP1 基因GG型的IL-12水平显著低于AG型,研究表明,IL-12水平过高会抑制Th2细胞的产生从而抑制IL-10的产生,且IL-10的表达与IL-12的表达早现负相关[47]。虽然沙乌头猪的TAP1 基因GG型与AG型的IL-10 没有显著差异,但AG 型的IL-10 水平低于GG型。本研究总结了上海白猪,枫泾猪和沙乌头猪部分抗腹泻基因与部分免疫因子间的的关系,通过分析,对各猪种的抗腹泻有了初步的认识,可为后期试验提供一定的理论依据。
参 考 文 献
[1] CANIBE N, H?JBERG O, KONGSTED H, et al .. Review onpreventive measures to reduce post-weaning diarrhoea inpiglets [J/OL]. Animals, 2022, 12(19):2585 [2023-02-23]. https://doi.org/10.3390/ani12192585.
[2] MEIJERINK E, NEUENSCHWANDER S, FRIES R, et al .. ADNA polymorphism influencing α(1,2) fucosyltransferase activityof the pig FUT1 enzyme determines susceptibility of smallintestinal epithelium to Escherichia coli F18 adhesion [J].Immunogenetics, 2000, 52:129-136.
[3] 方晨, 胡瑞举, 杨明华, 等. 迪庆藏猪FUT1 基因遗传变异分析[J]. 中国畜牧杂志, 2020, 56(12):29-35.
FANG C, HU R J, YANG M H, et al .. Genetic variationanalysis of FUT1 gene in Diqing Tibetan pig [J]. Chin. J. Anim.Sci., 2020, 56 (12):29-35.
[4] MEIJERINK E, FRIES R, VOGELI P, et al .. Two α(1, 2)fucosyltransferase genes on porcine chromosome 6q11 areclosely linked to the blood group inhibitor (S) and Escherichiacoli F18 receptor (ECF18R) loci [J]. Mamm. Genome, 1997, 8(10):736-741.
[5] KIM K, NGUYEN D T, CHOI M, et al .. Alpha (1, 2) -fucosyltransferase M307A polymorphism improves pigletsurvival [J]. Anim. Biotechnol., 2013, 24(3):243-250.
[6] 赵乔辉, 刘颖, 董文华, 等. TAP1 基因外显子3在9个不同猪群体中的遗传多态性分析[J]. 中国畜牧杂志, 2014, 50(7):1-5.
ZHAO Q H, LIU Y, DONG W H, et al .. Analysis of geneticdiversity in TAP1 gene exon 3 from 9 different pig populations [J].Chin. J. Anim. Sci., 2014, 50(7):1-5.
[7] 刘艳冬, 许厚强, 稽辛勤, 等. 香猪NRAMP1 基因多态性与仔猪腹泻的研究[J]. 中国畜牧兽医, 2010, 37(4):125-127.
LIU Y D, XU H Q, JI X Q, et al .. NRAMP1 gene polymorphismand pig piglet diarrhea research [J]. China Anim. Husb. Vet.Med., 2010, 37(4):125-127.
[8] 刘艳冬, 许厚强, 林家栋, 等. 贵州地方猪NRAMP1 基因多态性研究[J]. 贵州畜牧兽医, 2009, 33(2):1-2.
LIU Y D, XU H Q, LIN J D, et al .. Genetic polymophism ofNRAMP1 genc in Guizhou local pig [J]. Guizhou J. Anim.Husb. Vet. Med., 2009, 33(2):1-2.
[9] JOLLER D, JORGENSEN C B, BERTSCHINGER H U, et al ..Refined localization of the Escherichia coli F4ab/F4ac receptorlocus on pig chromosome 13 [J]. Anim. Genet., 2009, 40(5):749-752.
[10] JACOBSEN M, KRACHT S S, ESTESO G, et al .. Refinedcandidate region specified by haplotype sharing for Escherichiacoli F4ab/F4ac susceptibility alleles in pig [J]. Anim. Genet.,2010, 41(1):21-25.
[11] 洪渊, 韩云珍, 薛永钦, 等. 长白猪MUC13基因多态性及其与生产性状的关联性分析[J]. 福建畜牧兽医, 2022, 44(4):7-9.
HONG Y, HAN Y Z, XUE Y Q, et al .. Association betweenpolymorphism of MUC13 gene and production traits inAmerican Landrace pig [J]. Fujian J. Anim. Husb. Vet. Med.,2022, 44(4):7-9.
[12] PENG Q L, REN J, YAN X M, et al .. The g. 243A> G mutationin intron 17 of MUC4 is significantly associated withsusceptibility/resistance to ETEC F4ab/ac infection in pig [J].Anim. Genet., 2007, 38(4):397-400.
[13] 任军, 晏学明, 艾华水, 等. 仔猪断奶前腹泻抗病基因育种技术的创建及应用[J]. 猪业科学, 2012, 29(1):44-48.
REN J, YAN X M, AI H S, et al .. Establishment andapplication of gene breeding technology for resistance todiarrhea in piglets before weaning [J]. Swin. Ind. Sci., 2012, 29 (1):44-48.
[14] 刘荣荣,徐勇,周慧姝,等.规模化猪场免疫程序的制定标准[J]. 畜牧兽医科学, 2017 (10):87.
[15] 薛玮玮. 猪TAP1 基因多态性及其与断奶仔猪免疫指标的相关性分析[D]. 合肥:安徽农业大学, 2014.
XUE W W. Poylmorphisms of porcine TAP1 gene and theirassociationswith immune indicator in weaned piglets [D]. Hefei:Anhui Agricultural University, 2014.
[16] 刘颖, 董文华, 苏先敏,等. 梅山猪Mx1 基因第14外显子多态性及其与部分免疫指标和早期生长性能的关联分析[J].中国畜牧杂志, 2014, 50(5):18-20,64.
LIU Y, DONG W H, SU X M, et al .. Polymorphisms in exon 14of Mx1 gene and its relationship with partial cytokines leveland early growth performance in Meishan pig [J]. Chin. J.Anim. Sci., 2014, 50(5):18-20,64.
[17] 马小军. 不同猪种免疫功能及免疫相关基因表达差异研究[D]. 兰州:甘肃农业大学, 2005.
MA X J. Studies on immune function and differentialexpressionof immune-related gene in different pig breeds [D].Lanzhou: Gansu Agricultural University, 2005.
[18] ZHAO Q, LIU Y, DONG W, et al .. Genetic variations of TAP1gene exon 3 affects gene expression and Escherichia coli F18resistance in piglets [J]. Int. J. Mol. Sci., 2014, 15(6):11161-11171.
[19] 张雄, 王婧, 张静, 等. 3个群体猪FUT1 基因M229与M307位点遗传多样性研究[J]. 基因组学与应用生物学, 2020, 39(6):2536-2541.
ZHANG X, WANG J, ZHANG J, et al .. The polymorphismanalysis between M229 and M307 locus of FUT1 gene in threegroup pig [J]. Genomics Appl. Biol., 2020, 39(6):2536-2541.
[20] YAN X M, GUO Y M, DING N S, et al .. Study on the geneticvariation ofal-fucosytransferase gene in different pig breed [J].Chin. J. Anim. Sci., 2004, 40(3): 8-10.
[21] 吴华莉, 涂尾龙, 曹建国, 等. FUT1 基因在上海地区5个猪群体内的多态性分析[J]. 畜牧与饲料科学, 2017, 38(1):18-20.
WU H L, TU W L, CAO J G, et al .. Polymorphism analysis ofFUT1 gene in five pig herds in Shanghai [J]. Anim. Husb. FeedSci., 2017, 38(1):18-20
[22] 张艳. 浦东白猪重要抗病基因多态性位点及其可能相关免疫学指标检测分析[D]. 上海:上海交通大学, 2016.
ZHANG Y. Polymorphism sites of important disease resistantgenes in Pudong white pig and detection and analysis ofimmune indices possibly related to the genes [D]. Shanghai:Shanghai Jiaotong University, 2016.
[23] BLACKWELL J M. Structure and function of the naturalresistance-associated macrophage protein (NRAMP1), a candidateprotein for infectious and autoimmune disease susceptibility [J].Mol. Med. Today, 1996, 2(5):205-211.
[24] 杨军, 陈红颂, 丁山河,等. 3个外种猪NRAMP1 基因多态性研究[J]. 长江大学学报(自然科学版), 2009, 6(4):40-43,120.
YANG J, CHEN H S, DING S H, et al .. Study on polymorphismof NRAMP1 gene in three exotic pig [J]. J. Yangtze Univ. (Nat.Sci.), 2009, 6(4):40-43,120.
[25] 刘艳冬. 香猪NRAMP1 基因多态性及与仔猪腹泻相关性研究[D]. 贵阳:贵州大学, 2009.
LIU Y D. Study of Xiang pig NRAMP1 gene polymorphism andcorrelation with the piglet diarrhea [D]. Guiyang: GuizhouUniversity, 2009.
[26] 钦伟云, 甘丽娜, 魏宗友, 等. MUC4 和MUC13 基因在ETECF18抗性型和易感型梅山断奶仔猪间的差异表达分析[J]. 中国畜牧兽医, 2017, 44(4):959-964.
QIN W Y, GAN L N, WEI Z Y, et al .. Differential expressionanalysis of MUC4 and MUC13 genes between resistant andsensitive weaned Meishan piglets to ETEC F18 [J]. ChinaAnim. Husb. Vet. Med., 2017, 44(4):959-964.
[27] LIU Y, YIN X M, XIA R W, et al .. Association between theMUC4 g. 243A> G polymorphism and immune andproductiontraits in Large white pig [J]. Turk. J. Vet. Anim. Sci., 2015, 39(2):141-146.
[28] 李聪聪, 刘思雨, 吴姣, 等. 不同品种猪SLA-DQA、FUT1 和MUC4 基因遗传变异初析[J]. 黑龙江畜牧兽医, 2020 (2):55-61.
LI C C, LIU S Y, WU J, et al .. Preliminary analysis of geneticvariation of SLA-DQA, FUT1 and MUC4 genes in differentbreeds of pig [J]. Heilongjiang J. Anim. sci., 2020 (2):55-61.
[29] JACOBSEN M, CIRERA S, JOLLER D, et al .. Characterisationof five candidate genes within the ETEC F4ab/ac candidateregion in pig [J/OL]. BMC Res. Notes, 2011, 4: 225 [2023-02-23]. https://doi.org/10.1186/1756-0500-4-225.
[30] JACOBSEN M, KRACHT S S, ESTESO G, et al .. Refinedcandidate region specified by haplotype sharing for Escherichiacoli F4ab/F4ac susceptibility alleles in pig [J]. Anim. Genet.,2010, 41(1):21-25.
[31] REN J, YAN X, AI H, et al .. Susceptibility towardsenterotoxigenic Escherichia coli F4ac diarrhea is governed bythe MUC13 gene in pig [J/OL]. PLoS One, 2012, 7(9):e44573[2023-02-23]. https://doi.org/10.1371/journal.pone.0044573.
[32] 杨明, 王青来, 刘敬顺, 等. MUC13、FUT1 基因在2个种猪核心群中的分子标记辅助选择研究[J]. 华南农业大学学报,2015, 36(6):1-8.
YANG M, WANG Q L, LIU J S, et al .. Molecular maker-assistedselections of MUC13 and FUT1 genes in the two swine nucleuspopulations [J]. J. South China Agric. Univ., 2015, 36(6):1-8.
[33] 蒋钦杨, 韦英明, 陈宝剑, 等. 马生长激素基因多态性与体尺指标之间的关联性分析[J]. 中国畜牧杂志, 2013, 49(3):1-4.
JIANG Q Y, WEI Y M, CHEN B J, et al .. Association ofpolymorphisms of growth hormone gene with body sizesindexes in horses [J]. Chin. J. Anim. Sci., 2013, 49(3):1-4.
[34] 严燕, 张陈华, 王阳, 等. 圩猪OB 基因SNPs检测及其与产仔性能的关系[J]. 中国农业大学学报, 2010, 15(6):78-83.
YAN Y, ZHANG C H, WANG Y, et al .. SNPs detection of OBgene and its association with reproduction in Wei pig [J]. J.China Agric. Univ., 2010, 15(6):78-83
[35] 相德才, 张斌, 刘邵娜, 等. 迪庆藏猪NRAMP1 基因第二内含子和第二外显子多态性位点遗传分析[J]. 养猪, 2020, 169(2):60-62.
XIANG D C, ZHANG B, LIU S N, et al .. Genetic analysis ofthe polymorphism in the second intron and the second exon ofNRAMP1 gene in diqing tibetan pig [J]. Swin. Prod., 2020, 169(2):60-62.
[36] ZERGER K R, RICHARDERSON B J. A rapid poulationexpansion retains genetic diversity within european rabbit inaustralia [J]. Mol. Ecol., 2003, 12(3):789-794.
[37] BOURNAZOS S, RAVETCH J V. Diversification of IgGeffector functions [J]. Int. Immunol., 2017, 29(7):303-310.
[38] KOGUT M, ROTHWELL L, KAISER P. Differential effects ofage on chicken heterophil functional activation by recombinantchicken interleukin-2 [J]. Dev. Comp. Immunol., 2002, 26(9):817-830.
[39] ZIZZO G, TAMBURELLO A, CASTELNOYO L, et al ..Immunotherapy of COVID-19: inside and beyond IL-6signalling [J/OL]. Front. Immunol., 2022, 13:795315 [2023-02-23]. https://doi.org/10.3389/fimmu.2022.795315.
[40] WU Y R, HSING C H, CHIU C J, et al .. Roles of IL-1 and IL-10 family cytokines in the progression of systemic lupuserythematosus: friends or foes [J]. IUBMB Life, 2022, 74(2):143-156.
[41] XUE D, MOON B, LIAO J, et al .. A tumor-specific pro-IL-12activates preexisting cytotoxic T cells to control establishedtumors [J/OL]. Sci. Immunol., 2022, 7(67):6899 [2023-02-23].https://www.science.org/doi/10.1126/sciimmunol.abi6899.
[42] 姜素华, 唐慧, 邢建新. IL-12在约氏疟原虫感染中作用的初步实验研究[J]. 农垦医学, 2008, 30(5):360-362.
JIANG S H, TANG H, XING J X. Primary research oninfluence of IL-12 on plasmodium yoelii infection [J]. J.NongkenMed., 2008, 30(5):360-362.
[43] 郭紫晶, 陈飞, 张志雄, 等. 白细胞介素-10对口蹄疫病毒感染小鼠T 细胞增殖及其表达TNF- α、IFN- γ 和IL-2 的影响[J]. 畜牧兽医学报, 2023, 54(2):694-705.
GUO Z J, CHEN F, ZHANG Z X, et al .. Effects of interleukin-10 on T cell proliferation and its expression of TNF-a, IFN- γand IL-2 in mice infected with foot and-mouth disease virus [J].J. Anim. Vet. Sci., 2023, 54 (2):694-705.
[44] KOPER-LENKIEWICZ O M, SUTKOWSKA K,WAWRUSIEWICZ-KURYLONEK N, et al .. Proinflammatorycytokines (IL-1,-6,-8,-15,-17,-18,-23, TNF-α) single nucleotidepolymorphisms in rheumatoid arthritis-a literature review [J/OL].Int. J. Mol. Sci., 2022, 23(4):2106 [2023-02-23]. https://doi.org/10.3390/ijms23042106.
[45] 吕琼霞, 张书霞, 赵茹茜. 运输应激对猪淋巴结IL-2、IL-6和IL-10 及其受体mRNA 转录的影响[J]. 南京农业大学学报, 2011, 34(1):95-100.
LYU Q X, ZHANG S X, ZHAO R X. Effects of transportationstress on transcription of IL-2, IL-6 and IL-10 and the relativereceptors mRNA of lymph nodes in pig [J]. J. Nanjing Agric.Univ., 2011, 34 (1):95-100.
[46] PENNICA D, KOHR W J, FENDLY B M, et al ..Characterization of a recombinant extracellular domain of thetype 1 tumor necrosis factor receptor: evidence for tumornecrosis factor. alpha. induced receptor aggregation [J].Biochemistry, 1992, 31(4):1134-1141.
[47] OGARRA A, MURPHY K M. From IL-10 to IL-12: howpathogens and their products stimulate APCs to induce TH1development [J]. Nat. Immunol., 2009, 10(9):929-932.
(责任编辑:胡立霞)
基金项目:国家重点研发计划项目(2021YFD120303);上海市农业科学院助跑计划人才项目(ZP22171);重庆市技术创新与应用发展专项(CSTC2021JSCX-DXWTBX0004);宁波科技创新2025重大专项(2019B10023)。

