应用T1与T2加权比值探讨0~2岁婴幼儿创伤性脑损伤灰质髓鞘的改变
张泽栋 孙惠苗 靳波 李倩云 杨宏
摘要 目的: 应用T1与T2加权比值探讨0~2岁婴幼儿创伤性脑损伤(TBI)脑灰质髓鞘的改变。 方法: 基于常规T1加权和T2加权图像计算得到T1与T2加权比值图,并提取90个大脑灰质区域的T1与T2加权比值,比较37例婴幼儿TBI(TBI组)与43名健康对照者(HC组)脑灰质髓鞘的差异。采用两独立样本 t 检验和Mann.Whitney U 检验比较TBI组与HC组脑灰质髓鞘T1与T2加权比值的差异,并对所得 P 值进行假发现率(FDR)矫正;为了捕获灰质在快速髓鞘化阶段的区域差异,将0~2岁的婴幼儿按照每6个月为1组分为4组。应用二次拟合曲线建立TBI组与HC组灰质T1与T2加权比值随年龄变化的发育轨迹图。 结果: TBI组双侧中央旁回、双侧补充运动区及左侧海马等22个脑区的T1与T2加权比值低于HC组( P <0.05)。7~12月亚组中,TBI组双侧尾状核、双侧壳核等8个脑区T1与T2加权比值低于HC组( P <0.05)。19~24月亚组中,TBI组双侧海马、双侧海马旁回等包括颞枕叶在内的52个脑区T1与T2加权比值低于HC组( P <0.05)。0~2岁婴幼儿及亚组(7~12月组、19~24月组)中,TBI组双侧尾状核、双侧壳核、右侧颞横回,左侧梭状回及左侧补充运动区的T1与T2加权比值均低于HC 组( P <0.05)。HC组发育轨迹表现为0~2 岁内T1与T2加权比值持续上升;TBI组发育轨迹表现为0~16月T1与T2加权比值快速上升,之后下降。从发育轨迹可知,TBI组T1与T2加权比值整体低于HC组。 结论: T1与T2加权比值可作为评估TBI婴幼儿脑灰质髓鞘改变的代替指标,TBI组T1与T2加权比值的发育轨迹低于HC组,且在19~24月最明显。T1与T2加权比值提示脱髓鞘和髓鞘异常发育,可为TBI患儿脑灰质研究提供新思路。
关键词 创伤性脑损伤;婴幼儿;T1与T2加权比值;灰质髓鞘
doi: 10.12102/j.issn.1672.1349.2024.10.033
创伤性脑损伤(traumatic brain injury,TBI)是指外部机械力对大脑造成的获得性脑损伤 [1] 。在儿童中,婴幼儿TBI发生率最高 [2] 。跌倒、运动、钝器创伤及机动车事故是儿童TBI的主要原因 [3] 。TBI可对大脑灰质与白质产生直接机械冲击,引起压迫、撕裂、剪切等,直接损伤受伤部位细胞和血管 [4.5] ,进而导致髓鞘损伤和脱髓鞘改变 [6.8] ,且这种脱髓鞘可扩散到远端,超出初始损伤的部位,导致感觉、运动、认知和自主神经功能受损 [9] 。因此,评估婴幼儿髓鞘损伤具有重要的临床意义。
灰质内髓鞘形成是出生后大脑发育的重要过程,且0~2岁内髓鞘化速度最快 [10.12] ,髓鞘形成可保证有效的信号传输和结构支持 [13.15] ,调节发育过程中突触形成 [16] ,具有一定的区域特异性 [17.19] 。应用常规磁共振成像(MRI)技术评估婴幼儿的髓鞘形成可能受限,由于婴幼儿大脑MRI对比度低,髓鞘损伤的细微改变较难检测到。由于婴儿大脑中水分含量较高,常 规序列如液体衰减反转恢复序列(fluid attenuated inversion recovery,FLAIR)和弥散加权成像(diffusion weighted imaging,DWI)检查,可能导致患有髓鞘相关 损伤的婴儿漏诊,如缺氧缺血性损伤(hypoxic.ischemic injury,HII) [20.21] 。随着人们将研究聚焦于量化灰质结构,尤其是灰质内髓鞘形成时,量化儿童灰质髓鞘含量取得了一定成果,如相关研究应用髓鞘水分数(myelin water fraction,MWF)和磁化转移(magnetization transfer,MT)表征了儿童皮质髓鞘的形成 [17,22] 。虽然这些技术可评估髓鞘含量,但存在一定的局限性,MWF在定量信息方面功能强大,但扫描时间较长,不适合在儿童中应用 [23] ;MT是量化髓鞘含量的间接指标,不一定与髓鞘含量直接相关 [4] 。
T1与T2加权比值是一种有效评估大脑髓鞘含量的测量方法。该方法基于常规T1加权序列(T1WI)和T2加权序列(T2WI)图像,提高了髓鞘信号的对比度和敏感性 [24] 。与其他评估髓鞘的方法(如MT/MWF)相比,T1与T2加权比值未增加总扫描时间,且后处理过程相对简单 [25.26] 。这种方法开始应用于灰质内髓鞘含量的评估 [27.29] ,之后广泛应用于白质髓鞘含量的相关研究中 [30.31] 。相关研究证实了T1与T2加权比值可作为反映TBI后灰质髓鞘含量变化的可靠指标 [32.33] 。另有研究表明,孤独症谱系障碍(autism spectrum disorder,ASD)高风险婴儿在几个早期髓鞘区域(如视觉、后扣带回、楔前皮质)的T1与T2加权比值低于健康对照组,且较高的T1与T2加权比值与较高的发育水平得分相关 [27] 。目前,T1与T2加权比值应用于TBI婴幼儿脑灰质髓鞘改变的研究较少。本研究应用T1与T2加权比值探讨0~2岁婴幼儿TBI脑灰质髓鞘的改变,现报道如下。
1 资料与方法
1.1 一般资料
选取2021年1月—2023年5月在山西省儿童医院确诊的TBI患儿(TBI组)。TBI组纳入标准:外力导致的非穿透性脑损伤;年龄0~2岁;接受检查时间距离脑外伤时间≤7 d;有完整的MRI检查数据;所有患儿监护人均签署知情同意书,自愿参与本研究。TBI组排除标准:其他神经系统疾病,包括多动症、精神分裂症、癫痫症、脑肿瘤。收集年龄、性别与TBI组匹配 的同期健康对照者(HC组)。HC组纳入标准:年龄 0~2岁;完整的MRI检查数据;所有健康对照者监护人均签署知情同意书,自愿参与本研究。HC组排除标准:12个月内有TBI史、脑震荡史、任何导致的多发性创伤外伤史;有神经或精神类疾病史。所有检查对象均在镇静情况下完成检查。本研究经医院伦理委员会批准(批准文号:IRB.KYSB.2023.028)。
1.2 检查方法
采用5%水合氯醛按1 mL/kg灌肠检查对象,佩戴听力保护装置,检查对象待熟睡后扫描。采用美国GE DISCOVERY MR750W 3.0T磁共振仪,头部矩阵线圈。T1WI:重复时间(TR)1 750 ms,回波时间(TE) 27.3 ms;T2WI:TR 5 231 ms,TE 128.7 ms;成像中的视野大小(FOV)200 mm×200 mm,矩阵256×256,层厚/层间距5.0 mm/1.2 mm,激励次数2次。
1.3 数据处理
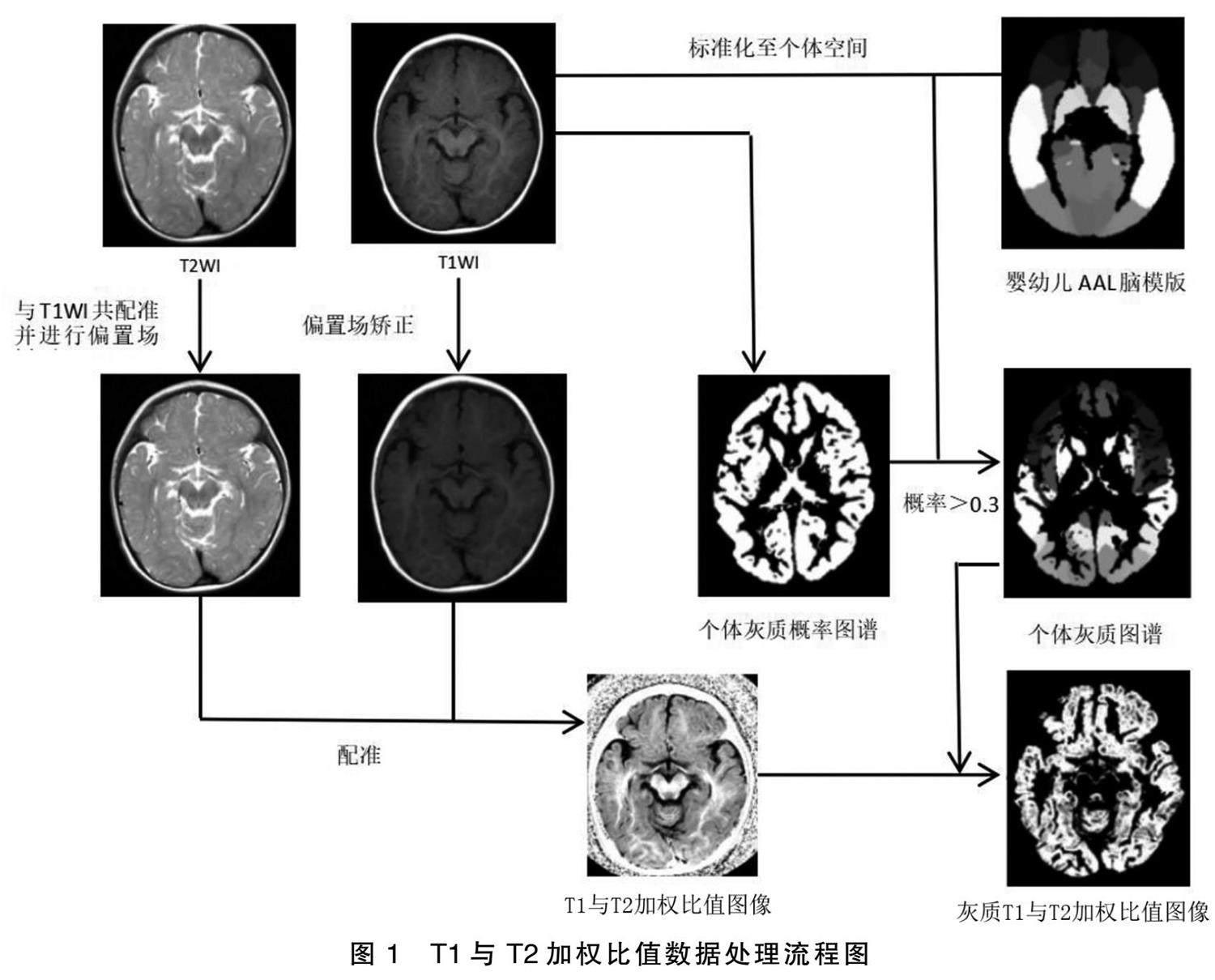
使用MATLAB2021 SPM12进行数据处理,详见图1。1)手动矫正原点:对T1WI、T2WI图像进行手动原点矫正,包括调节左右脑至对称,起始点被手动调节为前联合。2)将研究对象的T1加权图像与T2加权图像进行严格配准。3)对T1加权图像与T2加权图像进行偏置场矫正,纠正由于患儿位置、减少扫描仪等因素所致的图像质量差异。4)利用上述步骤得到的T1与T2加权比值图像。5)利用SPM12分割功能对T1WI数据进行分割,得到灰质、白质、脑脊液的概率图。在灰质图谱中,将>0.3的概率作为个体灰质掩膜。6)将婴幼儿自动解剖标记(anatomical automatic labeling,AAL)图谱模板(UNC 0.1.2 Infant Atlases [34] ,NITRC:UNC 0.1.2 Infant Atlases:Tool/Resource Info)标准化至个体空间,并根据个体灰质掩膜得到个体灰质图谱。7)利用T1与T2加权比值图像与个体灰质图谱计算得到基于感兴趣区(ROI)分析得到的平均T1与T2加权比值。AAL模板共116个区域,本研究属于大脑90个灰质区域。采用二次拟合曲线建立T1与T2加权比值随年龄变化的发育轨迹。
1.4 统计学处理
应用SPSS 26.0统计软件进行数据分析。采用Mann.Whitney U 检验、 χ 2检验或Fisher确切概率法进行TBI组与HC组人口学资料比较;符合正态分布的定量资料以均数±标准差( x ± s )表示,非正态分布的定量资料以中位数、四分位数[ M ( P 25 , P 75 )]表示,两独立样本 t 检验和Mann.Whitney U 检验用于比较TBI组与HC组灰质T1与T2加权比值的组间差异。对所得的 P 值进行假发现率(FDR)矫正,以 P <0.05为差异有统计学意义。
2 结 果
2.1 两组一般资料比较
TBI组入组38例,HC组入组44名,两组各1例因为图像质量无法进行相关图像后处理被排除,最终TBI组纳入37例,HC组纳入43名。根据样本分布及各个阶段数据,后续分析以每6个月进行分组:0~6月、7~12月、13~18月、19~24月。TBI组与HC组月龄、性别比较,差异均无统计学意义( P >0.05)。详见表1、表2。
2.2 TBI组与HC组双侧大脑各脑区T1与T2加权比值比较
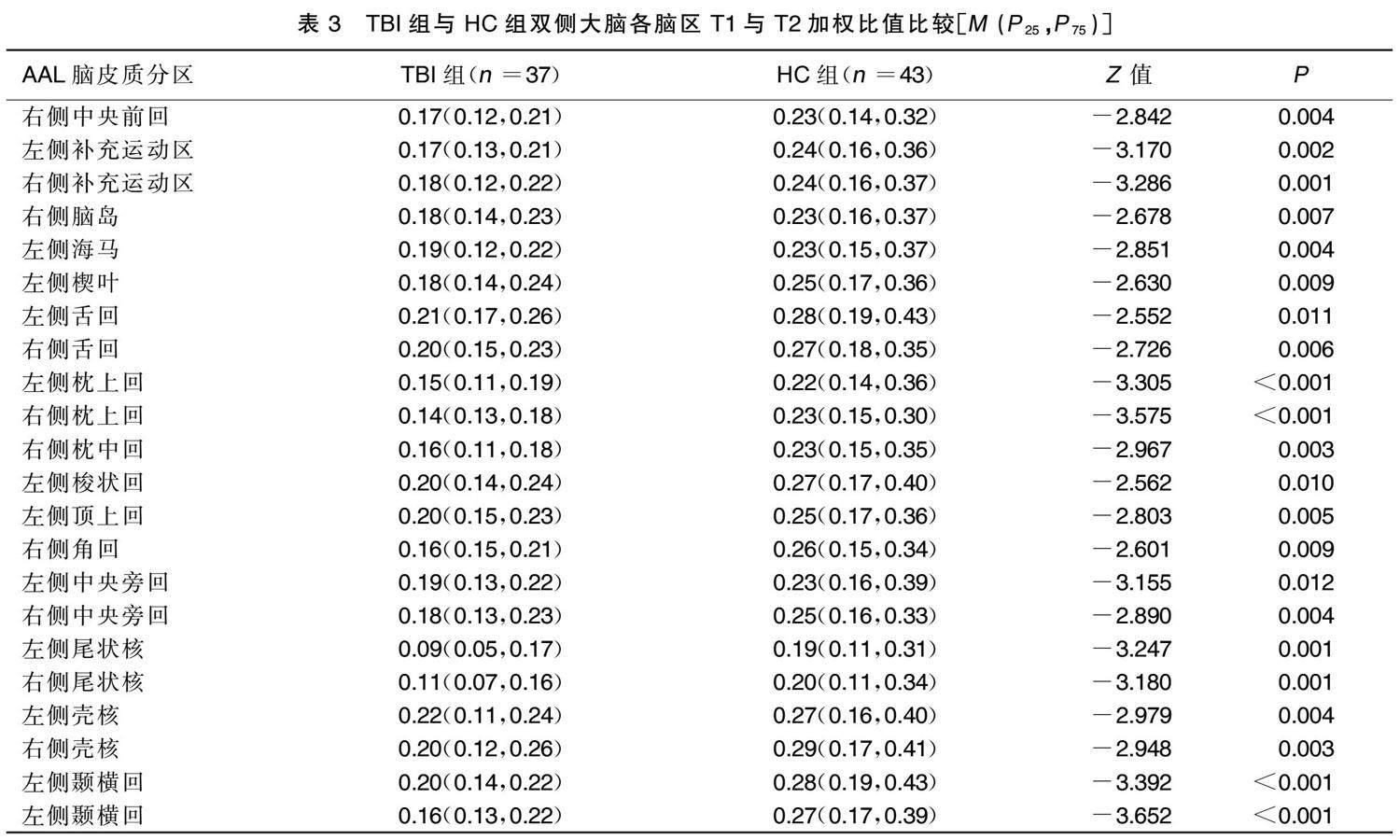
TBI组右侧中央前回,双侧中央旁回、双侧补充运动区、左侧梭状回、左侧顶上回、右侧角回、双侧颞横回、双侧枕上回、右侧枕中回、双侧舌回、双侧尾状核、双侧壳核、右侧脑岛、左侧海马、左侧楔叶T1与T2加权 比值均低于HC组,差异均有统计学意义( P <0.05)。 详见表3。
2.3 各亚组TBI组和HC组T1与T2加权比值的差异
0~6月亚组、13~18月亚组中,TBI组和HC组双侧大脑各脑区T1与T2加权比值比较,差异均无统计学意义( P >0.05)。7~12月亚组中,TBI组双侧尾状核、双侧壳核、右侧颞横回、左侧梭状回、左侧补充运动区、右侧顶下缘角回的T1与T2加权比值均低于HC组( P <0.05)。19~24月亚组中,TBI组双侧中央前回、双侧中央后回、双侧尾状核、双侧壳核、双侧梭状回、双侧补充运动区、双侧海马、双侧海马旁回、双侧颞叶等52个灰质区域的T1与T2加权比值均低于HC组( P <0.05)。7~12月亚组、19~24月亚组,TBI组双侧尾状核、双侧壳核、右侧颞横回、左侧梭状回、左侧补充运动区的T1与T2加权比值均低于HC组( P <0.05)。详见表4、表5及图2。
2.4 T1与T2加权比值的发育轨迹图
0~2岁TBI组与HC组全脑灰质平均T1与T2加权比值的发育轨迹图见图3。TBI组和HC组代表性脑区T1与T2加权比值的发育轨迹图见图4。HC组发育轨迹表现为0~2岁内T1与T2加权比值持续上升,TBI组发育轨迹表现为0~16月T1与T2加权比值快速上升,之后下降。从发育轨迹图可知,TBI组T1与T2加权比值整体低于HC组。
3 讨 论
虽然髓鞘常与大脑白质有关,但灰质内也含有大量的髓鞘纤维,且主要位于更深的皮质层 [35] ,部分原因是白质髓鞘可扩散到皮质神经网的外围 [36] 。与白质的成熟一样,灰质髓鞘形成可能在神经发育及认知、行为功能的完善中发挥着重要作用 [14] ,尤其在0~2岁是婴幼儿认知发展最快和发生神经认知障碍风险最高的阶段 [37] 。TBI导致大脑灰质产生不同程度的脱髓鞘改变和髓鞘重新形成的障碍,从而使患儿产生认知缺陷和认知障碍 [38] 。因此,有效评估婴幼儿脑灰质髓鞘损伤意义重大,可提示临床及早干预,更好地改善婴幼儿预后。
3.1 TBI婴幼儿不同脑区灰质髓鞘T1与T2加权比值的改变
本研究探讨了0~2岁婴幼儿TBI后脑灰质髓鞘的改变,结果显示,0~2岁中,TBI组双侧中央旁回、双侧补充运动区及左侧海马等22个脑区的T1与T2加权比值低于HC组;7~12月亚组中,TBI组双侧尾状核、双侧壳核等8个脑区T1与T2加权比值低于HC组;19~24月亚组中,TBI组双侧海马、双侧海马旁回及左侧前扣带回与旁扣带回等包括颞枕叶在内的52个脑区的T1与T2加权比值低于HC组;0~6月亚组、13~18月亚组未发现TBI组与HC组双侧大脑半球各脑区的T1与T2加权比值存在明显差异,分析可能是由于2岁以内婴幼 儿不同灰质髓鞘的发育速度存在差异 [39] 或各组的样本量有限。
本研究结果还发现,0~2岁婴幼儿及亚组(7~12月组、19~24月组)中,TBI组双侧尾状核、双侧壳核、右侧颞横回、左侧梭状回及左侧补充运动区的T1与T2 加权比值均低于HC组;0~2岁婴幼儿及亚组(19~ 24月组)TBI组中央前回、中央后回、中央旁回、枕叶等脑区的T1与T2加权比值低于HC组;7~12月亚组中这些脑区并无明显差异。有研究表明,1岁时观察到躯体感觉皮质(中央后回)、运动皮质(中央前回)和视觉皮质(枕叶)的成熟,颞叶的成熟时间更长 [17] 。提示7~12月,躯体感觉运动皮质及视觉皮质可能未成熟。
本研究在 0~2岁婴幼儿及亚组(7~12月组、19~ 24月组)均观察到TBI组双侧尾状核、双侧壳核的T1与T2加权比值低于HC组。有研究显示,正常发育儿童的灰质髓鞘含量与灰质体积呈正相关 [39] 。相关研究表明,0~2岁健康婴幼儿尾状核和壳核的灰质体积增大 [39.40] ,生长速度过快导致其更易受到损害 [40] 。上述研究结果提示,尾状核和壳核可能是TBI婴幼儿脑灰质髓鞘损伤的易损脑区。有研究表明,0~1岁海马体积增长较慢,1~2岁海马体积迅速增长 [39] 。本研究结果显示,7~12月亚组中,两组海马的T1与T2加权比值无明显差异;0~2岁婴幼儿及亚组(19~24月组)海马的T1与T2加权比值均有明显差异。空间上,海马接近充满液体的颞角,发生脑创伤时更易积累剪切力 [41] ,海马较皮质、灰质更易发生机械性损伤 [42] 。研究表明,TBI后儿童和青少年的海马体积减小 [43] ,与儿科脑损伤神经病理学证据一致 [44] 。结合本研究提示海马可能是TBI脑灰质髓鞘损伤的易损脑区。
脑损伤后执行功能的障碍与纹状体功能异常有关,进入基底节的多数皮质信号通过纹状体传输。纹状体分为3个亚区,包括尾状核、壳核和伏隔核,分别与认知、运动和动 机过程有关 [45] 。本研究结果显示,0~ 2岁婴幼儿及亚组(7~12月组、19~24月亚组)中,TBI组双侧尾状核的T1与T2加权比值均低于HC组,提示TBI婴幼儿尾状核髓鞘有不同程度的损伤。相关研究表明,TBI尾状核功能连接发生改变,认知障碍主要表现为执行功能、处理速度和记忆功能,尤其是执行功能的障碍,执行功能包括信息处理、冲突监测和行动控制 [46] 。本研究同时发现,19~24月组中,TBI组前扣带回与旁扣带回的T1与T2加权比值低于HC组,提示TBI婴幼儿前扣带回与旁扣带回的髓鞘含量减少。前扣带回与尾状核密切连接 [47] ,前扣带回在认知控制中发挥核心作用,当潜在行动之间发生冲突时,前扣带回被强烈激活,如Stroop任务 [48] 。前扣带回涉及的认知过程包括奖励处理、冲突监测和行动选择 [49] 。患有注意力缺陷多动障碍(attention deficit hyPeractivity disorder,ADHD)的儿童在执行Stroop任务时无法激活前扣带回,表明其认知障碍可能是由于抑制常规反应时,前扣带未激活造成的 [50] 。结合本研究结果提示,尾状核和前扣带回的髓鞘损伤可能导致它们之间的连接中断,从而导致前扣带回无法激活。TBI和ADHD可能有类似的灰质损伤机制,但疾病的灰质之间是否有关需要随访或进一步的研究证实。
本研究结果显示,0~2岁婴幼儿及亚组(7~12月组、19~24月组)中,TBI组双侧壳核的T1与T2加权比值均低于HC组,提示TBI婴幼儿壳核的髓鞘损伤。壳核在学习和运动技能中发挥着重要作用,特别是在躯体运动的启动和执行过程中 [51] 。19~24月亚组中,TBI组左侧苍白球的T1与T2加权比值低于HC组。壳核与苍白球是参与主动抑制的功能网络,与自上而下的运动控制有关 [50] 。这些基底节通过抑制丘脑活动,进而阻止运动 [52.53] 。TBI后壳核与苍白球损伤导致的执行功能障碍表现为难以抑制冲动和习惯性行为 [54] 。结合本研究结果提示,当婴幼儿壳核和苍白球损伤时,患儿可能有学习、运动及主动抑制方面的功能障碍。
本研究结果显示,0~2岁婴幼儿及亚组(7~12月组、19~24月组)中,TBI组左侧梭状回的T1与T2加权比值降低,提示TBI患儿的髓磷脂含量减少。相关研究显示,梭状回在面部和视觉认知过程中发挥着重要作用 [55.56] 。角回一般与阅读困难和语义性失语有关 [57.58] 。有研究发现,反复TBI的患儿在角回18氟代脱氧葡萄糖(18F.FDG) PET摄取量减少 [59] 。本研究结果显示,0~2岁婴幼儿及亚组(19~24月组)中,TBI组角回的T1与T2加权比值均降低,提示TBI婴幼儿可能出现相应的神经认知功能障碍。既往研究表明,儿童轻度TBI后4周,角回与梭状回在默认模式网络(default mode network,DMN)的功能连接降低 [60] ,相应区域的灰质体积减小 [61] 。该DMN参与社会认知和知觉认知过程 [62] 。结合本研究结果提示,角回和梭状回髓鞘的损伤可能是婴幼儿脑外伤后观察到认知困难的基础。目前的研究尚未明确DMN连接的变化是脑损伤的直接影响还是损伤后的代偿机制 [60] 。
补充运动区主要参与执行过程中的运动规划 [63] 。一项研究表明,TBI后患儿补充运动区的损伤与肢体的运动性失用有关 [64] 。另一项功能磁共振静息态技术研究表明,脑创伤后帕金森综合征的患儿与动作相关的任务中,补充运动区与初级感觉运动皮质(运动执行)和顶下回(动作提取和运动想象)皮质区的激活减低 [63] 。本研究结果显示,0~2岁婴幼儿及亚组(7~12月组、19~24月组)中,TBI组左侧补充运动区的T1与T2加权比值低于HC组,提示TBI婴幼儿可能存在运动规划方面的障碍。
本研究结果显示,0~2岁婴幼儿及亚组(19~24月组)中,两组海马的T1与T2加权比值存在差异,且TBI组低于HC组,提示TBI组婴幼儿海马髓鞘可能丢失。既往定量核磁共振研究表明,言语和情景记忆可能与TBI儿童的海马体积减小有关 [65.66] ,且海马结构的损伤程度与记忆障碍的严重程度相关 [67] 。有研究表明,正常发育儿童的灰质髓鞘含量与灰质体积呈正相关 [39] 。上述研究结果均提示,TBI婴幼儿海马髓鞘的改变可能导致海马体积减小,且与婴幼儿、儿童言语和情景记忆障碍有关。海马结构损伤可能中断海马与杏仁核的联系,从而使儿童表现出记忆、学习和情绪功能的障碍 [68] 。
本研究结果显示,19~24月亚组中,TBI组海马旁回与中央旁回T1与T2加权比值低于HC组。除与记忆功能有关外,海马在步态功能中发挥着重要作用,海马和邻近的海马旁回形成了空间表征系统,应用于跟踪在空间中的自我运动 [69.70] 。相关研究表明,海马与平衡、步态控制和寻路运动功能存在联系 [71.72] 。中央旁回是执行运动任务的控制中心,是大脑内侧表面的初级感觉和运动皮质的延续,通常与步态执行有关,当中央旁回损伤时表现步长的不对称性 [73] 。有研究表明,青少年TBI后的步态障碍与海马、海马旁回及中央旁回的体积减小有关 [73] 。Gilmore等 [39] 研究认为,正常发育儿童的灰质髓鞘含量与灰质体积呈正相关。上述研究结果提示,TBI后海马旁回及中央旁回髓鞘损伤可 能导致婴幼儿步态障碍,揭示了神经损伤的基础。
3.2 T1与T2加权比值的发育轨迹
本研究应用二次拟合曲线建立了TBI组与HC组全脑和有代表性脑区灰质T1与T2加权比值的发育轨迹,结果表明,与HC组持续快速增长的发育轨迹不同,TBI组的发育轨迹表现为在0~16月T1与T2加权比值快速上升,之后到2岁下降。从发育轨迹图可知,TBI组T1与T2加权比值整体低于HC组。有研究显示,髓鞘形成与灰质体积增长速率存在定性关系,健康婴幼儿脑总体灰质体积在出生后第1年增加108%,第2年增加19% [39] 。表明灰质髓鞘在第1年快速增长,第2年增长速度变慢。从发育轨迹图可知,19~24月时,TBI组和HC组T1与T2加权比值差异最大,表明19~24月的TBI婴幼儿经过快速髓鞘化后可能导致明显的髓鞘损伤。从发育轨迹可知,0~16月壳核T1与T2比值迅速增加。有研究表明,3~13月健康婴幼儿壳核灰质体积显著增长 [40] 。
本研究存在以下不足:1)样本量有限,局限于横断面数据探索婴幼儿TBI后髓鞘的改变及发育轨迹。今后将进行大样本量、随访追踪进行婴幼儿和儿童TBI后灰质及白质髓鞘改变的纵向拓展研究。2)虽然髓鞘形成较大程度上决定了T1与T2加权比值;然而某些因素,如炎症、水肿、代谢、萎缩或铁积累可能对T1与T2加权比值产生影响 [74] 。3)TBI后颅脑损伤的严重程度根据格拉斯哥昏迷评分(Glasgow Coma Score,GCS)分为轻度、中度和重度 [75] ,本研究未考虑到这一点,今后将探讨GCS评分和T1与T2加权比值的相关性,帮助临床尽早干预,改善预后。4)本研究关于TBI后髓鞘损伤的改变与患儿认知、行为和执行运动障碍之间的关联处于推理阶段,今后需采用认知发育量表进一步深入研究。
综上所述,基于T1与T2加权比值的方法研究了TBI婴幼儿灰质髓鞘结构的改变,结果显示,尾状核、壳核和海马可能为TBI婴幼儿脑灰质髓鞘损伤的易损脑区,提示了TBI后髓鞘损伤可能导致婴幼儿出现神经认知、运动及执行功能障碍;TBI组婴幼儿的整体T1与T2加权比值低于HC组,且在19~24月最明显。T1与T2加权比值可作为评估TBI婴幼儿脑灰质髓鞘改变的替代指标,为TBI患儿脑灰质的研究提供了新思路。
参考文献:
[1] CAPIZZI A, WOO J,VERDUZCO.GUTIERREZ M.Traumatic brain injury:an overview of epidemiology,pathophysiology,and medical management[J].The Medical Clinics of North America,2020,104(2):213.238.
[2] KEENAN H T, CLARK A,HOLUBKOV R, et al .Longitudinal developmental outcomes of infants and toddlers with traumatic brain injury[J].JAMA Network Open,2023,6(1):e2251195.
[3] LINDSEY H M, WILDE E A,CAEYENBERGHS K, et al .Longitudinal neuroimaging in pediatric traumatic brain injury:current state and consideration of factors that influence recovery[J].Frontiers in Neurology,2019,10:1296.
[4] ALIZADEH A, DYCK S M,KARIMI.ABDOLREZAEE S.Traumatic spinal cord injury:an overview of pathophysiology,models and acute injury mechanisms[J].Frontiers in Neurology,2019,10:282.
[5] JOHNSON V E, STEWART W,SMITH D H.Axonal pathology in traumatic brain injury[J].Experimental Neurology,2013,246:35.43.
[6] DENNIS E L, JIN Y,VILLALON.REINA J E, et al .White matter disruption in moderate/severe pediatric traumatic brain injury:advanced tract.based analyses[J].NeuroImage:Clinical,2015,7:493.505.
[7] ROBERTS R M, MATHIAS J L,ROSE S E.Relationship between diffusion tensor imaging(DTI) findings and cognition following pediatric TBI:a meta.analytic review[J].Developmental Neuropsychology,2016,41(3):176.200.
[8] HUNTEMER.SILVEIRA A, PATIL N,BRICKNER M A, et al .Strategies for oligodendrocyte and myelin repair in traumatic CNS injury[J].Frontiers in Cellular Neuroscience,2021,14:619707.
[9] FISCHER I, DULIN J N,LANE M A.Transplanting neural progenitor cells to restore connectivity after spinal cord injury[J].Nature Reviews Neuroscience,2020,21:366.383.
[10] DUBOIS J, DEHAENE.LAMBERTZ G,KULIKOVA S, et al .The early development of brain white matter:a review of imaging studies in fetuses,newborns and infants[J].Neuroscience,2014,276:48.71.
[11] LEBEL C, WALKER L,LEEMANS A, et al .Microstructural maturation of the human brain from childhood to adulthood[J].NeuroImage,2008,40(3):1044.1055.
[12] REYNOLDS J E, GROHS M N,DEWEY D, et al .Global and regional white matter development in early childhood[J].NeuroImage,2019,196:49.58.
[13] BAUMANN N, PHAM.DINH D.Biology of oligodendrocyte and myelin in the mammalian central nervous system[J].Physiological Reviews,2001,81(2):871.927.
[14] LIU S, LI A,ZHU M F, et al .Genetic influences on cortical myelination in the human brain[J].Genes,Brain,and Behavior,2019,18(4):e12537.
[15] MCDOUGALL S, VARGAS RIAD W,SILVA.GOTAY A, et al .Myelination of axons corresponds with faster transmission speed in the prefrontal cortex of developing male rats[J].eDeuro,2018,5(4):ENEURO.0203.18.2018.
[16] MOUNT C W, MONJE M.Wrapped to adapt:experience.dependent myelination[J].Neuron,2017,95(4):743.756.
[17] DEONI S C L, DEAN D C,REMER J, et al .Cortical maturation and myelination in healthy toddlers and young children[J].Neuro Image,2015,115:147.161.
[18] NIEUWENHUYS R. The myeloarchitectonic studies on the human cerebral cortex of the Vogt.Vogt school,and their significance for the interpretation of functional neuroimaging data[J].Brain Structure and Function,2013,218(2):303.352.
[19] VAN DER KOUWE A J W, BENNER T,SALAT D H, et al .Brain morphometry with multiecho MPRAGE[J].Neuro Image,2008,40(2):559.569.
[20] LIAUW L, VAN DER GROND J,VAN DEN BERG. HUYSMANS A A, et al .Hypoxic.ischemic encephalopathy:diagnostic value of conventional MR imaging pulse sequences in term.born neonates[J].Radiology,2008,247(1):204.212.
[21] RUTHERFORD M A, WARD P,MALAMATENTIOU C.Advanced MR techniques in the term.born neonate with perinatal brain injury[J].Seminars in Fetal and Neonatal Medicine,2005,10(5):445.460.
[22] ENGELBRECHT V, RASSEK M,PREISS S, et al .Age.dependent changes in magnetization transfer contrast of white matter in the pediatric brain[J].American Journal of Neuroradiology,1998,19(10):1923.1929.
[23] SOUN J E, LIU M Z,CAULEY K A, et al .Evaluation of neonatal brain myelination using the T1. and T2.weighted MRI ratio[J].Journal of Magnetic Resonance Imaging,2017,46(3):690.696.
[24] GLASSER M F, VAN ESSEN D C.Mapping human cortical areas in vivo based on myelin content as revealed by T1. and T2.weighted MRI[J].The Journal of Neuroscience,2011,31(32):11597.11616.
[25] GANZETTI M, WENDEROTH N,MANTINI D.Whole brain myelin mapping using T1. and T2.weighted MR imaging data[J].Frontiers in Human Neuroscience,2014,8:671.
[26] UDDIN M N, FIGLEY T D,SOLAR K G, et al .Comparisons between multi.component myelin water fraction,T1w/T2w ratio,and diffusion tensor imaging measures in healthy human brain structures[J].Scientific Reports,2019,9:2500.
[27] DARKI F, NYSTRM P,MCALONAN G, et al .T1.weighted/T2.weighted ratio mapping at 5 months captures individual differences in behavioral development and differentiates infants at familial risk for autism from controls[J].Cerebral Cortex,2021,31(9):4068.4077.
[28] GRYDELAND H, WALHOVD K B,TAMNES C K, et al .Intracortical myelin links with performance variability across the human lifespan:results from T1. and T2.weighted MRI myelin mapping and diffusion tensor imaging[J].The Journal of Neuroscience,2013,33(47):18618.18630.
[29] SHAFEE R, BUCKNER R L,FISCHL B.Gray matter myelination of 1 555 human brains using partial volume corrected MRI images[J].Neuro Image,2015,105:473.485.
[30] FILIMONOVA E, AMELINA E,SAZONOVA A, et al . Assessment of normal myelination in infants and young children using the T1w/T2w mapping technique[J].Frontiers in Neuroscience,2023,17:1102691.
[31] 朱琳琳, 王苗苗,李贤军,等.应用T1与T2加权比探讨阿尔茨海默病患者脑白质纤维髓鞘的改变[J].磁共振成像,2023,14(3):36.41.
[32] GORDON E M, MAY G J,NELSON S M.MRI.based measures of intracortical myelin are sensitive to a history of TBI and are associated with functional connectivity[J].Neuro Image,2019,200:199.209.
[33] MAHONEY S O, CHOWDHURY N F,NGO V, et al .Mild traumatic brain injury results in significant and lasting cortical demyelination[J].Frontiers in Neurology,2022,13:854396.
[34] SHI F, YAP P T,WU G R, et al .Infant brain atlases from neonates to 1. and 2.year.olds[J].PLoS One,2011,6(4):e18746.
[35] FIELDS R D. Neuroscience.myelin.more than insulation[J].Science,2014,344(6181):264.266.
[36] SHAW P, KABANI N J,LERCH J P, et al .Neurodevelopmental trajectories of the human cerebral cortex[J].The Journal of Neuroscience,2008,28(14):3586.3594.
[37] KNICKMEYER R C, GOUTTARD S,KANG C, et al .A structural MRI study of human brain development from birth to 2 years[J].The Journal of Neuroscience,2008,28(47):12176.12182.
[38] AU A K, CLARK R S B.Paediatric traumatic brain injury:prognostic insights and outlooks[J].Current Opinion in Neurology,2017,30(6):565.572.
[39] GILMORE J H, SHI F,WOOLSON S L, et al .Longitudinal development of cortical and subcortical gray matter from birth to 2 years[J].Cerebral Cortex,2012,22(11):2478.2485.
[40] CHOE M S, ORTIZ.MANTILLA S,MAKRIS N, et al .Regional infant brain development:an MRI.based morphometric analysis in 3 to 13 month olds[J].Cerebral Cortex,2013,23(9):2100.2117.
[41] MAYER A R, MEIER T B,DODD A B, et al .Prospective study of gray matter atrophy following pediatric mild traumatic brain injury[J].Neurology,2023,100(5):e516.e527.
[42] GEDDES D M, LAPLACA M C,CARGILL R S.Susceptibility of hippocampal neurons to mechanically induced injury[J].Experimental Neurology,2003,184(1):420.427.
[43] TASKER R C, SALMOND C H,WESTLAND A G, et al .Head circumference and brain and hippocampal volume after severe traumatic brain injury in childhood[J].Pediatric Research,2005,58(2):302.308.
[44] KOTAPKA M J, GENNARELLI T A,GRAHAM D I, et al .Selective vulnerability of hippocampal neurons in acceleration.induced experimental head injury[J].Journal of Neurotrauma,1991,8(4):247.258.
[45] HABER S N. The primate basal Ganglia:parallel and integrative networks[J].Journal of Chemical Neuroanatomy,2003,26(4):317.330.
[46] UNSCHULD P G, JOEL S E,LIU X Y, et al .Impaired cortico.striatal functional connectivity in prodromal Huntington′s disease[J].Neuroscience Letters,2012,514(2):204.209.
[47] YETERIAN E H, VAN HOESEN G W.Cortico.striate projections in the rhesus monkey:the organization of certain cortico.caudate connections[J].Brain Research,1978,139(1):43.63.
[48] KERNS J G, COHEN J D,MACDONALD A W, et al .Anterior cingulate conflict monitoring and adjustments in control[J].Science,2004,303(5660):1023.1026.
[49] SHENHAV A, BOTVINICK M M,COHEN J D.The expected value of control:an integrative theory of anterior cingulate cortex function[J].Neuron,2013,79(2):217.240.
[50] BUSH G, FRAZIER J A,RAUCH S L, et al .Anterior cingulate cortex dysfunction in attention.deficit/hyperactivity disorder revealed by fMRI and the Counting Stroop[J].Biological Psychiatry,1999,45(12):1542.1552.
[51] PACKARD M G, KNOWLTON B J.Learning and memory functions of the Basal Ganglia[J].Annual Review of Neuroscience,2002,25:563.593.
[52] SCHMIDT R, LEVENTHAL D K,MALLET N, et al .Canceling actions involves a race between basal Ganglia pathways[J].Nature Neuroscience,2013,16:1118.1124.
[53] PRAN P, CATANI S,FALLETTA CARAVASSO C, et al .Supplementary motor area activation is impaired in severe traumatic brain injury Parkinsonism[J].Journal of Neurotrauma,2014,31(7):642.648.
[54] RAO V, LYKETSOS C.Neuropsychiatric sequelae of traumatic brain injury[J].Psychosomatics,2000,41(2):95.103.
[55] KANWISHER N, MCDERMOTT J,CHUN M M.The fusiform face area:a module in human extrastriate cortex specialized for face perception[J].The Journal of Neuroscience,1997,17(11):4302.4311.
[56] BUCKNER R L, KRIENEN F M.The evolution of distributed association networks in the human brain[J].Trends in Cognitive Sciences,2013,17(12):648.665.
[57] BEAUVOIS M F, SAILLANT B,MEININGER V, et al .Bilateral tactile aphasia:a tacto.verbal dysfunction[J].Brain,1978,101(3):381.401.
[58] BANG S A, SONG Y S,MOON B S, et al .Neuropsychological,metabolic,and GABAA receptor studies in subjects with repetitive traumatic brain injury[J].Journal of Neurotrauma,2016,33(11):1005.1014.
[59] TUERK C, DGEILH F,CATROPPA C, et al .Pediatric moderate.severe traumatic brain injury and gray matter structural covariance networks:a preliminary longitudinal investigation[J].Developmental Neuroscience,2021,43(6):335.347.
[60] IYER K K, ZALESKY A,BARLOW K M, et al .Default mode network anatomy and function is linked to pediatric concussion recovery[J].Annals of Clinical and Translational Neurology,2019,6(12):2544.2554.
[61] WANG X Y, HAN Z Z,HE Y, et al .Where color rests:spontaneous brain activity of bilateral fusiform and lingual regions predicts object color knowledge performance[J].NeuroImage,2013,76:252.263.
[62] TUERK C, DGEILH F,CATROPPA C, et al .Altered resting.state functional connectivity within the developing social brain after pediatric traumatic brain injury[J].Human Brain Mapping,2020,41(2):561.576.
[63] JANG S H, SEO J P.Motor execution problem due to injured corticofugal tracts from the supplementary motor area in a patient with mild traumatic brain injury[J].American Journal of Physical Medicine & Rehabilitation,2017,96(10):e193.
[64] PUGH K R, MENCL W E,SHAYWITZ B A, et al .The angular gyrus in developmental dyslexia:task.specific differences in functional connectivity within posterior cortex[J].Psychological Science,2000,11(1):51.56.
[65] YEATES K O, LURIA J,BARTKOWSKI H, et al .Postconcussive symptoms in children with mild closed head injuries[J].The Journal of Head Trauma Rehabilitation,1999,14(4):337.350.
[66] BIGLER E D, FINUF C,ABILDSKOV T J, et al .Cortical thickness in pediatric mild traumatic brain injury including sports.related concussion[J].International Journal of Psychophysiology,2018,132:99.104.
[67] HERGERT D C, SICARD V,STEPHENSON D D, et al .Test.retest reliability of a semi.structured interview to aid in pediatric traumatic brain injury diagnosis[J].Journal of the International Neuropsychological Society,2022,28(7):687.699.
[68] DRIJKONINGEN D, CHALAVI S,SUNAERT S, et al .Regional gray matter volume loss is associated with gait impairments in young brain.injured individuals[J].Journal of Neurotrauma,2017,34(5):1022.1034.
[69] EPSTEIN R A .Parahippocampal and retrosplenial contributions to human spatial navigation[J].Trends in Cognitive Sciences,2008,12(10):388.396.
[70] MOSER E I, KROPFF E,MOSER M B.Place cells,grid cells,and the brain′s spatial representation system[J].Annual Review of Neuroscience,2008,31:69.89.
[71] PAYLOR R, ZHAO Y,LIBBEY M, et al .Learning impairments and motor dysfunctions in adult Lhx5.deficient mice displaying hippocampal disorganization[J].Physiology & Behavior,2001,73(5):781.792.
[72] RIVAS J, GAZTELU J M,GARCA.AUSTT E.Changes in hippocampal cell discharge patterns and Theta rhythm spectral properties as a function of walking velocity in the guinea pig[J].Experimental Brain Research,1996,108(1):113.118.
[73] ZIELINSKI B A, GENNATAS E D,ZHOU J, et al .Network.level structural covariance in the developing brain[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(42):18191.18196.
[74] GLASSER M F, COALSON T S,HARMS M P, et al .Empirical transmit field bias correction of T1w/T2w myelin maps[J].Neuro Image,2022,258:119360.
[75] TEASDALE G, JENNETT B.Assessment of coma and impaired consciousness.A practical scale[J].Lancet,1974,2(7872):81.84.
(收稿日期:2023.12.05)
(本文编辑 薛妮)

