芹菜素调控Caveolin.1对慢性心力衰竭大鼠血管紧张素1.7及左室舒张功能的影响
俞志军 张桂娟 陈丽新 杨森林 崔玉祥
摘要 目的: 探讨芹菜素通过调控窖蛋白.1(Caveolin.1)对慢性心力衰竭(CHF)大鼠血管紧张素1.7(Ang1.7)及左室舒张功能的机制研究。 方法: 按照随机数字表法将大鼠分为假手术(Sham)组、CHF组、芹菜素组、Caveolin.1组及联合组,每组10只,除Sham组外均建立CHF大鼠模型。建模后24 h,芹菜素组大鼠腹腔注射2 mg/kg的芹菜素,Caveolin.1组腹腔注射1.2 mg/kg的Caveolin.1质粒的脂质体溶液,联合组大鼠腹腔注射2 mg/kg的芹菜素及1.2 mg/kg的Caveolin.1质粒的脂质体溶液,Sham组及CHF组大鼠腹腔注射等体积生理盐水。比较各组大鼠心脏收缩及舒张功能指标、血清因子水平;苏木精.伊红(HE)染色检测心肌组织病理形 态;电镜观察心房超微结构;免疫组化检测心肌组织血管生成情况;蛋白免疫印迹检测心肌组织Caveolin.1、缺氧诱导因子1(HIF.1)、 血管内皮生长因子(VEGF)蛋白水平。 结果: CHF组与Sham组比较, 大鼠左心室射血分数(LVEF)、左心室短轴缩短率(LVFS)、Ang1.7 及Caveolin.1蛋白、HIF.1蛋白、VEGF蛋白降低,左心室舒张末期内径(LVEDD)、左心室收缩末期内径(LVESD)、左心室舒张末期容积(LVEDV)、左心室收缩末期容积(LVESV)、 血管紧张素Ⅱ(AngⅡ)、醛固酮(ALD)、肾素活性(PRA)升高,差异有统计学意义( P <0.05); 芹菜素组、Caveolin.1组与CHF组比较,大鼠LVEF、LVFS、Ang1.7、Caveolin.1蛋白、HIF.1蛋白、VEGF蛋白及血管数目升高,LVESD、LVEDD、LVEDV、LVESV、AngⅡ、ALD、PRA降低,差异有统计学意义( P <0.05);芹菜素组与Caveolin.1组各指标比较,差异均无统计学意义( P >0.05);联合组与芹菜素组及
Caveolin.1组
各指标比较,差异均有统计学意义( P <0.05)。 结论: 芹菜素对慢性心力衰竭大鼠心脏舒张及收缩功能具有改善作用,并可通过上调Ang1.7改善心肌重塑从而保护心脏,其机制可能与激活Caveolin.1表达而增加心肌新生血管相关。
关键词 慢性心力衰竭;芹菜素;心功能;血管紧张素1.7;窖蛋白.1
doi: 10.12102/j.issn.1672.1349.2024.09.009
Effects of Apigenin Regulating Caveolin.1 on Angiotensin 1.7 and Left Ventricular Diastolic Function in Rats with Chronic Heart Failure
YU Zhijun, ZHANG Guijuan, CHEN Lixin, YANG Senlin, CUI Yuxiang
Tangshan Hongci Hospital, Tangshan 063000, Hebei, China
Corresponding Author ZHANG Guijuan, E.mail: tshcyy_yzj@126.com
Abstract Objective: To investigate the effect of apigenin regulating Caveolin.1 on angiotensin 1.7(Ang1.7) and left ventricular diastolic function in rats with chronic heart failure. Methods: According to random number table method,the rats were divided into Sham group,chronic heart failure(CHF) group,apigenin group,Caveolin.1 group and combined group with 10 rats in each group.CHF rat models were established except Sham group.24 h after modeling,the apigenin group rats were intraperitoneally injected 2 mg/kg apigenin,Caveolin.1 group was intraperitoneally injected with 1.2 mg/kg liposome solution of Caveolin.1 plasmid,rats in the combined group were intraperitoneally injected with 2 mg/kg apigenin and 1.2 mg/kg liposome solution of Caveolin.1 plasmid,rats in Sham group and CHF group were intraperitoneally injected with equal volume of normal saline.Cardiac systolic and diastolic function indexes and serum factor levels were compared among all groups.Hematoxylin.eosin(HE) staining was used to detect the pathological morphology of myocardium.The ultrastructure of atrium was observed by electron microscope.Myocardial angiogenesis was detected by protein immunohistochemistry.The protein levels of hypoxia.inducing factor 1(HIF.1),Caveolin.1,vascular endothelial growth factor(VEGF) were detected by Western Blot. Results: Compared with Sham group,left ventricular ejection fraction(LVEF),left ventricular short axis shortening rate(LVFS),Ang1.7,Caveolin.1,HIF.1,VEGF,and vascular number decreased in CHF group( P <0.05).Compared with Sham group,left ventricular end.diastolic diameter(LVEDD),left ventricular end.systolic diameter(LVESD),left ventricular end.diastolic volume(LVEDV),left ventricular end.systolic volume(LVESV),angiotensin Ⅱ(AngⅡ),aldosterone(ALD) and renin activity(PRA) increased in CHF group( P <0.05).Compared with CHF group,LVEF,LVFS,Ang1.7,Caveolin.1,HIF.1,VEGF,and the number of blood vessels in apigenin group and Caveolin.1 group increased,LVESD,LVEDD,LVEDV,LVESV,AngⅡ,ALD and PRA decreased( P <0.05).There were no significant differences between apigenin group and Caveolin.1 group( P >0.05).Compared with apigenin group,combined group and Caveolin.1 group,there were statistically significant differences in all indexes( P <0.05). Conclusion: Apigenin can improve cardiac diastolic and systolic functions in rats with chronic heart failure,and can improve myocardial remodeling and protect the heart by upregulating Ang1.7.The mechanism may be related to the activation of Caveolin.1 expression and the increase of myocardial angiogenesis.
Keywords chronic heart failure; apigenin; cardiac function; angiotensin 1.7; Caveolin.1
慢性心力衰竭(chronic heart failure,CHF)是多种心脏疾病发展至终末出现的疾病 [1] 。CHF主要为心肌结构及功能的改变,5年死亡率高达30% [2] 。心肌重塑是CHF发生发展过程中的主要病机,在此过程中神经内分泌相关因子血管紧张素(Ang)Ⅱ可参与CHF发生的全过程。Ang1.7是血管紧张素的成员之一,与血管紧张素转换酶2(ACE2)形成复合物而抑制心肌重塑,改善心脏功能 [3] 。心脏的最基本作用为泵血,维持机体组织器官血氧供应,但CHF发生时泵血功能大幅度降低,心肌舒张、收缩功能障碍,损伤心肌组织的同时增加心脏失代偿状态,进一步促进CHF发生。因此,调节心室舒张及收缩功能障碍对于改善疾病具有重要作用。
胞膜窖(caveolae)是心肌细胞膜上存在的一类结构,首个发现的蛋白为窖蛋白.1(Caveolin.1)。研究表明,Caveolin.1在心脏疾病发生发展过程中起重要作用,当敲除Caveolin.1基因时会增加心肌肥大、心力衰竭及扩张型心肌病等的发生风险,因此,Caveolin.1可作为缓解上述疾病损伤的干预靶点之一 [4] 。研究表 明,Caveolin.1缺失小鼠出现扩张型心肌病,Caveolin.1 表达降低可诱发心肌梗死,其缺失后信号传导转录激活子3(STAT3)上调可使细胞周期蛋白(cyclin)D1、D3表达上调而加重心肌损伤 [5] 。芹菜素是黄酮类化合物,在自然界广泛分布,可发挥抗肿瘤、抗病毒及抗氧化应激的作用。另有研究表明,芹菜素可以降低心血管疾病的发生,具有心肌保护作用 [6] 。在缺氧心肌细胞中,采用芹菜素预处理后可通过调节细胞内B淋巴细胞瘤.2基因(Bcl.2)及Bcl.2关联X蛋白(Bax)而抑制心肌细胞凋亡 [7] 。本研究探讨芹菜素调控Caveolin.1对CHF大鼠Ang1.7及左室舒张功能的机制研究,为CHF疾病的用药选择提供参考依据。
1 材料与方法
1.1 实验动物
Sprague.Dawley成年雄性大鼠55只购自北京大学医学部动物中心,合格证号:SCXK(京)2021.0009, 体质量240~260 g,鼠龄4~5周。每笼5只,温度23 ℃ 左右,湿度50%左右,黑夜白昼交替循环,自由饮水,标准颗粒饲料进食饲养。实验前,所有大鼠适应环境1周,严格按照动物使用指南进行实验。
1.2 主要试剂与仪器
芹菜素[阿拉丁试剂(上海)有限公司];pCDNA3.1(+)Caveolin.1(南华大学药物药理研究所赠);Caveolin.1抗体、血管内皮生长因子(VEGF)抗体及缺氧诱导因子1(HIF.1)抗体(美国Abcam公司);二喹啉甲酸(BCA)蛋白试剂盒(天津金克隆生物技术有限公司);甘油醛.3.磷酸脱氢酶(GAPDH)抗体(圣克鲁斯生物有限公司);苏木精.伊红(HE)试剂盒(湖北康迪斯化工有限公司);低温高速离心机(河北慧采科技有限公司);S80彩色多普勒超声诊断仪(大为医疗有限公司);显微镜(苏州景通仪器公司);自动生化分析仪(Au5400,Beckman Coulter Inc.,Massachusetts,CA,USA);普通显微镜(Olympus,Japan);蛋白电泳仪(北京六一仪器厂);D700 LAB彩超诊断仪(飞依诺科技)。
1.3 CHF动物模型的建立
参考文献[8]建立心力衰竭动物模型,建模前对所有大鼠均采用S80彩色多普勒超声诊 断仪进行心脏检查,确保心功能正常。采用1%戊巴比妥钠40 mg/kg 麻醉大鼠后,连接小动物呼吸机,在第3肋和第4肋间分离皮肤后剪开心包,采用6.0丝线结扎左侧心耳及动脉圆锥正下方2 mm处,后缝合皮肤,待大鼠自主呼吸后撤掉呼吸机,连续3 d注射40×10 4 U的青霉素。选取10只大鼠作为假手术(Sham)组,Sham组大鼠仅切口穿线不结扎。4周后,当大鼠出现精神萎靡、活动量下降、皮毛粗糙及饮食饮水减少,进行心脏超声检查,以左心室射血分数(LVEF)<60%为建模成功,最终因感染导致死亡5只,共有40只大鼠建模成功。
1.4 分组及干预方法
将造模成功的40只大鼠采用随机数字表法分为CHF组、芹菜素组、Caveolin.1组及联合组,每组10只。建模成功后,芹菜素组大鼠腹腔注射2 mg/kg的芹菜素 [9] ,Caveolin.1组参考文献[10]腹腔 注射1.2 mg/kg的Caveolin.1质粒的脂质体溶液[将pCDNA3.1 (+)Caveolin.1与lipofectamine TM 2000稀释,按1∶3静置4 min,混合,静置20 min];联合组大鼠腹腔注射2 mg/kg的芹菜素及1.2 mg/kg的Caveolin.1质粒的脂质体溶液;Sham组及CHF组大鼠腹腔注射等体积生理盐水。
1.5 心脏收缩及舒张功能指标
干预24 h后,采用1%戊巴比妥钠(40 mg/kg)腹腔麻醉,采用D700 LAB彩超诊断仪心动图检查,频率为9 MHz,深度为4 cm,记录大鼠左心室舒张末期内径(LVEDD)、左心室收缩末期内径(LVESD)、左心室舒张末期容积(LVEDV)、左心室收缩末期容积(LVESV)、LVEF、左心室短轴缩短率(LVFS)。
1.6 酶联免疫吸附法(ELISA)检测血清因子水平
干预24 h后,各组随机处死5只大鼠,采集主动脉血5 mL,采用高速冷冻离心机对外周血按照3 000 r/min离心10 min,保留血清,ELISA试剂盒检测肾素活性(PRA)、血管紧张素Ⅱ(AngⅡ)以及醛固酮(ALD)、Ang1.7水平,严格按照试剂盒操作进行,然后通过标准曲线计算含量。
1.7 HE染色检测心肌组织病理形态
干预24 h后,取各组剩余的5只大鼠,麻醉处死,分离心脏切片后液氮保存。心肌组织放入10%的多聚甲醛固定,切片4 μm,放入37 ℃复温15 min,二苯甲脱蜡后按照100%、95%、85%、75%乙醇进行逐层脱水,苏木精染色10 min,1%盐酸处理,伊红复染, 100%、95%、85%、75%乙醇脱水,封片后观察组织 形态。
1.8 电镜观察心房超微结构
左心房组织采用3%的戊二醛固定后,采用醋酸 双氧铀.柠檬酸铅进行组织染色,采用日本电子 JEM.1200EX透射电镜观察心肌组织超微结构,电压为70 kV,倍数为1 000~20 000。
1.9 免疫组化检测心肌组织血管生成情况
取各组大鼠心肌组织,用二甲苯进行两次脱蜡,每次20 min,再用乙醇进行梯度浸泡水化,冲净并擦干后用过氧化氢温室孵育10 min,强磷酸盐缓冲液(PBS)冲洗3次,用柠檬酸盐缓冲液进行微波热修复,按说明书用封闭液稀释一抗(1∶200),加入稀释的CD 31 一抗,4 ℃冰箱过夜后洗膜;加入稀释的辣根过氧化物酶标记山羊抗兔IgG二抗(1∶200),37 ℃水浴30 min;洗膜后,用二氨基联苯胺(DAB)进行显色,PBS洗涤3次后用苏木素复染后中性树胶封片,用DAB处理样 本,在400倍视野下观察计算随机5个视野中血管 数目。
1.10 蛋白免疫印迹检测心肌组织Caveolin.1、HIF.1、VEGF蛋白水平
心肌组织采用PBS冲洗后切碎,加入1 mL细胞裂解液,10 000×g,4 ℃离心5 min,取上清液,加入样孔中,采用BCA法检测总蛋白浓度,每孔上样蛋白量 20 μg,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS.PAGE) 凝胶电泳。转印缓冲液配制好后放入4 ℃冰箱内预冷,然后全部转移到聚偏二氟乙烯膜 (PVDF)上,加入脱脂奶粉,全程封闭1 h。加入一抗Caveolin.1 (1∶100)、VEGF(1∶200)及HIF.1(1∶500),TBS.吐温20(TTBS)漂洗3次,每次10 min;4 ℃过夜,加入羊抗兔 IgG二抗(1∶2 500),电化学发光法(ECL) 系统JY.Clear分析蛋白相对表达量。
1.11 统计学处理
采用GraphPad Prism 8软件进行数据分析。符合正态分布的定量资料以均数±标准差( x ± s )表示,组间两两比较采用LSD. t 检验,多组间比较采用单因素方差分析。以 P <0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠心脏收缩、舒张功能比较
与Sham组比较,CHF组大鼠LVEF、LVFS降低,LVESD、LVEDD、LVEDV及LVESV升高( P <0.05);与CHF组比较,芹菜素组及Caveolin.1组大鼠LVEF、LVFS升高,LVESD、LVEDD、LVEDV及LVESV降低( P <0.05);芹菜素组与Caveolin.1组上述指标比较,差异无统计学意义( P >0.05);与芹菜素组及Caveolin.1组比较,联合组大鼠LVEF、LVFS升高,LVESD、LVEDD、LVEDV及LVESV降低( P <0.05)。详见表1。
2.2 各组大鼠血清AngⅡ、ALD、PRA、Ang1.7水平比较
与Sham组比较,CHF组大鼠Ang1.7降低,ALD、AngⅡ、PRA升高( P <0.05);与CHF组比较,芹菜素组及Caveolin.1组大鼠Ang1.7升高,AngⅡ、ALD、PRA降低( P <0.05);芹菜素组与Caveolin.1组上述指标比较,差异无统计学意义( P >0.05);与芹菜素组及 Caveolin.1组比较,联合组大鼠Ang1.7升高,AngⅡ、 ALD、PRA降低( P <0.05)。详见表2。
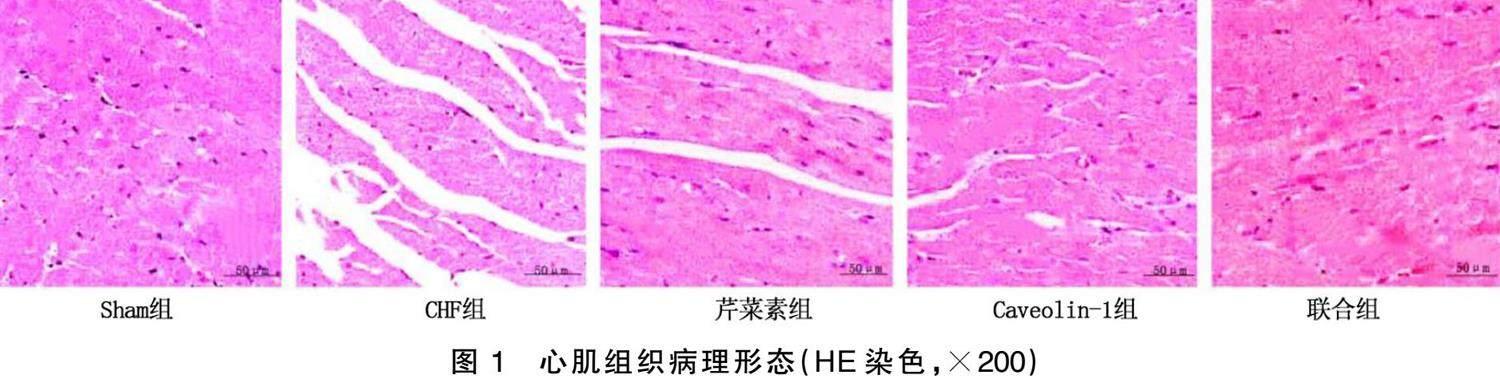
2.3 HE染色观察心肌组织病理形态
Sham组大鼠心肌细胞排列整齐、结构完整,未见坏死。CHF组心肌细胞排列紊乱且形态大小各异,心肌纤维化加重且炎症反应剧烈。芹菜素组及Caveolin.1组大鼠心肌紊乱情况较CHF组显著改善,炎症反应缓解,联合组改善程度优于芹菜素组及Caveolin.1组。详见图1。
2.4 电镜观察心房超微结构
Sham组大鼠心肌组织线粒体肌原纤维束间分布均匀且结构完好,CHF组大鼠心肌组织线粒体肌原纤维束间形态改变呈现不规则及变大趋势,芹菜素组及Caveolin.1组线粒体肌原纤维束间呈现轻度肿胀且单细胞膜完整性较好,联合组肌原纤维束间呈现板层状,肿胀显著改善。详见图2。
2.5 免疫组化检测心肌组织血管生成
CHF组与Sham组血管生成数目比较,差异无统计学意义( t =0.075, P =0.941);与CHF组比较,芹菜素组及Caveolin.1组大鼠心肌组织血管生成数目增多( P <0.05);芹菜素组与Caveolin.1组血管生成数目比较,差异无统计学意义( P >0.05);与芹菜素组及Caveolin.1组比较,联合组大鼠心肌组织血管生成数目增多( P <0.05)。详见图3、图4。
2.6 蛋白免疫印迹法检测心肌组织Caveolin.1、HIF.1、 VEGF水平
与Sham组比较,CHF组大鼠Caveolin.1、HIF.1、VEGF降低( P <0.05);与CHF组比较,芹菜素组及 Caveolin.1组大鼠Caveolin.1、HIF.1、VEGF升高 ( P <0.05);芹菜素组与Caveolin.1组上述指标比较,差异无统计学意义( P >0.05);与芹菜素组比较,联合组大鼠Caveolin.1、HIF.1、VEGF升高( P <0.05)。详见表3、图5。
3 讨 论
本研究结果显示,CHF大鼠LVEF、LVFS降低,LVESD、LVEDD、LVEDV及LVESV升高,芹菜素治疗后可逆转这一现状,认为芹菜素可以改善CHF大鼠心功能。心力衰竭时,左房压力增高、二尖瓣相对关闭不全,加重心肌损伤及心脏射血功能减弱,导致心功能减退 [11] 。芹菜素属于一种天然的无毒副作用的黄酮类化合物,药理活性丰富,在保护心脑血管的同时还具有抗肿瘤作用 [12] 。研究显示,CHF发生发展时氧化应激程度增加,促使心肌细胞电生理、收缩、舒张功能障碍,影响心脏功能 [13] 。
在心肌缺血再灌注模型大鼠中已经证实芹菜素具有心脏保护作用,同时芹菜素也具有较强的抗氧化作用,认为其可以通过抑制脂质过氧化损伤心肌细胞,改善心脏功能 [14] 。本研究结果证实,CHF组大鼠Ang1.7降低,AngⅡ、ALD、PRA升高,芹菜素治疗后Ang1.7升高,AngⅡ、ALD、PRA降低,说明芹菜素可以增加心肌组织Ang1.7而减少心肌重塑。心力衰竭发生过程中Toll样受体(TLR)4与髓样分化因子(MyD)88结合后使得核因子(NF).κB活化,炎性细胞因子得以释放,心室重塑加重。芹菜素可减轻阿霉素导致的心肌损伤,其机制与抑制TLR4表达相关。另有研究表明,芹菜素能增加心肌组织抗氧化能力并可降低血脂水平,还可以抑制Ang.Ⅱ水平而发挥抗心肌纤维化的作用 [15] 。本研究结果显示,CHF组大鼠血管新生数目减少,芹菜素干预后血管新生数目升高,说明芹菜素可以加快心肌组织血管新生,其机制可能与激活Caveolin.1、HIF.1、VEGF蛋白相关。
Caveolin.1在细胞膜上独立的区域,参与多种生理过程,在心血管系统中含量丰富。Caveolin.1表达缺陷的动物模型中,心血管系统显现出明显的异常,如动脉粥样硬化、心肌肥厚、平滑肌细胞增殖等,证明Caveolin.1具有重要的生理功能。Caveolin.1可参与细胞信号传导及血管生成,VEGF是血管生成的强力促进剂,可存在内皮细胞的Caveolin中,但是当敲除Caveolin.1基因,血管功能降低,VEGF作用减弱,说明Caveolin.1是血管生成的关键 [16] 。Caveolin.1可促血管生成并加快缺氧组织细胞功能的恢复,在心肌纤维化大鼠中其表达降低,Caveolin.1过表达后可促血管生成而抑制大鼠心肌纤维化 [17] 。本研究结果表明,CHF组大鼠Caveolin.1、HIF.1、VEGF蛋白降低,芹菜素干预后表达升高,证实芹菜素可以加快血管新生,改善心肌组织缺血损伤,进而缓解病情。
综上所述,芹菜素对慢性心力衰竭大鼠心脏舒张及收缩功能具有改善作用,并可通过上调Ang1.7而改善心肌重塑,保护心脏,研究机制可能与激活Caveolin.1表达而增加心肌血管新生相关。
参考文献:
[1] WONG C M ,HAWKINS N M,EZEKOWITZ J A, et al. Heart failure in young adults is associated with high mortality:a contemporary population.level analysis[J].The Canadian Journal of Cardiology,2017,33(11):1472.1477.
[2] HUANG K, LU S J,ZHONG J H, et al. Effect of atractylodes macrocephala extract on chronic heart failure in rats[J].Tropical Journal of Pharmaceutical Research,2021,18(10):2075.2079.
[3] 杨吕, 黄煜,何庆.调控血管紧张素转化酶2.血管紧张素(1.7).Mas轴是心脏重构和心力衰竭治疗的新靶点[J].中华危重病急救医学,2019,31(11):1425.1428.
[4] TANAKA S ,FUJIO Y,NAKAYAMA H.Caveolae.specific CaMKII signaling in the regulation of voltage.dependent calcium channel and cardiac hypertrophy[J].Frontiers in Physiology,2018,9:1081.
[5] JEAN.FRANOIS J ,ISABELLE M,ROBERT H, et al. Lung remodeling and pulmonary hypertension after myocardial infarction:pathogenic role of reduced caveolin expression[J].Cardiovascular Research,2004,63(4):747.755.
[6] 王峰. 微小RNA.122.5p和155.5p在芹菜素改善TGF.β 1/Smads介导心肌纤维化中的作用研究[D].苏州:苏州大学,2020.
[7] 张楠, 廖海含,陈思,等.芹菜素改善棕榈酸诱导的H9c2心肌细胞凋亡与氧化应激[J].中华生物医学工程杂志,2018,24(3):153.160.
[8] 刘宝辉, 李明凯,罗晓星,等.心力衰竭实验动物模型构建方法研究[J].中国心血管杂志,2013,18(3):233.236.
[9] 朵杰, 汪晓洲.芹菜素与老年大鼠缺血心肌细胞凋亡及Bcl.2、Bax、Caspase.3表达的相关性[J].中国老年学杂志,2017,37(1):54.56.
[10] 杨林, 何永红,沈永岱,等.小鼠窖蛋白.1基因重组腺病毒载体的构建[J].四川大学学报(医学版),2008,39(2):294.297.
[11] 桂艳霞. 左室收缩末期生物力学变化与舒张性心力衰竭发病机制的相关性研究[J].医用生物力学,2020,35(6):744.749.
[12] 赵婷婷, 姜胜,杨一波,等.芹菜素对大鼠心肌缺血再灌注损伤的影响[J].中国临床药理学杂志,2021,37(20):2809.2812.
[13] 徐务军. 通心络胶囊联合地高辛片治疗慢性心力衰竭的临床效果及对氧化应激、血管内皮功能的影响[J].临床合理用药,2024,17(2):41.44.
[14] 王仙. 芹菜素对大鼠阿霉素性心肌损伤保护作用的实验研究[D].太原:山西医科大学,2011.
[15] 何芳, 陈赫军,李洁.芹菜素对高脂高盐所致高血压大鼠降压及心脏保护作用[J].中药药理与临床,2016,32(5):48.51.
[16] PARK S Y, PIAO Y J,JEONG K J, et al. Periostin(POSTN) regulates tumor resistance to antiangiogenic therapy in glioma models[J].Molecular Cancer Therapeutics,2016,15(9):2187.2197.
[17] 洪牮. 缺血性心肌纤维化中聚合胶原对促进小鼠成纤维细胞表型转化的相关信号通路的研究[D].南京:南京医科大学,2011.
(收稿日期:2022.11.07)
(本文编辑 邹丽)

