基于SIRT1/PGC.1α信号通路探讨抑眩宁颗粒干预缺血性眩晕的作用机制
王福荣 李明坤 刘志广 马金波

摘要 目的: 探讨抑眩宁颗粒对沉默信息调节因子1(SIRT1)/过氧化物酶体增殖物激活受体γ辅激活因子1α(PGC.1α)信号通路的调控作用及对缺血性眩晕大鼠眩晕症状的改善作用。 方法: 对清洁级SD大鼠进行电刺激逃避反射训练3 d后建立缺血性眩晕模型。将大鼠分为模型组、抑眩宁颗粒组(6 g/kg)、SIRT1抑制剂(EX527)组(5 mg/kg)、抑眩宁颗粒+EX527组(抑眩宁颗粒6 g/kg+EX527 5 mg/kg),各组给予相应药物干预7 d;另取16只清洁级SD大鼠作为假手术组(进行造模前训练,仅穿线不结扎)。采用跳台逃避实验测定跳台逃避潜伏期;多普勒激光血流仪测量大鼠前庭神经核组织血流量,计算血流量下降率;苏木精.伊红染色观察大鼠脑组织病理特征;酶联免疫吸附法检测大鼠脑组织丙二醛(MDA)、超氧化 物歧化酶(SOD)活性、一氧化氮(NO)、白细胞介素.1β(IL.1β)、 肿瘤坏死因子.α(TNF.α) 含量;蛋白免疫印迹法检测大鼠脑组织SIRT1、PGC.1α、B淋巴细 胞瘤.2相关X蛋白(Bax)、B淋巴细胞瘤.2(Bcl.2) 蛋白表达水平。 结果: 与假手术组比较,模型组大鼠脑组织神经细胞变形、固缩和凋亡,跳台逃避潜伏期、 给药后血流量下降率、脑组织MDA、NO、IL.1β、 TNF.α含量、Bax蛋白表达水平升高( P <0.05),SOD活性、SIRT1、PGC. 1α和Bcl.2蛋白表达水平降低( P <0.05)。 与模型组比较,抑眩宁颗粒组大鼠脑组织凋亡变异的细胞数量减少,胶质周围的正常细胞数量增多,跳台逃避潜伏期、给药后血流量下降率、脑组织MDA、NO、IL.1β、TNF.α含量及Bax蛋白表达水平降低( P <0.05),SO D活性、SIRT1、PGC.1α和Bcl.2蛋白表达水平升高( P <0.05); EX527组大鼠脑组织神经细胞严重变形,固缩和凋亡现象明显,跳台逃避潜伏期、给药后血流量下降 率、脑组织MDA、NO、IL.1β、 TNF.α含量及Bax蛋白表达水平升高( P <0.05),SOD活性、SIRT1、PGC.1α和Bcl.2蛋白表达水平降低( P <0.05)。EX527可逆转抑眩宁颗粒对缺血性眩晕大鼠的改善作用( P <0.05)。 结论: 抑眩宁颗粒可能通过激活SIRT1/PGC.1α通路、抑制氧化应激和炎症反应,进而改善缺血性眩晕大鼠眩晕症状。
关键词 缺血性眩晕;抑眩宁颗粒;沉默信息调节因子1/过氧化物酶体增殖物激活受体γ辅激活因子1α,SIRT1/PGC.1α;大鼠;实验研究
doi: 10.12102/j.issn.1672.1349.2024.10.010
Mechanism of Yixuanning Granules on Ischemic Vertigo Based on SIRT1/PGC.1α Signaling Pathway
WANG Furong, LI Mingkun, LIU Zhiguang, MA Jinbo
Zhaogezhuang Hospital Kailuan General Hospital, Tangshan 063000, Hebei, China
Corresponding Author MA Jinbo, E.mail: 605088130@qq.com
Abstract Objective: To investigate the regulatory effect of Yixuanning granules on silencing information regulatory factor 1(SIRT1)/peroxisome proliferator.activated receptor γ.coactivator 1α(PGC.1α) signaling pathway and its improvement effect on vertigo symptoms of ischemic vertigo in rats. Methods: After 3 days of escape reflex training of electrical stimulation,rat model of ischemic vertigo was established,a nd the rats were divided into model group,Yixuanning granules group(6 g/kg),SIRT1 inhibitor(EX527) group (5 mg/kg), Yixuanning granules+EX527 group(Yixuanning granules 6 g/kg+EX527 5 mg/kg).Each group was given drug for 7 days.Another 16 rats were selected as sham group(pre.modeling training,only threading without ligature).The stage escape latency of rats was measured by the stage escape experiment.The blood flow in vestibular nucleus of rats was measured by Doppler laser blood flow analyzer,and the decreasing rate of blood flow was calculated.Hematoxylin.eosin staining was used to observe the pathological characteristics of rat brain.The activities of malondialdehyde(MDA),superoxide dismutase(SOD),nitric oxide(NO),interleukin.1β(IL.1β) and tumor necrosis factor.α(TNF.α) were detected by enzyme.linked immunosorbent assay(ELISA).The expressions of SIRT1 ,PGC.1α, B.lymphoblastoma.2.associated X protein(Bax) and B.lymphoblastoma.2(Bcl.2) in rat brain were detected by Western Blot. Results: Compared with sham group,brain nerve cells in the model group were deformable,constricted and apoptotic,stage escape latency blood flow rate decreased after administration,the activity of MDA,NO,IL.1β,TNF.α content and Bax protein expressions in cerebral tissue increased( P <0.05).SOD activity,SIRT1,PGC.1α and Bcl.2 protein expressions decreased( P <0.05).Compared with model group,the number of apoptotic cells in brain tissue of Yixuanning granules group decreased,the number of normal cells around glia increased significantly,the latency of stage escape,the decrease rate of blood flow after administration,the activity of MDA,NO,IL.1β,TNF.α content and Bax protein expressions in cerebral tissue decreased( P <0.05).SOD activity,SIRT1,PGC.1α and Bcl.2 protein expressions increased( P <0.05).Cerebral nerve cells in the EX527 group deformated severely,with obvious signs of contraction and apoptosis,and the activity of MDA,NO,IL.1β,TNF.α content and Bax protein expressions in brain tissue increased( P <0.05),SOD activity,SIRT1,PGC.1α and Bcl.2 protein expressions decreased( P <0.05).EX527 could reverse the improvement effect of Yixuanning granules on ischemic vertigo in rats( P <0.05). Conclusion: Yixuanning granules might improve vertigo symptoms of ischemic vertigo in rats by activating the SIRT1/PGC.1α pathway and inhibiting oxidative stress and inflammatory responses.
Keywords ischemic vertigo; Yixuanning granules; silencing information regulatory factor 1/peroxisome proliferator.activated receptor γ.coactivator 1α, SIRT1/PGC.1α; rats; experimental study
缺血性眩晕是临床的常见病和多发病,具有多病因、多病机、病位广、难诊断、难根治等特点,中医药治疗效果显著且作用持久 [1] 。其中抑眩宁颗粒是治疗缺血性眩晕的常用药物,主要功效为平肝潜阳、降火涤痰、养血健脾、祛风清热;主要适应证为肝阳上亢、气血两虚型眩晕症,但其中的药理机制尚未明确。沉默信息调节因子1(silent information regulator 1,SIRT1)在较多神经退行性疾病中发挥神经保护作用,过氧化物酶体增殖物激活受体γ辅激活因子1α(peroxisome proliferator activated receptor γ coactivator.1α,PGC.1α) 水平升高,可减轻氧化应激、炎症反应,消除活性氧,同时使SIRT1和PGC.1α蛋白表达增加,激活SIRT1及其下游抗氧化防御机制,减轻糖尿病大鼠心肌病变 [2] 。激活SIRT1可提高PGC.1α去乙酰化,降低脑缺血再灌注大鼠死亡率,改善行为学障碍和神经元凋亡 [3] 。其中,褪黑素通过激活SIRT1/PGC.1α通路减轻铬诱导的肺损伤 [4] ,姜黄素通过激活SIRT1/PGC.1α通路减轻异烟肼诱导的肝毒性 [5] 。抑眩宁颗粒是否通过SIRT1/PGC.1α通路改善缺血性眩晕大鼠眩晕症状的研究较少。本研究通过构建缺血性眩晕大鼠模型,使用抑眩宁颗粒和SIRT1抑制剂(EX527)干预,旨在从SIRT1/PGC.1α通路揭示抑眩宁颗粒对缺血性眩晕大鼠眩晕症状的改善作用,为抑眩宁颗粒在临床应用于缺血性眩晕的治疗提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
清洁级SD大鼠,雌雄各半,5~7周龄,体质量180~200 g,购自长沙市天勤生物技术有限公司,许可证号:SCXK(湘)2019.0027。饲养条件:温度22 ℃,湿度55%,12 h光暗循环。本研究经开滦总医院赵各庄医院伦理委员会批准。
1.1.2 实验药物与试剂
抑眩宁颗粒(批号20220127)购自通化茂祥制药有限公司,SIRT1抑制剂(EX527,批号49843.98.3)购自美国Selleck公司;苏木精.伊红(HE)染液、二喹啉甲酸(BCA)蛋白检测试剂盒、电化学发光(ECL)显色试剂盒(批号分别为SW.2398、SW.3783、SW.2387)均购自北京中山金桥生物科技有限公司;蛋白提取试剂盒、超氧化物歧化酶(SOD)、丙二醛(MDA)、一氧化氮 (NO)、白细胞介素.1β(IL.1β)、肿瘤坏死因子.α(TNF.α) 酶联免疫吸附(ELISA)试剂盒(批号分别为ML91627、ML012634、 ML012784、ML034782、ML047392、ML013476) 均购自上海酶联生物科技有限公司;兔源β.肌动蛋白(β.actin)、SIRT1、PGC.1α、B淋巴细胞瘤.2相关X蛋白(Bax)、B淋巴细胞瘤.2(Bcl.2)、羊抗兔二抗(批号分别为ZM1016、ZM2390、ZM2493、ZM3489、ZM2479、ZM3478)均购自北京四正柏生物科技有限公司。
1.1.3 实验仪器
跳台记录仪(型号YLS.3Tb)购自上海软隆科技发展有限公司;脑立体定位仪(型号ALC.H)、多普勒激光血流仪(型号LDI2)、离心机(型号5418R)均购自上海玉研科学仪器有限公司;光学显微镜(型号ML11)、酶标仪(型号EnVision)均购自北京瑞宇科技有限公司;蛋白凝胶成像系统(型号JY.04)购自上海菲特科学器材有限公司。
1.2 方法
1.2.1 造模前训练
造模前对大鼠进行电刺激逃避反射训练,将大鼠置入跳台仪中,适应3 min后给予强度为30 V、50 Hz的电刺激,当大鼠跳上跳台并保持30 s为训练成功,每日训练2次 ,连续3 d,建立稳定的逃避刺激条件反射。
1.2.2 缺血性眩晕大鼠模型的建立、分组及给药
第4天选取训练成功的大鼠,采用结扎右侧颈总动脉和右侧锁骨下动脉构建缺血性眩晕大鼠模型 [6] :大鼠腹腔注射戊巴比妥钠麻醉,在脑立体定位仪上仰卧固定,切开颈部皮肤,暴露右侧颈总动脉并穿线备用。沿右侧颈总动脉近心端找到右侧锁骨下动脉分叉处,剥离周围组织,穿线备用。平颅头位,定位大鼠右侧前庭神经核,切正中头皮1.5 cm切口,过氧化氢灼皮暴露前囟,用牙科钻钻孔,使之可容纳激光探头;采用多普勒激光血流仪测定大鼠右前庭神经核组织血流量,待血流平稳后,结扎右侧颈总动脉和锁骨下动脉,术后肌肉注射抗生素预防感染。大鼠脑血流量明显下降且次日仍存活视为造模成功 [6] 。
将造模成功的64只大鼠按照随机 数字表法分为模型组、抑眩宁颗粒组(6 g/kg) [7] 、EX527组(5 mg/kg) [8] 、 抑眩宁颗粒+EX527组(抑眩宁颗粒6 g/kg+EX527 5 mg/kg),每组16只。另取16只大鼠作为假手术组(进行造模前训练,仅穿线不结扎)。造模成功后开始给药,抑眩宁颗粒组给予大鼠6 g/kg的抑 眩宁颗粒灌胃(将抑眩宁颗粒和蒸馏水配制成浓度为0.6 g/mL的混悬液,灌胃体积10 mL/kg) [7] ;EX527组给予大鼠腹腔注射5 mg/kg的EX527 [8] ;抑眩宁颗粒+EX527组给予大鼠6 g/kg的抑眩宁颗粒灌胃给药,同时腹腔注射5 mg/kg的EX527;模型组和假手术组灌胃等量蒸馏水。每日1次,连续给药7 d。给药期间,EX527组2只大鼠死亡,其余各组所有大鼠均存活。
1.2.3 跳台逃避实验测定大鼠跳台逃避潜伏期
给药周期结束后,大鼠置入500 r/min的离心机匀速转动30 s,立即放入跳台仪中,记录从大鼠受到强度为30 V、50 Hz的电刺激到第1次跳上平台,且30 s内不跌落所需的时间(不包含在平台上的时间),即为跳台逃避潜伏期。
1.2.4 多普勒激光血流仪测定大鼠前庭神经核组织血流量
使用多普勒激光血流仪测量各组大鼠结扎前20 min、结扎后20 min(给药前)、给药7 d后(给药后)的前庭神经核组织血流量,计算血流量下降率。给药前血流量下降率(%)=(结扎前20 min血流量-结扎后20 min血流量)/结扎前20 min血流量×100%;给药后血流量下降率(%)=(结扎前20 min血流量-给药7 d后血流量)/结扎前20 min血流量×100%。
1.2.5 HE染色观察大鼠脑组织病理变化
随机取EX527组7只大鼠,其余各组分别随机取8只大鼠,处死大鼠,获取脑组织标本,采用10%甲醛中性缓冲液固定,分别用75%、85%、95%和100%浓度梯度的乙醇脱水(每次5 min),之后用二甲苯清洗3次(每次5 min),石蜡包埋,切成4 μm厚的薄片,置于60 ℃培养箱中孵育1 h,冷却后再次使用不同浓度梯度的乙醇脱水,苏木精染色7 min,洗涤,盐酸乙醇分化5 s,伊红浸泡1 min,使用中性树脂固定后通风,将切片置于光学显微镜下观察脑组织的病理变化。
1.2.6 ELISA法检测大鼠脑组织MDA、SOD活性、NO、IL.1β、TNF.α含量
将EX527组剩余的7只大鼠,其余各组剩余的8只大鼠,断头取脑,将右侧半脑的脑组织清洗干燥后,称重0.5 g(剩余部分迅速置入-80 ℃冰箱中用于后续实验),制成组织匀浆,离心分离上清液按相关指标的ELISA试剂盒说明书,分别测定SOD活性、MDA、NO、IL.1β、TNF.α含量。
1.2.7 蛋白免疫印迹法检测大鼠脑组织SIRT1、PGC.1α、 Bax、Bcl.2蛋白表达水平
取-80 ℃保存的剩余大鼠脑组织,解冻匀浆,蛋白提取试剂盒提取脑组织总蛋白,定量蛋白浓度, 进行电泳、转膜,加入兔源SIRT1(1∶750)、PGC.1α(1∶700)、 Bax(1∶1 750)、Bcl.2(1∶1 350)、β.actin(1∶730)一抗,4 ℃过夜孵育,加入羊抗兔二抗(1∶2 150)室温孵育1.5 h,使用ECL试剂盒显色,Image.J软件分析蛋白相对表达水平。
1.3 统计学处理
采用SPSS 26.0统计学软件对数据进行分析,符合正态分布的定量资料以均数±标准差( x ± s )表示,多组间比较采用单因素方差分析,两组间比较采用SNK. q 检验。以 P <0.05为差异有统计学意义。
2 结 果
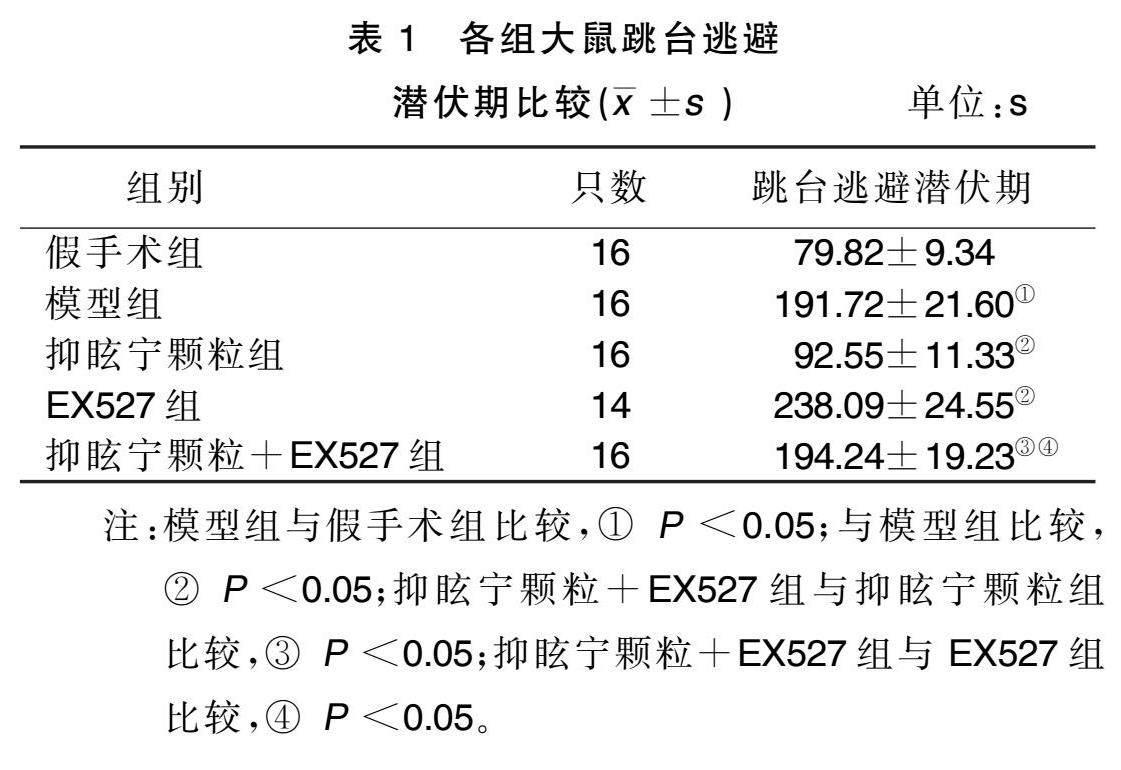
2.1 各组大鼠跳台逃避潜伏期比较
与假手术组比较,模型组大鼠跳台逃避潜伏期延长( P <0.05);与模型组比较,抑眩宁颗粒组大鼠跳台逃避潜伏期缩短( P <0.05),EX527组大鼠跳台逃避潜伏期延长( P <0.05);与抑眩宁颗粒组比较,抑眩宁颗粒+EX527 组大鼠跳台逃避潜伏期延长( P <0.05); 与EX527组比较,抑眩宁颗粒+EX527组大鼠跳台逃避潜伏期缩短( P <0.05)。详见表1。
2.2 各组大鼠前庭神经核组织血流量下降率比较
与假手术组比较,模型组和各给药组给药前血流量下降率升高( P <0.05)。与假手术组比较,模型组大鼠给药后血流量下降率升高( P <0.05);与模型组 比较,抑眩宁颗粒组大鼠给药后血流量下降率降低 ( P <0.05),EX527组大鼠给药后血流量下降率升高( P <0.05);与抑眩宁颗粒组比较,抑眩宁颗粒+EX527组大鼠给药后血流量下降率升高( P <0.05);与EX527组比较,抑眩宁颗粒+EX527组大鼠给药后血流量下降率降低( P <0.05)。详见表2。
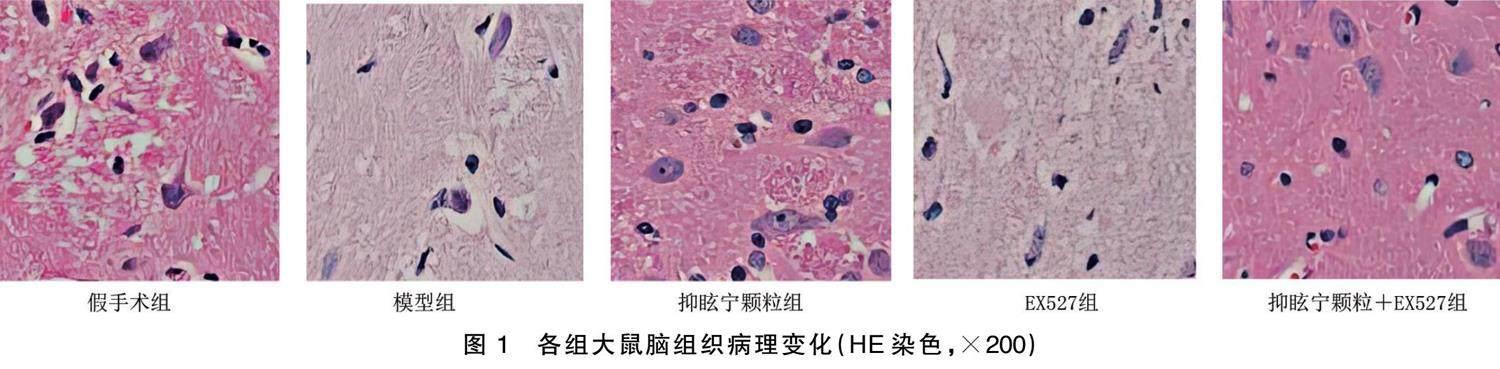
2.3 各组大鼠脑组织病理变化
对照组大鼠脑组织可见明显的多级神经元和粗大的尼氏体,大量正常细胞;模型组大鼠脑组织神经细胞变形、固缩和凋亡;抑眩宁颗粒组大鼠脑组织中凋亡变异的细胞数目减少,胶质周围的正常细胞数量增多;EX527组大鼠脑组织神经细胞严重变形,固缩和凋亡现象显著;抑眩宁颗粒+EX527组大鼠脑组织神经细胞形态较EX527组改善,细胞固缩和凋亡现象缓解。详见图1。
2.4 各组大鼠脑组织SOD活性及MDA、NO、IL.1β、TNF.α含量比较
与假手术组比较,模型组大鼠脑组织MDA及NO、IL.1β、TNF.α含量升高( P <0.05),SOD活性降低( P <0.05);与模型组比较,抑眩宁颗粒组大鼠脑组织MDA及NO、IL.1β、TNF.α含量降低( P <0.05),SOD活性升高( P <0.05),EX527组大鼠脑组织MDA及NO、IL.1β、TNF.α含量升高( P <0.05),SOD活性降低( P <0.05);与抑眩宁颗粒组比较,抑眩宁颗粒+EX527组大鼠脑组织MDA及NO、IL.1β、TNF.α含量升高( P <0.05),SOD活性降低( P <0.05);与EX527组比较,抑眩宁颗粒+EX527组大鼠脑组织MDA、NO、IL.1β及TNF.α含量降低( P <0.05),SOD活性升高( P <0.05)。详见表3。
2.5 各组大鼠脑组织SIRT1、PGC.1α、Bax、Bcl.2蛋白表达比较
与假手术组比较,模型组大鼠脑组织SIRT1、PGC.1α和Bcl.2蛋白表达水平降低( P <0.05),Bax蛋白表达水平升高( P <0.05);与模型组比较,抑眩宁颗粒组大鼠脑组织SIRT1、PGC.1α和Bcl.2蛋白表达水平升高( P <0.05),Bax蛋白表达水平降低( P <0.05), EX527组大鼠脑组织SIRT1、PGC.1α和Bcl.2蛋白表达水平降低( P <0.05),Bax蛋白表达水平升高( P <0.05);与抑眩宁颗粒组比较,抑眩宁颗粒+EX527组大鼠脑组织SIRT1、PGC.1α和Bcl.2蛋白表达水平降低( P <0.05),Bax蛋白表达水平升高( P <0.05);与EX527组比较,抑眩宁颗粒+EX527组大鼠脑组织SIRT1、 PGC.1α和Bcl.2蛋白表达水平升高( P <0.05), Bax蛋白表达水平降低( P <0.05)。详见图2、表4。
3 讨 论
缺血性眩晕常与平衡障碍并发,是前庭、视觉及本体觉功能障碍引起的自我重力方向感觉异常现象,治疗周期长、副作用大、成本高 [9] 。其中,前庭功能感知位置和运动,其功能障碍表现为运动异常、眩晕和平衡异常,导致心理衰弱和行为困难等症状 [10] 。炎症反应及氧化应激诱导的神经细胞凋亡是参与缺血性脑及神经损伤的主要病理过程之一 [11] 。本研究通过结扎右侧颈总动脉和右侧锁骨下动脉法构建缺血性眩晕大鼠模型,结果发现建模大鼠脑组织神经细胞变形、固缩和凋亡,跳台逃避潜伏期、给药后血流量下降率、脑组织MDA、NO、IL.1β、TNF.α含量及促凋亡蛋白Bax表达水平升高,SOD活性和抑凋亡蛋白Bcl.2表达水平降低。提示缺血性眩晕大鼠模型构建成功,脑组织氧化应激及炎症反应增强。
抑眩宁颗粒的主要成分为胆南星、枸杞、黄芩、白芍、苍耳子、菊花、生铁落、牡蛎、茯苓、竹茹,主要用于类眩晕症的治疗。本研究结果显示,经抑眩宁颗粒治疗后,大鼠脑组织凋亡变异的细胞数量减少,胶质周围的正常细胞数量增多,且抑眩宁颗粒可降低缺血性眩晕大鼠跳台逃避潜伏期、给药后血流量下降率、脑组织中MDA、NO、IL.1β、TNF.α含量及Bax蛋白表达水平,并提高大鼠SOD活性和Bcl.2蛋白表达水平,改善大鼠缺血性眩晕症状。
沉默SIRT1表达可抑制大鼠神经元细胞存活,降低细胞内SOD活性,提高MDA含量,加剧氧化损伤 [12] 。尹晓新等 [13] 研究显示,激活SIRT1/PGC.1α信号通路表达可减轻脑缺血损伤大鼠神经损伤,缓解氧化应激。Jia等 [14] 研究发现,激活心肌梗死大鼠SIRT1/PGC.1α信号通路,可降低心肌纤维化和氧化应激,提高大鼠存活率。有研究表明,抑制SIRT1和PGC.1α表达可促进 心肌缺血损伤 [15] ,而SIRT1/PGC.1α 通路过表达可减轻锰诱导的小鼠神经损伤和线粒体功能障碍 [16] 。相关研究显示,多种中药均通过SIRT1/PGC.1α 信号通路减少疾病的产生和发展,如雷公藤甲素通过激活SIRT1/PGC.1α信号通路改善血管性痴呆大鼠认知功能障碍 [17] ;丹酚酸B和黄连素通过激活SIRT1/PGC.1α通路,改善糖尿病小鼠肾损伤 [18] ;五味子酚 通过SIRT1/PGC.1α 通路降低乙酰胆碱酯酶活性,减轻氧化损伤,改善小鼠学习和记忆能力 [19] 。另有研究发现,上调SIRT1、PGC.1α和Bcl.2/Bax的表达可减轻氧化应激损伤和神经元凋亡,但EX527可逆转该过程 [20] 。本研究给予抑眩宁颗粒处理后,缺血性眩晕大鼠脑组织SIRT1、PGC.1α蛋白表达水平升高,表明抑眩宁颗粒可能通过上调SIRT1/PGC.1α通路、改善缺血性眩晕大鼠的不良症状;进一步采用抑眩宁颗粒和EX527联合处理后,缺血性眩晕大鼠脑组织SIRT1、PGC.1α蛋白表达水平较抑眩宁颗粒单独处理降低,较EX527单独处理升高,表明抑眩宁颗粒对缺血性眩晕大鼠的改善作用可被EX527逆转,提示抑眩宁颗粒可能通过激活 SIRT1/PGC.1α通路,发挥改善缺血性眩晕大鼠的作用。
综上所述,抑眩宁 颗粒可能通过激活SIRT1/PGC.1α 通路,减轻缺血性眩晕大鼠脑组织氧化应激及炎症反应,改善眩晕症状。本研究为缺血性眩晕的治疗提供了一定的参考,但抑眩宁颗粒治疗缺血性眩晕的作用机制复杂,其可能通过干预其他通路影响缺血性眩晕症状,有待进一步深入研究。
参考文献:
[1] 李雪, 黄石娇,岳文华,等.后循环缺血性眩晕机制研究及中西医治疗研究进展[J].辽宁中医药大学学报,2022,24(3):60.63.
[2] WANG G D. Aerobic exercise ameliorates myocardial ischemia/reperfusion injury and thrombosis of diabetic rats via activation of AMPK/Sirt1/PGC.1α pathway[J].General Physiology and Biophysics,2022,41(4):319.328.
[3] LI L, ZHI D Y,CHENG R B, et al .The neuroprotective role of SIRT1/PGC.1α signaling in limb postconditioning in cerebral ischemia/reperfusion injury[J].Neuroscience Letters,2021,749:135736.
[4] HAN B, LI S Y,LV Y Y, et al .Dietary melatonin attenuates chromium.induced lung injury via activating the Sirt1/PGC.1α/Nrf2 pathway[J].Food & Function,2019,10(9):5555.5565.
[5] LI Y, LUO W W,CHENG X, et al .Curcumin attenuates isoniazid.induced hepatotoxicity by upregulating the SIRT1/PGC.1α/NRF1 pathway[J].Journal of Applied Toxicology:JAT,2022,42(7):1192.1204.
[6] 董永书, 行书丽,周红艳,等.快捻久留针刺法对后循环缺血性眩晕大鼠的治疗作用分析[J].针灸临床杂志,2018,34(8):66.69.
[7] 王紫嫣, 王泽雨,王国强,等.抑眩宁颗粒对小鼠和大鼠缺血性眩晕的治疗作用及其机制[J].吉林大学学报(医学版),2019,45(3):546.550.
[8] 李闯, 马晓莉,文志萍,等.香青兰总黄酮对心肌缺血再灌注损伤大鼠氧化应激和线粒体的保护作用[J].中成药,2022,44(2):390.395.
[9] KOCAK M N, ATES O,ONDAS O, et al .Differential diagnosis of ischemic vertigo by optical coherence tomography[J].The Eurasian Journal of Medicine,2020,52(3):288.291.
[10] HALL C D, HERDMAN S J,WHITNEY S L, et al .Vestibular rehabilitation for peripheral vestibular hypofunction:an updated clinical practice guideline from the academy of neurologic physical therapy of the American Physical Therapy Association[J].Journal of Neurologic Physical Therapy,2022,46(2):118.177.
[11] HOU R H, HAN P,LIU Q, et al .RETRACTED:a new Zn(Ⅱ).coordination polymer based on m.terphenyl pentacarboxylic acid ligand for photocatalytic methylene blue degradation and protective effect against Alzheimer′s disease by reducing the inflammatory response and oxidative stress in the nerve cells[J].Arabian Journal of Chemistry,2020,13(4):5171.5180.
[12] ZHANG X S, LU Y,TAO T, et al .Fucoxanthin mitigates subarachnoid hemorrhage.induced oxidative damage via sirtuin 1.dependent pathway[J].Molecular Neurobiology,2020,57(12):5286.5298.
[13] 尹晓新, 冯海松,杨涛,等.脂联素介导SIRT1/PGC.1α信号通路对大鼠脑缺血损伤后的影响[J].疑难病杂志,2022,21(6):633.637.
[14] JIA D D, HOU L,LV Y Z, et al .Postinfarction exercise training alleviates cardiac dysfunction and adverse remodeling via mitochondrial biogenesis and SIRT1/PGC.1α/PI3K/Akt signaling[J].Journal of Cellular Physiology,2019,234(12):23705.23718.
[15] 赵云丽, 袁勇,马晓莉,等.基于AMPK/SIRT1/PGC.1α信号通路研究香青兰总黄酮对大鼠心肌缺血再灌注损伤的保护机制[J].中国药房,2021,32(3):278.283.
[16] LEI M Y, CONG L,LIU Z Q, et al .Resveratrol reduces DRP1.mediated mitochondrial dysfunction via the SIRT1.PGC1α signaling pathway in manganese.induced nerve damage in mice[J].Environmental Toxicology,2022,37(2):282.298.
[17] YAO P, LI Y L,YANG Y J, et al .Triptolide improves cognitive dysfunction in rats with vascular dementia by activating the SIRT1/PGC.1α signaling pathway[J].Neurochemical Research,2019,44(8):1977.1985.
[18] 胡媛媛, 暴雪丽,武彦香,等.丹酚酸B.黄连素复合物对糖尿病小鼠肾损伤及SIRT1/PGC.1α信号通路的影响[J].中国中医急症,2022,31(4):580.583.
[19] HAN Y F, YANG H Y,LI L B, et al .Schisanhenol improves learning and memory in scopolamine.treated mice by reducing acetylcholinesterase activity and attenuating oxidative damage through SIRT1.PGC.1α.Tau signaling pathway[J].The International Journal of Neuroscience,2019,129(2):110.118.
[20] HUANG J ,LIU W,DOYCHEVA D M, et al .Ghrelin attenuates oxidative stress and neuronal apoptosis via GHSR.1α/AMPK/Sirt1/PGC.1α/UCP2 pathway in a rat model of neonatal HIE[J].Free Radical Biology & Medicine,2019,141:322.337.
(收稿日期:2022.11.09)
(本文编辑 薛妮)

