灯盏乙素通过细胞转运途径对阿尔茨海默病大鼠β.淀粉样蛋白跨血脑屏障的影响
李可 苗果 柳秋 ,赵昆朋
摘要 目的: 探讨灯盏乙素对阿尔茨海默病(AD)大鼠β.淀粉样蛋白(Aβ)跨血脑屏障(BBB)的影响及其机制。 方法: 无特定病原体(SPF)级SD大鼠70只,随机分为假手术组、模型组、灯盏乙素低剂量组、灯盏乙素高剂量组以及阳性对照组,除假手术组大鼠外,其余组大鼠侧脑室注射Aβ 1.42 氯化钠溶液建立AD大鼠模型,灯盏乙素低 剂量和高剂量组大鼠分别灌胃灯盏乙素5 mg/kg和10 mg/kg, 阳性对照组灌胃盐酸多奈哌齐0.9 mg/kg,持续30 d,观察大鼠行为能力以及血脑屏障通透性,进行苏木精.伊红(HE)染色和免疫组化染色,蛋白质免疫印迹法(Western Blot)检测基质金属蛋白酶.9(MMP.9)、闭合蛋白.5(Claudin.5)、咬合蛋白(Occludin)、低密度脂蛋白相关蛋白(LRP.1)以及p糖蛋白(P.gp)表达情况。 结果: 模型组神经元细胞排列疏松、紊乱,细胞数量减少,可见明显空泡化,灯盏乙素低剂量组、灯盏乙素高剂量组及阳性对照组神经元细胞数量增多,空泡化细胞减少,细胞排列稍整齐致密。灯盏乙素低剂量组、灯盏乙素高剂量组及阳性对照组大鼠逃避潜伏期、伊文思蓝含量、Aβ斑块面积以及MMP.9蛋白相对表达量均低于模型组,穿过平台的次数以及LRP.1、P.gp、Claudin.5、Occludin蛋白相对表达量高于模型组( P <0.05)。 结论: 灯盏乙素可减轻AD大鼠神经元病理损伤,保护血脑屏障。
关键词 阿尔茨海默病;血脑屏障;β.淀粉样蛋白;灯盏乙素;实验研究
doi: 10.12102/j.issn.1672.1349.2024.10.009
Effect of Breviscapine on β.amyloid across Blood.brain Barrier of Alzheimer′s Disease Rats Via Cellular Transporter Pathway
LI Ke, MIAO Guo, LIU Qiu, ZHAO Kunpeng
Nanshi Hospital of Nanyang, Nanyang 473000, Henan, China, E.mail: like880919@163.com
Abstract Objective: To investigate the effect of breviscapine on β.amyloid(Aβ) across blood.brain barrier (BBB) in rats with Alzheimer′s disease(AD) rats and its mechanism. Methods: Seventy specific pathogen free(SPF) SD rats were randomly divided into sham operation group,model group,scutellarin low.dose group,scutellarin high.dose group and positive control group.Except for sham operation group,the AD rat model was established by injecting Aβ 1.42 sodium chloride solution into the lateral ventricle of the other groups.Scutellarin low.dose group and scutellarin high.dose group were gavaged scutellarin with 5 mg/kg and 10 mg/kg for 30 days respectively,and positive control group was gavaged donepezil hydrochloride with 0.9 mg/kg for 30 days.The behavioral ability and BBB permeability of rats were observed,and hematoxylin.eosin staining(HE) and immunohistochemical staining were performed.Matrix metalloproteinase.9(MMP.9),closure protein.5(Claudin.5),Occludin,low density lipoprotein.related protein(LRP.1) and P.glycoprotein(P.gp) were detected by Western Blot. Results: In the model group,the neuronal cells arranged loosely and disorganized,the number of cells reduced,and the vacuolation was obvious.The number of neuronal cells increased in the scutellarin low.dose group,scutellarin high.dose group and positive control group,and the number of vacuolated cells reduced,and the arrangement of the cells was slightly neat and dense.The escape latency,Evans blue content,Aβ plaque area and relative expression of MMP.9 protein in the scutellarin low.dose group,scutellarin high.dose group and positive control group were lower than those in model group.The frequency of crossing the platform,the relative expression of LRP.1,P.gp,Claudin.5 and Occludin were higher than those in the model group( P <0.05). Conclusion: Breviscapine could alleviate pathological damage of neurons and protect BBB in rats with AD.
Keywords Alzheimer′s disease; blood.brain barrier; β.amyloid; breviscapine; experimental study
阿尔茨海默病(Alzheimer′s disease,AD)是一种具有进展性、隐匿性且不可治愈的神经退行性疾病,其 临床症状主要以学习能力和记忆力丧失、行为认知能力异常为主 [1] 。β.淀粉样蛋白(β.amyloid,Aβ)脑内过度沉积是发生AD公认的病理学变化,Aβ由淀粉样前体蛋白(amyloid precursor protein,APP)水解而成,是造成神经元死亡的重要因素,Aβ的过度产生和异常积累以及在大脑中的清除是治疗AD的焦点 [2] 。血脑屏障(blood.brain barrier,BBB)是一种具有高选择性的半透明结构,而且是一道有力的化学屏障,在维持大脑内部环境稳定,阻碍脑外异物侵入大脑方面发挥了重 要作用,一旦血脑屏障受损,将导致Aβ从脑内清除到外周血液的能力降低,引起Aβ沉积和神经毒性,最终导致神经元损伤、记忆力丧失和认知功能障碍 [3] 。灯盏乙素是灯盏细辛主要的药理活性成分,研究发现,灯盏乙素通过干预Aβ生成途径中的相关因子抑制Aβ的产生,从而发挥改善AD的作用 [4] 。而本研究通过两侧海马内注射Aβ 1.42 建立AD大鼠模型,探讨灯盏乙素是否通过发挥保护血脑屏障、清除Aβ蛋白沉积从而改善AD病理症状。
1 材料与方法
1.1 实验动物
无特定病原体(SPF)级SD大鼠70只,8周龄,体质量(200±20)g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2017.0011。
1.2 试剂与仪器
灯盏乙素购自南京泽朗生物医药科技有限公司;Aβ 1.42 购自美国Sigma公司;苏木素试剂盒和免疫组化试剂盒购自上海碧云天生物科技有限公司;盐酸多奈哌齐购自陕西方舟制药有限公司;基质金属蛋白酶.9(matrix metalloprotein 9,MMP.9)、闭合蛋白.5(Claudin.5)、咬合蛋白(Occludin)、低密度脂蛋白相关蛋白 1(low density lipoprotein receptor.related protein.1,LRP.1) 、p糖蛋白(P.glycoprotein,P.gp)抗体购自美国Abcam公司;DW.2000脑立体定位仪购自成都泰盟有限公司;MK3型酶标仪购自美国Thermo公司。
1.3 模型制备与分组
将70只大鼠按照随机数字表法分为假手术组、模型组、灯盏乙素低剂量组、灯盏乙素高剂量组以及阳性对照组,每组14只。除假手术组14只大鼠外,其余大鼠予腹腔麻醉,固定于脑立体定位仪上,剔除头部局部毛发,消毒,在距前囟2 mm、正中矢状缝左右各2 mm处做一长约1 cm、深约3 mm的切口,用微量进样器沿切口向两侧海马注射2 μL含2.5 μg/μL的Aβ 1.42 氯化钠溶液,而假手术组大鼠仅注射氯化钠溶液 [5] 。造模后,灯盏乙素低剂量组和高剂量组大鼠分别灌胃灯盏乙素5 mg/kg和10 mg/kg,阳性对照组灌胃盐酸多奈哌齐0.9 mg/kg,假手术组和模型组灌胃生理盐水,持续给药30 d,给药期间每天定时海马内注射Aβ 1.42 氯化钠溶液。
1.4 实验方法
1.4.1 Morris水迷宫实验
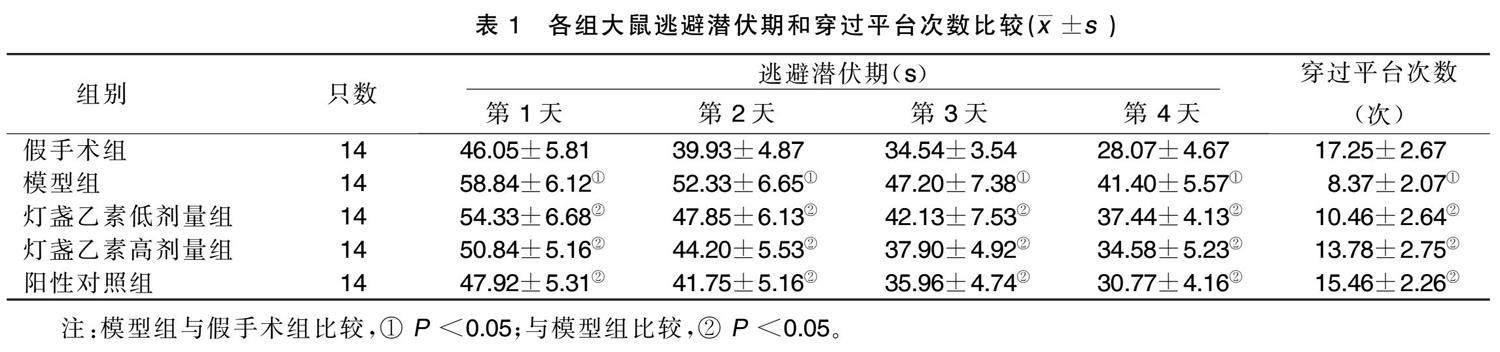
末次给药结束后,进行水迷宫测试,将水迷宫划分为4个区域,将一黑色平台置于左下方区域水面上,将大鼠从右上方区域面向池壁放入,直至大 鼠找到平台并停留于平台上,停止记录时间(逃避潜伏期),若1 min 内未找到平台,则将其引导至平台位置,并停留5 s,连续进行为期4 d的学习,于第5天,撤去平台,从原来的位置将大鼠放入水池,记录大鼠穿过平台所在位置的次数。
1.4.2 血脑屏障通透性检测
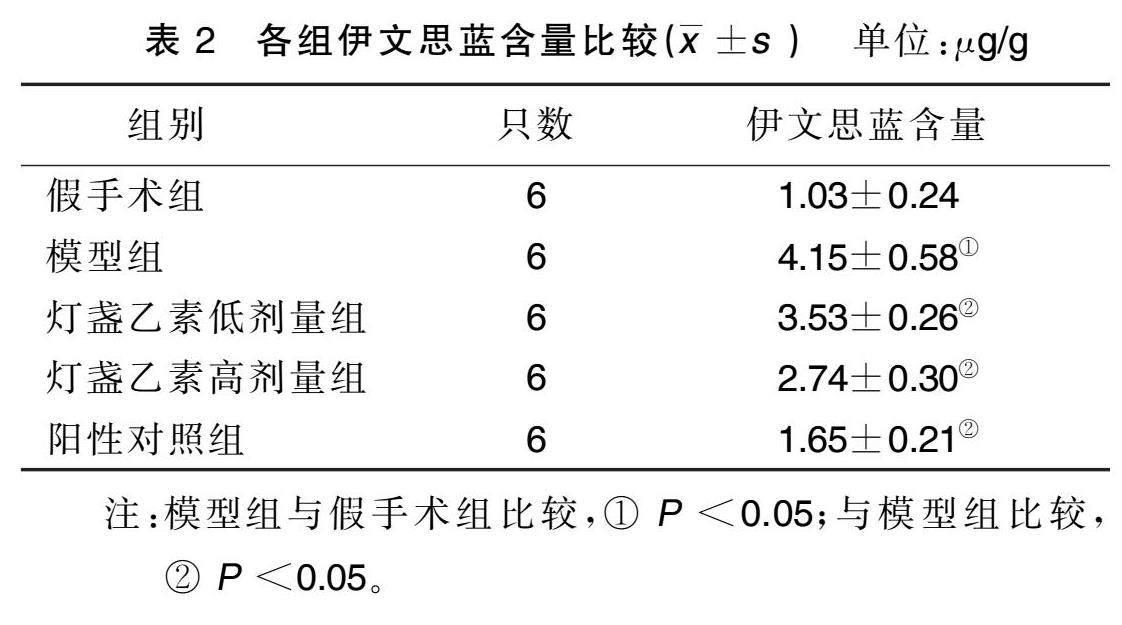
取材前1 h随机从各组大鼠中取6只,经尾静脉注射2%伊文思蓝(4 mL/kg),直至大鼠皮肤以及四肢变蓝,1 h后予腹腔麻醉,打开腹腔,经左心室灌注生理盐水,直至右心耳有清亮液体流出,冰台上迅速解剖取出脑组织,将脑组织置于甲酰胺溶液中浸泡72 h,避光,研磨,匀浆,离心,取上清液,在酶标仪630 nm波长处测定吸光(A)值,计算出伊文思蓝含量。
1.4.3 苏木精.伊红(HE)染色
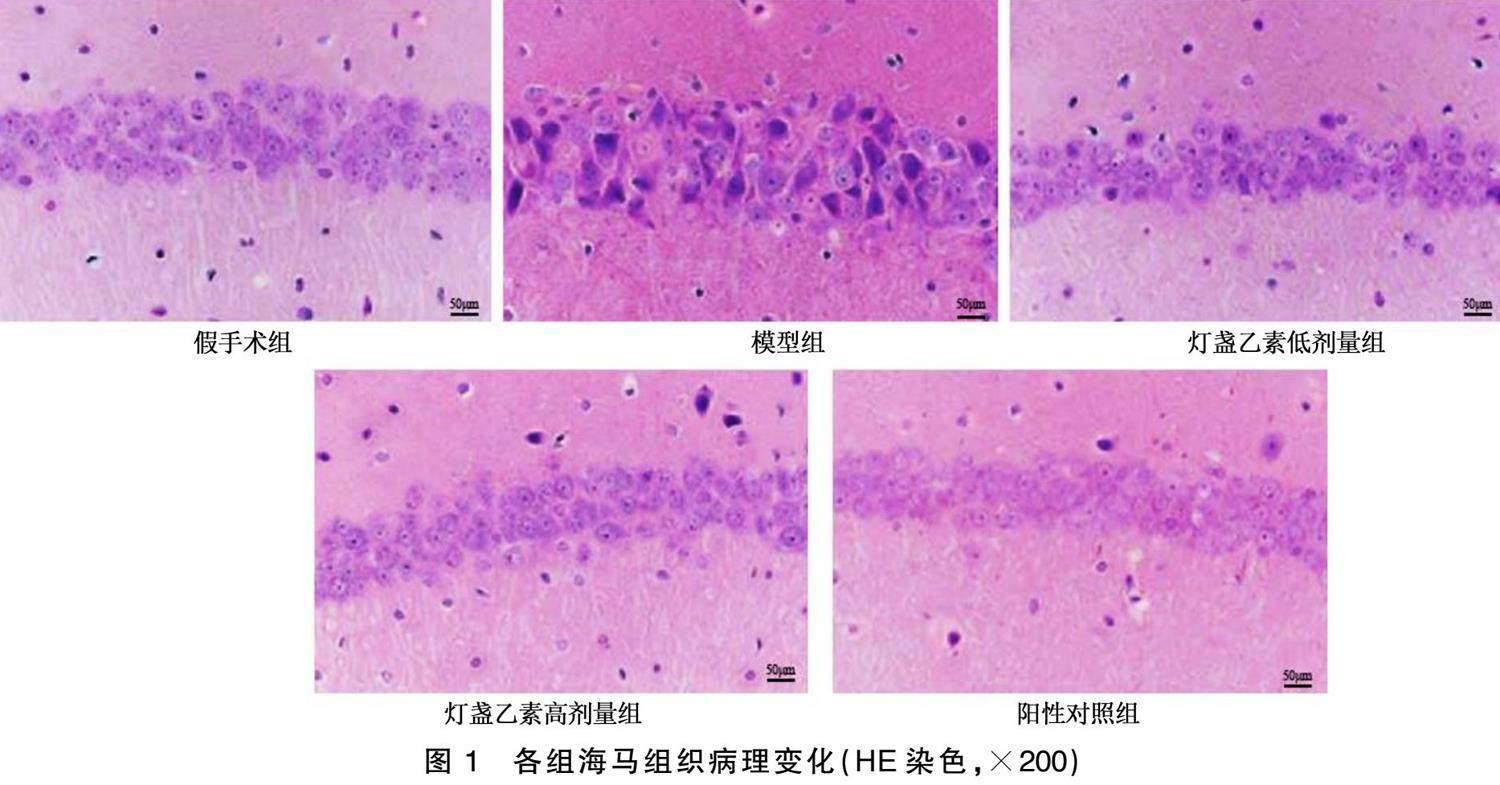
取各组剩余大鼠脑组织,经常规脱水、包埋、切片后,按照HE染色试剂盒说明书进行操作,显微镜下观察病理损伤情况。
1.4.4 免疫组化染色
取石蜡切片,经脱水、透明 后,根据免疫组化试剂盒说明书进行Aβ含量测定,棕黄色为Aβ阳性染色面积。
1.4.5 蛋白质免疫印迹法(Western Blot)检测
取部分脑组织,剪碎,匀浆,加入裂解液裂解,二喹啉甲酸法(BCA)测定蛋白浓度,120 V恒压电泳,0.3 A恒流湿转,室温封闭,GAPDH、MMP.9、LRP.1、P.gp、Claudin.5以及Occludin蛋白抗体(1∶1 000)4 ℃孵育过夜,二抗(1∶5 000)室温孵育,显色,Image J分析条带灰度值,计算目的蛋白相对表达量。
1.5 统计学处理
采用SPSS 21.0统计学软件分析数据,符合正态分布的定量资料以均数±标准差( x ± s )表示,多样本定量资料比较采用单因素方差分析,进一步两两比较采用LSD. t 检验,以 P <0.05为差异有统计学意义。
2 结 果
2.1 大鼠行为能力
在水迷宫实验中,随着训练时间的延长各组大鼠的逃避潜伏期均有缩短,而各时间点模型组大鼠逃避潜伏期均高于假手术组,灯盏乙素低剂量组、灯盏乙素高剂量组及阳性对照组大鼠逃避潜伏期均低于模型组( P <0.05)。模型组大鼠穿过平台的次数低于假手术组,灯盏乙素低剂量组、灯盏乙素高剂量组及阳性对照组大鼠穿过平台的次数高于模型组( P <0.05)。详见表1。
2.2 血脑屏障通透性
与假手术组比较,模型组大鼠脑组织伊文思蓝含量升高( P <0.05);与模型组比较,灯盏乙素低剂量组、灯盏乙素高剂量组及阳性对照组大鼠脑组织中伊文思蓝含量降低( P <0.05)。详见表2。
2.3 脑组织病理变化
假手术组未见神经元异常,锥体细胞排列有序、整齐且致密;模型组神经元细胞排列疏松紊乱、细胞数量减少,可见明显空泡化;灯盏乙素低剂量组、灯盏乙素高剂量组及阳性对照组神经元细胞数量增多,空泡化细胞减少,细胞排列稍整齐、致密。详见图1。
2.4 脑组织Aβ斑块面积
与假手术组比较,模型组大鼠脑组织中Aβ斑块面积增大( P <0.05);与模型组比较,灯盏乙素低剂量组、灯盏乙素高剂量组及阳性对照组大鼠脑组织中Aβ斑块面积减小( P <0.05)。假手术组大鼠脑组织未见棕黄色深染的Aβ斑块;模型组大鼠脑组织棕黄色深染的Aβ斑块明显增多;灯盏乙素各剂量组大鼠脑组织棕黄色深染的Aβ斑块较模型组减少。详见表3及图2。
2.5 脑组织中MMP.9、LRP.1、P.gp、Claudin.5及Occludin蛋白表达
与假手术组比较,模型组MMP.9蛋白相对表达量升高,LRP.1、P.gp、Claudin.5以及Occludin蛋白相对表达量降低( P <0.05);与模型组比较,灯盏乙素低剂量组、灯盏乙素高剂量组及阳性对照组大鼠脑组织中MMP.9蛋白相对表达量降低,LRP.1、P.gp、Claudin.5以及Occludin蛋白相对表达量升高( P <0.05)。详见表4及图3。
3 讨 论
Aβ异常沉积将导致一系列神经毒性,包括胆碱能功能障碍、神经炎症、氧化应激以及突触损伤和线粒体功能障碍等,而这些神经毒性反应相互作用最终导致神经细胞凋亡,诱发痴呆 [6] 。体内外研究发现,灯盏乙素具有抗L.谷氨酸造成的HT22神经细胞凋亡和氧化应激反应,因此,可能成为治疗AD的潜在药物 [7] 。本研究通过海马内注射Aβ 1.42 建立AD模型,探讨灯盏 乙素对AD大鼠血脑屏障的保护作用及对Aβ的清除 作用。
本研究通过为期4 d的Morris水迷宫实验,结果显示:模型组大鼠逃避潜伏期明显长于假手术组,灯盏乙素低、高剂量组和阳性对照组大鼠逃避潜伏期较模型组缩短。经过为期4 d的训练后,第5天撤去平台,发现模型组大鼠穿过平台的次数低于假手术组,给予药物治疗后,穿过平台的次数多于模型组。由此可见,Aβ 1.42 造成大鼠记忆功能障碍,而灯盏乙素治疗可改善这一病理特征。海马区主要负责存储信息,是学习和记忆的关键部位,在AD病人中,海马体最先受到损伤,因此,病人出现记忆力衰退以及方向知觉丧失 [8] 。本研究通过HE染色显示:模型组大鼠海马区神经元细胞排列紊乱,细胞数量减少且出现空泡化,经灯盏乙素和盐酸多奈哌齐治疗后,神经元细胞结构清晰,细胞数量增多,排列致密。可见灯盏乙素具有改善AD海马神经损伤的作用。血脑屏障是介于血液和脑组织之间的一种特殊屏障,是一个极其复杂的细胞系统,在多种神经退行性疾病中常伴随血脑屏障结构和功能损坏,导致局部通透性增加,脑组织所处内环境紊乱,有害物质入侵,营养物质及其代谢产物通过异常,最终造成神经元损伤 [9] 。本研究通过伊文思蓝染色检测了血脑屏障的通透性,结果显示:模型组大鼠血脑屏障通透性明显增加,经灯盏乙素和盐酸多奈哌齐治疗后血脑屏障的通透性降低,可见灯盏乙素可保护血脑屏障。此外,显微镜下观察AD大鼠海马组织,发现海马体中出现一些老年斑,而且已经证实这些老年斑是Aβ蛋白沉积的结果 [10.11] 。本研究通过免疫组化法检测海马区Aβ蛋白沉积情况,结果显示:模型组大鼠海马区Aβ蛋白斑明显多于假手术组,经灯盏乙素和盐酸多奈哌齐治疗后Aβ蛋白斑减少。可见灯盏乙素可抑制Aβ蛋白沉积。根据以上结果,推测灯盏乙素可能通过改善血脑屏障结构和功能的完整性,增强Aβ蛋白的转运能力,抑制Aβ蛋白造成的神经毒性,从而改善AD大鼠记忆功能障碍。
血脑屏障的结构组成包括许多相邻细胞间的紧密连接,而这种紧密连接主要是由多种结构和功能相联系的蛋白质组合成一个群体而实现的,在这个群体中Claudin家族和Occludin发挥了重要作用 [12] 。Occludin是一种跨膜蛋白,它的头端和尾端暴露于细胞质中,中间形成两个存在于细胞膜外面的环状结构,而两个相邻细胞正是借助这两个环状结构实现彼此连接,从而使细胞间缝隙被封锁。Claudin.5是Claudin家族在调节血脑屏障通透性中起到重要作用的一员 [13] 。LRP.1是一种跨膜糖蛋白,一方面LRP.1通过与APP裂解酶竞争性结合减少Aβ生成,另一方面可介导Aβ在血脑屏障中向外转运 [14] 。P.gp是一种多药转运蛋白,其可限制循环成分进入大脑,保护脑组织免受有害物质的入侵,对维持脑内环境稳态具有重要作用,此外,还可增强血脑屏障的外排能力 [15] 。MMP.9可特异性分解构成血脑屏障结构的紧密连接蛋白,因此,MMP.9水平直接影响血脑屏障结构和功能完整性 [16] 。
本研究结果显示:模型组大鼠MMP.9蛋白表达升高,LRP.1、P.gp、Claudin.5以及Occludin蛋白表达降低,经灯盏乙素和盐酸多奈哌齐治疗后逆转各蛋白表达情况。由此可见,灯盏乙素可上调血脑屏障中紧密连接蛋白LRP.1、P.gp、Claudin.5以及Occludin,下调MMP.9,加强Aβ的清除率,从而改善AD大鼠学习和记忆能力,减轻神经元病理损伤,保护血脑屏障。
参考文献:
[1] KHAN S, BARVE K H,KUMAR M S.Recent advancements in pathogenesis,diagnostics and treatment of Alzheimer′s disease[J].Curr Neuropharmacol,2020,18(11):1106.1125.
[2] YANG L, ZHOU R Y.Effects of androgens on the amyloid.β protein in Alzheimer′s disease[J].Endocrinology,2018,159(12):3885.3894.
[3] WU T, CHEN L,ZHOU L, et al. Platelets transport β.amyloid from the peripheral blood into the brain by destroying the blood.brain barrier to accelerate the process of Alzheimer′s disease in mouse models[J].Aging(Albany NY),2021,13(5):7644.7659.
[4] 王豫君, 敖俊文,郭莉莉,等.灯盏乙素对阿尔茨海默病小鼠脑组织 β分泌酶途径相关蛋白表达的影响[J].山东医药,2018,58(26):5.8.
[5] 林志川, 文国强,吕艳,等.天麻素对阿尔茨海默症大鼠神经保护作用的研究[J].广西医科大学学报,2020,37(8):1435.1441.
[6] SIMUNKOVA M, ALWASEL S H,ALHAZZA I M, et al. Management of oxidative stress and other pathologies in Alzheimer′s disease[J].Arch Toxicol,2019,93(9):2491.2513.
[7] HU X, TENG S,HE J, et al. Pharmacological basis for application of scutellarin in Alzheimer′s disease:antioxidation and antiapoptosis [J].Mol Med Rep,2018,18(5):4289.4296.
[8] 曹育, 安玉兰,张卓铭,等.针刺对阿尔茨海默症小鼠海马CA1区树突结构及认知功能影响的研究[J].中国比较医学杂志,2021,31(10): 9.15.
[9] SOLM, ESTEBAN.LOPEZ M,TALTAVULL B, et al. Blood.brain barrier dysfunction underlying Alzheimer′s disease is induced by an SSAO/VAP.1.dependent cerebrovascular activation with enhanced Aβ deposition[J].Biochim Biophys Acta Mol Basis Dis,2019,1865(9):2189.2202.
[10] KINOSHITA M, KAKIMOTO E,TERAKAWA M S, et al. Model membrane size.dependent amyloidogenesis of Alzheimer′s amyloid.β peptides[J].Physical Chemistry Chemical Physics,2017,19(24):16257.16266.
[11] MICHNO W, NYSTRM S,WEHRLI P, et al. Pyroglutamation of amyloid.βx.42(Aβx.42)followed by Aβ1.40 deposition underlies plaque polymorphism in progressing Alzheimer′s disease pathology[J].The Journal of Biological Chemistry,2019,294(17):6719.6732.
[12] ZHU L, LIN M Q,MA J, et al. The role of LINC00094/miR.224.5p(miR.497.5p)/endophilin.1 axis in Memantine mediated protective effects on blood.brain barrier in AD microenvironment[J].Journal of Cellular and Molecular Medicine,2019,23(5):3280.3292.
[13] YAMAZAKI Y, SHINOHARA M,SHINOHARA M, et al. Selective loss of cortical endothelial tight junction proteins during Alzheimer′s disease progression[J].Brain,2019,142(4):1077.1092.
[14] WU S, LIU H,ZHAO H, et al. Environmental lead exposure aggravates the progression of Alzheimer′s disease in mice by targeting on blood brain barrier[J].Toxicol Lett,2020,319:138.147.
[15] STORELLI F, BILLINGTON S,KUMAR A R, et al. Abundance of P.Glycoprotein and other drug transporters at the human blood.brain barrier in Alzheimer′s disease:a quantitative targeted proteomic study[J].Clin Pharmacol Ther,2021,109(3):667.675.
[16] LIU C Y, BAI K,LIU X H, et al. Hyperoside protects the blood.brain barrier from neurotoxicity of amyloid beta 1.42[J].Neural Regeneration Research,2018,13(11):1974.1980.
(收稿日期:2022.09.13)
(本文编辑 王雅洁)

