两种丛枝菌根真菌复合接种对青山杨叶片抗美国白蛾的影响

收稿日期Received:2022-09-25""" 修回日期Accepted:2023-09-21
基金项目:国家重点研发计划(2021YFD1400300)。
第一作者:方静(18232313783@qq.com)。
*通信作者:严善春(yanshanchun@126.com),教授。
引文格式:
方静,张书曼,严善春,等. 两种丛枝菌根真菌复合接种对青山杨叶片抗美国白蛾的影响. 南京林业大学学报(自然科学版),2024,48(2):144-154.
FANG J, ZHANG S M, YAN S C, et al. Effects of the compound inoculation of two arbuscular mycorrhizal(AM) fungi on the resistance of Populus pseudo-cathayana × P. deltoides leaves to Hyphantria cunea. Journal of Nanjing Forestry University (Natural Sciences Edition),2024,48(2):144-154.
DOI:10.12302/j.issn.1000-2006.202209054.
摘要:【目的】为研究青山杨叶部害虫生物防控新途径,探索丛枝菌根(arbuscular mycorrhiza,AM)真菌复合接种对青山杨(Populus pseudo-cathayana × P. deltoides)叶片抗美国白蛾的影响。【方法】于温室盆栽条件下对1年生青山杨扦插苗进行根内根孢囊霉(Rhizophagus intraradices, RI)和摩西斗管囊霉(Funneliformis mosseae,FM)单一及复合接种(M)处理,以不接种处理为对照(CK),测定对青山杨叶片次生代谢物质、防御酶和蛋白酶抑制剂方面等化学防御能力的影响,并以美国白蛾(Hyphantria cunea)幼虫为生物测定对象判断青山杨的抗虫效果。【结果】在120 d内M组的菌根侵染率、丛枝着生率和根内泡囊数均高于FM和RI组,同时,M组能在一定程度上提高青山杨叶片的化学防御能力,其中叶片总生物碱、纤维素含量和过氧化物酶(POD)、过氧化氢酶(CAT)、脂氧合酶(LOX)、多酚氧化酶(PPO)、胰凝乳蛋白酶抑制剂(CI)、胰蛋白酶抑制剂(TI)活性显著高于RI、FM和CK组(Plt;0.05)。取食M组叶片的3龄美国白蛾幼虫取食量、排粪量、纤维素酶活性、乙酰胆碱酯酶(AchE)活性和多功能氧化酶(MFO)活性显著低于取食FM、RI和CK组的(Plt;0.05),3龄幼虫体长、食物利用率、胰蛋白酶活性、羧酸酯酶(CarE)活性、谷胱甘肽S-转移酶(GSTs)活性显著高于取食RI和FM组的(Plt;0.05),3龄幼虫食物消耗率和α-淀粉酶活性与RI组差异不显著,其体质量与取食FM组的差异不显著;取食M组叶片的4龄幼虫体质量、取食量、食物消耗率、纤维素酶活性、GSTs活性、CarE活性、AchE活性、MFO活性显著低于取食FM、RI和CK组的(Plt;0.05),4龄幼虫排粪量显著低于取食RI和CK组的(Plt;0.05),4龄幼虫胰蛋白酶活性显著高于其余3组(Plt;0.05),4龄幼虫的体长和食物利用率与取食RI组的差异不显著,4龄幼虫α-淀粉酶活性与取食FM和RI组的差异均不显著;取食M组叶片的5龄幼虫体长、体质量、取食量、排粪量、食物利用率、α-淀粉酶活性、纤维素酶活性、GSTs活性、CarE活性和MFO活性显著低于取食FM、RI和CK组的(Plt;0.05),5龄幼虫食物消耗率显著低于取食FM和RI组的(Plt;0.05),5龄幼虫AchE活性显著低于取食FM组的(Plt;0.05),5龄幼虫胰蛋白酶活性显著高于其余3组(Plt;0.05)。【结论】将RI与FM复合接种能够诱导青山杨叶片在次生代谢物质、防御酶和蛋白酶抑制剂方面的化学防御性能,RI和FM复合接种对青山杨的抗虫性表现优于RI、FM单一接种和无AM真菌接种,并且对美国白蛾幼虫具有一定的抑制效果,在实际应用时可优先考虑RI和FM复合接种。
关键词:丛枝菌根真菌;根内根孢囊霉;摩西斗管囊霉;复合接种;青山杨;美国白蛾
中图分类号:S718.8;S763""""" 文献标志码:A开放科学(资源服务)标识码(OSID):
文章编号:1000-2006(2024)02-0144-11
Effects of the compound inoculation of two arbuscular mycorrhizal(AM) fungi on the resistance of Populus pseudo-cathayana × P. deltoides leaves to Hyphantria cunea
FANG Jing, ZHANG Shuman, YAN Shanchun*, WU Shuai, ZHAO Jiaqi, MENG Zhaojun
(Key Laboratory of Sustainable Forest Ecosystem Management of Ministry of Education, School of Forestry, Northeast Forestry University, Harbin 150040, China)
Abstract: 【Objective】In order to study a new way of biological control of pests on Populus pseudo-cathayana × P. deltoides leaves, the effects of compound inoculation with arbuscular mycorrhizal (AM) fungi on the resistance of" P. pseudo-cathayana×P. deltoides leaves to Hyphantria cunea were investigated. 【Method】 One-year-old P. pseudo-cathayana × P. deltoides cuttings were inoculated with Rhizophagus intraradices (RI) and Funneliformis mosseae (FM) by single and mixed inoculation (M) in a greenhouse, with no inoculation (CK) as the control. The chemical defense ability of secondary metabolites, defense enzymes and protease inhibitors in poplar leaves was determined, and the larva of H. cunea was used as a bioassay object to determine its anti-insect effect.【Result】In 120 days, the mycorrhizal infection rate, arbuscular growth rate and number of vesicles in the root of the M group were higher than those of the FM and RI groups. Meanwhile, the M group could improve the chemical defense ability of the leaves of P. pseudo-cathayana × P. deltoides to a certain extent. The contents of total alkaloids and cellulose and the activities of peroxidase (POD), catalase (CAT), lipoxygenase (LOX), polyphenol oxidase (PPO), chymotrypsin inhibitor (CI) and trypsin inhibitor (TI) in leaves were significantly higher than those in the RI, FM and CK groups (Plt;0.05). The food intake, fecal output, cellulase activity, acetylcholinesterase (AchE) activity and multifunctional oxidase (MFO) activity of the third instar larvae in the M group were significantly lower than those in the FM, RI and CK groups (Plt;0.05). The body length, food availability, trypsin activity, carboxylesterase (CarE) activity, and glutathione S-transferase (GSTs) activity of the third instar larvae were significantly higher than those of the RI and FM groups (Plt;0.05). The food consumption rate and α-amylase activity of the third instar larvae did not significantly differ from those of the RI group, and the body weight of the third instar larvae did not significantly differ from those of the FM group. Body weight, food intake, food consumption rate, cellulase activity, GSTs activity, CarE activity, AchE activity and MFO activity of the fourth instar larvae were significantly lower than those of the FM, RI and CK groups (Plt;0.05), the fecal output of the fourth instar larvae was significantly lower than that of the RI and CK groups (Plt;0.05), and the trypsin activity of the fourth instar larvae was significantly higher than that of the other three groups (Plt;0.05). The body length and food availability of the fourth instar larvae did not significantly differ from those of the RI group, and the α-amylase activity of the fourth instar larvae did not significantly differ from those of the FM and RI groups. The body length, body weight, food intake, fecal output, food utilization, α-amylase activity, cellulase activity, GSTs activity, CarE activity, and MFO activity of the fifth instar larvae were significantly lower than those in the FM, RI and CK groups (Plt;0.05). The food consumption rate of the fifth instar larvae was significantly lower than that in the FM and RI groups, and the AchE activity of the fifth instar larvae was significantly lower than that in the FM group (Plt;0.05). The trypsin activity of the fifth instar larvae was significantly higher than that of the other three groups (P lt;0.05).【Conclusion】The mixed inoculation of RI and FM could induce the chemical defense performance of P. pseudo-cathayana × P. deltoides leaves in the aspects of secondary metabolites, defense enzymes, and protease inhibitors. The anti-insect performance of combined RI and FM inoculation was better than that of single RI and FM inoculation and no AM fungi inoculation and had certain inhibitory effect on the larva of H. cunea. In practical application, combined RI and FM inoculation can be prioritized.
Keywords:arbuscular mycorrhizal (AM) fungi; Rhizophagus intraradices; Funneliformis mosseae; compound inoculation; Populus pseudo-cathayana × P. deltoids; Hyphantria cunea
美国白蛾(Hyphantria cunea)属鳞翅目(Lepidortera)灯蛾科(Arctiidae),是一种典型的多食性食叶害虫,在我国寄主包括杨树(Populus spp.)、桑树(Morus spp.)、榆树(Ulmus spp.)和白蜡(Fraxinus chinensis)等300多种植物,严重威胁植物的生长发育。丛枝菌根(arbuscular mycorrhiza,AM)真菌是球囊菌门(Glomeromycota)球囊菌纲(Glonerormycete)的一类真菌,能够与陆地上80%~90%植物的根系形成丛枝菌根,被誉为“植物根系共生体之母”。在森林生态系统中,AM真菌能与植物建立共生关系并直接或间接参与植物的生理代谢,提供养分辅助增加植物抗病虫害能力。AM真菌定殖植物形成共生体后诱导植物产生的抗性是菌根诱导抗性,诱导防御产生的生化反应会较大程度地启动物理防御和化学防御。其中,化学防御是植物通过提高次生代谢产物含量和防御酶活性等一系列生理生化反应来抵御昆虫危害的能力。诱导防御类似于免疫反应,并被认为具有“开-关效应”。例如,Formenti等研究发现,茉莉酸合成缺陷型番茄(Solanum lycopersicum)接种异形根孢囊霉(Rhizophagus irregularis)能够诱导植物合成茉莉酸,进而降低海灰翅夜蛾(Spodoptera littoralis)的存活率;张伟珍等研究发现,扭形球囊霉(Glomus tortuosum)定殖‘兰箭3号’春箭筈豌豆(Vicia sativa ‘Lanjian No.3’)显著降低了豌豆蚜(Acyrthosiphon pisum)的取食率;Roger等发现AM真菌以一种基因型特异性的方式影响植物抗性,部分接种AM真菌降低了昆虫对其取食的喜好程度,并且昆虫优先选择以非菌根植物的叶片为食;还有研究发现,这些诱导出来的防御特性有时在第2代个体中还能够继续保持。因此,深入剖析菌根诱导抗性(MIR)对寄主植物的作用机制,可为害虫防治提供重要的理论基础。
单一接种AM真菌能够诱导寄主植物产生抗虫性,而复合菌接种多表现为协同或累加效应。目前,将两种或两种以上AM真菌复合接种对林木抗虫性影响的研究较少。杨树作为木本植物研究中的模式树种,不仅是我国人工林栽植的主要树种,而且大部分杨树品种是典型的内外生菌根植物,与AM真菌的亲和性较高。为探究青山杨(Populus pseudo-cathayana× P. deltoides)叶部害虫生物防控新途径,探索AM真菌对青山杨叶片的抗虫效应,本研究将根内根孢囊霉(Rhizophagus intraradices, RI)与摩西斗管囊霉(Funneliformis mosseae, FM)单一和复合接种(M)青山杨,探究不同接种处理对青山杨物理和化学防御性能的影响,并通过用不同处理组叶片饲喂美国白蛾幼虫的方法,进一步判断其抗虫效果,以期为叶部害虫可持续治理及菌根化育苗技术的研究提供参考依据。
1" 材料与方法
1.1" 试验材料
1.1.1" 供试植物
1年生青山杨(Populus pseudo-cathayana×P. deltoides)插穗(长15 cm)。扦插前7 d对插穗进行沙藏,临用前用体积分数70%乙醇溶液表面消毒15 s,蒸馏水冲洗3次后进行扦插。
1.1.2" 供试菌种
供试菌种选用根内根孢囊霉(RI)和摩西斗管囊霉(FM),由甘肃农业科学院提供,接种物包括孢子、菌根根段、菌丝和扩繁植物的根围土。
1.1.3" 培养基质
培养基质为配比为V(草炭土)∶V(蛭石)∶V(沙子)=3∶1∶1的混合基质,充分混匀后在121 ℃下高压灭菌2 h。
1.1.4 "供试昆虫
美国白蛾卵块和喂食饲料购自中国林业科学研究院森林生态环境与自然保护研究所。试验前将卵粒放入10%的甲醛溶液中浸泡消毒60 min,然后清水漂洗 4~5次,确保无甲醛残留。用吸水纸擦干水分后放入人工气候培养箱(哈尔滨市东联电子技术开发有限公司,型号HPG-400HX)孵化,温度(25±1)℃,湿度(70±1)%,光暗周期为16 h/8 h。幼虫孵化后,用人工饲料喂养至2龄备用,之后将刚蜕皮的2龄美国白蛾幼虫,分别用AM真菌定殖青山杨90 d时的FM、RI和M组(复合接种)叶片进行饲养,对照(CK)组饲喂未接种的青山杨叶片,每个处理饲养150头幼虫。
1.2" 苗木接种处理
试验地为黑龙江省哈尔滨市森林植物园(126°38′E,45°43′N)温室大棚,于2021年5月初将1年生青山杨插穗分别扦插在提前装入2.5 kg培养基质和20 g菌种的育苗盆(18 cm × 25 cm)中。RI组每盆加入20 g根内根孢囊霉菌种,FM组每盆加入20 g 摩西斗管囊霉菌种,M组每盆加入RI和FM菌种各10 g,CK组(即对照)加入等量的灭菌土。每盆栽植1株,每个处理栽植200株。定期统一进行浇水、松土和除草等日常养护管理。
1.3" 指标测定
1.3.1" AM真菌侵染测定
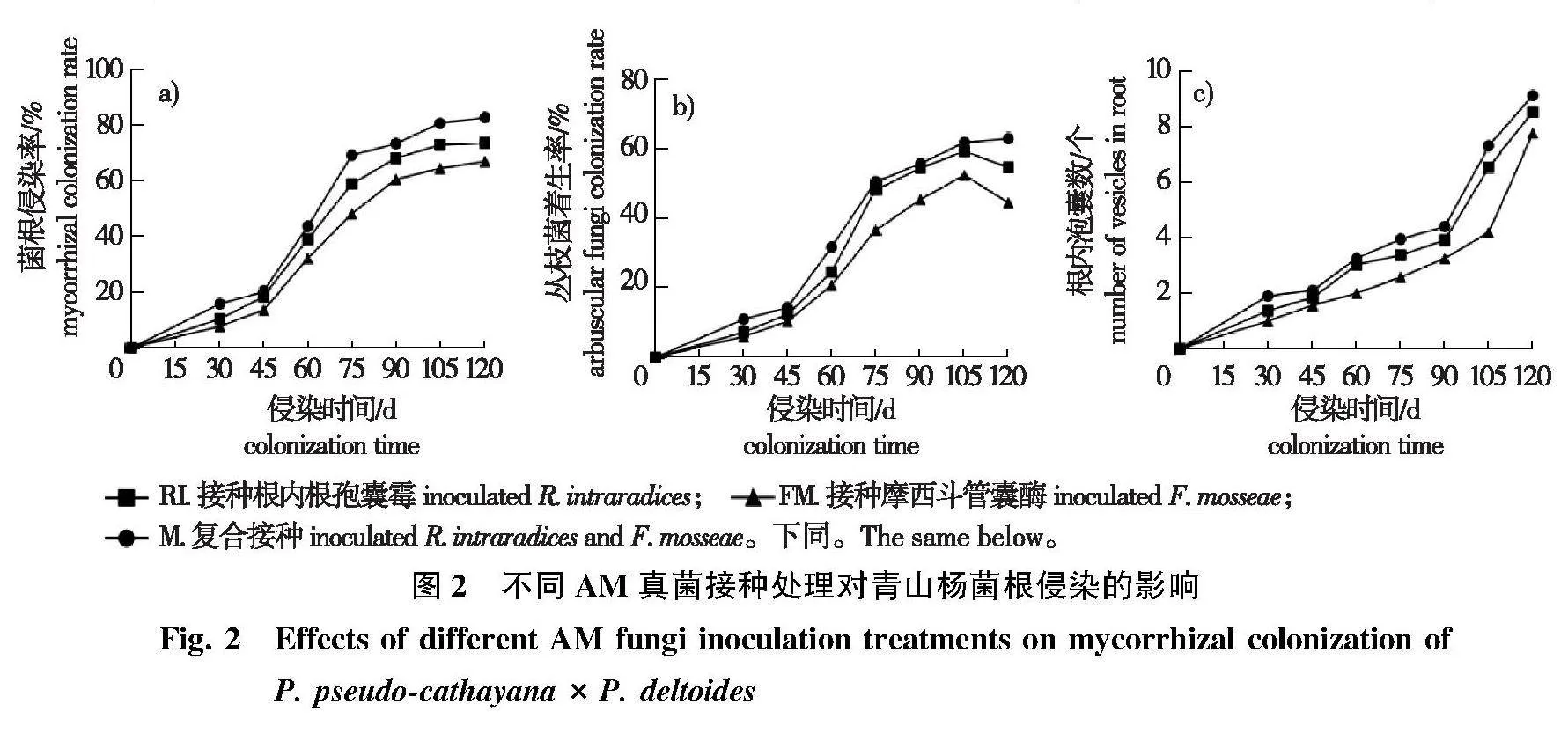
在接种AM真菌后,分别在30、45、60、75、90、105和120 d,从每个处理组中随机选取10株样树,将根段剪成0.5~1.5 cm小段,每株20段。依据刘润进等的染色镜检方法观察测定各处理组的菌根侵染率、丛枝着生率和根内泡囊数。
1.3.2" 青山杨化学防御指标测定
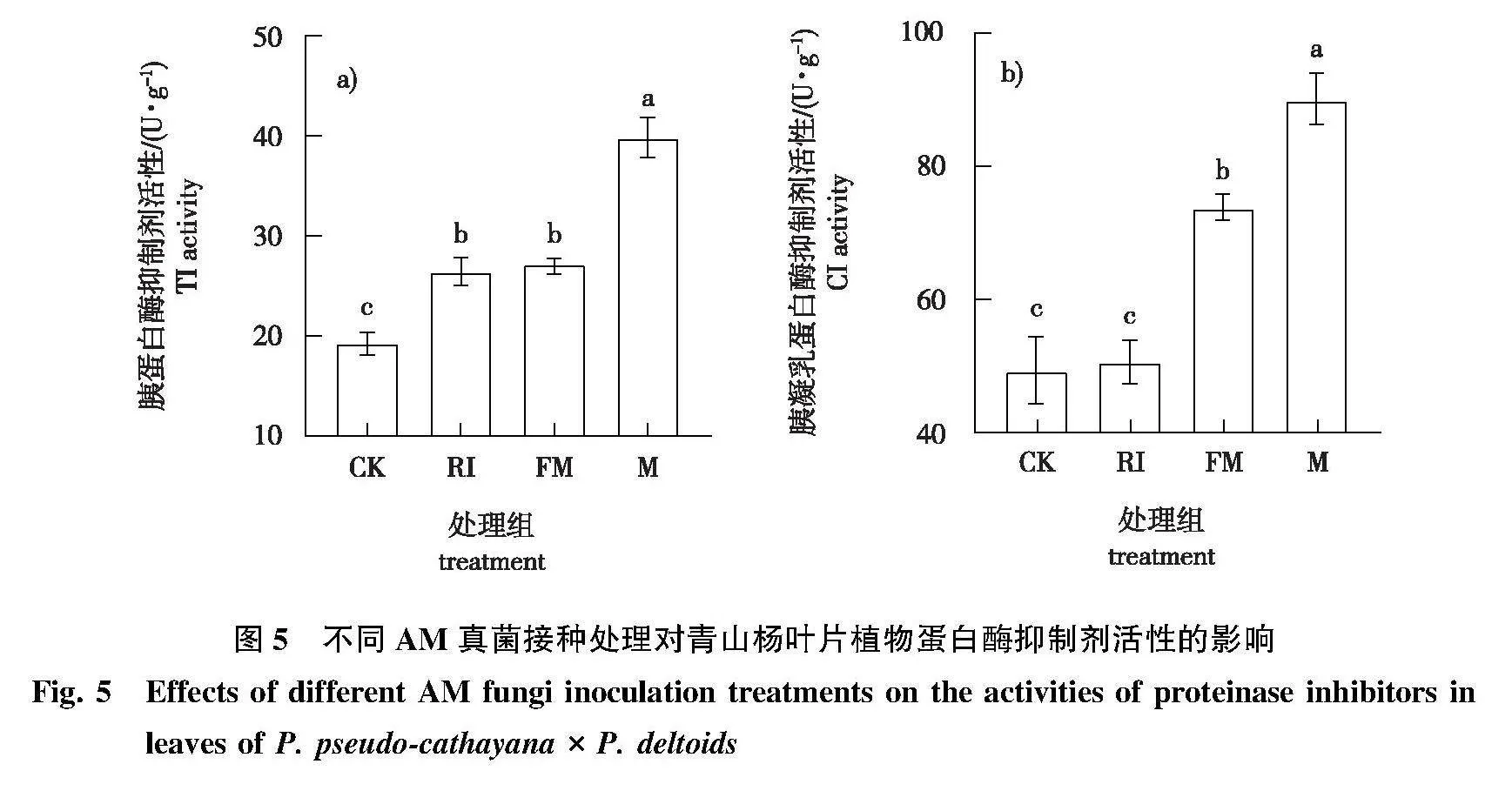
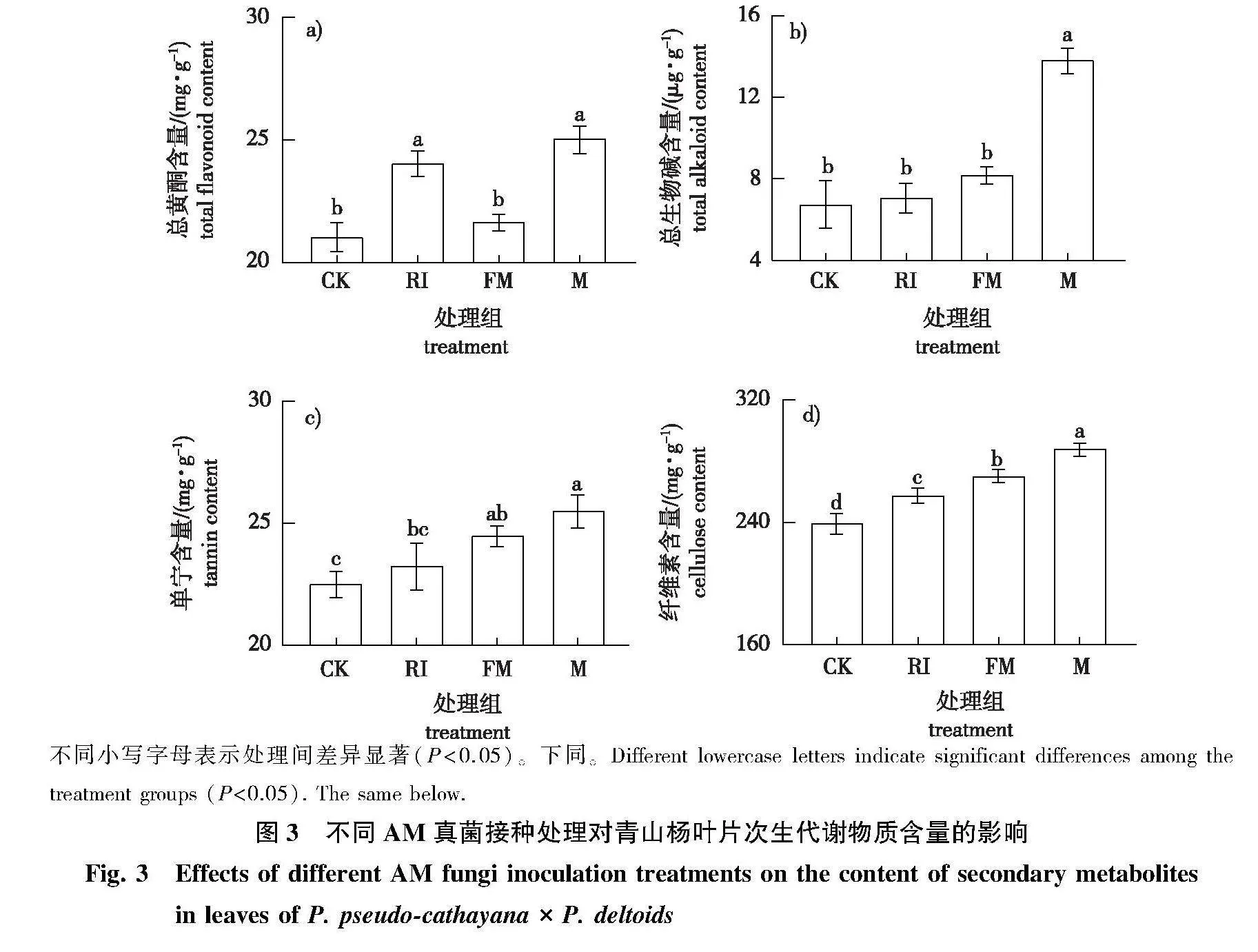
在AM真菌定殖侵染第90天时,每个处理组随机选取9株样树进行相关指标测定。总生物碱、总黄酮、单宁和纤维素含量的测定均采用可见分光光度法,具体操作参照苏州格锐思生物科技有限公司试剂盒说明书中方法。过氧化物酶(peroxidase,POD)活性参照刘凯洋等的方法测定,过氧化氢酶(catalase,CAT)、脂氧合酶(lipoxygenase,LOX)、苯丙氨酸解氨酶(phenylalnine ammonialyase,PAL)、多酚氧化酶(polyphenol oxidase,PPO)活性的测定参照苏州格锐思生物科技有限公司试剂盒说明书中方法,其中CAT和PPO活性测定采用可见分光光度法(CAT活性单位定义为在25 ℃下,每克组织每分钟催化分解1 μmol H2O2为1个酶活单位,PPO活性单位定义为每克组织每分钟在反应体系中使420 nm处吸光值变化0.005为1个酶活单位),LOX和PAL活性测定采用紫外分光光度法(LOX活性单位定义为每克组织每分钟使234 nm处吸光值变化0.05个单位为1个酶活单位。PAL活性单位定义为在37 ℃下每克组织在反应体系中每小时使290 nm处吸光值变化0.05为1个酶活单位)。胰蛋白酶抑制剂(trypsin inhibitor,TI)、胰凝乳蛋白酶抑制(chymotrypsin inhibitor,CI)活性参照孙兴华等的方法测定(TI活性单位定义为每克组织每分钟在256 nm处吸光值变化0.01个单位为1个酶活单位。CI活性单位定义为每克组织每分钟使253 nm处吸光值变化0.964个单位为1个酶活单位)。
1.3.3" 美国白蛾生长发育指标测定
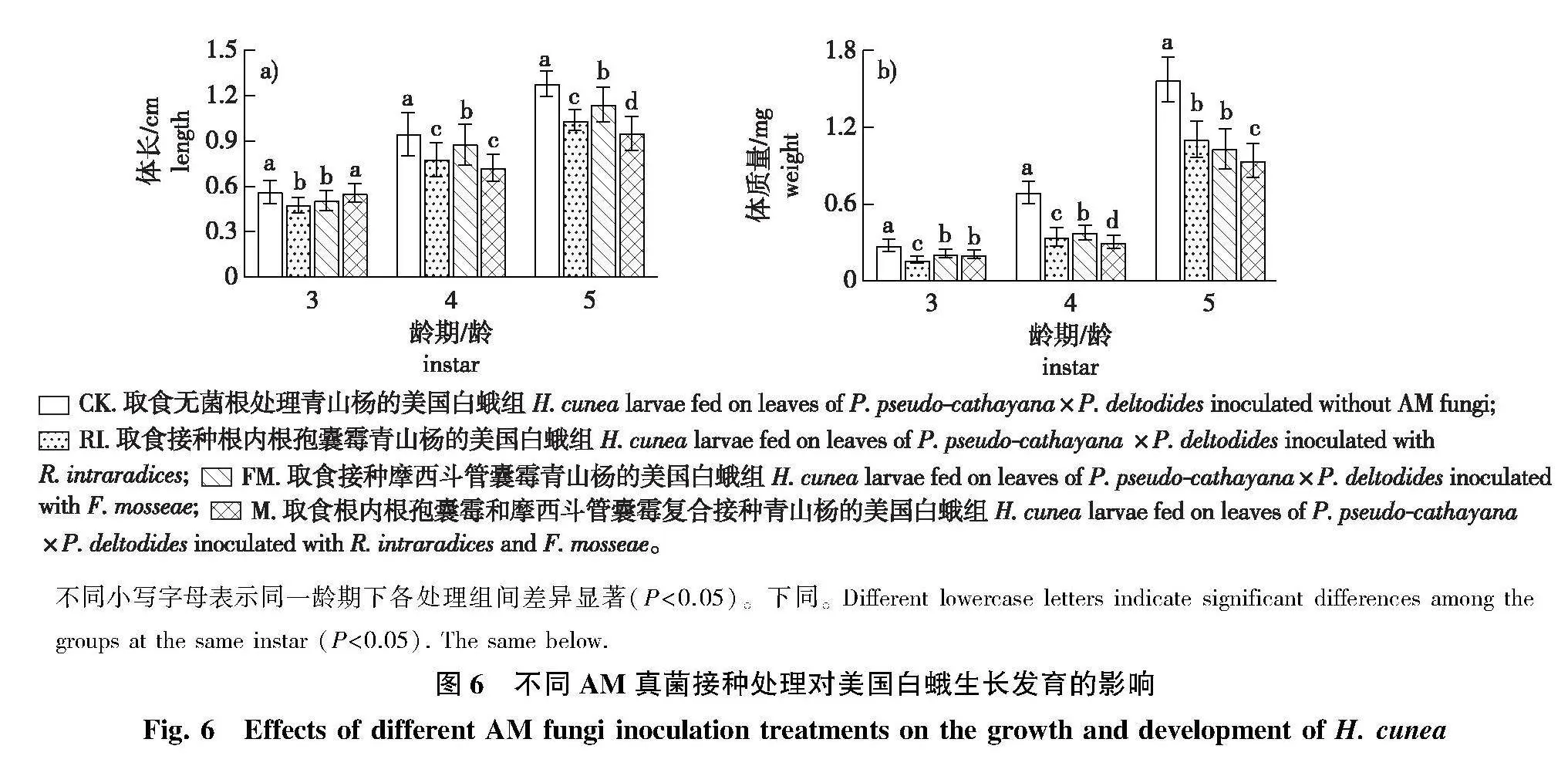
在美国白蛾幼虫蜕皮分别进入3、4、5龄时,分别从各组中选取30头蜕皮不超过24 h的幼虫,测定每头幼虫的体质量和体长。利用分析天平(赛多利斯科学仪器北京有限公司,型号:SQP)称美国白蛾幼虫体质量(精度为0.000 1 g);将标有刻度的网格纸作为虫体的拍照背景进行拍照,用Image J软件处理电子图像进行体长数据分析。
1.3.4" 美国白蛾幼虫食物利用指标测定
在美国白蛾幼虫分别进入3、4、5龄时,分别从各组中选取30头蜕皮不超过24 h的幼虫,并将每组选取的幼虫均分为3组,10头为1个重复,记录每次更换叶片时各组幼虫的体质量、取食前鲜叶质量、取食后残叶质量和幼虫粪便质量,同时设置叶片失水率校正组,以便计算幼虫取食量、排粪量、食物消耗率和食物利用率,关于幼虫的食物利用指标计算方法参照文献。
1.3.5" 美国白蛾幼虫消化酶及防御酶活性测定
收集刚蜕皮的3、4和5龄幼虫,分别从每处理组的各龄期中,均随机选取15头幼虫分成3组,5头为1个重复,放置于-80 ℃超低温冰箱(中科美菱低温科技股份有限公司,型号:DW-HL398)中保存,用于消化酶和防御酶的测定。α-淀粉酶、纤维素酶和胰蛋白酶活性测定参照苏州格锐思试剂盒说明书中方法,其中α-淀粉酶的测定运用微板法,纤维素酶和胰蛋白酶的测定运用可见分光光度法;乙酰胆碱酯酶(acetylcholinesterase,AchE)、羧酸酯酶(carboxylesterase,CarE)和谷胱甘肽S-转移酶(glutathione S-transferase,GSTs)活性的测定方法均参照苏州科铭试剂盒微量法(CarE活性单位为每克组织在37 ℃反应体系中每分钟催化吸光值增加1定义为1个酶活单位);多功能氧化酶(mixed function oxidase,MFO)活性的测定方法参照苏州格锐思试剂盒说明书中微板法。
1.4" 数据处理
利用SPSS 21.0对所测指标进行单因素方差分析(One-way ANOVA),运用最小显著差数法(LSD)进行多重比较,并在0.05水平下进行差异显著性分析。利用GraphPad Prism 9.4.0对所得数据进行绘图。
2" 结果与分析
2.1" 不同接种方式对青山杨菌根侵染的影响
通过对不同接种处理的青山杨根系进行染色观察,侵染情况见图1。
由图1可知,CK组无菌根侵染情况(图1a),RI、FM和M组均侵染定殖成功(图1b、图1c、图1d),并且在0~120 d内,各处理组菌根侵染率、丛枝着生率和根内泡囊数整体上呈现M gt;RI gt; FM的趋势(图2),3个处理组的菌根侵染率和根内泡囊数均随着侵染天数的增加而增加,而RI和FM组的丛枝菌着生率在105~120 d时有7.66%~15.03%减幅。因此选定接种后第90天时取样测定青山杨的化学防御相关指标,并开始用各处理组青山杨叶片饲养2龄美国白蛾幼虫。
2.2" 不同接种方式对青山杨叶片化学防御的影响
1)不同接种方式对青山杨叶片次生代谢物质含量的影响不同(图3)。RI和FM处理组的纤维素含量均显著高于CK组(Plt;0.05)。M组的总黄酮、总生物碱、单宁和纤维素含量均显著高于CK组(Plt;0.05),其中,总生物碱和纤维素含量显著高于FM和RI组(Plt;0.05);总黄酮含量显著高于FM组(Plt;0.05),但与RI组差异不显著;单宁含量显著高于RI组(Plt;0.05),但与FM组差异不显著。
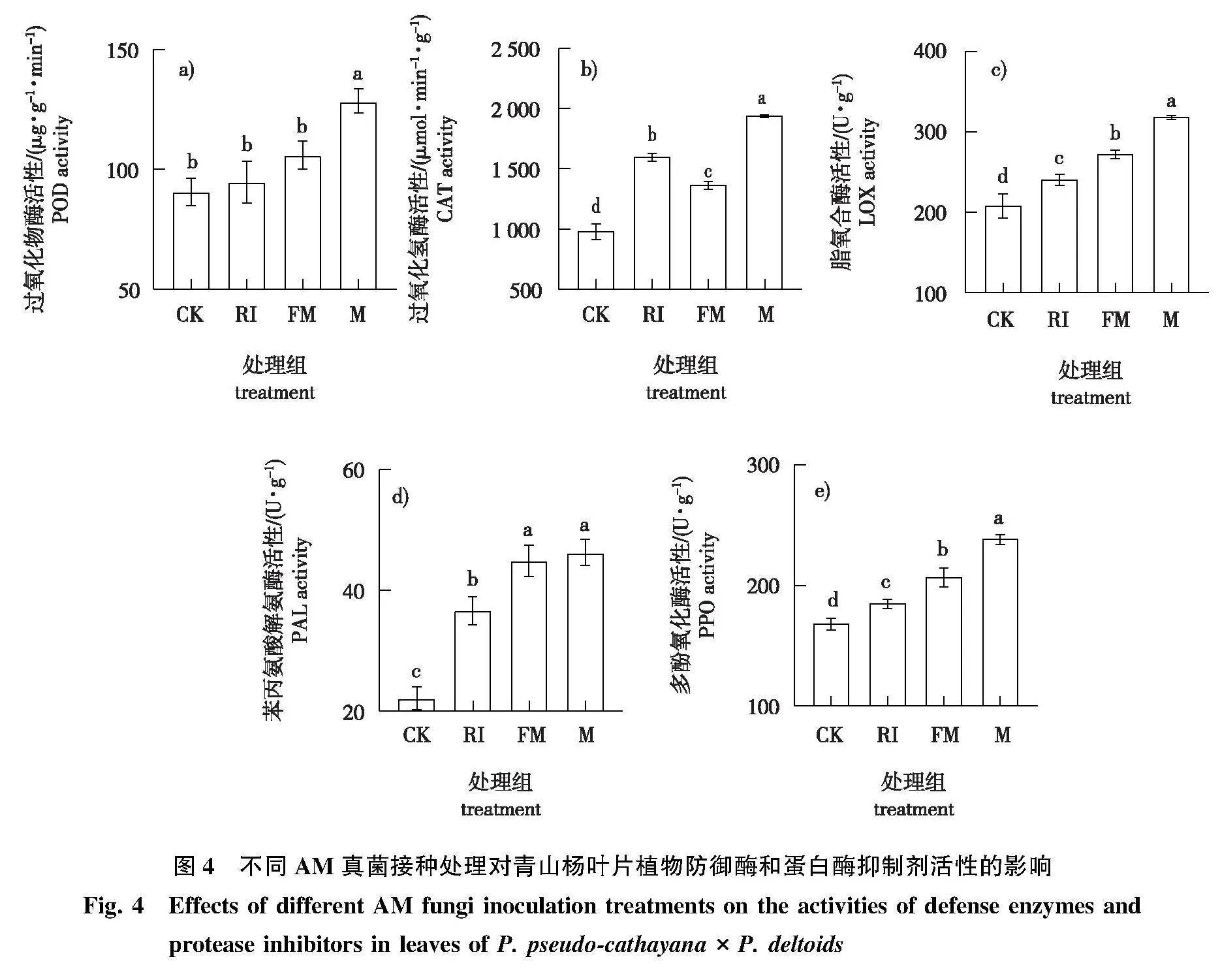
2)青山杨叶片防御酶活性对AM真菌不同接种方式的响应趋势不同(图4)。M组的POD、CAT、LOX和PPO活性均显著高于FM、RI和CK组(Plt;0.05);FM组的LOX、PAL和PPO活性显著高于RI和CK组,CAT活性显著低于RI组(Plt;0.05);RI组的CAT、LOX、PAL和PPO活性显著高于CK组(Plt;0.05)。
3)青山杨叶片蛋白酶抑制剂活性对AM真菌不同接种方式的响应趋势不同(图5)。M组的TI和CI活性均显著高于FM、RI和CK组(Plt;0.05);FM组的CI活性显著高于RI和CK组(Plt;0.05);RI组的TI活性显著高于CK组(Plt;0.05)。
2.3" 不同接种方式对美国白蛾的影响
1)美国白蛾幼虫体长和体质量对不同接种处理青山杨的响应趋势不同(图6)。M组的4~5龄体长和3~5龄体质量均受到一定程度的抑制,且5龄幼虫体长和4~5龄幼虫体质量显著低于CK、RI和FM组(Plt;0.05),3龄幼虫体长与CK组差异不显著;RI组4~5龄幼虫体长和3~4龄幼虫体质量显著低于FM和CK组(Plt;0.05);FM组3~5龄幼虫体长和体质量显著低于CK组(Plt;0.05)。
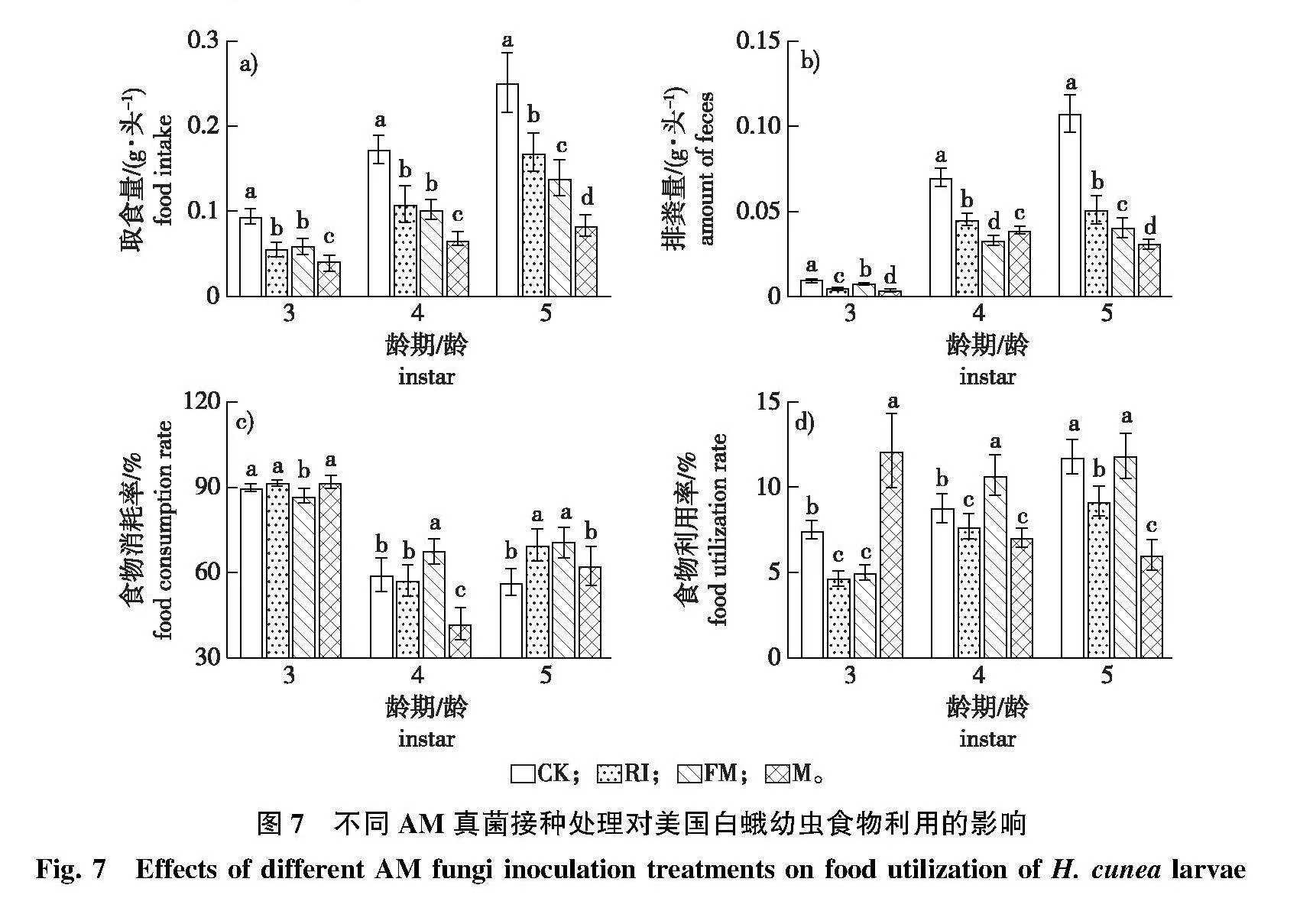
2)经观测,3~5龄美国白蛾幼虫的食物利用情况对不同接种处理青山杨的响应趋势不同(图7)。M组的3~5龄幼虫取食量、3龄和5龄幼虫排粪量、4龄幼虫食物消耗率、5龄幼虫食物利用率显著低于RI、FM和CK组,3龄幼虫食物利用率显著高于RI、FM和CK组(Plt;0.05);FM组3龄幼虫食物消耗率、4龄幼虫排粪量、5龄幼虫取食量和排粪量显著低于RI和CK组,4龄幼虫食物消耗率和食物利用率显著高于RI和CK组(Plt;0.05);RI组3龄幼虫排粪量、4~5龄幼虫食物利用率显著低于FM和CK组(Plt;0.05)。
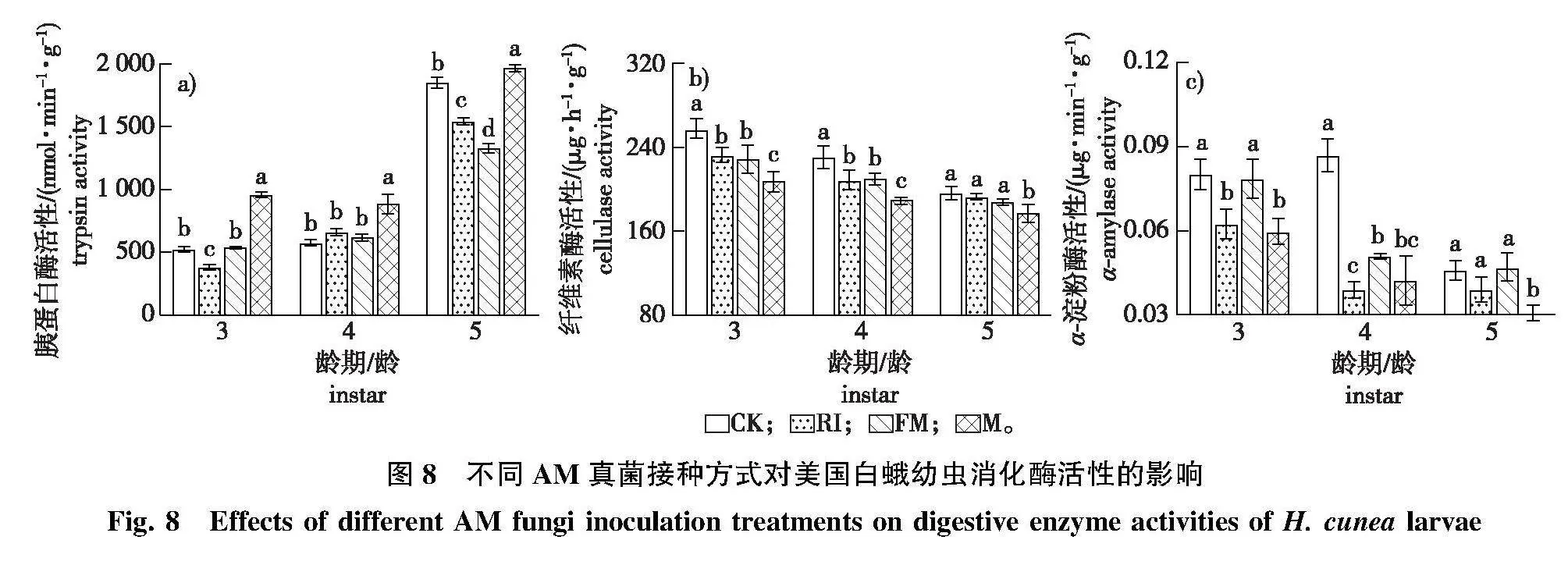
3)经观测,3~5龄美国白蛾幼虫的消化酶活性对不同接种处理青山杨的响应趋势不同(图8)。M组的3~5龄幼虫胰蛋白酶活性显著高于RI、FM和CK组,3~5龄幼虫纤维素酶活性和5龄α-淀粉酶活性显著低于RI、FM和CK组(Plt;0.05);FM组5龄幼虫胰蛋白酶活性显著低于RI和CK组;RI组3龄幼虫胰蛋白酶活性和3~4龄幼虫α-淀粉酶活性显著低于FM和CK组(Plt;0.05)。
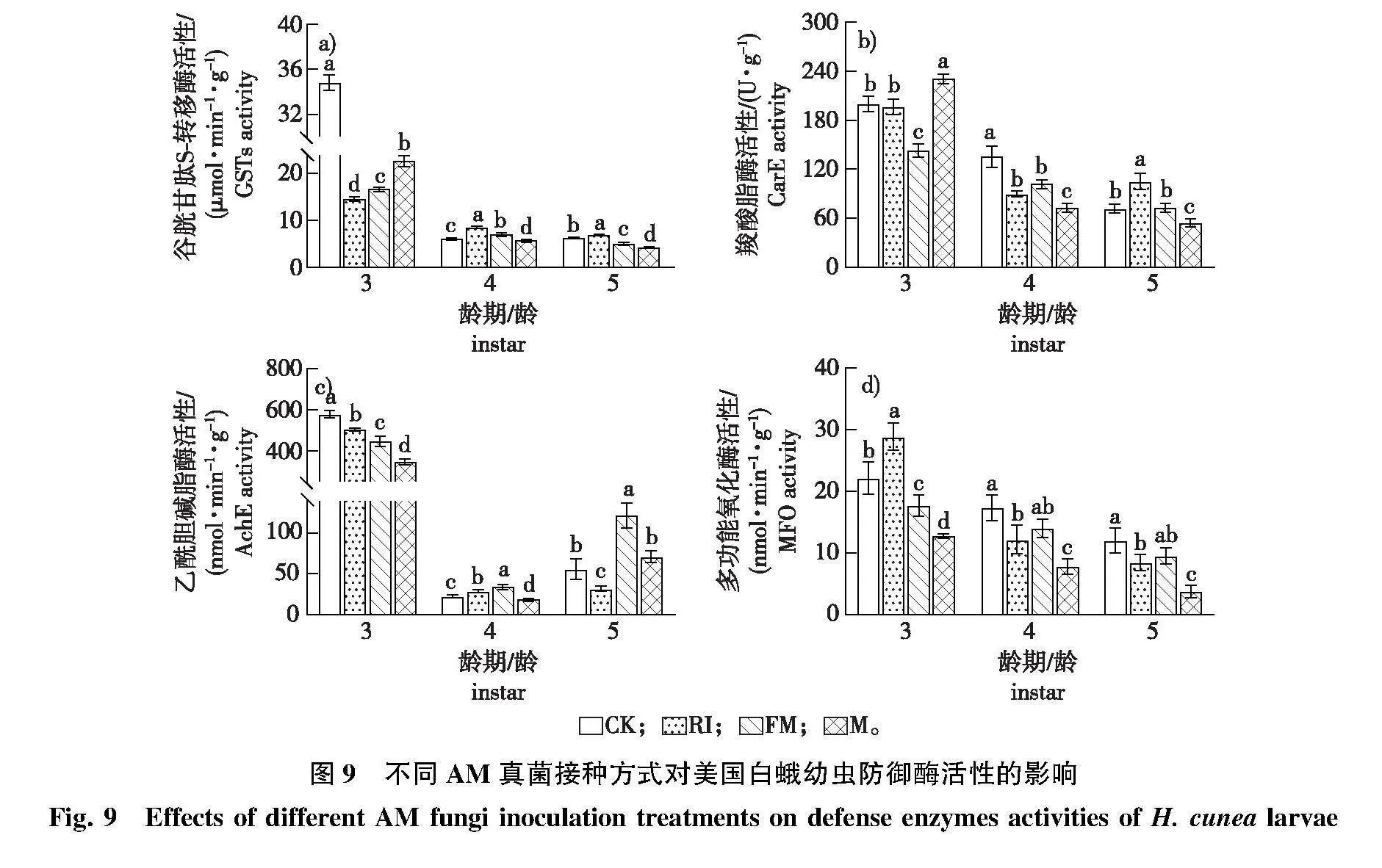
4)经观测,3~5龄美国白蛾幼虫的防御酶活性对不同接种处理青山杨的响应趋势不同(图9)。M组的3龄幼虫AchE和MFO活性显著低于RI、FM和CK组,CarE活性显著高于RI、FM和CK组(Plt;0.05);4龄幼虫GSTs、CarE、AchE和MFO活性显著低于RI、FM和CK组(Plt;0.05);5龄幼虫GSTs、CarE和MFO活性显著低于RI、FM和CK组(Plt;0.05)。FM组的3龄幼虫CarE、AchE、MFO活性和5龄幼虫GSTs活性显著低于RI和CK组,4~5龄幼虫AchE活性显著高于RI和CK组(Plt;0.05)。RI组3龄幼虫GSTs活性和5龄幼出AchE活性显著低于FM和CK组,3龄幼虫MFO活性、4~5龄幼虫GSTs活性和5龄幼虫CarE显著高于FM和CK组(Plt;0.05)。
3" 讨" 论
植物次生代谢物质是植物代谢的终端产物,对植食性昆虫有摄食前拒食和摄食后毒杀的效果。在本研究中,根内根孢囊霉(RI)和摩西斗管囊霉(FM)复合接种处理(M)组的总生物碱和纤维素含量显著高于其他处理,表明复合接种处理有利于青山杨叶片对食叶害虫化学防御能力的提高。有研究发现,纤维素是植物细胞壁的主要成分,其含量越高,植物组织的细胞壁越厚,越不利于植食性昆虫的取食,可对昆虫起到一定的拒食效果,如棉花对绿盲蝽(Apolygus lucorum)的抗性与花铃期叶片纤维素含量呈显著正相关;而生物碱作为植物保护的次生代谢产物,具有较高的杀虫活性,目前的研究主要集中于抑制昆虫取食和毒杀昆虫的作用上,如雷公藤(Tripterygium wilfordii)总生物碱不仅对家蝇(Musca domestica)成虫有较好的毒杀作用,而且对棉铃虫(Helicoverpa armigera)幼虫和玉米象(Sitophilus zeamais)有较强的抑制作用。
在植物抵抗虫害过程中防御酶和蛋白酶抑制剂起重要作用,例如POD 和 CAT可以清除植物体内多余氧化自由基,使自身自由基保持在正常水平,以此提高自身抗虫性,并且POD也是木质素合成的还原酶。PPO可以催化酚类物质氧化为更有毒性的醌类物质,降低昆虫对植物的可食性。LOX可以通过脂氧合酶途径生成一系列绿叶挥发性化合物,受伤植物释放的绿叶挥发物可直接杀伤植食性昆虫。TI和CI可以抑制鳞翅目和鞘翅目幼虫的消化酶,还能减缓其虫体的生长发育。本研究发现M组的POD、CAT、LOX、PPO、TI和CI活性均显著高于单一接种处理组和对照组。这可能是由于RI与FM复合接种青山杨能够达到共生平衡,且协同促进。相似研究发现,兰科菌根真菌PF02(Kirschsteiniothelia tectonae)×PF06(Phialophora sp.)及PF06×PF07(Cyphellophora sp.)通过强-弱菌株组合出现了强协同互作效应,PF02×PF07的强-强菌株组合受接种势、生长空间及养分竞争等影响,共生效应弱化,缓慢促进植株生长,呈现弱协同互作效应。
幼虫体长、体质量是表征幼虫生长发育状况的重要形态学特征,昆虫能否正常生长发育与其食物利用状况密切相关。本研究发现,M组的4~5龄幼虫体长和3~5龄幼虫体质量均受到一定程度的抑制,并且M组3龄幼虫取食量和排粪量,4龄幼虫取食量和食物消耗率,5龄幼虫取食量、排粪量和食物利用率也显著降低。这可能是由于M组青山杨叶片的总生物碱和纤维素含量显著升高,降低了青山杨叶片的适口性,不利于美国白蛾幼虫取食、消化和营养吸收。
另外,RI和FM复合接种处理(M)对美国白蛾幼虫胰蛋白酶活性的提高具有诱导效应,本研究发现M组3~5龄幼虫胰蛋白酶活性显著高于CK、RI和FM组,TI和CI并没有抑制美国白蛾幼虫的胰蛋白酶活性。造成这种结果的原因,一是植物产生的次生代谢产物如黄酮、木质素,容易在植物受到组织损伤时被氧化成醌类化合物,有些醌类化合物可以同植物蛋白酶抑制剂结合,致使其失去功能;二是当昆虫识别到蛋白酶抑制剂存在时,可通过调控敏感蛋白酶的基因表达,分泌大量敏感蛋白酶,借此适应蛋白酶抑制剂。有研究发现,饲喂丝氨酸蛋白酶抑制剂开始时能显著降低大豆夜蛾(Anticarsia gemmatalis)胰蛋白酶和总蛋白酶活性,但连续饲喂14 d后,该虫体内总蛋白酶活性会有一定程度恢复甚至升高。
昆虫一般采取避毒、贮毒和解毒3种方式抵御植物中的有毒物质,其中解毒是主要方式。GST、MFO和CarE是昆虫的重要解毒酶,可激活解毒系统缓解症状。AChE在昆虫神经传导中起关键作用,该酶通过降解乙酰胆碱,终止递质对突触后膜的刺激,干扰神经信号的传导。M组3龄幼虫AchE和MFO活性显著低于RI、FM和CK组,且4~5龄幼虫的GSTs、MFO和CarE活性也显著低于其余3组,说明复合接种RI和FM对美国白蛾解毒酶活性具有显著抑制效应,这可能是由于RI和FM复合接种青山杨显著提高了类黄酮、单宁和生物碱含量。有相似研究发现,饲喂美国白蛾幼虫含有单宁、黄酮的饲料,饲喂中后期5~6龄美国白蛾幼虫的酸性磷酸酯酶(ACP)、细胞色素P450酶、AchE活性均出现抑制效应。此外,本研究发现M组3龄幼虫CarE活性显著高于RI、FM和CK组,这说明美国白蛾幼虫可以在取食不同的寄主植物时调节CarE活性,以适应寄主植物。
综上所述,将RI与FM复合接种能够诱导青山杨叶片在次生代谢物质、防御酶和蛋白酶抑制剂方面的化学防御性能,RI和FM复合接种对青山杨的抗虫性表现优于RI、FM单一接种和无AM真菌接种,并且对美国白蛾幼虫具有一定的抑制效果,在实际应用时可优先考虑RI和FM复合接种。
参考文献(reference):
[1]SCHOWALTER T D, RING D R.Biology and management of the fall webworm, Hyphantria cunea (Lepidoptera: Erebidae). J" Integ" Pest Manage, 2017, 8(1): 1-6. DOI: 10.1093/jipm/pmw019.
[2]ZOU H, ZHANG B, ZOU C, et al. Knockdown of GFAT disrupts chitin synthesis in Hyphantria cunea larvae. Pestic" Biochem" Physiol, 2022, 188(9): 1-9. DOI: 10.1016/j.pestbp.2022.105245.
[3]SUN L L, LIU P, SUN S H, et al. Transcriptomic analysis of interactions between Hyphantria cunea larvae and nucleopolyhedrovirus. Pest Manage" Sci, 2019, 75(4): 1024-1033." DOI: 10.1002/ps.5212.
[4]王幼珊, 刘润进. 球囊菌门丛枝菌根真菌最新分类系统菌种名录. 菌物学报, 2017, 36(7): 820-850. WANG Y S, LIU R J. A checklist of arbuscular mycorrhizal fungi in the recent taxonomic system of Glomeromycota. Mycosystema, 2017, 36(7):820-850. DOI: 10.13346/j.mycosystema.170078.
[5]GUTJAHR C, PARNISKE M. Cell and developmental biology of arbuscular mycorrhiza symbiosis. Annu" Rev of Cell" Dev" Biol, 2013, 29(1): 593-617. DOI: 10.1146/annurev-cellbio-101512-122413.
[6]张可可, 蒋德明, 余海滨, 等. 接种菌根菌剂对科尔沁沙地4种造林幼苗生长特性的影响. 生态学杂志, 2017, 36(7):1791-1800. ZHANG K K, JIANG D M, YU H B, et al. Impacts of mycorrhizal fungi inoculum on growth characteristics of four kinds of afforestation seedlings in Horqin sandy land, China. Chin J Ecol, 2017, 36(7): 1791-1800. DOI: 10. 13292/j. 1000-4890. 201707. 036.
[7]PARNISKE M. Arbuscular mycorrhiza: the mother of plant root endosymbiosis. Nat" Rev" Microbiol, 2008, 6(10): 763-775. DOI: 10.1038/nrmicro1987.
[8]黄小辉, 陈道静, 冯大兰. 不同基质条件下丛枝菌根真菌对桑树生长的影响. 南京林业大学学报(自然科学版), 2019, 43(3): 9-16. HUANG X H, CHEN D J, FENG D L. The effects of arbuscular mycorrhiza fungi on the growth of mulberry in different nursery substrates. J" Nanjing For" Univ(Nat" Sci" Ed), 2019, 43(3): 9-16. DOI: 10. 3969 /j. issn. 1000-2006. 201810005.
[9]张伟珍, 段廷玉. AM真菌对箭筈豌豆响应豌豆蚜取食的影响. 草地学报, 2019, 27(6): 1518-1525. ZHANG W Z, DUAN T Y. Effect of AM fungus on the responses of common vetch to Acyrthosiphon pisum infection. Acta Agrestia Sin, 2019, 27(6): 1518-1525. DOI: 10. 11733/j.issn.1007-0435. 2019. 06. 008.
POZO M J, AZCN-AGUILAR C. Unraveling mycorrhiza-induced resistance. Curr Opin"" Plant Biol, 2007, 10(4): 393-398. DOI: 10.1016/j.pbi. 2007.05.004.
王小菲, 高文强, 刘建锋, 等. 植物防御策略及其环境驱动机制. 生态学杂志, 2015, 34(12): 3542-3552. WANG X F, GAO W Q, LIU J F, et al. Plant defensive strategies and environment-driven mechanisms . Chin" J" Ecol, 2015, 34(12): 3542-3552. DOI:10.13292/j. 1000-4890. 2015. 0333.
禹海鑫, 叶文丰, 孙民琴, 等. 植物与植食性昆虫防御与反防御的三个层次. 生态学杂志, 2015, 34(1): 256-262. YU H X, YE W F, SUN M Q, et al. Three levels of defense and anti-defense responses between host plants and herbivorous insects. Chin J" Ecol, 2015, 34(1): 256-262. DOI: 10. 13292/j. 1000-4890.2015.0036.
FORMENTI L, RASMANN S. Mycorrhizal fungi enhance resistance to herbivores in tomato plants with reduced jasmonic acid production. Agronomy, 2019, 9(3): 131. DOI: 10.3390/agronomy9030131.
ROGER A, GETAZ M, RASMANN S, et al. Identity and combinations of arbuscular mycorrhizal fungal isolates influence plant resistance and insect preference. Ecol" Entomol, 2013, 38(4): 330-338. DOI: 10.1111/een.12022.
JIANG D, TAN M T, WU S, et al. Defense responses of arbuscular mycorrhizal fungus-colonized poplar seedlings against gypsy moth larvae: a multiomics study. Hortic" Res, 2021, 8(1): 245. DOI: 10. 1038/s41438-021-00671-3.
李虹谕, 卫星, 徐庆祥. 接种丛枝菌根真菌对水曲柳实生苗光合特性和叶片解剖结构的影响. 东北林业大学学报, 2019, 47(10): 49-54. LI H Y, WEI X, XU Q X. Photosynthetic functions and anatomical structure variations of Fraxinus mandshurica seedling leaf after AMF inoculation. J Northeast For" Univ, 2019, 47(10): 49-54. DOI: 10.13759/j.cnki.dlxb. 2019. 10. 011.
张勇, 张守攻, 齐力旺, 等. 杨树——林木基因组学研究的模式物种. 植物学通报, 2006, 22(3): 286-293. ZHANG Y, ZHANG S G, QI L W, et al. Poplar as a model for forest tree in genome research. Chin" Bull" Bot, 2006, 23(3): 286-293.
ROONEY D C, PROSSER J I, BENDING G D, et al. Effect of arbuscular mycorrhizal colonisation on the growth and phosphorus nutrition of" Populus euramericana cv. Ghoy. Biomass"" Bioe-nergy, 2011, 35(11): 4605-4612. DOI: 10.1016/j. biombioe. 2011. 08. 015.
刘润进, 陈应龙. 菌根学. 北京: 科学出版社, 2007: 1-447. LIU R J, CHEN Y L. Mycorrhizology. Beijing: Science Press, 2007: 1-447.
刘凯洋, 邱智军, 张巧明, 等. 丛枝菌根真菌对砷胁迫下棉花根系形态和生理特征的影响. 西北植物学报, 2021, 41(7): 1188-1198. LIU K Y, QIU Z J, ZHANG Q M, et al. Effect of arbuscular mycorrhizal fungi on root morphological and physiological characteristics of cotton under arsenic stress. Acta Bot" Boreali-Occidentalia Sin, 2021, 41(7): 1188-1198. DOI: 10.7606/j. issn. 1000-4025. 2021.07.1188.
孙兴华, 周晓榕, 庞保平, 等. 南美斑潜蝇为害对黄瓜叶片中蛋白酶抑制剂活性及葫芦素B含量的影响. 应用昆虫学报, 2014, 51(1): 169-177. SUN X H, ZHOU X R, PANG B P, et al. Effects of Liriomyza huidobrensis (Blanchard) larval infestation on trypsin and chymotrypsin activity and cucurbitacin B content in cucumber leaves. Chin J" Appl Entomol, 2014, 51(1): 169-177. DOI: 10.7679/j.issn. 2095-1353. 2014. 019.
JIANG D, WU S, TAN M T, et al. The high adaptability of Hyphantria cunea larvae to cinnamic acid involves in detoxification, antioxidation and gut microbiota response. Pestic" Biochem Physiol, 2021, 174(2): 1-9. DOI: 10.1016/j. pestbp. 2021. 104805.
YAZDANFAR H, GHODSKHAHDARIAII M, JALALISENDI J. The effects of host plants on the feeding indices and chemical activities of elm leaf beetle,Xanthogaleruca luteola (Muller) (Coleoptera: Chrysomelidae). Iran Agric" Res, 2016, 35(1): 81-87. DOI: 10.22099/IAR.2016.3697.
徐正浩, 崔绍荣, 何勇, 等. 植物次生代谢物质和害虫防治. 植物保护, 2004, 30(4): 8-11. XU Z H, CUI S R, HE Y, et al. Plant secondary metabolites and their effects on insect management. Plant Prot, 2004, 30(4): 8-11.
雒珺瑜, 崔金杰, 辛惠江. 棉花叶片纤维素和木质素含量与绿盲蝽抗性的关系. 西北农林科技大学学报(自然科学版), 2012, 40(4): 81-85. LUO J Y, CUI J J, XIN H J. Relationship between the contents of cellulose and lignin in cotton leaf and their resistance to Apolygus lucorum. J" Northwest A"" F Univ" (Nat" Sci" Ed), 2012, 40(4): 81-85. DOI: 10.13207/j.cnki. jnwafu. 2012.04.026.
CHEN X D, KAUR N, HORTON D R, et al. Crude extracts and alkaloids derived from Ipomoea-Periglandula symbiotic association cause mortality of asian citrus psyllid Diaphorina citri Kuwayama (Hemiptera: Psyllidae). Insects, 2021, 12(10): 1-12. DOI: 10.3390/insects12100929.
周琳, 冯俊涛, 张锦恬, 等. 雷公藤总生物碱对几种昆虫的生物活性. 植物保护,2007, 33(6): 60-64. ZHOU L, FENG J T, ZHANG J T, et al. Bioactivity of the total alkaloid from Tripterygium wilfordii Hook against several important pests. Plant Prot, 2007, 33(6): 60-64. DOI:10.16409/j.cnki. 2095-039x. 2010. 01. 016.
周北雅, 郭艳东, 薛雅鞠, 等. 功能蛋白酶催化及应用进展.生物加工过程,2023,21(4):419-438. ZHOU B Y, GUO Y D, XUE Y J, et al. Advances in the catalysis and application of functional proteases. Chi J Bio Eng, 2023,21(4):419-438.DOI:10.3969/j.issn.1672-3678.2023.04.007.
何应, 马向丽, 任健, 等. 蝗虫取食对毛花雀稗防御酶活性的影响. 草业科学, 2021, 38(11): 2294-2300. HE Y, MA X L, REN J, et al. Defense enzyme activity of dallisgrass in response to grasshopper feedting. Pratacultural Sci, 2021, 38(11): 2294-2300. DOI: 10.11829/j. issn. 1001-0629. 2021-0394.
杨乃博, 伍苏然, 沈林波, 等. 植物抗虫性研究概况. 热带农业科学, 2014, 34(9): 61-68,89. YANG N B, WU S R, SHEN L B, et al. A review on plant resistance to insect pests. Chin" J" Trop" Agric, 2014, 34(9): 61-68,89.
HU Y X, WANG Y, DENG J, et al. The structure of a prophenoloxidase (PPO) from Anopheles gambiae provides new insights into the mechanism of PPO activation. BMC Biol, 2016, 14(1): 1-13. DOI: 10.1186/s12915-015-0225-2.
宋福强, 杨国亭, 孟繁荣, 等. 丛枝菌根(AM)真菌对大青杨苗木根系的影响. 南京林业大学学报(自然科学版), 2005, 29(6): 35-39. SONG F Q, YANG G T, MENG F R, et al. The effects of arbuscular mycorrhizal fungi on the radicular system of Populus ussuriensis seedlings. J" Nanjing For" Univ(Nat" Sci Ed), 2005, 29(6): 35-39.
吕敏, 卫甜, 刘怀阿, 等. 昆虫取食和机械损伤对棉花和玉米脂氧合酶活性的诱导作用. 江苏农业科学, 2021, 49(10): 86-90. LYU M, WEI T, LIU H A, et al. Induction of lipoxygenase activity in cotton and maize by insect feeding and mechanical damage. Jiangsu Agric" Sci, 2021, 49(10): 86-90. DOI:10.15889/j.issn.1002-1302.2021.10.016.
陈宝玲, 杨开太, 黄森, 等. 有益菌根真菌及其互作对带叶兜兰试管苗生理生长的影响. 西南林业大学学报(自然科学), 2022, 42(2): 19-25. CHEN B L, YANG K T, HUANG S, et al. Effects of mycorrhizal fungi interaction on the growth and physiology of Paphiopedilum hirsutissimum seedlings in vitro. J" Southwest For" Univ" (Nat" Sc), 2022, 42(2): 19-25. DOI: 10.11929/j.swfu.202105008.
JIANG D, ZHOU Y, TAN M, et al. Cd exposure-induced growth retardation involves in energy metabolism disorder of midgut tissues in the gypsy moth larvae. Environ" Pollut, 2020, 266(7): 1-11. DOI: 10.1016/j.envpol.2020.115173.
赵海龙. 苜蓿斑蚜胰蛋白酶抑制剂筛选及效果评价. 沈阳: 沈阳农业大学, 2018. ZHAO H L. Screening of alfafa trypsin inhibitor and the inhibiting effect on Therioaphis trifolii Monel (Homptera: aphididae). Shenyang: Shenyang Agricultural University, 2018.
ZHU-SALZMAN K, KOIWA H, SALZMAN R A, et al. Cowpea bruchid" Callosobruchus maculatus uses a three-component strategy to overcome a plant defensive cysteine protease inhibitor. Insect Mol" Biol, 2003, 12(2): 135-145. DOI: 10.1046/j. 1365-2583. 2003. 00395. x.
LOSVIK A, BESTE L, MEHRABI S, et al. The protease inhibitor" CI2c Gene induced by bird cherry-oat aphid in barley inhibits green peach aphid fecundity in transgenic Arabidopsis. Int" J" Mol" Sci, 2017, 18(6): 1-16. DOI: 10.3390/ijms18061317.
任茂琼, 李家慧, 褚旭东, 等. 不同抗性玉米自交系对朱砂叶螨体内解毒酶活性的影响差异. 中国植保导刊, 2017, 37(11): 15-18. REN M Q, LI J H, CHU X D, et al. Effects on activities of detoxification enzymes in Tetranychus cinnabarinus feeding on maize inbred lines with different resistance. China Plant Prot, 2017, 37(11): 15-18.
FENG X, LIU N. Functional analyses of house fly carboxyleste-rases involved in insecticide resistance. Front Physiol, 2020, 11(10): 1-11. DOI: 10.3389/fphys.2020.595009.
ABDELAAL K, ESSAWY M, QURAYTAM A, et al. Toxicity of essential oils nanoemulsion against" Aphis craccivora and their inhibitory activity on insect enzymes. Processes, 2021, 9(4): 1-14. DOI: 10.3390/pr9040624.
李定银, 郅军锐, 张涛, 等. 乙基多杀菌素和乙虫腈对西花蓟马解毒酶和乙酰胆碱酯酶活性的影响. 应用昆虫学报, 2020, 57(6): 1385-1393. LI D Y, ZHI J R, ZHANG T, et al. Effects of spinetoram and ethiprole on detoxification enzyme andacetylcholin esterase activity in Frankliniella occidentalis (Pergande). Chin J" Applied Entomol, 2020, 57(6): 1385-1393. DOI: 10.7679/j. issn. 2095-1353. 2020. 143.
王沫. 美国白蛾对植物次生代谢物质的适应性. 哈尔滨: 东北林业大学, 2020. WANG M. Adaptability of" Hyphantria cunea to plant secondary metabolites. Harbin: Northeast Forestry University, 2020.
MA J, SUN L, ZHAO H, et al. Functional identification and characterization of GST genes in the Asian gypsy moth in response to poplar secondary metabolites. Pestic" Biochem" and Physiol, 2021, 176(5): 1-9. DOI: 10. 1016/j. pestbp. 2021. 104860.
(责任编辑" 王国栋)

