丛枝菌根真菌对丹参内源激素的影响
周修腾+王雪+杨光+陈敏+李鹏英+华国栋+陈美兰+郭姣
[摘要]该文旨在初步探索接种地表球囊霉(Glomus versiforme,GV)真菌不同时期丹参内源激素含量的动态变化,实验设定对照组和菌根组,测定接种GV菌剂30,60,75,90,105,130 d丹参根系侵染率,同时采用ELISA方法测定内源激素ABA,ZR,GA,IAA,MeJA含量的动态变化。结果表明,接种菌根90 d丹参根部侵染率为90%,基本达到平衡;地上部分鲜重和叶片数显著高于对照组,约为对照组的2.7,1.96倍;除ABA外,丹参接种菌剂75 d地上部分其他内源激素含量均显著低于对照组(P<0.05),分别约为对照组含量的63%~75%;接种菌剂90 d后地下部分内源激素含量均显著低于对照组(P<0.05),分别约为对照组含量的45%~81%;接种GV菌剂105 d后地下部分内源激素含量均显著高于对照组(P<0.05),分别高1.4~1.7倍;接种菌剂60,75,105 d地下部分ABA含量显著增加。因此,推论丛枝菌根真菌能促进丹参生长,且不同侵染时期影响丹参内源激素含量。
[关键词]丛枝菌根真菌; 丹参; 内源激素
[Abstract]To investigate the dynamic changes of endogenous hormones contents in Salvia miltiorrhiza after the inoculation of Glomus versiforme(GV).The contents of endogenous hormones of ABA, ZR, GA, IAA and MeJA by ELISA were measured. Infection rata of GV reached plateau of 90% at the 90th d of inoculation; fresh weight of overground part and leaf number were significantly higher in GV group, with 2.7 and 1.96 fold than that of control; contents of all endogenous hormones apart from ABA in over- and under-ground part were markedly lower (P<0.05) in GV group at the 75th and 90th d, respectively, with 63% to 75% and 45% to 81% of that in control, and were significantly higher (P<0.05) in both over- and under-ground part in GV group at the 105th d, with 1.4 to 1.7 fold higher than that of control; content of ABA in underground part increased significantly at 60th, 75th and 105th d. Arbuscular mycorrhizal fungi could promote the growth of S. miltiorrhiza, and affect the dynamic changes of endogenous hormones contents in different infection periods.
[Key words]arbuscular mycorrhizal fungi; Salvia miltiorrhiza; endogenous hormones;
doi:10.4268/cjcmm20162010
丛枝菌根(arbuscular mycorrhiza,AM)是自然界分布最广泛、最普遍的一类菌根。有相关文献报道地球上80%以上的陆地植物具有菌根,只有少数的植物如杜鹃、兰科、松科、桦科、十字花科、藜科、石竹科、莎草科、灯心草科、荨麻科、蓼科中的种很少或完全没有发现丛枝菌根[1]。丛枝菌根是由球囊菌门Glomeromycota真菌侵染植物根系所形成的一大类菌根,现代的研究表明,AM真菌能促进植物生长发育[2-3],增强其对养分和水分的吸收与利用[4-6],同时能加强植物根系吸收面积和吸收能力,改变植物内源激素平衡状况[7]。
植物激素作为植株内重要信号分子,在调节植物的生长发育和对外界环境的响应的过程起十分重要的作用。在AM真菌侵染宿主植物,建立共生关系的过程中可直接合成或诱导植物产生多种激素类物质,如细胞分裂素(cytokinin,CK)、生长素(auxin,IAA)、脱落酸(abscisic acid,ABA)、油菜素内酯(brassinosteroids,BR)、赤霉素(giberellin acid,GA)、乙烯(ethylene,ET)、茉莉酸(jasmonic acid,JA)、水杨酸(salicylic acid,SA)等[8-10],这些激素形成一个复杂的网络,除调节植物自身生长发育、控制植物形态建成和生理代谢外,还能在菌根真菌与植物相互识别、菌根形成、诱导植物抗逆性等方面发挥作用[11-12]。此外,AM真菌可以通过影响植物内源激素的含量以及它们之间的平衡,促进植物生长,进而间接提高植物抗病性。
丹参Salvia miltiorrhiza Bunge为唇形科多年生草本植物,是一类菌根营养型植物,能被丛枝菌根真菌侵染,形成典型的菌根结构。前期课题组研究结果表明,AM真菌能促进丹参的生长,提高丹参的抗病性,但其作用机制不清楚,本研究通过盆栽实验,接种AM真菌不同时期丹参体内内源激素脱落酸(ABA)、生长素(IAA)、赤霉素(GA)、玉米素核苷(ZR,属于游离态细胞分裂素)、茉莉酸甲酯(MeJA,茉莉酸衍生物)含量的动态变化,初步探索AM真菌影响药用植物丹参内源激素的作用机制,为后期深入研究内源激素在AM真菌提高丹参次生代谢产物及抗性中的作用奠定基础。
1 材料与方法
1.1 仪器
显微镜(Nikon E200型)、高速冷冻离心机HC-3018R;台式快速离心浓缩干燥器或氮气吹干装置,酶联免疫分光光度计,恒温箱,酶标板(40孔或96孔),其他常规器材。
1.2 供试种子
供试丹参种子,由山东莱芜丹参种植基地提供,由中国中医科学院中药资源中心黄璐琦研究员鉴定为白花丹参S. miltiorrhiza的种子。供试AM菌Glomus versiforme由三叶草Trifolium repens L.扩繁,用其根段、菌丝体、孢子及其混合物作为菌剂。
1.3 实验设计
将丹参种子先在室温下浸泡10 h后,用75%乙醇浸洗30 s,蒸馏水漂洗3次,用10%过氧化氢浸泡消毒5 min,蒸馏水漂洗至无过氧化氢为止,播种至蛭石中,待种子萌发。移栽前进行接种AM菌处理,即接种G. versiforme,每盆接种10 g菌剂,同时以不接种菌剂作为对照CK。采用高10 cm,盆口直径为12.5 cm,盆底直径为8.5 cm的小盆,每盆装入121 ℃高压蒸汽灭菌土-河沙-蛭石 1∶1∶1混合基质,将萌发的丹参转入到小盆中生长,每周浇2次50%的hoagland营养液。温室白天气温20~25 ℃,夜间15~19 ℃,光照12 h,夜间12 h。植物分别于接种30,60,75,90,105,130 d后取样,将地上部分和地下部分剪断,称重后迅速放入液氮中冷冻,-80 ℃保存备用,每个处理重复10次。
1.4 菌根侵染率测定
随机选取不同时期CK组和GV组30条根段,根据Trouvelot等[13]的方法测定,并按照菌根侵染和丛枝丰度分级的标准,输入等级参数,用mycocalc软件计算菌根侵染频率(frequency of mycorrhiza in the root system,用F表示),整个根系的菌根侵染强度(intensity of the mycorrhizal colonisation in the root system,用M表示),侵染根段的菌根侵染强度(intensity of the mycorrhizal colonization in the root fragments,用m表示)。
1.5 植物激素测定
取上述丹参植物材料1 g,加入 2 mL 样品提取液(含1 mmol·L-1二叔丁基对甲苯酚的80%甲醇溶液),液氮中研磨成匀浆,转入10 mL离心管中,4 ℃下提取4 h,1万r·min-1离心15 min,取上清液。沉淀物再加入1 mL上述提取液,涡旋混匀,4 ℃下再次提取1 h,1万r·min-1离心15 min,合并上清液,通过C18固相萃取小柱(预先用甲醇3 mL活化,纯水3 mL平衡),用80%甲醇5 mL洗脱。收集洗脱液,氮气吹干,用样品稀释液[500 mL磷酸盐缓冲液中加0.5 mL聚氧乙烯失水山梨醇单月桂酸酯(Tween-20),0.5 g明胶]复溶,用于植物激素酶联免疫测定[14]。
1.6 数据分析
实验所得数据采用Excel 2010和SPSS 18.0软件进行统计分析。
2 结果
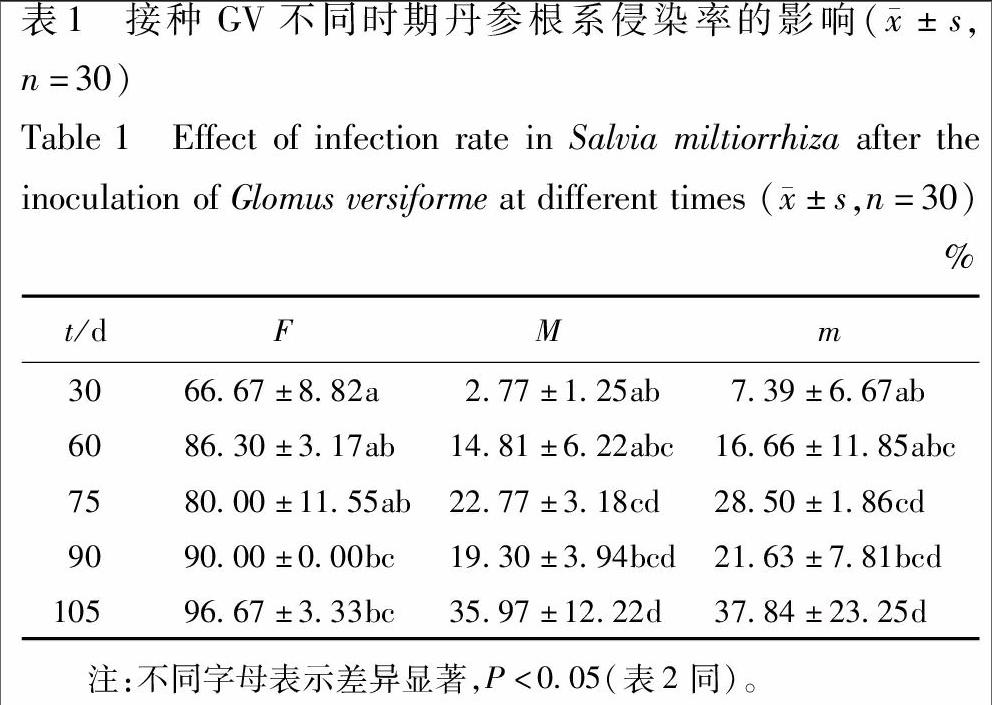
2.1 接种GV不同时期丹参根系侵染强度的变化
接种GV 60 d内,丹参根系侵染频率呈快速上升的趋势,60 d丹参根系侵染频率(F)达到86.30%;接种GV丹参整个根系侵染强度(m)在75 d显著增加为(22.77±3.18)%(P<0.5,n=30),75 d后根系侵染强度变化不显著;丹参根段侵染强度(m)75 d也显著增加为(28.50±1.86)%(P<0.5,n=30),75 d后根段侵染率强度变化不显著,见表1。
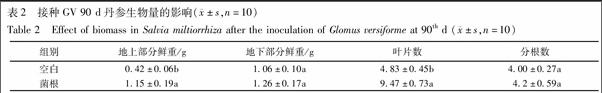
2.2 接种GV对丹参生长情况的影响
从实验结果可以看出,接种GV真菌90 d后丹参地上部分鲜重显著高于对照组,约为对照组的2.7倍,叶片数显著高于对照组,约为对照组的1.96倍(P<0.05);地下部分鲜重和分根数有高于对照组的趋势,但是差异不显著,见表2。
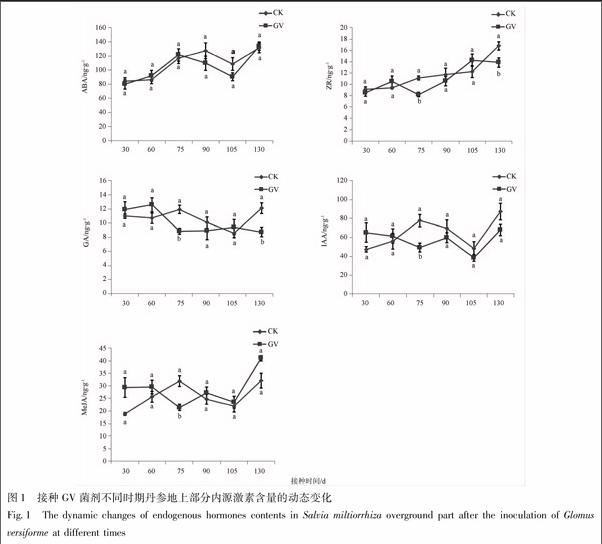
2.3 接种GV不同时期丹参内源激素含量的变化
2.3.1 接种GV不同时期丹参地上部分内源激素含量的变化 接种GV菌剂75 d时,丹参地上部分内源激素ZR,GA,IAA,MeJA均显著低于对照组(P<0.05),分别约为对照组含量的73.81%,74.09%,63.14%,66.97%;接种GV菌剂130 d时,内源激素ZR,GA均显著低于对照组(P<0.05),约低于对照组1.2,1.4倍。其余时间各个内源激素变化不显著,见图1。
2.3.2 接种GV不同时期丹参地下部分内源激素含量的变化 接种GV菌剂60 d时,丹参地下部分内源激素ABA显著高于对照组(P<0.05),约高于对照组的1.3倍,MeJA显著低于对照组,约低于对照组的1.6倍,其他激素含量无显著性差异;接种GV菌剂75 d时,ABA显著高于对照组(P<0.05),约高于对照组的1.1倍,其他激素含量无显著性差异;接种GV菌剂90 d时,ZR,GA,IAA,MeJA均显著低于对照组(P<0.05),分别约为对照组含量的80.01%,45.63%,78.21%,60.15%;接种GV菌剂105 d时,ABA,ZR,GA,IAA,MeJA均显著高于对照组(P<0.05),分别高于对照组的1.6,1.6,1.4,2.1,1.7倍;接种GV菌剂130 d时,ZR,MeJA均显著低于对照组(P<0.05),分别约为对照组含量的65.16%,71.09%,其他时间段内各个激素含量无显著性差异,见图2。
3 结论与讨论
研究结果表明,接种GV菌剂75 d内,丹参根系侵染强度和根段侵染强度显著增加,90 d侵染率达到了90%,故本研究选择90 d作为丹参生物量测定。由生物量结果可以看出,接种AMF 90 d能显著提高丹参地上部分鲜重和叶片数,而对于地下部分鲜重和分根数有提高的趋势,但是差异不明显,究其原因可能是地下部分植株生物量积累速度滞后于地上部分植株[15]。
植物内源激素能够调节植物生长发育,对植物的产量等有重要影响,而AM真菌在大多数条件下能提高植物激素类物质的含量[16]。研究结果表明,接种GV菌剂105 d时ZR,GA,IAA,MeJA均显著增加,这与前期的研究结果一致。如丁建新等[17]研究表明5种AM真菌均能提高番茄体内IAA,GA,ZR含量,显著地促进番茄植株的鲜重,植株高度以及地上和地下部干重;刘润进等[18]利用室内盆栽研究表明AM真菌在正常水分与干旱条件下均能显著提高玉米以及棉花植株叶片和根中生长素(IAA)、玉米素和赤霉素(GA)含量。
目前,AM真菌对ABA含量的影响尚存在争论,丁建新等[17]和Meixner等[19]研究接种AM真菌能提高ABA含量;而刘润进等[18]研究发现,接种AM真菌6周后能显著降低ABA含量。本研究结果表明,接种AM真菌60,75,105 d能显著增加丹参地下部分ABA含量,课题组前期还研究接种AM真菌45 d能显著降低地上部分和地下部分ABA含量[20],分析原因可能ABA在植物体内的含量与AM真菌接种时间的长短有关。
研究结果也表明,接种GV菌剂不同时期植物丹参内源激素含量的变化有所不同,但均处于动态变化的过程,地下部分在接种GV菌剂90 d时显著降低,105 d时显著增加,之后恢复平衡状态。究其原因是AM真菌能够通过影响丹参内源激素水平以及不相激素间的配比来影响宿主植物丹参的生理状况[21],GV菌剂不同时期的侵染强度存在差异,促使丹参内源激素含量出现不同的状态,接种GV菌剂75 d时,丹参根系侵染率显著增加,90 d时趋于平衡。植物激素在植物的生长发育及抗性反应中发挥着重要的作用,多种激素之间的作用不是独立的,而是相互作用,在植物体内处于动态平衡的状态,不同的植物激素通过不同途径相互之间的协调来调控植物生长抗病信号的网络,从而刺激了宿主植物的生长及对各种生物胁迫的防御反应[22]。
[参考文献]
[1]Miransari M, Abrishamchi A, Khoshbakht K, et al. Plant hormones as signals in arbuscular mycorrhizal symbiosis[J]. Crit Rev Biotechnol, 2014, 34(2):123.
[2]吴志刚, 郭兰萍, 黄璐琦. 接种VA菌根对苍术生长发育影响的初步观察[J]. 中药研究与信息, 2005, 7(11):27.
[3]Jonse M D, Durall D M, Ttinker P B. A comparison of arbuscular and ectomycorrhizal Eucalyptus coccifera:growth response, phosphorus uptake efficiency and external hyphal production[J]. New Phytol, 1998, 140(1):125.
[4]Attia M, Awad N M. Assessment the impact of certain growth promoting rhizobacteria strains on symbiotic effectiveness of arbuscular mycorrhizal fungi[J]. New Egypt J Microbiol, 2003, 38(1):75.
[5]Augé R M. Water relations, drought and vesicular arbuscular mycorrhizal symbiosis[J]. Mycorrhiza, 2001, 11(1):3.
[6]Biró B, Kves-Péchy K, Vrs I, et al. Interrelations between Azospirillum and Rhizobium nitrogen fixers and arbuscular mycorrhizal fungi in the rhizosphere of alfalfa in sterile, AMF free or normal soil conditions[J]. Appl Soil Ecol, 2000, 15(2):159.
[7]Liu R J, Li M, Meng X X, et al. Effects of AM fungi on endogenous hormones in corn and cotton plants[J]. Mycosystema, 2000, 19(1):91.
[8]段娜, 贾玉奎, 徐军, 等. 植物内源激素研究进展[J]. 中国农学通报, 2015, 31(2):159.
[9]Pieterse C M J, Leon-Reyes A, Van der Ent S, et al. Networking by small-molecule hormones in plant immunity[J]. Nat Chem Biol, 2009, 5(5):308.
[10]路文静. 植物生理学 [M]. 北京:中国林业出版社, 2011:190.
[11]于建新, 李敏, 刘润进. 菌根真菌与植物激素相互作用研究进展[J]. 青岛农业大学学报:自然科学版, 2009, 26(1):4.
[12]Ritsema A V, Joosten R, De Vos M, et al. Cross-talk between signaling pathways leading to defense against pathogens and insects[J]. Bio Plant-Microbe Interac, 2008, 6(1):1.
[13]Trouvelot A. Mesure du taux de mycorhization VA dun systeme radiculaire. Recherche de methodes destimation ayant une significantion fonctionnelle[C]. Dijon:Physiological and Genetical Aspects of Mycorrhizae=Aspects Physiologiques Et Genetiques Des Mycorhizes:Proceedings of the European Symposium on Mycorrhizae, 1986.
[14]何钟佩. 农作物化学控制实验指导[M]. 北京:北京农业大学出版社,1993:60.
[15]王丽, 胡金, 宋长春, 等. 水分梯度对三江平原典型湿地植物小叶章地上生物量的影响[J]. 草业学报, 2008, 17(4):19.
[16]Dugassa G D, Vonalten H, Schonbeck F. Effect of arbuscular mycorrhiza on health of linumusita tissimuml infected by fungal pathogens[J]. Plant Soil, 1996, 185(2):173.
[17]于建新, 李辉, 郭绍霞, 等. 丛枝菌根真菌对番茄植株内源激素含量的影响[J]. 青岛农业大学学报:自然科学版, 2010, 27(2):100.
[18]刘润进, 李敏, 孟祥霞, 等. 丛枝菌根真菌对玉米和棉花内源激素的影响(英文)[J]. 菌物系统, 2000, 19(1):91.
[19]Meixner C, Ludwig-Muller J, Miersch O, et al. Lack of mycorrhizal autoregulation and phytohormonal changes in the supernodulating soybean mutant nts1007[J]. Planta, 2005, 222:709.
[20]周修腾, 康利平, 李鹏英, 等. UPLC-MS/MS测定AM真菌侵染丹参植物脱落酸含量[J]. 中国农学通报, 2016, 32(12):92.
[21]Aroca R, Ruiz-Lozano, J M, et al. Arbuscular mycorrhizal symbiosis influences strigolactone production under salinity and alleviates salt stress in lettuce plants[J]. J Plant Physiol,2013, (170):47.
[22]Ludwig-Müller J. Hormonal responses in host plants triggered by arbuscular mycorrhizal fungi[M]//Hinanit Koltai,Yoram Kapulnik. Arbuscular mycorrhizas:physiology and function. Berlin:Springer,2009:169.
[责任编辑 吕冬梅]

