对几个初中化学实验的新设计
刘信友
摘要: 借用T型管、单向阀、注射器和干燥管等常用仪器设计木炭吸附二氧化氮气体及其解吸的实验以及稀盐酸和氢氧化钠溶液反应的拓展实验,改善了原实验现象不够明显的缺陷,让实验更好地服务于教学。新设计的实验取材方便、操作简单、安全快速、现象明显,适合教师课堂演示和学生课外探究实验。
关键词: T型管; 单向阀; 注射器; 实验改进
文章编号: 1005-6629(2024)05-0079-03
中图分类号: G633.8
文献标识码: B
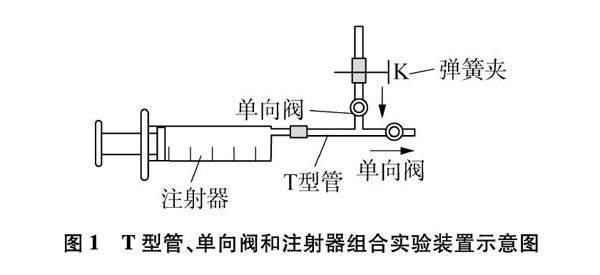
将T型管、单向阀和注射器组合成如图1所示的装置,这个特殊的结构在注射器拉、推的作用下能使液体或气体单向流动;可将固体与液体、液体与液体、气体与液体、气体与气体之间的反应设计在密闭的容器中进行,且能控制反应物的量,可完成多种化学实验。
查阅知网文献[1,2],发现教师多处提到单向阀的运用,李德前等设计“氢气爆炸实验的一体化设计”,曹桂祯等设计“单向阀和自制气筒在化学实验中的应用”,上述实验改进(防止回火,气体、液体的单向流动)的案例,对我们的研究有很大的启发。为了进一步凸显单向阀在实验教学中的作用,彰显化学学科的育人价值,下面结合几个改进案例,介绍T型管、单向阀、注射器等在初中化学实验中的应用,供同行们参考。
1 木炭吸附二氧化氮气体及其解吸实验
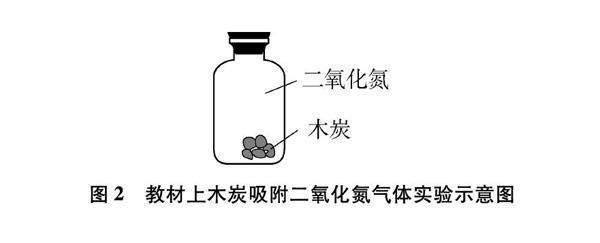
现行人教版九年义务教育教科书《化学》上册第六章第一节实验6-1,在盛有半瓶水的锥形瓶里,加入一滴红墨水,使水略显红色。投入几块烘烤过的木炭(或活性炭),轻轻振荡锥形瓶观察现象。该实验中木炭能吸附水中的色素,现象明显。在教材P112[练习与应用]第6题:如图2所示,向盛有红棕色NO2气体的集气瓶里投入几小块烘烤过的木炭,为什么红棕色会消失[3]?为了能让学生清晰观察到木炭能吸附红棕色的二氧化氮气体,我们在开展社团活动时增加了这个实验活动,取得了较好的效果。
该实验演示时一般能达到预期效果,但也存在如下不足:
(1) 向装有二氧化氮气体的集气瓶中加木炭颗粒时,集气瓶中的二氧化氮气体会从瓶口逸出,造成对室内空气的污染;
(2) 在摇动集气瓶时木炭与集气瓶内壁碰撞会沾上黑色碳粒,从而影响实验现象的观察;
(3) 不能观察到红棕色二氧化氮气体被木炭吸附后瓶内压强的减小。
我们用T型管、注射器和单向阀改进上述实验,能清晰地观察到红棕色的二氧化氮气体被木炭吸附及其解吸的现象,效果很好。
1.1 实验用品
二氧化氮气体(150mL)1瓶、活性炭小颗粒、广口瓶(150mL)1个、T型管1个、单向阀(3mm)3个、球形干燥管(20×150mm)1个、乳胶管(20mm)3根、注射器(50mL)2支、酒精灯1盏、单孔硅胶塞(30mm)1个、单孔橡皮塞(0号)1个、20%氢氧化钠溶液、玻璃棉、导管1根(5cm)
1.2 实验装置
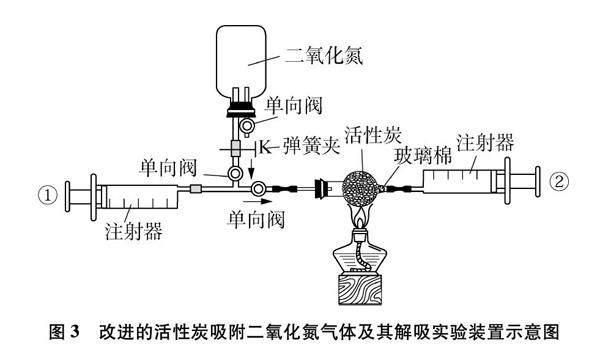
如图3所示,夹持装置略。
1.3 实验步骤及现象
1.3.1 实验步骤
首先取1个球形干燥管(20×15mm),装入烘干的活性炭小颗粒填实(为防小颗粒炭被吹出,在球形干燥管出口处填少量玻璃棉),干燥管大口端用带导管的单孔橡皮塞塞紧,再与带有单向阀的T型管连接,T型管上端连接一根乳胶管(20mm);其次,将注射器①和注射器②的活塞推到底部,排尽注射器内的空气,分别与T型管左端和球形干燥管右端乳胶管连接,用150mL的集气瓶收集一瓶红棕色的二氧化氮气体,用带有单向阀的双孔硅胶塞塞紧(二氧化氮气体被抽出后,瓶内压强减小,外界的空气沿硅胶塞上的单向阀进入集气瓶中,有利于二氧化氮气体持续抽出),双孔硅胶塞上的导管一端乳胶管(带弹簧夹K)与T型管的上口连接(弹簧夹的作用:防止连接T型管时集气瓶中的二氧化氮逸出,造成污染);最后,打开弹簧夹K,拉①号注射器活塞,从集气瓶中抽取30mL红棕色二氧化氮气体进入①号注射器中,关闭弹簧夹K。再缓慢推动①号注射器活塞,将10mL二氧化氮气体缓慢推入球形干燥管中的活性炭粒中。
1.3.2 实验现象
观察到②号注射器的活塞向右慢慢地移动,注射器中收集到的气体比①号注射器中的气体颜色明显变淡且气体体积变小;然后推动②号注射器的活塞,使变淡的气体再次进入球形干燥管中的活性炭粒中,停留1分钟后,再缓慢推动①号注射器活塞,将注射器①的二氧化氮气体(10mL)推入球形干燥管中的活性炭粒中,此时进入②号注射器中的气体已变为无色;用酒精灯微微烘烤球形干燥管中的活性炭小颗粒,又看到红棕色的二氧化氮气体进入②号注射器中,此即为被吸附的红棕色的二氧化氮气体被解吸了出来。
1.4 几点说明
(1) 装入球形干燥管中的活性炭小颗粒需现制且要烘干;
(2) 推动注射器活塞的速度不能过快,以免二氧化氮气体与球形干燥管中的活性炭小颗粒没有充分接触,影响吸附效果;
(3) 酒精灯要求微微加热球形干燥管(以免二氧化氮在150~160℃分解成2NO+O2,O2和灼热的C会反应生成CO或CO2),且加热时间不宜过长,以免球形干燥管破裂,使二氧化氮氣体逸出,造成室内空气污染;
(4) 实验结束后,用弹簧夹K夹紧硅胶塞上导管一端的乳胶管,用50mL的注射器吸取过量的20%氢氧化钠溶液,打开弹簧夹K,从导管口向集气瓶中压入。氢氧化钠溶液能有效除去集气瓶中剩余的二氧化氮气体,有效处理尾气和废液,防止有毒气体逸出造成环境污染(反应的化学方程式:2NO2+2NaOHNaNO3+NaNO2+H2O)。
2 稀盐酸和氢氧化钠溶液反应实验的拓展
现行人教版九年义务教育教科书[4]《化学》下册第十章第二节P60,安排有在氢氧化钠溶液中滴加稀盐酸的实验(见图4)。
教材实验设计的理念是借助无色酚酞溶液的变色来判断稀盐酸和氢氧化钠发生了化学反应。为了能让学生清晰地观察到稀盐酸和氢氧化钠溶液发生反应后有氯化钠生成,我们将氢氧化钠水溶液改为氢氧化钠乙醇溶液,将盐酸改为氯化氢气体通入氢氧化钠乙醇溶液中,可清晰地观察到有白色固体(NaCl)生成,实验的可视化效果良好。
2.1 实验用品
38%浓盐酸(100mL)、无水氯化钙、饱和氢氧化钠乙醇溶液(5mL)、广口瓶(150mL)1个、T型管1个、单向阀(3mm)3个、球形干燥管(20×15mm)1个、乳胶管(20mm)3根、注射器(50mL)1支、直角导管1个、试管(20×200mm)1支、硅胶翻口塞(30mm)1个、单孔橡皮塞(0号)1个、导管1根(5cm)
2.2 實验装置
如图5所示,夹持装置略。
2.3 实验操作步骤及现象
2.3.1 实验操作
先将无水氯化钙装入球形干燥管(20×15mm)中,塞上带有导管的单孔橡皮塞,用带单向阀的T型管与球形干燥管连接;再将T型管的左侧连接注射器(活塞推到底部),T型管上端通过单向阀连接装有50mL38%浓盐酸的广口瓶(广口瓶上瓶塞导管一端的乳胶管用弹簧夹K夹紧,防止氯化氢气体逸出),实验装置组装完成。
2.3.2 实验步骤及现象
打开弹簧夹K,缓慢拉动注射器的活塞,广口瓶中浓盐酸挥发出的氯化氢气体通过单向阀被吸入注射器中(约30mL)。关闭弹簧夹K,打开另一个单向阀,推动注射器的活塞,氯化氢气体经过单向阀进入装有无水氯化钙的球形干燥管中(干燥氯化氢气体),再经过导管进入盛有5mL饱和氢氧化钠乙醇溶液的试管中,片刻后即可观察到饱和无色氢氧化钠乙醇溶液中出现白色浑浊现象,静置1分钟,试管底部出现白色固体物质(氯化钠)。查资料[5]得:常温下的乙醇中NaOH(S=17.3g)与HCl(S=41.6g)均是易溶物,而NaCl(S=0.065g)是微溶物,即使在89.6%的乙醇溶液中,NaCl的溶解度也仅是0.43g。可推得实验原理[6]为:NaOH+HCl乙醇NaCl↓+H2O。
2.4 几点说明
(1) 用干燥氯化氢气体可减少生成物中水的含量,让更多的氯化钠以固体呈现出来;
(2) 用注射器抽取广口瓶中浓盐酸挥发出的氯化氢气体时,浓盐酸底部会有气泡产生(原因:一定温度下,压强减小,氯化氢气体的溶解度也减小);
(3) 为了防止装浓盐酸广口瓶瓶塞脱落造成浓盐酸流出,应采用医用硅胶翻口塞(网购)代替普通橡皮塞;
(4) 在医用硅胶翻口塞上接一个单向阀,是为了平衡大气压强,能用注射器持续抽取氯化氢气体。
参考文献:
[1]李德前, 龚皓, 魏海.氢气爆炸实验的一体化设计[J].化学教学, 2022, (6): 72~75.
[2]曹桂祯, 郑顺来.单向阀和自制气筒在化学实验中的应用[J].化学教学, 2023, (1): 62~66.
[3][4]王晶, 郑长龙主编.义务教育课程标准实验教科书· 化学(九年级上、下册)[M].北京: 人民教育出版社, 2012: 112, 60.
[5]顾庆超等.化学用表[M].南京: 江苏科学技术出版社, 1979: 136~137.
[6]张红卫.酸碱中和反应实验的新设计[J].化学教学, 2022, (2): 71~72.

