IGF-1基因克隆及其产物的测序鉴定
曹尚美 邹真真 陈泊霖 杨少哲 张清伟 王单单 王浩然 付秀虹

基金项目:河南省自然科学基金(2223000420247);2023年河南省博士后科研资助项目(312145);中央引导地方项目(Z20221343023);河南省重点研发与推广专项(212102310813、222102310361);河南省医学科技攻关项目(LHGJ20221031);漯河医学高等专科学校科技创新项目(2023ZD18)
第一作者简介:曹尚美(1987-),女,博士,主治医师。研究方向为泌尿内科。
*通信作者:付秀虹(1967-),女,主任医师,教授。研究方向为女性生殖。
DOI:10.19981/j.CN23-1581/G3.2024.16.002
摘 要:基因过表达在基础实验和基因治疗应用中都是常用的手段,而质粒的扩增在基因过表达过程中是不可或缺的技术,如何规范、高效地对质粒进行扩增和提取是基因治疗应用的前提,也是困扰很多基础研究人员的难题。利用现有的实验技术,在降低实验成本基础上,建立过表达质粒扩增、提取的最优方案。首先采用传统方法制作LB培养基和感受态细胞,对转化后的质粒进行大量扩增培养,之后使用商业试剂盒对质粒进行提取,反复试验后对商业试剂盒质粒提取过程进行优化,提高效率,最终获得高纯度和浓度的质粒溶液。经超微量分光光度计、琼脂糖凝胶电泳检测和sanger测序等多种方式检测验证后与NCBI数据库中目标基因序列一致,提示扩增、提取成功。经优化后的质粒扩增、提取方案标准、高效,成本低廉,是质粒基因克隆的最佳选择。
关键词:IGF-1基因;质粒克隆;基因过表达;质粒的扩增;基因治疗应用
中图分类号:Q811.4 文献标志码:A 文章编号:2095-2945(2024)16-0007-05
Abstract: Gene overexpression is a common method in basic experiments and gene therapy applications, and plasmid amplification is an indispensable technique in the process of gene overexpression. How to amplify and extract plasmids standardized and efficiently is the premise of gene therapy application, and it is also a difficult problem for many basic researchers. To establish the optimal scheme of amplification and extraction of overexpression plasmid on the basis of reducing the experimental cost by using the existing experimental technology. Firstly, the LB medium and competent cells were made by traditional method, and the transformed plasmid was amplified and cultured, and then the plasmid was extracted by commercial kit. After repeated experiments, the plasmid extraction process of commercial kit was optimized, the efficiency was improved, and the plasmid solution with high purity and concentration was obtained. The sequence of the target gene was verified by ultramicro spectrophotometer, agarose gel electrophoresis and sanger sequencing, which was consistent with that in NCBI database, indicating that the amplification and extraction were successful. The optimized plasmid amplification and extraction scheme is standard, efficient and low cost, which is the best choice for plasmid gene cloning.
Keywords: IGF-1 gene; plasmid cloning; gene overexpression; plasmid amplification; gene therapy application
胰島素样生长因子1(Insulin-like growth factor 1,IGF-1)是胰岛素样生长因子(Insulin-like growth factor,IGF)家族成员之一,具有促进细胞生长、分化、血管形成及抗肿瘤的作用,日益受到人们的关注[1]。IGF-1可与其受体结合,参与激活磷酸肌醇3激酶(PI3K)信号通路等,并可调控肿瘤细胞增殖、凋亡等生物学行为[2]。IGF-1是一个只有477 bp的基因片段,其编码的蛋白质只有7.8 kDa。它是一种小分子物质,其功能类似于生长因子,在促进细胞分化、增殖和个体生长发育方面发挥着重要作用[3]。
IGF-1是调节人体生长与发育的因子[4]。参与了很多疾病的分子信号通路,它可以调节卵母细胞质量,改善女性生育力水平[5]。IGF-1可以通过介导其他信号通路比如PI3K-AKT通路调节心脏功能[6-7],还可以直接参与肿瘤疾病的发生发展[8],参与机体代谢在糖尿病疾病发展中发挥作用[9]。IGF-1基因过表达在很多疾病模型中都有应用[10]。本研究立足分子实验基础,构建IGF-1基因扩增的标准实验流程,为IGF-1的广泛应用提供实验基础。
1 材料与方法
1.1 主要试剂及仪器
质粒PUC57-Kana-IGF-1(ABM21906,上海生工生物),大肠杆菌DH5α(B528411-0001,上海生工生物),50×TAE 缓冲液(T1060,北京索莱宝科技),2×RNA Loading Buffer(R0215,上海碧云天生物),NA-Red核酸染料(D0128,上海碧云天生物),DNA ladder(D0107,上海碧云天生物),超净工作台(Thermo Fisher, USA),恒温培养箱(Thermo Fisher, USA),低温摇床Innova40R(Eppendorf,USA),超微量分光光度计(B-500,上海元析仪器)。
1.2 试剂制备
试剂设备方法见表1。
1.3 感受态细胞制备
①从购买的菌管中挑一个DH5α菌落,转到2 mL不含抗性的LB液体培养基中,37 ℃摇床中过夜。②第二天打开制冰机预制冰,将2 mL的菌液分装转到4个50 mL离心管中,剧烈振摇 2~3 h。③制作冰浴桶,取出处于对数生长期的菌液冰浴10~15 min。④离心(4 ℃,4 000 rpm)10 min,收集细菌,尽可能地弃去培养液。⑤冰浴 30 min,用20 mL无菌预冷的 0.1 mol/L CaCl2(无甘油)重悬沉淀(置于冰中)。⑥离心(4℃,4 000 rpm)10 min,弃上清,尽可能地弃去培养液。⑦用12 mL CaCl2(含甘油,冰预冷)重悬沉淀。⑧分装到灭菌的1.5 mL的EP管中,200 ?滋L/管,-80℃冻存,备用。
1.4 质粒转化与细菌扩增
①从-80 ℃冰箱取1支含有100 μL感受态细胞,置于冰水混合物中进行解冻,解冻时长3~5 min。②吸取2~3 μL质粒(质粒浓度稀释到10 ng/ μL左右),加入解冻后的感受态细胞中,轻弹离心管混匀,或使用移液器进行多次吹打混匀。③再将离心管置于冰水混合物中10 min。④将上述离心管2/3浸入42 ℃水浴锅,热激时长90 s。⑤热激结束,离心管冰浴3 min。⑥加入600 μL不含抗性的LB液体培养基中,37℃摇床(200 rpm)复苏培养45 min。⑦复苏结束,吸取50~100 μL
转化物用无菌枪头呈田字格状均匀涂布在含有卡那抗性的LB平板上。⑧将平板倒置放入37℃培养箱进行过夜培养。挑取平板中的单个细菌克隆,放入含有卡那抗性的LB液体培养基中,37℃摇床6~8 h进行扩增。
1.5 质粒提取
使用天根质粒大提试剂盒(Catalog No.DP117)进行质粒提取,根据说明书进行优化步骤。溶液P1在使用前先加入RNase A,混匀,置于2~8℃保存。①向吸附柱CP6中加入2.5 mL的平衡液BL,离心(4℃,4 000 rpm)2 min,倒掉收集管中的废液,将吸附柱重新放回收集管中。取200~400 mL过夜培养的菌液加入离心管,离心(4℃,4 000 rpm)3 min收集细菌,尽量吸除上清。尽量吸除上清,为确保上清液全部吸取,请用干净的吸水纸吸去瓶壁上的水滴。向留有菌体沉淀的离心管中加入8 mL溶液P1,使用移液器或涡旋振荡器彻底悬浮细菌细胞沉淀。②向離心管中加入8 mL溶液P2,立即温和地上下翻转6~8次,使菌体充分裂解,室温放置5 min。向离心管中加入8 mL溶液P4,立即温和地上下翻转6~8次,充分混匀,至溶液出现白色分散絮状沉淀。然后室温放置10 min左右。离心(4 ℃,4 000 rpm)5~10 min,使白色沉淀离至管底,将全部溶液小心倒入过滤器CS1中,慢慢推动推柄过滤,滤液收集在干净的50 mL的管中。③向滤液中加入0.3倍滤液体积的异丙醇,上下颠倒混匀后转移到吸附柱CP6中。离心(4 ℃,4 000 rpm)2 min,倒掉收集管中的废液,将吸附柱CP6重新放回收集管中。④向吸附柱CP6中加入10 mL漂洗液PW,离心(4℃,4 000 rpm)2 min,弃掉收集管中的废液,将吸附柱重新放回收集管中。⑤重复操作步骤④。向吸附柱CP6中加入3 mL无水乙醇,离心(4 ℃,4 000 rpm)2 min,倒掉废液。将吸附柱CP6重新放回收集管中,离心(4 ℃,4 000 rpm)5 min,目的是将吸附柱中残余的漂洗液去除。⑥将吸附柱CP6置于一个干净的50 mL收集管中,向吸附膜的中间部位悬空滴加1~2 mL洗脱缓冲液TB,室温放置5 min,然后离心(4℃,4 000 rpm)2 min。⑦重复步骤⑥,每1 mL洗脱液加入1.42 mL异丙醇以及0.42 mL 5 mol/L NaCl,混匀,室温放置5 min,离心(4 ℃,4 000 rpm)10 min,小心弃上清。⑧加入0.5 mL的70%乙醇洗涤沉淀,离心(4 ℃,4 000 rpm)5 min,小心弃乙醇。
重复操作步骤8。空气中干燥沉淀约5~10 min,根据需要用适当体积的TB缓冲液溶解沉淀。洗脱缓冲液体积不少于1 mL,体积过小影响回收效率。将提取好的质粒分装于100 μL的离心管中,保存于-20 ℃冰箱。
1.6 质粒DNA浓度及纯度检测
1.6.1 超微量分光光度计检测质粒的浓度与纯度
开机后选择检测核酸,使用前用蒸馏水清洗再次清洗,吸取2 μL蒸餾水作为空白调零,擦去蒸馏水。取2 μL提取的质粒DNA,测量浓度和纯度。
1.6.2 琼脂糖凝胶电泳检测其纯度及完整性
①将清洁干燥的塑料托盘放入配胶板,置于水平面上。②配制足量的电泳缓冲液(1×TAE)用以灌满电泳槽和配制凝胶。轻轻地旋转以充分混匀凝胶溶液。③配制0.8%的琼脂糖凝胶(0.24 g琼脂糖粉末加入1×TAE 30 mL)微波炉加热2 min沸腾,降温到50℃左右时加入DD核酸染料1.5 μL。琼脂糖溶液正在冷却时,用一个合适的梳子形成加样孔。梳齿的位置应在托盘底面上0.5~1.0 mm,这样琼脂糖浇灌到托盘时将形成符合要求的加样孔。④浇灌温热的琼脂糖溶液进入模具,室温下放置30~45 min,待凝胶溶液完全凝结,小心拔出梳子。⑤将凝胶安放在电泳槽内,向电泳槽加入电泳缓冲液,刚好没过凝胶约1 mm。⑥混合DNA样品和一定比例的载样缓冲液。DNA 5 μL+1 μL RNA lodding buffer,DNA ladder 5 μL作为对照。原始质粒和提取质粒均进行10倍稀释。⑦关上电泳槽盖,接好电极插头。给予120 V,30 min条件下电泳,其中距离以阳极至阴极之间的测量为准。⑧当DNA样品或染料在凝胶中迁移了足够距离时,关上电源、拔出电极插头和打开电泳槽盖,用紫外灯在302 nm处观察凝胶和拍照。
1.6.3 对提取的质粒进行sanger测序
测序引物使用puc57-R(TAGCTCACTCATTAGGCAC)。
2 结果
2.1 超微量分光光度计检测
OD260/OD280的比值为1.9,浓度为268.30 ng/μL。
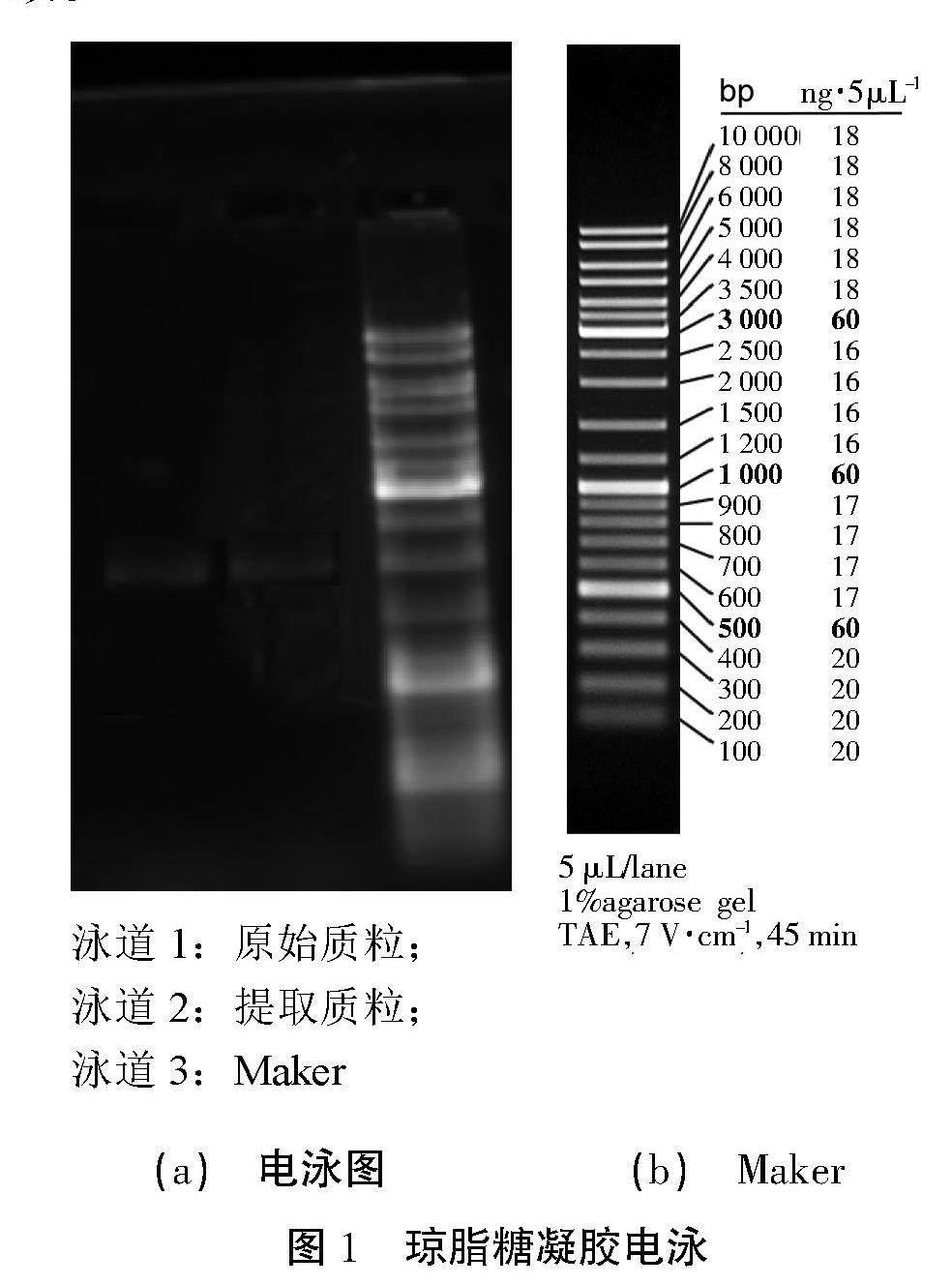
2.2 琼脂糖凝胶电泳检测结果
结果如图1所示,原始质粒和提取质粒电泳后位置一致。
(a) 电泳图 (b) Maker
图1 琼脂糖凝胶电泳
2.3 Sanger测序结果
测序结果如图2所示,测序序列与NCBI中IGF1基因序列一致。
IGF1基因序列(下载于NCBI)
ATGGGAAAAATCAGCAGTCTTCCAACCCAATTATTTA
AGTGCTGCTTTTGTGATTTCTTGAAGGTGAAGATGCA
CACCATGTCCTCCTCGCATCTCTTCTACCTGGCGCTGT
GCCTGCTCACCTTCACCAGCTCTGCCACGGCTGGACC
GGAGACGCTCTGCGGGGCTGAGCTGGTGGATGCTCTT
CAGTTCGTGTGTGGAGACAGGGGCTTTTATTTCAACA
AGCCCACAGGGTATGGCTCCAGCAGTCGGAGGGCGC
CTCAGACAGGCATCGTGGATGAGTGCTGCTTCCGGA
GCTGTGATCTAAGGAGGCTGGAGATGTATTGCGCAC
CCCTCAAGCCTGCCAAGTCAGCTCGCTCTGTCCGTGC
CCAGCGCCACACCGACATGCCCAAGACCCAGAAGTA
TCAGCCCCCATCTACCAACAAGAACACGAAGTCTCA
GAGAAGGAAAGGAAGTACATTTGAAGAACGCAAGT
AG。
经过检测,此次提取的质粒符合使用标准。后续可直接应用于细胞转染甚至动物体内实验等对DNA纯度要求很高的实验中。
3 讨论
基因过表达在基础实验和基因治疗应用中都是常用的手段,而质粒的扩增在基因过表达过程中是不可或缺的技术[11],如何规范、高效地对质粒进行扩增和提取是应用的前提,也是困扰很多基础研究人员的难题[12]。本实验中建立了一个质粒进行扩增和提取的最新标准,使用了最新的试剂和技术,反复试验后优化了质粒扩增、提取的步骤,制定了标准的实验流程,提高了常规质粒扩增、提取的效率,实验时间大大缩短,且降低了实验成本,为质粒在基因过表达中的广泛应用打下了坚实的基础。
大部分文献的实验流程不够详细,容易造成实验的失败,反复实验造成资源浪费。经过本实验的多次调试,总结出一套详实的实验过程,极大减小了实验失败的可能性。前期经过文献检索发现,有的基因过表达实验成本较高,比如CRISPR-Cas9技术[13],给后续实验造成经费上的负担。有的基因克隆实验时间较长,实验流程复杂,不利于推广和普及,比如文献[14]中介绍的方法。而本研究中使用的方法可以大大降低后续配制试剂的时间,提高实验效率。另外一种扩增质粒的方法是利用病毒扩增[15]的方式,虽然其后续实验转染效率可能更高,但是相较于细菌扩增不仅成本更高,风险也更大。质粒提取的商业试剂盒中实验条件过于笼统,需要反复试验才能找到最佳实验条件,经过优化后的实验流程可重复性高,实验条件较稳定,得到的质粒质量较高,提高了实验成功率。综上所述,本实验采用的质粒扩增和提取方式成本更低、获取效率更高,又可以保证后续实验效果,是基因克隆一种较好的选择。
本实验以IGF-1质粒为例,以较低的价格购进微量的质粒母液,利用公司成功的商业质粒为模板,对质粒进行扩增和提取,并对提取质粒的商业试剂盒中实验条件进行优化,整个过程不超过48 h。经过检测和验证后提取的质粒质量纯度、浓度均达到标准,对质粒母液的扩增倍数达到了指数级。建立了重复性和成功率高的实验标准流程,为其他类似的基因克隆实验提供了有价值的参考,也为基因治疗的应用打下良好的基础,具有很高的科研价值和现实意义。
参考文献:
[1] SHI J W, LAI Z Z , YANG H L, et al. An IGF1-expressing endometrial stromal cell population is associated with human decidualization[J].BMC biology,2022,20(1):276.
[2] WEI S, XIAO Y J, XIAO Y Y, et al. Regulation of the IGF1 signaling pathway is involved in idiopathic pulmonary fibrosis induced by alveolar epithelial cell senescence and core fucosylation.[J].Aging,2021(13).
[3] M L V D V, PETER M, MIRANDA A V, et al. Small molecules to regulate the GH/IGF1 axis by inhibiting the growth hormone receptor synthesis[J].Frontiers in Endocrinology,2022(13):926210.
[4] MASATO K, NAHO I, HIROFUMI N, et al. IGF1 gene is epigenetically activated in preterm infants with intrauterine growth restriction.[J].Clinical epigenetics,2020,12(1):108.
[5] PAWE?覵K, KORNELIA K, AGNIESZKA S, et al. Pleiotropic Effects of IGF1 on the Oocyte[J].Cells,2022,11(10):1610.
[6] BASS-STRINGER S, TAI C M K, MCMULLEN J R. IGF1-PI3K-induced physiological cardiac hypertrophy:Implications for new heart failure therapies,biomarkers,and predicting cardiotoxicity[J].Journal of sport and health science,2021,10(6):637-647.
[7] HIGASHI, GAUTAM S, DELAFONTAINE P, et al. IGF-1 and cardiovascular disease[J].Growth Hormone IGF Research,2019(45):6-16.
[8] WERNER H, LARON Z. Role of the GH-IGF1 system in progression of cancer[J].Molecular and Cellular Endocrinology,2020(518):111003.
[9] SHIMONA S. Genomics suggest role for IGF1 resistance in T2DM[J].Nature reviews. Endocrinology,2022,19(2):64.
[10] CHATTERJEE E, CHAUDHURI R D, SARKAR S. Cardiomyocyte targeted overexpression of IGF1 during detraining restores compromised cardiac condition via mTORC2 mediated switching of PKCδ to PKCα[J].Biochimica et biophysica acta. Molecular basis of disease,2019,1865(10):2736-2752.
[11] 陳伟珊,黄一芳,叶昕怡,等.质粒连接克隆法用于提高单细胞全基因组扩增产物覆盖率及质量的初探[J].暨南大学学报(自然科学与医学版),2022,43(6):643-652.
[12] 朱俊闻,杜祎萌,霍楠,等.ABRACL基因启动子不同片段重组质粒构建及转录活性研究[J].军事医学,2023,47(5):341-345.
[13] 吴仲胜,高誉,杜勇涛,等.CRISPR-Cas9基因编辑技术对细胞内源蛋白进行荧光标记的实验操作[J].遗传,2023,45(2):165-175.
[14] 杨少哲.聚乙酰亚胺载体介导的高效基因传递方法[D].汕头:汕头大学,2015.
[15] MALLOL C, CASANA E, JIMENEZ V, et al. AAV-mediated pancreatic overexpression of Igf1 counteracts progression to autoimmune diabetes in mice[J].Molecular Metabolism,2017,6(7):664-680.

