猪肺炎支原体实时荧光定量PCR检测方法建立及应用
刘 莹,李 峰,殷宗俊,王敬茹,李书光*,郑先瑞*
(1.山东省滨州畜牧兽医研究院,山东滨州 256600;2.安徽农业大学动物科技学院,安徽合肥 230036;3.滨州市滨城区畜牧兽医服务中心,山东滨州 256600)
猪肺炎支原体(Mycoplasmahyopneumoniae)是导致猪呼吸道疾病综合征的主要病原体之一,这是一种慢性猪呼吸系统疾病[1],其主要症状为气喘并伴随着咳嗽,该病会导致猪生产性能降低、饲料转化率下降,同时较易受到感染和诱导引发其他疾病,这就增加了对该病进行防治的困难,对我国养猪业的发展和经济效益造成严重影响[2-3]。猪肺炎支原体感染在几乎所有的生猪产区都非常普遍,随着药物使用的增加和猪生产性能的下降,给养猪业造成了重大的经济损失[4]。该病菌会附着在气管、支气管和细支气管的纤毛上皮细胞上,影响了黏膜清除系统,并调节免疫系统,使动物更容易受到其他呼吸道病原的感染[5]。猪肺炎支原体不仅能通过空气传播,还能进行垂直传播,仔猪染病后,临床症状表现较晚。一旦猪场感染该病,病原很难在短时间内清除,且容易出现继发感染[6]。因此,必须对猪群进行监测,以便能早发现并早治疗,避免造成更大的经济损失。
猪肺炎支原体的诊断主要有4种方法,包括临床诊断、病理组织学诊断、病原检测和抗体检测等[7],感染猪肺炎支原体的临床症状为间歇性且强度可变的干咳[8],在肺脏呈现“肉样” 或“虾肉样”实变[9],剖检变化呈现的特征是融合性支气管肺炎,病理组织学诊断时需要在排除其他病原的情况下,检测到特异性抗原或抗体,才能最终确诊为猪肺炎支原体感染[10],目前,ELISA是临床应用最广泛的Mhp的抗体检测方法[11],经典的病原检测方法还有常规PCR,具有简单、方便、快速及节约成本等优点,但是其发展受到限制[12],其中重要的原因是灵敏度低,不能精确定量。本研究基于猪肺炎支原体编码乳酸脱氢酶的P36因基因序列保守区,设计引物和探针,建立一种Mhp实时荧光定量PCR检测方法,具有敏感性高、特异性强、重复性好、耗时短等优点。该方法可为Mhp的监测和检测提供技术支持。
1 材料与方法
1.1 材料
1.1.1 菌株及样品 猪肺炎支原体(Mycoplasmahyopneumoniae) 疫苗株RM48株、鸡毒支原体(Mycoplasmagallisepticum)R株、猪鼻支原体(Mycoplasmahyorhinis)WH-C株、绵羊肺炎支原体(Mycoplasmaovipneumoniae)HS2017株、牛支原体(Mycoplasmabovis)PG45株、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、猪圆环病毒2型(Porcine circovirus virus type 2,PCV2)、猪瘟病毒(Classical swine fever virus,CSFV)、伪狂犬病病毒(Pseudorabies virus,PRV)等病原均由山东绿都生物科技有限公司保存。
1.1.2 主要试剂 Simply P病毒基因组DNA/RNA提取试剂盒,BioEasy多重荧光qPCR预混液(含UDG)试剂盒,杭州博日生物科技有限公司产品。
1.1.3 主要仪器 微量分光光度计(Thermo Scientific NanoDrop 2000),美国Thermo Fisher Scientific公司产品;鲲鹏基因荧光定量PCR仪(Archimed X4),鲲鹏基因(北京)科技有限公司产品;电热恒温培养箱(DRP-9272),上海森信实验仪器有限公司产品;生物安全(BSC-130ⅡA2),苏州安泰空气技术有限公司产品。
1.2 方法
1.2.1 引物和探针设计 根据猪肺炎支原体编码乳酸脱氢酶的P36基因序列,在NCBI上选择其保守区域,利用Prime premier 5.0软件设计其引物探针MhpF、MhpR和MhpP(表1)。扩增的目的片段大小为111 bp。引物和探针由通用生物公司合成。
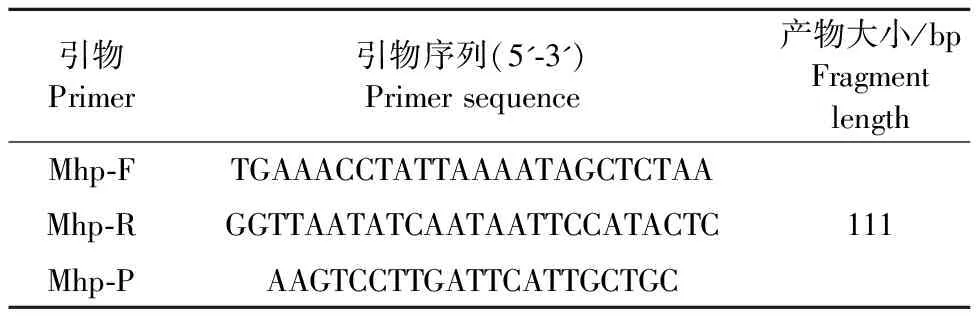
表1 荧光定量PCR引物信息
1.2.2 猪肺炎支原体DNA模板的制备 根据病毒基因组DNA/RNA提取试剂盒的说明书,提取Mhp的基因组DNA,并使用微量分光度计测定其浓度和纯度,稀释后作为标准品,置-20 ℃保存备用。
1.2.3 猪肺炎支原体荧光PCR反应体系的优化 在模板浓度相同的情况下,以Mycoplasma基因组DNA为模板,通过矩阵法对引物浓度(2.5~10 μmol/L)和探针浓度(1.25~5 μmol/L)进行优化,建立最佳的反应体系后,设置的退火温度为(50~60 ℃)进行优化,确定最佳的退火温度。
荧光定量PCR反应体系(20 μL)组成如下:PCR反应液10 μL,Mycoplasma引物终浓度为10 μmol/L、探针终浓度为5 μmol/L,模板2 μL,ddH2O补足至20 μL。反应条件:50 ℃ 5 min;95 ℃ 2 min,95 ℃ 15 s,60 ℃ 15 s,72 ℃ 30s,40个循环,根据Ct值和荧光强度来确定最佳的反应条件。
1.2.4 建立猪肺炎支原体PCR标准曲线 以106~102copies/μL Mhp基因组DNA为模板,经过Archimed Analyzer1.0 PCR仪进行扩增,每个稀释度重复3次,并用Archimed Analyzer 1.0 PCR仪绘制标准曲线。
1.2.5 特异性试验 以猪肺炎支原体、猪鼻支原体、牛支原体、绵羊肺炎支原体、鸡毒支原体、猪繁殖与呼吸综合征病毒、猪圆环病毒2型、猪瘟病毒、伪狂犬病病毒等核酸为模板,在最佳的反应体系和退火温度下进行特异性试验。
1.2.6 敏感性试验 以106~100copies/μL Mhp基因组DNA为模板,经Archimed Analyzer 1.0 PCR仪检测其敏感性。
进行常规PCR扩增,反应体系(20 μL)为:2×EasyTaqSuper Mix 10 μL,F(10 μmol/L)1 μL,R(10 μmol/L)1 μL,模板DNA 2 μL,dd H2O 6 μL。
PCR扩增过程中,按照以下程序进行:预变性95 ℃ 5 min;95 ℃ 45 s,60 ℃ 45 s,72 ℃ 1 min,共30个循环;终延伸72 ℃ 10 min。扩增结束后,取5 μL扩增产物进行1%琼脂糖凝胶电泳,在220 V电压下,电泳30 min后观察结果,比较荧光定量PCR和常规PCR的灵敏度。
1.2.7 重复性试验 使用猪肺炎支原体标准模板,选取A:1×106、B:1×105、C:1×104、D:1×103、E:1×102copies/μL等5个稀释度作为荧光定量PCR的阳性模板,进行重复性检验,并分析其变异率。
1.2.8 荧光定量PCR的临床应用 对采集的30份临床病料(来源于猪场的鼻拭子)提取基因组DNA,用本试验建立的TaqMan实时荧光定量PCR和常规PCR对其进行检测,通过统计猪肺炎支原体阳性率来比较两种方法的检出率。
2 结果
2.1 反应体系的优化
以1×105copies/μLMycoplasma基因组DNA为模板进行荧光定量PCR扩增。通过对引物浓度和探针浓度进行优化,确定最佳体系为:F(10 μmol/L)1 μL,R(10 μmol/L)1 μL,P(5 μmol/L)0.5 μL,模板2 μL,dd H2O补足至20 μL。优化的反应条件:50 ℃ 5 min;95 ℃ 2 min,95 ℃ 15 s,50 ℃ 15 s,72 ℃ 30 s,共40个循环。
2.2 标准曲线的建立
将1×106copies/μL的Mycoplasma基因组以10倍倍比系列稀释(1×102~1×106),将等体积稀释后的样品作为模板进行荧光定量PCR扩增,获得扩增曲线(图1)以及标准曲线(图2),得到基因组拷贝数(x)和Ct值(y)的线性方程为y=-3.419x+39.886,线性相关系数R2为0.998,扩增效率为96.10%,扩增产物的Ct值与浓度之间呈现良好的线性关系。
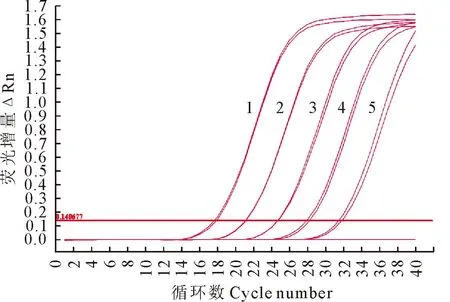
1~5.基因组DNA浓度分别为1.0×106 ~1.0×102 copies/μL
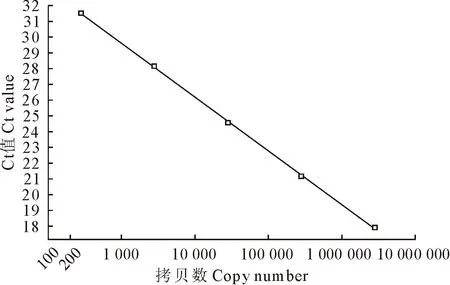
图2 猪肺炎支原体荧光定量PCR标准曲线
2.3 特异性试验结果
采用建立的荧光定量PCR对猪肺炎支原体、猪鼻支原体、牛支原体、绵羊肺炎支原体、鸡毒支原体、猪繁殖与呼吸综合征病毒、猪圆环病毒2型、猪瘟病毒、伪狂犬病病毒的核酸样品进行检测,结果显示(图3),仅猪肺炎支原体出现荧光信号,检测结果为阳性,其他8种病原核酸的检测均未达到阈值,检测结果为阴性,这表明所建立的荧光定量PCR检测方法具有较强的特异性。

1、2、3、4、5、6、7、8、9分别为猪肺炎支原体、猪鼻支原体、牛支原体、绵羊肺炎支原体 、鸡毒支原体、猪繁殖与呼吸综合征病毒、猪圆环病毒2型、猪瘟病毒、伪狂犬病病毒
2.4 敏感性试验结果
将1×106copies/μL的Mycoplasma基因组以10倍倍比系列稀释(1×100~1×106),等体积混匀后作为模板,进行荧光定量PCR扩增。结果表明(图4),荧光定量PCR对Mycoplasma基因组的检测下限为10 copies/μL,而常规PCR对的检测下限为100 copies/μL,通过比较两种方法可检测的最低浓度,发现荧光定量PCR比常规PCR的灵敏度提高了10倍,说明荧光定量PCR的敏感性较高。
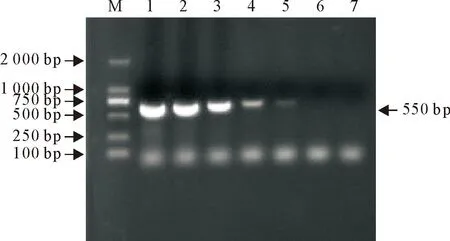
M.DNA标准DL 2 000; 1~7.基因组DNA浓度分别为1.0×106~1.0×100 copies/μL
2.5 重复性试验结果
使用已建立的TaqMan实时荧光定量PCR,对5个不同浓度的猪肺炎支原体核酸标准品进行3次批内和3次批间的重复试。结果显示(表2),TaqMan实时荧光定量PCR的组内和组间变异系数(CV)值均小于2%,表明该方法具有良好的重复性。
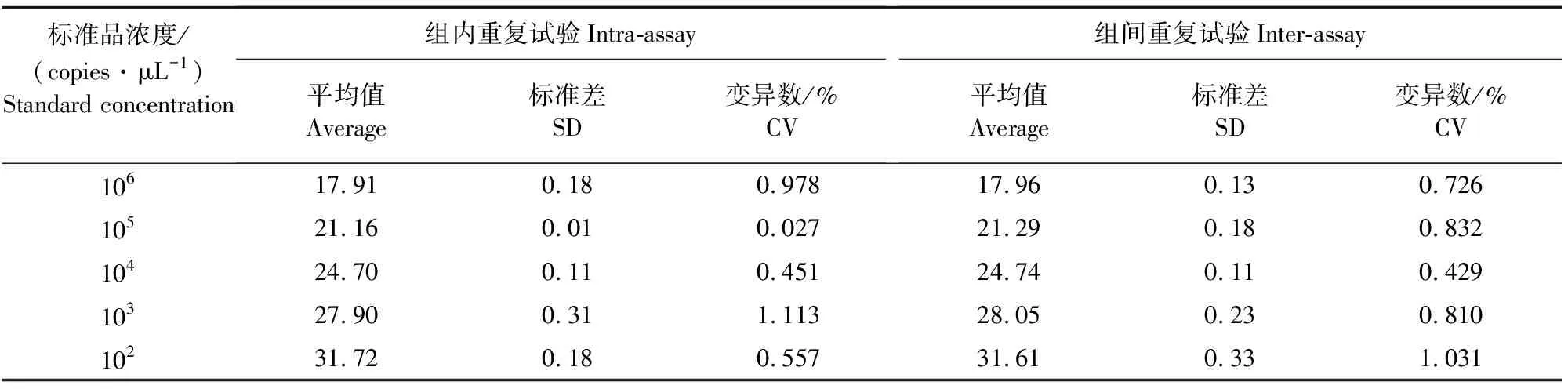
表2 荧光定量PCR重复性试验
2.6 临床病料的检测
对采集的30份临床样品利用本研究建立的TaqMan实时荧光定量PCR进行检测,并与常规PCR的结果进行比较,TaqMan实时荧光定量PCR检测Mhp的阳性率为63%(19/30),而常规PCR检测Mhp的阳性率为30%(9/30),表明本试验建立的TaqMan实时荧光定量PCR比常规PCR更敏感。
3 讨论
猪肺炎支原体(M.hyopneumoniae)是猪呼吸道疾病综合征的主要病原体之一,也是世界范围内最重要的猪病病原[5]。疫苗接种是预防和控制该疾病的最具有成本效益的策略,但仍然无法完全控制猪肺炎支原体感染,造成了显著的经济损失[13]。支原体作为基因组规模和代谢途径有限的最小微生物之一,Mhp可以利用多种机制实现免疫逃避效应,并从其宿主中获取足够的营养物质,表明Mhp与猪机体之间存在较强的相互作用[14]。在南美洲,根据分子诊断[15],阿根廷门多萨省猪的猪肺炎支原体患病率估计为48%,巴西东南部和南部的患病率从52%~90%以上[16-17]。说明猪肺炎支原体已经成为严重危害全球养猪业经济发展的重要疫病之一,因此对猪群进行定期监测并采取及时的防控是非常必要的。
为此,养猪业需要可对猪肺炎支原体快速定量检测的方法,本试验建立了猪肺炎支原体TaqMan 实时荧光定量PCR检测方法,该方法比常规PCR更灵敏,最低检出浓度可达10 copies/μL,比肖婷等[18]建立的猪肺炎支原体、猪圆环病毒2型和3型多重荧光定量PCR检测方法的灵敏度高,与武昱孜[19]建立的猪肺炎支原体和猪鼻支原体双重荧光定量PCR检测方法灵敏度相当。此外,该方法具有较好的的特异性,对猪肺炎支原体、猪鼻支原体、羊支原体、牛支原体、猪繁殖与呼吸综合征病毒、猪圆环病毒2型、猪瘟病毒、伪狂犬病病毒等均无交叉反应,说明具有良好的特异性;在进行3次重复性试验检测不同浓度的核酸标准品,变异系数均小于2%,表明具有良好的重复性。使用该方法对选取的30份临床病料(来源于猪场的鼻拭子组织样品)进行检测,结果表明,相较于常规PCR,实时荧光定量PCR具有更高的敏感性,可用于猪肺炎支原体感染的检测。总的来说,实时荧光定量PCR不仅灵敏性高,特异性和重复性也较好,可以用于临床样品检测和流行病学调查,为及时对感染后的猪场采取措施提供技术支持。

