玉米须绞股蓝复合提取总黄酮工艺及其降压片的制备
刘霞 马泽刚 马林


摘要:以玉米须(stigma maydis)、绞股蓝(Gynostemma pentaphyllum)(1∶1)为提取原料,总黄酮含量为考察指标,通过提取溶剂、乙醇体积分数、提取温度、提取时间、料液比和提取次数等单因素考察对复合总黄酮含量的影响,再通过正交试验优化总黄酮的提取工艺,最后将优化提取的总黄酮过D101大孔吸附树脂精制后制备成降压片。结果表明,复方总黄酮的最佳提取工艺为乙醇体积分数50%,料液比1∶10,50 ℃下提取3.5 h。制备的片剂质量(片重差异±5.1%,脆碎度0.83%,崩解时限2.41 min)符合《中华人民共和国药典》(2020版)片剂的有关规定,并且降压片能降低SHR大鼠血压。
关键词:玉米须(stigma maydis);绞股蓝(Gynostemma pentaphyllum);总黄酮;提取工艺;降压片;制备
中图分类号:R284 文献标识码:A
文章编号:0439-8114(2024)04-0136-05
Extraction process of total flavonoids from stigma maydis and Gynostemma pentaphyllum and preparation of the antihypertensive tablets
Abstract: Taking stigma maydis and Gynostemma pentaphyllum (1∶1) as the extraction raw material and the total flavonoids content as the investigation index, the effect of compound total flavonoids content was investigated by single factors including extraction solvent, ethanol volume fraction, extraction temperature, extraction time, material-liquid ratio and extraction times. Then, the extraction process of total flavonoids was optimized by the orthogonal test. Finally, the optimized total flavonoids were refined by D101 macroporous adsorption resin and prepared into antihypertensive tablets. The results showed that the best extraction process of compound total flavonoids was 50% ethanol volume fraction, the material-liquid ratio was 1∶10, and the extraction time was 3.5 h at 50 ℃. The quality of the prepared tablets (weight difference ±5.1%, fragmentability 0.83%, disintegration time 2.41 min) was in line with the relevant provisions of the Pharmacopoeia of the Peoples Republic of China (2020 edition), and the antihypertensive tablets could reduce the blood pressure of SHR rats.
Key words:stigma maydis;Gynostemma pentaphyllum;total flavonooids;extraction process;antihypertensive tablets;preparation
絞股蓝(Gynostemma pentaphyllum (Thunb.)Makino)又名七叶胆,为葫芦科绞股蓝属植物绞股蓝全草,富含皂苷、氨基酸、黄酮、萜类、生物碱、多糖、蛋白质等活性物质[1-3]。其中的活性成分黄酮与抗氧化有密切关系[4]。玉米须含有黄酮类、多糖类、氨基酸类、生物碱等多种生物活性物质,具有利尿、降压、降糖、降脂等功效。黄酮类物质作为玉米须重要的活性成分之一,其含量远高于玉米粒,是天然无毒的抗氧化剂[5-7]。目前,已有文献报道了绞股蓝总黄酮[8]、玉米须总黄酮[9]的提取工艺,但对两者复配提取总黄酮及复合黄酮降压片的研究未有涉及。本研究以总黄酮含量为指标,先对玉米须、绞股蓝复配提取总黄酮工艺进行探讨,再将黄酮精制后制备成降压片,并对片剂进行质量评价(按《中华人民共和国药典》2020标准)[10],最后进行SHR大鼠降压试验。
1 材料与方法
1.1 材料
原材料:绞股蓝,购于泸州江阳西路农贸市场,经四川卫生康复职业学院副主任药师钟辉云鉴定为葫芦科绞股蓝属植物绞股蓝[Gynostemma pentaphyllum (Thunb.)Makino];玉米须:干品,购于泸州江阳西路农贸市场。芦丁标准品(纯度≥99%),中国药品生物制品检验所;无水乙醇、NaOH、NaNO2,天津市福晨化学试剂厂;Al(NO3)3,南京化学试剂有限公司,以上均为分析纯。纯净水(农夫山泉);D101型大孔吸附树脂,中山东鸿化工有限公司;微晶纤维素、硬脂酸镁、羧甲基纤维素钠、滑石粉等辅料均购于潍坊英轩实业有限公司,食品级;淀粉、山梨糖醇、乳粉、柠檬酸等添加剂均购于浙江华康药业股份有限公司,食品级。原发性高血压(SHR)大鼠,15只,SCXK(京)2018-0009,购于北京维通利华实验动物技术有限公司。
1.2 仪器
R201D型恒温水浴锅,巩义市英浴高科仪器厂;RE-52A型旋转蒸发仪,上 海亚荣生化仪器厂;SHB-Ⅲ型循环水式多用真空泵,上海一展实验设备有限公 司;BL610型电子天平,上海上天精密仪器有限公司;UV1000型紫外可见分光光度计,上海天美科学仪器有限公司;DP120型压片机,江苏泰兴制药机械二厂;CJY-300D型脆碎度测定仪,上海黄海药检仪器有限公司;LB-2D型崩解仪,上海黄海药检仪器有限公司;moorLAB-NIBP型大鼠无创血压仪,美国吉安得尔科技有限公司。
1.3 方法
1.3.1 黄酮的提取及测定
1)绘制标准曲线[11]:配制0.200 mg/mL的芦丁标准溶液。精确吸取芦丁标准溶液0、0.5、1.0、2.0、3.0、4.0 mL分别置于10 mL容量瓶中;加入0.3 mL 5%的亚硝酸钠溶液,静置6 min ,再加入0.3 mL的10%硝酸铝溶液,静置60 min;加入4 mL的4%氢氧化钠溶液,静置15 min后用60%乙醇定容至刻度,静置15 min;测定其在505 nm处的吸光度。以芦丁浓度为横坐标、吸光度为纵坐标绘制标准曲线。
2)基础提取方法:称取1∶1(g∶g)的绞股蓝、玉米须各50 g,1 000 g 50%乙醇浸泡,拌匀,60 °C下搅拌回流2 h, 共回流3次,合并提取液,45 °C真空旋干,称重,得绞股蓝、玉米须复合总黄酮。取0.1 g干粉末,60%乙醇溶解并定容至50 mL,取1 mL定容液,根据上步获取的芦丁标准曲线,采用分光光度法测定黄酮含量。
1.3.2 单因素试验
1)不同提取溶剂试验:分别用乙醇、甲醇、丙酮、乙酸乙酯、石油醚、氯仿替代基础提取方法中的提取溶剂,其余操作不变。
2)不同乙醇体积分数试验:分别用40%、50%、60%、70%、80%、90%替代基础提取方法中的乙醇体积分数,其余操作不变。
3)不同料液比试验:分别用1∶2、1∶6、1∶10、 1∶14、1∶18、1∶22的料液比替代基础提取方法中的料液比,其余操作不变。
4)不同提取温度试验:分别用40、50、60、70、80、90 ℃替代基础提取方法中的提取温度,其余操作不变。
5)不同提取时间试验:分别用1.5、2.0、2.5、3.0、3.5、4.0、4.5 h替代基础提取方法中的提取时间,其余操作不变。
6)不同提取次数试验:分别用1、2、3、4、5、6次替代基础提取方法中的提取次数,其余操作不变。
1.3.3 正交优化试验
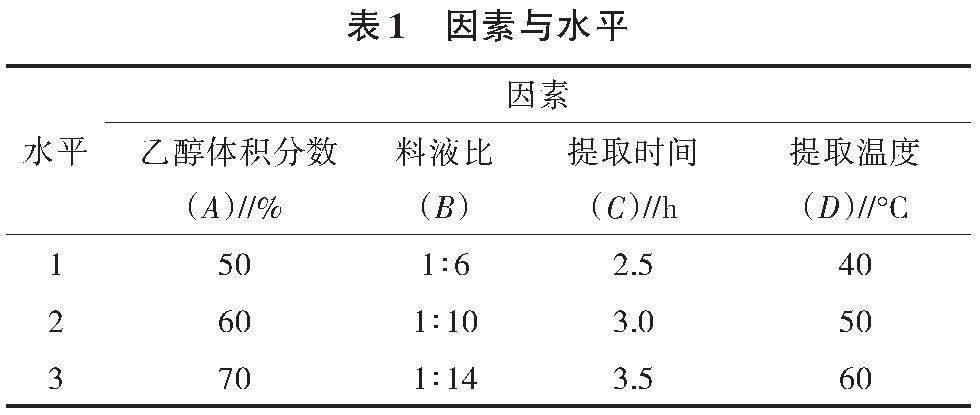
根据单因素试验结果,选取对总黄酮影响最大的4个因素及水平(表1),以总黄酮含量为指标进行L9(34)正交试验,每组3次平行,确定总黄酮的最佳提取工艺。
1.3.4 总黄酮精制试验 对D101大孔吸附树脂预处理后[12],装柱(50 cm玻璃柱装35 cm), 将最优工艺下提取的总黄酮浓缩液100 mL过D101大孔吸附柱(流速2 mL/min),60%乙醇1 500 mL洗脱(流速2 mL/min),收集洗脫液,真空浓缩成黄酮粉末,备用。
1.3.5 复合降压片的制备
1)混合:称取制备好的复方黄酮粉末5 g,微晶纤维素2.4 g,乳粉8 g,木糖醇6 g,柠檬酸0.03 g,淀粉8.57 g,混合均匀,过80目筛。
2)制软材:混合粉末和3 g淀粉浆混匀,手握成团不黏手,手指轻压裂开即可。
3)制粒:软材过16目的尼龙筛制得湿粒,40 ℃烘箱干燥。
4)整粒:干燥后的颗粒过14目的尼龙网。
5)压片:硬脂酸镁0.45 g、滑石粉0.1 g加入到颗粒中混匀,压片机压片。
以上制备的复合降压片为100片,片重300 mg,含50 mg/片黄酮提取物。
1.3.6 复合降压片的检测 参照《中华人民共和国药典》(2020版)片剂检测方法,主要检测复合降压片外观、重量差异、崩解时限及脆碎度。
1.3.7 降压试验
1)药剂:复合降压片1片为300 mg,其中含黄酮提取物50 mg。
2)分组:将SHR大鼠15只平均分为A、B、C组,其中A组为阳性对照组,灌胃给药卡托普利[4 mg/(只·d)];B组为试验组,每只每天喂食1片复合降压片(碾碎去离子水溶解),采用灌胃方式喂食;C组为空白组,每天每只给予去离子水,每天上午9:00灌胃试验。
3)试验:使用 moorALB-NIBP无创血压仪测定大鼠血压(尾动脉血压),每次给药后1 h测量,每次连续测3次,取平均值作为测定血压值,共试验5周。
1.3.8 数据处理 所有数据采用SPSS 20.0统计软件进行分析处理,计量采用单因素方差分析,均用平均值±标准差表示,P<0.05为差异显著,具有统计学意义。
3 结果与分析
3.1 单因素试验结果
3.1.1 不同溶剂对总黄酮含量的影响 由图1可知,丙酮和甲醇对总黄酮的提取效果相当,乙醇次之,石油醚提取效果最差,考虑到后续制备玉米须、绞股蓝片剂以及丙酮和甲醇的毒性,故该试验以下研究均以乙醇为提取溶剂。
3.1.2 不同乙醇体积分数对总黄酮含量的影响 由图2可知,随着乙醇体积分数的增加,总黄酮含量逐步趋于平稳,当乙醇体积分数达到50%后,继续加大乙醇体积分数,总黄酮含量变化不大,当乙醇体积分数达到80%时略有下降趋势,分析原因,可能是由于乙醇体积分数增大,导致提取液极性发生变化,从而提取出了许多可溶于大浓度乙醇的杂质。
3.1.3 不同料液比对总黄酮含量的影响 由图3可知,随着溶剂体积的增加,总黄酮含量也随之提高,当料液比为1∶14时,总黄酮含量最大,随后趋于稳定,但从减少溶剂用量、减少能耗、降低浓缩负荷等多方面考虑,乙醇用量不宜过大,因此选择1∶10作为最佳料液比。
3.1.4 不同提取温度对总黄酮含量的影响 由图4可知,随着提取温度的提高,总黄酮含量不断升高,在70 ℃时达到最高,但考虑提取温度会直接影响原料中黄酮分子的运动,过高的提取温度容易造成黄酮的结构被破坏,溶出的杂质增多,另一方面也容易造成溶剂损失,考虑提取的安全问题,选择60 ℃为最佳的提取温度。
3.1.5 不同提取时间对总黄酮含量的影响 由图5可知,当提取时间达3.0 h,总黄酮含量已基本达到平稳,随着提取时间的增加,总黄酮含量变化不大,从节约能耗以及总黄酮纯度考虑,若持续提取,可能会提取出更多的杂质,因此,选择3.0 h作为最佳的提取时间。
3.1.6 不同提取次数对总黄酮含量的影响 由图6可知,当提取次数为1~3次时,总黄酮含量呈直线上升状态;当提取次数为4次时,总黄酮含量有下降的趋势,可能是因为随着提取次数的增加,总提取时间也相应增加,提取出了其他杂质,从而影响总黄酮含量。如果继续增加提取次数,势必会造成能耗、杂质的增加,因此,选择最佳提取次数为3次。
3.2 正交试验结果
正交试验L9(34)共9组,每组3次重复,结果见表 2。根据极差R的大小,判断提取时间是影响总黄酮含量的主要因素,然后依次是提取温度、乙醇体积分数、料液比。从极差分析的均值大小确定优化水平为A1B2C2D2, 但根据正交试验结果,总黄酮提取含量最大的组合为A1B2C3D2,即乙醇体积分数为50%,料液比1∶10,50 ℃下提取时间3.5 h。与正交得出的结论不同,因此进行组合A1B2C2D2和组合A1B2C3D2的验证试验。由表3可知,组合A1B2C3D2提取的总黄酮含量高于A1B2C2D2,分析原因,可能为组合A1B2C3D2的提取时间较组合A1B2C2D2长,而提取时间是影响总黄酮含量的主要因素。综上,确定A1B2C3D2为最优组合,即乙醇体积分数50 %,料液比1∶10,提取时间3.5 h,提取温度50 ℃。
对正交试验进行方差分析(表4)结果表明,提取时间、提取温度、乙醇体积分数、料液比4个因素对总黄酮含量的影响均显著。
3.3 复合降压片质量检测结果
本试验制备的复合总黄酮降压片颜色为淡黄色,表面完整光洁,色泽均匀,无杂斑,口感柔和,考虑到服用该片剂的部分人群可能为糖尿病人,故甜度剂选用与白砂糖甜度相当的木糖醇,为解决提取的黄酮略苦的问题,配方中添加乳粉及柠檬酸来掩盖黄酮苦涩问题并改善片剂口感。根据《中华人民共和国药典》(2020版)片剂要求,测定的片重差异为±5.1%,脆碎度为0.83%,平均崩解时间为2.41 min,均符合药典要求(表4)。
3.4 复合降压片对SHR大鼠血压的影响
由表5、表6可知,给药前SHR大鼠的血压基本处于同一个水平。给药1周后,血压均有一定程度的下降。当给药到第3周时,血壓下降程度逐渐平稳,第4~5周收缩压下降结果与空白对照组比较具有显著性差异(P<0.05),第3~5周舒张压下降结果与空白对照组比较具有显著性差异(P<0.05)。
4 小结与讨论
单因素试验结果表明,提取总黄酮最佳的溶剂体积分数为50%,料液比为1∶10,这与潘志浩等[13]的研究结论(乙醇体积分数60%,料液比1∶40)存在较大差异,分析原因,可能与此研究所用原料为复合原料不同有关。本研究得出60 °C为最佳的总黄酮提取温度,3.0 h为最佳提取时间,与谭曾勇等[14]的研究中单因素最佳提取温度为90 °C,提取时间为2 h有一定差异,产生此差异的原因可能是因为采用的提取方法不同。
正交试验结果表明,乙醇体积分数为50%,料液比1∶10,50 ℃下提取3.5 h为最佳的玉米须绞股蓝复合总黄酮提取工艺。华心愉等[15]采用同种提取方法确定玉米须黄酮的最佳提取工艺为乙醇体积分数为60%,料液比1∶16,60 ℃下提取3 h,两者存在差异,分析原因可能是本研究加入了绞股蓝复合提取,导致最佳工艺与单独提取有出入。
制备的复合降压片剂质量(片重差异±5.1%,脆碎度0.83%,崩解时限2.41 min)符合《中华人民共和国药典》(2020版)片剂的有关规定,并且服用降压片第3周能明显降低SHR大鼠血压。与纪丽莲[16]报道的玉米须乙醇浸出液对家兔有显著降压作用一致,分析原因可能是由于复合降压片中含大量的玉米须黄酮。
目前以玉米须、绞股蓝为原料的产品仅有袋泡茶,尚未形成片剂产品,本研究证实玉米须、绞股蓝复合提取液黄酮含量丰富,存在降低SHR大鼠血压的作用,可为后续开发玉米须、绞股蓝复合降压片提供有利的数据支持。
参考文献:
[1] 周文超.绞股蓝种子中新皂苷的提取及其消炎活性研究[J].云南化工,2018,45(8):34-37.
[2] 陈 垚,卢连华,高景芳,等.葛根、山楂、绞股蓝的提取物与红曲米合用降血脂作用研究[J].预防医学论坛,2018,24(7):556-559.
[3] 吴秀丽,马泽刚,钟辉云.8个不同产地绞股蓝多糖含量的测定[J].南方农业,2018, 12(9): 102,112.
[4] NAGAI M, IZAWA K, NAGUMO S, et al. Two glycosides of a novel dammarane alcohol from Gynostemma pentaphyllm[J]. Chemical and pharmaceutical bulletin, 1981, 29(3): 779-783.
[5] 王秋实. 玉米须黄酮提取、纯化及其降糖研究[D]. 长春: 吉林农业大学, 2017.
[6] 张佳佳,何志涛,王新茹,等.玉米须多糖药理作用的研究进展[J].吉林医药学院学报,2021,42(1):64-66.
[7] RAHMAN N A, ROSLI W I W. Nutritional compositions and antioxidative capacity of the silk obtained from immature and mature corn[J]. Journal of King Saud University-Science, 2014, 26(2): 119-127.
[8] 欧阳辉,田启建,余 佶,等.酶法辅助提取绞股蓝中总黄酮工艺优化[J]. 中草药, 2011,42(5): 886-889.
[9] 刘 军. 玉米须黄酮类化合物制备及抗氧化活性研究[D]. 长春: 吉林大学, 2011.
[10] 国家药典委员会.中华人民共和国药典:四部[M].北京:中国医药科技出版社,2020.
[11] 蒋珍藕,邱宏聪,邓聿胤. 藤三七总皂苷和总黄酮提取工艺优选[J]. 中国实验方剂学杂志,2013,19(19):28-30.
[12] 杨秀珍.大孔吸附树脂对绞股蓝总黄酮分离纯化工艺的研究[J].中华中医药学刊,2013,31(4):928-930.
[13] 潘志浩,叶珍珍,崔升淼.绞股蓝总黄酮提取工艺的研究[J].广东药学院学报,2012,28(1):44-46.
[14] 谭曾勇,冉 勤,胡琼丹,等. 绞股蓝总黄酮提取工艺及抗氧化活性研究[J].化学与生物工程,2020,37(2):22-27.
[15] 华心愉,孙骏威,朱 诚. 玉米须总黄酮提取工艺及其降血糖作用研究[J].安徽农业科学,2017,45(14):117-119.
[16] 纪丽莲. 玉米须的食疗价值与开发[J].中国野生植物资源,1997,16(3):26-27.

