无机废水中有价金属回收再利用的实验设计*
邱江华,陈 阳,余高奇
(武汉科技大学化学与化工学院,湖北 武汉 430081)
实验教学作为实践教学的重要组成部分,是人才培养中一个极为重要的环节,是培养学生动手能力、独立思考能力和创新能力的重要部分。然而,当前国内高校无机化学实验普遍存在实验项目难度偏低、验证性实验偏多、教学方法单一、学生独立思考的空间甚少、学生创新能力培养不够等缺点,无法满足21世纪高校创新型人才培养的需要。因此,无机化学实验改革也迫在眉睫。王利平等[1]通过尝试“以考促练+翻转课堂” 混合式教学模式对大一新生化工类专业的无机化学实验课堂教学进行了探索改革,不仅体现了教学的“输入”,也保证了教学的“输出”。刘艳玲等[2]无论是教学内容、教学目标的设计,还是评价体系的设置,都从不同角度体现了“四个回归”在大一无机化学实验教学中的落实。马艺等[3]从教学内容、考核模式、教学平台、课程思政以及教学总结等方面进行阐述,并通过典型案例“二氧化碳分子量的测定”介绍了各项改革内容如何具体实施。黄微等[4]在通过改进经典实验内容,开设前沿实验项目,加强学科交叉融合,激活学生创新意识和创新能力。
近年来,随着高校化学实验教学改革的不断深入,综合型、设计型和探索型实验得到了很大发展,为创新型人培养发挥了重要作用。然而,大部分的高阶性实验都是材料的制备、表征及应用方面,鲜有涉及到环境保护和资源回收方面的高阶性化学实验。同时,当前不少人对化学在国家发展中的重要作用缺乏正确的认识,通过项目研究的实验形式对社会热点化学问题进行探索,有利于提升化学类学生的专业认同感和学习兴趣。因此,我们设计了《无机废水中有价金属回收再利用的实验设计》这个实验,将无机化学、分析化学和环境化学的知识有机融合到一起,以此实现三个目标:第一,通过本实验的方案设计、实验操作和结果分析,培养学生具备一定的科学研究的能力;第二,培养学生对水溶液中无机离子的定性分析和定量分析的能力,为未来从事水质的无机分析奠定重要基础;第三,通过对水中金属离子的回收和废水的可行性处理,培养学生的环保意识、资源综合利用的理念和创新思维。
1 实验原理
无机阳离子常见的包括Fe3+、Cu2+、Ba2+、Al3+、Co2+、Ni2+、Cr3+、Mn2+、Pb2+等,它们在化学反应性上具有不同的特点,因此可以使用不同的试剂进行分离[5]。常用的分离试剂包括氢氧化钠和氨水,在分离两性离子和非两性离子时,可以加入过量的氢氧化钠溶液,两性离子在碱性条件下以离子的形式存在于溶液中,而非两性的离子则以沉淀的形式存在,因此容易进行分离;有的离子在氨水里以沉淀的形式存在,而有的离子在氨水里以配离子的形式存在,因此也容易分离。在混合离子分离后,就可以对单个的离子采用标志性的反应进行鉴定。
在确定了阳离子的种类后,就可以运用分光光度法或滴定法,对溶液中的阳离子进行定量分析。然后采用合适的沉淀剂,实现混合阳离子的分步沉淀回收再利用。最后对回收后的水质进行阳离子含量的分析,确定其是否达到了排放标准。比如,在pH 值为2~9的溶液中,亚铁离子能与邻菲啰啉生成稳定的红色配合物,其最大吸收波长为508 nm;在pH 值为5~6的溶液中,铅离子可以与显色剂二甲酚橙溶液反应生成稳定的红色螯合物,其最大吸收波长为574 nm;在碱性条件下,Ag NPs-P(纳米颗粒)表面的三聚磷酸根与锰离子直接发生络合,导致Ag NPs-P发生团聚,Ag NPs-P溶液的的颜色由亮黄色逐渐变为灰褐色,可以测试Ag NPs-P溶液在390 nm处的吸光度来检测Mn2+的含量。
2 实验仪器与试剂
2.1 仪 器
离心机、离心试管、电加热套、移液管、容量瓶(50.00 mL)、pH试纸、干燥箱、722型分光光度计。
2.2 试 剂
阳离子未知液(可能含有Mn2+、Fe3+、Pb2+)、NaOH(6 mol·L-1)、3%H2O2、H2SO4(2 mol·L-1)、Na2SO4(1 mol·L-1)、KSCN溶液(0.1 mol·L-1)、HNO3(6 mol·L-1)、HAc(2 mol·L-1)、NaBiO3(s)、K2CrO4(0.1 mol·L-1)、盐酸羟胺(1.5 mol·L-1)、NaAc(1.0 mol·L-1)、标准铁溶液(2.0 mmol·L-1)、0.1 g/L的铅离子标准液、六次甲基四胺缓冲溶液(40 g六次甲基四胺和8.5 mL浓盐酸,定容于100 mL容量瓶中)、1.5 g/L的邻二氮菲、2.0 g/L的二甲酚橙。
3 实验步骤
3.1 阳离子的定性分析
设计实验方案,对可能含有Mn2+、Fe3+、Pb2+的溶液进行阳离子的分离与鉴定。
3.2 阳离子的定量分析
对确认存在的阳离子运用分光光度法或滴定法,进行定量分析。
3.3 阳离子的回收再利用
通过计算,确定混合阳离子分步沉淀所需要的试剂和条件,然后调节溶液到达第一个阳离子全部沉淀。经过滤回收第一个阳离子的沉淀物,继续加入第二种沉淀剂到达第二个阳离子全部沉淀,过滤回收第二个阳离子的沉淀物。将各阳离子的沉淀物经干燥处理后,得到可再次利用的产品。
3.4 水质分析
对阳离子回收后的水质进行分析,确定其阳离子浓度是否达到了废水排放国家标准。
4 结果与讨论
4.1 阳离子的定性分析
首先设计可能含有Mn2+、Fe3+、Pb2+的溶液进行阳离子的分离与鉴定方案,如图1所示。取15滴上述混合离子的溶液,加入20滴6 mol/L的NaOH溶液和10滴3%H2O2溶液,搅拌均匀,然后水浴加热反应数分钟。冷却后离心分离得到沉淀1和清液1。沉淀1经洗涤后加入稀硫酸,然后再次进行离心分离得到沉淀2和清液2。向清液2中加入2~3滴0.1 mol/L的KSCN溶液,溶液变为血红色,表明含有Fe3+。向沉淀2中加入15滴6 mol/L的HNO3溶液和少许NaBiO3粉末(过量),搅拌均匀,然后水浴加热反应数分钟。取出后,静置数分钟,观察到溶液并没有变为紫红色,表明不含有Mn2+。向清液1中加入2 mol/L的HAc至溶液的pH值≈6,然后加入2~3滴0.1 mol/L的K2CrO4溶液,有黄色沉淀析出,表明含有Pb2+。三种离子的鉴定结果如图2所示。

图1 混合阳离子的分离和鉴定方案图Fig.1 Schematic diagram of separation and identification of mixed cations

图2 三种离子的鉴定结果图Fig.2 Identification results of the three ions
4.2 阳离子的定量分析
上述阳离子定性分析结果表明,无机废水中含有Fe3+和Pb2+,下面将对两种离子分别进行定量分析。
4.2.1 Fe3+的定量分析
邻菲啰啉(邻二氮菲)是目前分光光度法测定微量铁含量的较好试剂[6],在 pH 值为2~9的溶液中试剂只与 Fe2+生成稳定的红色配合物。因此本实验中加入邻菲啰啉起显色作用,盐酸羟胺起还原作用,NaAc起调节溶液pH值的作用,主要反应如下:
2Fe3++2NH2OH+2OH-=2Fe2++N2+4H2O
2Fe2++3Phen=[Fe(Phen)3]2+
邻菲啰啉与Fe2+生成稳定的红色配合物的最大吸收波长为508 nm。
(1)取50.00 mL 容量瓶7个,按表1所列的量,用吸量管量取各种溶液加入容量瓶中,加蒸馏水稀释至刻度,摇匀,即配成一系列标准溶液和待测溶液。
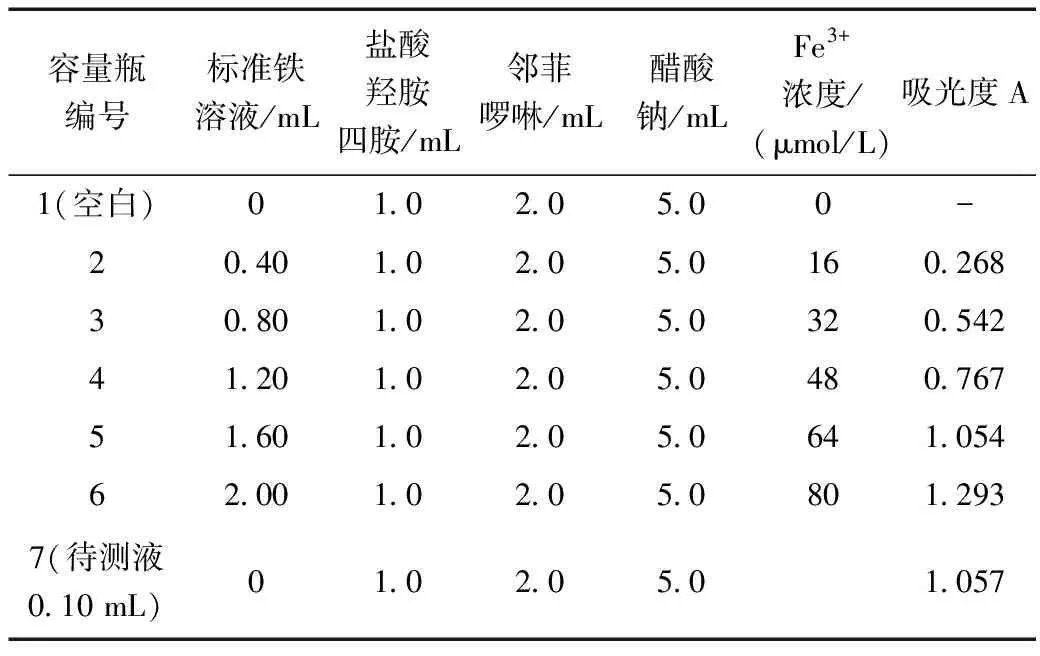
表1 标准溶液和待测液的配置及吸光度测试Table 1 Preparation and adsorption test of the standard solution and experimental solution
(2)按722型分光光度计的使用方法选择波长508nm,用空白溶液调整仪器,由稀至浓测定其吸光度,最后测待测水样的吸光度并填入表 1。
(3)以Fe3+离子的浓度c(μmol/L)为横坐标,以吸光度A为纵坐标绘制标准曲线如图3,溶液吸光度和铁离子浓度的关系式为:y=0.016 01x+0.016 32。
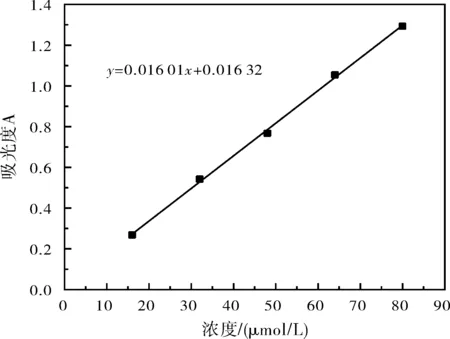
图3 Fe3+离子溶液的标准曲线图Fig.3 Standard curve of Fe3+ ion solution
(4)根据所测得的水样的吸光度,查标准曲线并换算出废水中Fe3+的含量为1 820 mg/L。
4.2.2 Pb2+的定量分析
在pH 值为5~6的溶液中,铅离子可以与显色剂二甲酚橙溶液反应生成稳定的红色螯合物,在574 nm波长下,其吸光度与铅离子的浓度符合朗伯-比尔定律[7],因此可以通过绘制其标准曲线,找出某一吸光度对应的铅离子的浓度。其中加入的二甲酚橙作显色剂,邻二氮菲作掩蔽剂,六次甲基四胺-盐酸溶液作为缓冲溶液调节pH值。
(1)取50.00 mL 容量瓶7个,按表2所列的量,用吸量管量取各种溶液加入容量瓶中,加蒸馏水稀释至刻度,摇匀,即配成一系列标准溶液和待测溶液。
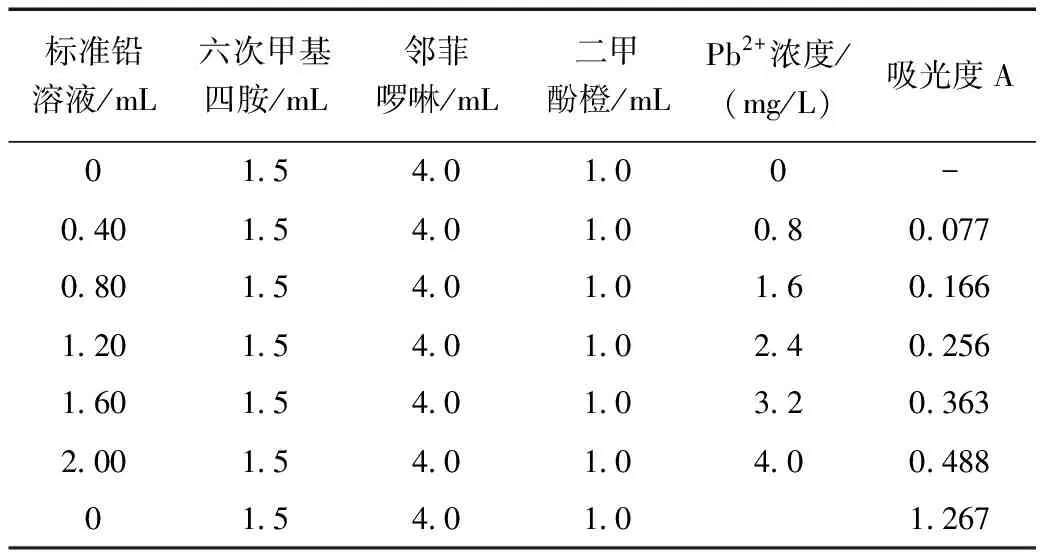
表2 标准溶液和待测液的配置及吸光度测试Table 2 Preparation and adsorption test of the standard solution and experimental solution
(2)按722型分光光度计的使用方法选择波长574 nm,用空白溶液调整仪器,由稀至浓测定其吸光度,最后测待测水样的吸光度并填入表2。
(3)以Pb2+离子的浓度c(mg/L)为横坐标,以吸光度A为纵坐标绘制标准曲线见图4,溶液吸光度和铁离子浓度的关系式为:y=0.127 37x-0.033 9。
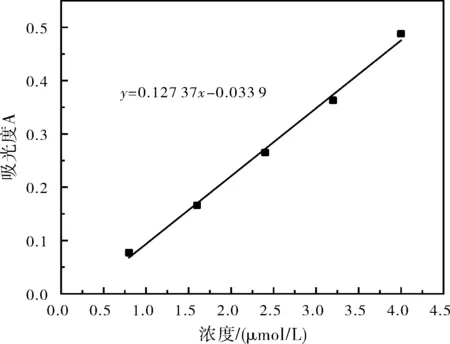
图4 Pb2+离子溶液的标准曲线图Fig.4 Standard curve of Pb2+ ion solution
(4)根据所测得的水样的吸光度,查标准曲线并换算出废水中Pb2+的含量为5 100 mg/L。
定性分析属于无机化学领域,定量分析属于分析化学领域,二者有机结合起来,能够培养学生对水溶液中无机离子的定性分析和定量分析的能力,为未来从事水质的无机分析奠定重要基础。
4.3 阳离子的回收
无机废水中含有Fe3+和Pb2+,二者的浓度分别为0.033 mol/L和0.025 mol/L,而Fe(OH)3的溶度积常数为2.79×10-39,Pb(OH)2的溶度积常数为1.43×10-15,PbSO4的溶度积常数为2.53×10-8[8]。因此,当溶液的pH值大于1.64且小于7.38时,溶液中的铁离子将以Fe(OH)3的形式存在,铅离子不会产生Pb(OH)2;分离后向滤液中加入足够的Na2SO4就可以析出PbSO4。
取无机废水40 mL,加入6 mol/L的NaOH溶液调节溶液的pH值等于6,加热至微沸,冷却静置,经离心分离回收Fe(OH)3。再向滤液中加入1 mol/L的Na2SO4溶液8 mL,经离心分离回收PbSO4。将上述回收得到Fe(OH)3和PbSO4在110 ℃下进行干燥,分别得到Fe2O3(图5)和PbSO4(图6)。产品的XRD结果如图7所示,表明所得产品Fe2O3和PbSO4和理论预测一致[9-10],并且Fe2O3属于典型的γ-Fe2O3晶型。Fe2O3可用于生产油漆、橡胶和玻璃等,PbSO4可用于生产铅蓄电池、颜料、涂料等。

图5 Fe2O3样品Fig.5 The Fe2O3 sample
图6 PbSO4样品Fig.6 The PbSO4 sample
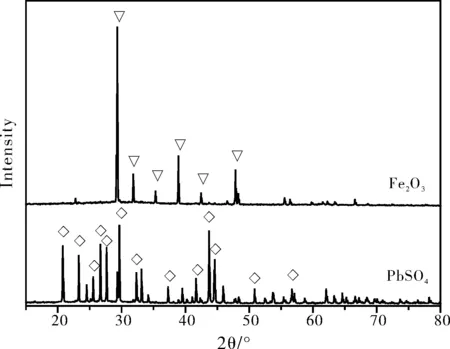
图7 回收产品的XRD图谱Fig.7 XRD spectrum of the recycled products
对上述回收Fe(OH)3和PbSO4后的废水进行Fe3+和Pb2+含量分析,结果表明,Fe3+含量太低无法检测出来,Pb2+含量为1.45 mg/L,接近工业废水的国家排放标准1 mg/L,同时废水的pH值为6。因此,回收后的废水基本上达到了工业废水的国家排放标准。
5 结 语
本实验首先采用无机离子分离与鉴定的方法,确定了无机废水中含有Fe3+和Pb2+。然后采用分光光度法对废水中的Fe3+和Pb2+含量进行定量分析,结果显示Fe3+和Pb2+的浓度分别为0.033 mol/L和0.025 mol/L。接下来加入6 mol/L的NaOH溶液调节溶液的pH值等于6,经离心分离回收Fe(OH)3。再向滤液中加入1 mol/L的Na2SO4溶液8 mL,经离心分离回收PbSO4。最后对回收后的水质进行阳离子含量的分析,结果显示Fe3+含量太低无法检测出来,Pb2+含量为1.45 mg/L,接近工业废水的国家排放标准1 mg/L,同时废水的pH值为6,基本上达到了工业废水的国家排放标准。
将化学实验与学科前沿问题相结合,设计项目研究的实验形式对工业无机废水的可行性处理进行探索,将定性分析、定量分析、回收再利用和水质分析结合到一起,有利于提升学生的学习兴趣,提升学生解决较为复杂的化学问题的综合能力,为创新型人才的培养发挥重要的推动作用。

