大蒜蒜瓣中细菌多样性分析及抑菌剂筛选
包佳亮,杜贺超,李思雨,姚宏亮,蒋加进
(金陵科技学院动物科学与食品工程学院,江苏 南京 210038)
大蒜(Allium sativumL.) 是一种常见的菜肴和调味品,富含蛋白质、磷、钙、铁、镁和硒等微量元素,不仅能提高食欲、增强消化功能,还具有降低血脂、血糖、血压及补脑等作用[1]。大蒜作为常见的调味食材,在火锅等餐饮行业具有很大的需求量。虽然大蒜中含有大蒜素(二烯丙基硫醚),能够起到杀菌消炎的作用,在贮藏的过程中依然会滋生细菌,引起腐败变质。
大蒜的生长、贮藏和深加工过程中都伴随着微生物的生长。谢玉清等人[2]的研究表明,大蒜根腐病与根际土壤真菌群落多样性变化有一定关系。刘春雷等人[3]从糖醋蒜中分离出2 株芽孢杆菌属的菌株,为后续优良菌种的选育提供条件。邱志常[4]从黑蒜加工过程中分离得到的大蒜内生菌主要为芽孢杆菌,包括甲基营养型芽孢杆菌和枯草芽孢杆菌,能够加速黑蒜褐变,促进黑蒜品质的形成。目前,关于大蒜中微生物的报道较少,主要集中在大蒜深加工方面,缺少针对大蒜贮藏过程中微生物分析及葱蒜等调味食材抑菌剂开发等方面的研究。
化学防腐剂生产和使用成本相对较低,并且防腐性能好,是当前食品生产过程中广泛应用的防腐剂类型。我国规定使用的防腐剂有苯甲酸、苯甲酸钠、山梨酸、山梨酸钾、丙酸钙等25 种,并规定了相应的使用范围和添加限量[5]。生物防腐剂因安全、高效等优点在食品行业受到广泛关注。Nisin 在食品中的防腐、保鲜、提质、可降解包材等作用方面已经具有丰富的研究基础[6]。多种新型生物抑菌剂的制备和应用,也吸引研究者的极大兴趣[7]。对不同防腐剂作用机理和应用范围等的深入研究,有利于促进开发出具有市场竞争力的抑菌产品,为食品保鲜拓宽途径。
研究分离纯化大蒜蒜瓣贮藏过程中的微生物,结合菌落形态、菌体形态和PCR 序列比对,分析大蒜蒜瓣中细菌多样性,并通过抑菌圈直径、最小抑菌浓度和最小杀菌浓度,筛选对指示菌有高效抑制作用的抑菌剂,为大蒜蒜瓣的保鲜提供依据。
1 材料与方法
1.1 材料
1.1.1 大蒜
大蒜,江苏一号农场科技股份有限公司提供。
1.1.2 菌种
试验所用菌株,保存于金陵科技学院试验B 楼402 实验室。
1.2 试剂
Luria-Bertani(LB)培养基、Platecountagar (PCA)培养基,北京路桥公司提供;革兰氏染色剂,北京索莱宝公司提供;Tris,国药试剂提供;苯甲酸钠、山梨酸钾、丙酸钠、双乙酸钠、脱氢乙酸,上海麦克林公司提供;无水柠檬酸,源叶生物公司提供;溶菌酶,Solarbio 公司提供;肉桂醛、壳聚糖、纳他霉素、乳酸链球菌素,南京寿德公司提供;2×Taq Master Mix(Dye Plus),南京诺唯赞生物科技有限公司提供;DNA 分子量标准Marker,广州东盛生物科技有限公司提供;引物合成,金唯智生物科技有限公司提供。
1.3 仪器与设备
梯度PCR 基因扩增仪,BIOER LifePro 公司产品;DHG-907385-III 型电热恒温鼓风干燥箱、HPX-160BSH-III 型恒温恒湿箱、SPX-1508SH-II 型生化培养箱,新苗公司产品;BXM-30R 型立式压力蒸汽灭菌锅,上海博讯公司产品;MX-S 型可调式混匀仪,北京大龙实验室产品;雪花制冰机,雪科公司产品;DYY-6C 型稳流稳压电泳仪,南京大学普阳科学仪器研究所产品;H2050R 型台式高速冷冻离心机,湘仪公司产品;BHC-11300IIA/B3 型生物洁净安全柜、ZQLY-300 型振荡培养箱,上海知楚仪器公司产品;BlueStarA 型分光光度计,北京莱伯泰科公司产品。
1.4 试验方法
1.4.1 细菌的分离纯化
将大蒜按照工厂加工流程处理并清洗,室温贮藏5 d 后,取25 g 蒜瓣样品加入到225 mL 生理盐水中混匀,倍比稀释后取10-4,10-5和10-6这3 个梯度的稀释液各1 mL,倾注在PCA 平板中,置于37 ℃恒温培养48 h。观察并记录细菌的菌落形态,挑取不同形态的细菌接种到LB 液体培养基中进行培养。进一步纯化后,用革兰氏染色法观察菌体形态。
1.4.2 PCR 扩增和测序
挑取单菌落到LB 肉汤中,放在温度37 ℃,转速180 r/min摇床上培养制得新鲜的菌液,取1 mL 新鲜菌液,以转速8 000 r/min 离心5 min,弃去上清液,加100 μL 的无菌水,充分混匀后煮沸10 min,以转速8 000 r/min 离心5 min 后,取上清作为模板。PCR 扩增反应体系:2×Taq Master Mix 12.5 μL,引16S rDNA 引物(27F:5'-AGAGTTTGATCCTGGCTCAG-3',1492R:5'-GG-TTACCTTGTTACGACTT-3') 各1 μL,DNA 模板1 μL,ddH2O 补足至25 μL。反应参数:预变性95 ℃,10 min;变性95 ℃,15 s;退火58 ℃,15 s;延伸72 ℃,80 s,循环30 次;于72 ℃末端延伸10 min。
取PCR 产物5 μL,用1×TAE 配置1%琼脂糖凝胶电泳检测,恒压120 V,时间45 min,紫外凝胶成像系统成像,保存图谱。观察所提取DNA 的完整性和浓度,DNA 保存于-20 ℃冰箱待用。PCR 产物送去苏州金唯智生物科技有限公司进行测序。
测序结果在NCBI 的Nucleotide BLAST 中进行比对分析。根据序列同源性,将菌种鉴定到种。
1.4.3 抑菌剂的制备
5 种化学防腐剂(山梨酸钾、苯甲酸钠、丙酸钠、双乙酸钠和脱氢乙酸) 溶于无菌水中,配置成质量浓度为1 024 mg/mL 的母液。纳他霉素溶于无菌水配成质量浓度32 mg/mL 母液,Nisin 溶于0.02 mol/L盐酸配成质量浓度20 mg/mL 的母液,壳聚糖溶于3%的柠檬酸配成质量浓度32 mg/mL 母液,肉桂醛溶于45%酒精配成质量浓度4 mg/mL 母液,溶菌酶溶于无菌水配成质量浓度100 mg/mL。
1.4.4 指示菌的活化
将4 种指示菌(大肠杆菌、金黄色葡萄球菌、土生拉乌尔菌和水生拉恩菌) 菌种在无菌条件下,划线到LB 固体培养基上,置于37 ℃恒温培养箱中培养24 h,从平皿上挑取菌种接种于LB 液体培养基中,置于振荡培养箱(温度37 ℃,转速180 r/min)中过夜培养。将活化好的指示菌接种到LB 液体培养基备用。
1.4.5 抑菌圈的测定[8]
采用琼脂平板打孔法测定不同化学抑菌剂和生物抑菌剂对指示菌的抑菌圈。配制LB 琼脂培养基100 mL,灭菌后温度降至55 ℃左右时,加入1 mL活化的指示菌菌液,倾倒平板,凝固后用5 cm 打孔器打孔,在底部的相应位置做好记号。在孔洞内分别加入60 μL 抑菌溶液,将平皿放置培养箱37 ℃培养24 h,用游标卡尺测量抑菌圈直径并记录。试验重复3 次。抑菌环直径大于7 mm 者,判为有抑菌作用。
1.4.6 最小抑菌浓度(MIC) 与最小杀菌浓度(MBC)的测定
MIC 的测定采用标准稀释法[9]。取新鲜的指示菌菌液,用LB 液体培养基调节OD600至0.6~0.8,稀释100 倍备用。将抑菌剂在无菌条件下进行配液,96 孔板第一孔中加入100 μL 菌悬液和100 μL 相应的抑菌剂,逐级2 倍稀释,得到质量浓度为20.000 0,10.000 0,5.000 0,2.500 0,1.250 0,0.625 0,0.312 5,0.156 3 mg/mL 的Nisin 处理组;质量浓度梯度为32.00,16.00,8.00,4.00,2.00,1.00,0.50,0.25 mg/mL 的纳他霉素处理组;质量浓度梯度为100.000 0,50.000 0,25.000 0,12.500 0,6.250 0,3.125 0,1.563 0,0.781 5 mg/mL 的溶菌酶处理组;质量浓度梯度为32.00,16.00,8.00,4.00,2.00,1.00,0.50,0.25 mg/mL的壳聚糖处理组;质量浓度梯度为4.000 0,2.000 0,1.0000,0.5000,0.2500,0.1250,0.0625,0.0313mg/mL的肉桂醛处理组。山梨酸钾、苯甲酸钠和丙酸钠的最终质量浓度为512, 256,128,64, 32,16,8,4,2,1 mg/mL;双乙酸钠和脱氢乙酸的最终质量浓度为32.000 0,16.000 0,8.000 0,4.000 0,2.000 0,1.000 0,0.500 0,0.250 0,0.125 0,0.062 5 mg/mL。
LB 培养基作为空白对照。培养孔中溶剂(酒精、柠檬酸等) 作为阴性对照,观察其对抑菌剂的抑菌效果有无干扰。孔板周边空白孔可加入蒸馏水,以保持培养过程中水分湿度。96 孔板置于37 ℃恒温培养箱中静置培养24 h 后,观察每组试验结果。培养液澄清透明的最低浓度为MIC。试验重复3 次。
在MIC 的基础上,取澄清组培养液100 μL 均匀涂布于LB 固体培养基中,于37 ℃恒温培养箱中静置培养24 h,观察平板,未长菌的最低浓度为该抑菌剂的MBC。试验重复3 次。
1.4.7 生长曲线的测定
参照唐志凌等人[10]的方法,采用紫外分光光度法测定大肠杆菌、金黄色葡萄球菌、土生拉乌尔菌和水生拉恩菌的生长曲线。将供试菌接种至100 mL 液体培养基中,菌液培养至对数生长期(OD600至0.3~0.5),加入抑菌物质,调至所需抑菌浓度1/2×MIC 处理组和1/4×MIC 处理组,同时设置空白组(不加抑菌剂的LB 肉汤培养基),恒温37 ℃摇床培养24 h,每2 h 取样,测定样品的OD600,记录结果,绘制对应的生长曲线。
1.4.8 菌落总数与大肠菌群数的测定
将大蒜蒜瓣在1×MIC 和2×MIC 的抑菌剂溶液中浸泡5~10 min,取出晾干后取25 g,装入有无菌生理盐水的锥形瓶中,根据GB 4789.2—2016 和GB 4789.3—2016 进行菌落总数和大肠菌群的测定。未经过抑菌剂处理的样品作为空白对照。
2 结果与分析
2.1 细菌多样性分析
2.1.1 不同的菌落形态特征
大蒜蒜瓣中分离到的细菌,按照菌落形态主要可分为以下8 类(表1),其中L1 和L5 占比较大,分别为49%和23%。

表1 8 种菌株的形态学特征
8 种菌株的形态学特征见表1。
2.1.2 PCR 结果分析
从大蒜中分离纯化培养得到的菌株,根据与Marker的对比可知,扩增后的大小为1 500 bp 左右。PCR 测序结果在NCBI 中用Nucleotide BLAST 进行比对。
菌株通过引物PCR 扩增产物的电泳图见图1,菌株的序列比对及鉴定结果见表2。
图1 菌株通过引物PCR 扩增产物的电泳图

表2 菌株的序列比对及鉴定结果
依据16S rRNA 基因序列的同源性分析,大蒜蒜瓣中的细菌有水生拉恩菌、土生拉乌尔菌、表皮葡萄球菌、肠膜明串珠菌、乳酸明串珠菌、苏云金芽孢杆菌、成团泛菌和柠檬酸杆菌。结合菌落形态的比例,大蒜蒜瓣中分离到的主要细菌为水生拉恩菌和土生拉乌尔菌。
2.2 不同防腐剂对指示菌的抑菌效果
2.2.1 抑菌圈直径
选择大蒜蒜瓣中主要菌株土生拉乌尔菌和水生拉恩菌,以及典型革兰氏阳性菌金黄色葡萄球菌和典型革兰氏阴性菌大肠杆菌为指示菌,进行后续抑菌试验。
5 种生物抑制剂对指示菌的抑菌圈直径见表3。
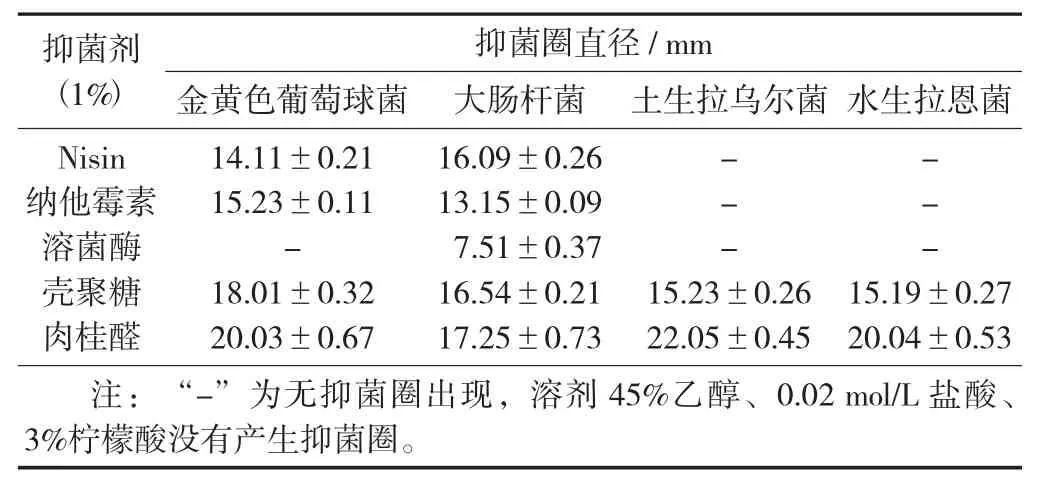
表3 5 种生物抑制剂对指示菌的抑菌圈直径
由表3 可知,质量分数为1%的5 种生物抑菌剂中,肉桂醛对4 种指示菌的作用效果最好,其次是壳聚糖,纳他霉素和Nisin 对金黄色葡萄球菌和大肠杆菌有抑菌效果,对土生拉乌尔菌和水生拉恩菌没有抑菌效果,而溶菌酶只对大肠杆菌有抑菌效果。
选用质量浓度为64 mg/mL 的化学抑菌剂对大肠杆菌、金黄色葡萄球菌、土生拉乌尔菌和水生拉恩菌的抑菌圈直径进行比较。
5 种化学防腐剂对指示菌的抑菌圈直径见表4。

表4 5 种化学防腐剂对指示菌的抑菌圈直径/mm
由表4 可知,5 种化学防腐剂对4 种指示菌均有一定的抑制作用,其中双乙酸钠的抑菌效果最佳,对大蒜中2 种主要细菌的抑菌圈直径都在20 mm 以上。
2.2.2 不同防腐剂对指示菌的MIC 和MBC
5 种生物抑菌剂对指示菌的MIC 和MBC见表5。
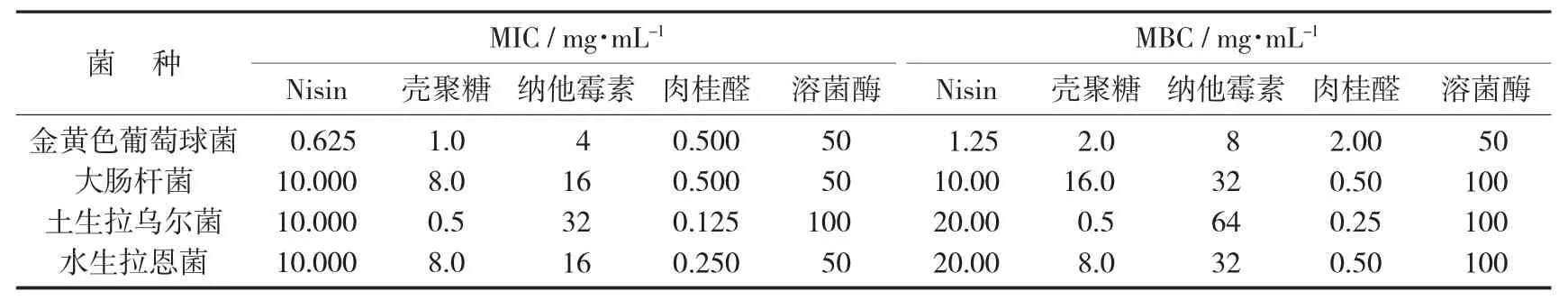
表5 5 种生物抑菌剂对指示菌的MIC 和MBC
从MIC 和MBC 结果来看,5 种生物抑菌剂对指示菌的抑菌效果最好的是肉桂醛,对土生拉乌尔菌和水生拉恩氏菌的MIC 发别为0.125 mg/mL 和0.250 mg/mL;其次是壳聚糖;Nisin 对金黄色葡萄球菌的MIC 值为0.63 mg/mL,MBC 值为1.25 mg/mL,明显小于对大肠杆菌、土生拉乌尔菌和水生拉恩氏菌的MIC 和MBC,可能是Nisin 的抗菌活性主要针对革兰氏阳性菌[11]。
5 种化学防腐剂对指示菌的MIC 和MBC见表6。

表6 5 种化学防腐剂对指示菌的MIC 和MBC /mg·mL-1
双乙酸钠是其中抑菌效果最好的一种防腐剂,对大肠杆菌和金黄色葡萄球菌的MIC 均为8 mg/mL,对土生拉乌尔菌和水生拉恩菌的MIC 均为4 mg/mL。防腐剂的MBC 普遍比MIC 大1 倍。化学防腐剂对几种革兰氏阴性菌的抑菌效果略高金黄色葡萄球菌,这与生物抑菌剂的结果相反,在实际生产中或许可以通过生物抑菌剂和化学防腐剂的联用来相互补充。
2.2.3 肉桂醛对指示菌生长曲线的影响
结合抑菌圈直径和MIC 的测定,发现肉桂醛和双乙酸钠对指示菌的抑菌效果最佳。因此,进一步研究肉桂醛和双乙酸钠对指示菌生长效果的影响。
肉桂醛设置1/2×MIC 处理组、1/4×MIC 处理组和CK 处理组,对4 种指示菌进行生长曲线影响。
肉桂醛作用下4 种指示菌的生长曲线见图2。

图2 肉桂醛作用下4 种指示菌的生长曲线
加入抑菌剂后,金黄色葡萄球菌的对数生长期明显缩短,在4 h 后金黄色葡萄球菌生长便进入稳定期,且对数生长期变化趋势变缓,1/2×MIC 处理组、1/4×MIC 处理组的最终OD600分别为2.573 7,3.741 8,与CK 组最终OD600(7.567 0) 有较大差距,说明肉桂醛对金黄色葡萄球菌的抑制效果明显。大肠杆菌CK 组0~10 h 处于对数期,10 h 后,大肠杆菌生长处于稳定期,向大肠杆菌菌悬液中分别加入肉桂醛后,8 h 后趋于稳定期,并表现出浓度越高,抑制作用越强的规律,OD600的最高值从3.6 下降到2.2。土生拉乌尔菌OD600在8 h 达到3.4 并趋于稳定,1/2×MIC 处理组、1/4×MIC 处理组细菌生长慢于CK 组,添加终浓度为1/2×MIC 肉桂醛的处理组,在12~20 h内生长缓慢,OD600无明显上升;在20~24 h 期间OD600略有上浮仅达到2.0 左右,1/4×MIC 处理组22 h 后OD600继续升高,在24 h 时OD600已接近CK组,达到3.7。CK 组水生拉恩菌大致在6 h 后快速进入稳定期,且在10 h 后快速进入衰亡期,稳定期较短,说明水生拉恩菌的代谢速率快,1/2×MIC 处理组对水生拉恩菌生长有明显的抑制作用,最终OD600仅为0.5 左右。
2.2.4 双乙酸钠对指示菌生长曲线的影响
加入1/4×MIC 和1/8×MIC 终浓度的双乙酸钠,测定对大肠杆菌、金黄色葡萄球菌、土生拉乌尔菌和水生拉恩菌4 种指示菌生长曲线的影响。
双乙酸钠作用下4 种指示菌的生长曲线见图3。
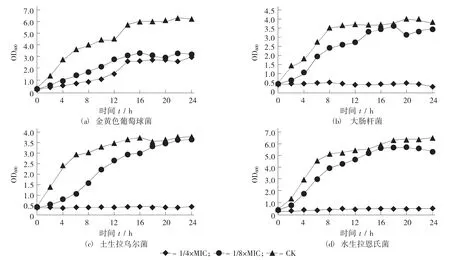
图3 双乙酸钠作用下4 种指示菌的生长曲线
双乙酸钠对3 种革兰氏阴性菌表现出相似的作用,1/4×MIC 的双乙酸钠基本上能够抑制住大肠杆菌、水生拉恩菌和土生拉乌尔菌的继续生长,1/8×MIC 的双乙酸钠在指示菌的生长前期具有一定程度的抑菌效果,随时间的推移,抑菌效果明显减弱,细菌的OD600逐渐接近CK 组。1/4×MIC 的双乙酸钠对金黄色葡萄球菌的抑制效果对3 种革兰氏阴性菌弱,但是1/8×MIC 的双乙酸钠对金黄色葡萄球菌的抑制效果又对3 种革兰氏阴性菌强。
2.3 抑菌剂对大蒜蒜瓣中菌落总数与大肠菌群数的影响
采用1×MIC 肉桂醛、1×MIC 双乙酸钠、1×MIC 肉桂醛+ 1×MIC 双乙酸钠两者组合分别处理大蒜蒜瓣,肉桂醛和双乙酸钠对大蒜中菌落总数的抑菌率达到55.3%和77.8%,对大肠菌群的抑菌率达到66%和100%。两者组合后抑菌率提高到98.4%。
大蒜蒜瓣中菌落总数和大肠菌群的测定见表7。
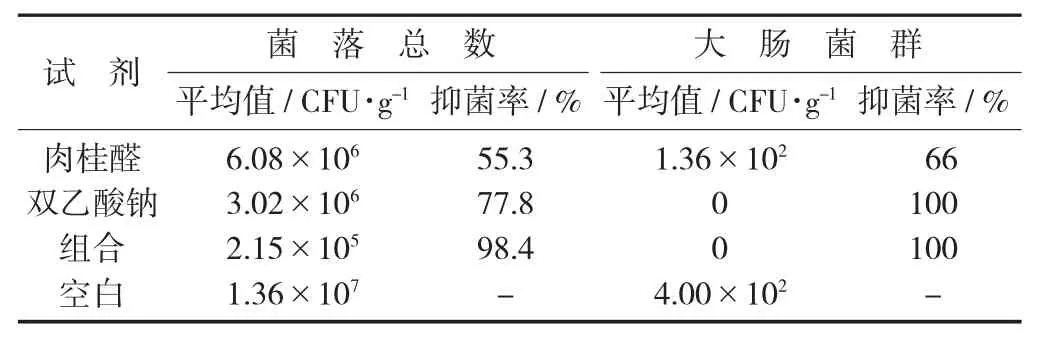
表7 大蒜蒜瓣中菌落总数和大肠菌群的测定
3 结论
结合形态学和分子生物学测定,大蒜蒜瓣中的细菌可分为肠杆菌科(水生拉恩菌、土生拉乌尔菌、成团泛菌、柠檬酸杆菌)、乳酸菌(肠膜明串珠菌、乳酸明串珠菌)、表皮葡萄球菌和苏云金芽孢杆菌。芽孢杆菌在多种蒜制品中被分离出来,可用于大蒜的深加工[3-4]。乳酸菌是大蒜本身含有的益生菌,可为乳酸菌复合发酵大蒜提供思路[12]。肠杆菌科是大蒜中主要的腐败菌和条件致病菌。因此,选择比例较高的水生拉恩菌和土生拉乌尔菌,以及典型的革兰氏阳性菌金黄色葡萄球菌和典型的革兰氏阴性菌大肠杆菌,作为抑菌剂筛选的指示菌。
在所选择的5 种生物抑菌剂中,肉桂醛的对指示菌的抑菌圈直径明显较大,MIC 和MBC 最小,说明抑菌能力最强。肉桂醛抑菌作用具有一定广谱性,对4 种指示菌均具有较好的抑菌作用。5 种化学防腐剂中,双乙酸钠对4 种指示菌的抑菌效果优于其他几种防腐剂,1/4×MIC 浓度的双乙酸钠能够完全抑制大肠杆菌、水生拉恩菌和土生拉乌尔菌的生长。金佳辛等人[13]的研究表明,肉桂醛缓释防腐包与0.3%双乙酸钠有利于传统猪肉干的长期贮藏。防腐剂有各自的特点,在生产中一般联合使用,增强效果。杨洁等人[14]以D -异抗坏血酸钠、乳酸链球菌素、双乙酸钠为防腐剂,添加到大蒜原汁中,探讨防腐剂对大蒜原汁的保鲜技术。用肉桂醛和双乙酸钠复配,对大蒜蒜瓣的抑菌率提高到98.4%,大肠菌群抑菌率为100%。

