微血管内皮细胞来源的外泌体对血管性痴呆模型小鼠脑血管形成及神经损伤的作用研究
林东晓,陈贞君,李华,黄星华
摘要目的:探究微血管內皮细胞来源的外泌体对血管性痴呆(VD)模型小鼠脑血管形及神经损伤修复的影响。方法:采用超高速离心法提取小鼠脑微血管内皮细胞bEnd.3的外泌体,透射电子显微镜(TEM)观察外泌体形态,纳米颗粒追踪分析(NTA)测定外泌体径粒分布情况,蛋白质免疫印迹法(Western Blot)测定外泌体标志蛋白CD63、TSG101、Alix表达;将40只小鼠按照随机数字表法分为假手术(Sham)组、模型(Model)组、外泌体(b-Exo)组、阳性对照(DP)组,每组10只,除假手术组,其余3组小鼠均采用双侧颈总动脉缩窄法构建VD模型,b-Exo组腹腔注射100 μL的b-Exo(100 μg/mL),DP组腹腔注射盐酸多奈哌齐(1 mg/kg),假手术组和模型组腹腔注射等体积生理盐水,每日1次,持续28 d;Morris水迷宫行为学实验分析小鼠学习记忆能力,苏木精-伊红(HE)染色法观察小鼠海马组织病理学变化,免疫荧光染色检测小鼠脑组织血管形成情况,Western Blot检测小鼠海马组织中血管内皮生长因子(VEGF)蛋白表达水平,免疫荧光染色检测小鼠海马组织中神经元特异核蛋白(NeuN)表达,酶联免疫吸附法(ELISA)测定小鼠血清脑损伤相关因子星形胶质源性蛋白(S-100β)与神经元特异性烯醇化酶(NSE)水平。 结果:从bEnd.3细胞分离的颗粒物呈圆形囊泡状,CD63、TSG101及Alix蛋白均高表达,说明该颗粒物为外泌体,记为b-Exo;与假手术组比较,模型组小鼠逃避潜伏期延长,通过目标象限次数和在目标象限停留时间百分比减少,海马CA1区神经元细胞数量减少,出现明显病理学损伤,血管形成减少,VEGF蛋白相对表达量下调,NeuN表达减少,血清S-100β与NSE水平升高,差异均有统计学意义(P<0.05);与模型组比较,b-Exo组和DP组小鼠逃避潜伏期缩短,通过目标象限次数和在目标象限停留时间百分比增加,海马CA1区损伤明显减轻,神经元细胞数量有所增加,血管形成增加,VEGF蛋白相对表达量上调(P<0.05),NeuN表达增加,同时,血清中S-100β与NSE水平降低(P<0.05)。结论:微血管内皮细胞来源的外泌体能明显促进VD小鼠的血管形成,并修复神经损伤,对VD小鼠起到治疗作用。
关键词血管性痴呆;微血管内皮细胞;外泌体;血管形成;神经保护;实验研究
doi:10.12102/j.issn.1672-1349.2024.08.010
Effect of Exosomes Derived from Microvascular Endothelial Cells on Cerebrovascular Formation and Neurological Injury in Vascular Dementia Model
LIN Dongxiao, CHEN Zhenjun, LI Hua, HUANG Xinghua
Cangshan Campus, The 900th Hospital of Joint Logistics Support Force, Fuzhou 350003, Fujian, China
Corresponding AuthorLI Hua, E-mail: lihua476476@126.com
AbstractObjective:To investigate the effects of exosomes derived from microvascular endothelial cells on cerebrovascular formation and nerve injury repair in vascular dementia(VD) model mice.Methods:The exosomes of mouse brain microvascular endothelial cells bEnd.3 were extracted by ultra-high-speed centrifugation method.The morphology of exosomes was observed by transmission electron microscopy(TEM),and the diameter distribution of exosomes was detected by nanoparticle tracking analysis(NTA).The expressions of exosomal marker proteins CD63,TSG101 and Alix were detected by Western Blot.Forty mice were divided into Sham group,Model group,exosome group(b-Exo group) and positive control group(DP group) according to numerical random table method,with 10 mice in each group.Except for sham group,the VD model of the other 3 groups was constructed by bilateral common carotid artery constriction method,b-Exo group was intraperitoneally injected with 100 μL b-Exo(100 μg/mL),DP group was intraperitoneally injected with Donepezil hydrochloride(1 mg/kg),sham group and model group were intraperitoneally injected with equal volume normal saline,once a day,for 28 days.Morris water maze behavior experiment was used to analyze the learning and memory ability of mice,hematoxylin-eosin(HE) staining was used to observe the histopathological changes of mice′s hippocampus,immunofluorescence staining was used to detect the formation of blood vessels in mouse brain tissue,and Western Blot was used to detect the expression level of vascular endothelial growth factor(VEGF) protein in mouse hippocampus.The expression of neuron-specific nucleoprotein(NeuN) in the hippocampus of mice was detected by immunofluorescence staining,and the levels of astroglia-derived protein(S-100β) and neuron-specific enolase(NSE) in serum of mice were detected by enzyme-linked immunosorbent assay(ELISA).Results:The particles isolated from bEnd.3 cells showed a round vesicular shape,and CD63,TSG101 and Alix proteins were highly expressed,indicating that the particles were exosomes,denoted b-Exo.Compared with the sham group,the escape latency of mice in the model group prolonged,the number of passing the target quadrant and the percentage of residence time in the target quadrant were reduced,the number of neurons in hippocampal CA1 region reduced,there was obvious pathological injury,angiogenesis was reduced,the relative expression of VEGF protein down-regulated,and the expression of NeuN reduced.Serum levels of S-100β and NSE increased(P<0.05).Compared with the model group,the escape latency of mice in the b-Exo group and DP group shortened,the number of passing the target quadrant and the percentage of residence time in the target quadrant increased,the damage in hippocampal CA1 region significantly reduced,the number of neuron cells increased,the formation of blood vessels increased,the relative expression of VEGF protein up-regulated,and the expression of NeuN was increased.Serum levels of S-100β and NSE decreased(P<0.05).Conclusion:Exosomes derived from microvascular endothelial cells could significantly promote angiogenesis and repair neurological injury in VD mice,and play some therapeutic role in VD mice.
Keywordsvascular dementia; microvascular endothelial cells; exosomes; angiogenesis; neuroprotection; experimental study
血管性痴呆(vascular dementia,VD)是一种获得性智力损害综合征,也是继阿尔茨海默病之后第二大常见的痴呆病因,约占痴呆病例的20%[1],主要由于长期暴露于脑缺血、缺氧损伤、脑动脉硬化等各种脑血管疾病中而引起[2]。VD持续发展会对病人的认知功能、情绪以及记忆进一步产生负面影响。近年来,随着人口老龄化进程的加快,脑血管疾病的发病率不断上升,VD的发病率也在不断上升,且该疾病发病机制复杂,目前临床上治疗VD的方法却十分有限[3]。因此,探讨VD的发病机制并寻找新型潜在疗法意义重大。
外泌体是由各种细胞分泌的直径为30~150 nm 的小膜包被的细胞外囊泡,其包含各种分子成分,包括来自母体细胞的蛋白质和RNA,并且可以充当桥接细胞间通讯的介质[4]。越来越多的证据表明,中枢神经系统中的细胞外泌体可以通过改善血管生成、减少细胞凋亡和抑制炎症等途径为多种脑血管疾病的治疗提供新方法[5-6]。例如,神经干细胞来源的外泌体可以改善神经功能损伤,减少脑卒中后的脑水肿[7];星形胶质细胞来源的外泌体抑制神经元凋亡和胶质瘢痕形成,起到改善神经功能及脑损伤的作用[8]。然而,关于脑微血管内皮细胞中外泌体的特征以及其介导的内皮细胞与脑内其他细胞之间信号传递的作用报道却很少。有研究指出,小鼠微血管内皮细胞bEnd.3来源的外泌体能够促进神经干细胞的增殖,这对脑缺血损伤后神经与血管修复起到关键作用[9]。但脑微血管内皮细胞来源的外泌体能否在VD中发挥作用仍缺少研究。本研究通过构建VD小鼠模型,给予bEnd.3来源的外泌体干预后,通过检测动物行为学、脑血管形成以及神经损伤等相关指标,以观察bEnd.3来源的外泌体对VD小鼠的治疗效果,现报道如下。
1材料与方法
1.1实验动物
40只无特定病原体(SPF)级健康C57BL/6J小鼠,雄性,8~10周龄,体质量25~30 g,由福州海王福药制药有限公司[生产许可证号:SCXK(闽)2020-0001]提供,并通过了中国人民解放军联勤保障部队第九OO医院伦理委员会批准。所有小鼠均饲养于标准动物房内,室温为20~25 ℃,相对湿度为40%~60%,自动控制光照/黑暗12 h交替,实验期间自由取食与饮水。
1.2主要材料与试剂
小鼠脑微血管内皮细胞bEnd.3购自广州博辉生物科技公司,盐酸多奈哌齐购自美国Selleck公司,外泌体提取试剂盒购自武汉华美生物工程有限公司,醋酸双氧乙铀购自上海吉至生化科技公司,RIPA裂解液、二喹啉甲酸法(BCA)检测试剂盒、聚偏二氟乙烯(PVDF)膜及增强型化学发光(ECL)显色液购自上海碧云天生物研究所,二脒基苯基吲哚(DAPI)染液和苏木精-伊红(HE)染色试剂盒购自北京中衫金桥生物公司,星形胶质源性蛋白(S-100β)检测试剂盒与神经元特异性烯醇化酶(NSE)检测试剂盒购自上海仁捷生物科技公司,兔抗人CD63多克隆抗体、兔抗鼠TSG101单克隆抗体、兔抗鼠Alix单克隆抗体、兔抗人CD31多克隆抗体、兔抗人NeuN单克隆抗体、兔抗人血管内皮生长因子(VEGF)多克隆抗体、兔抗人甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体、辣根过氧化物酶标记的山羊抗兔IgG抗体及Alexa Fluor 488标记的山羊抗兔IgG抗体均购自英国Abcam公司。
1.3实验方法
1.3.1脑血管内皮细胞外泌体的提取与鉴定
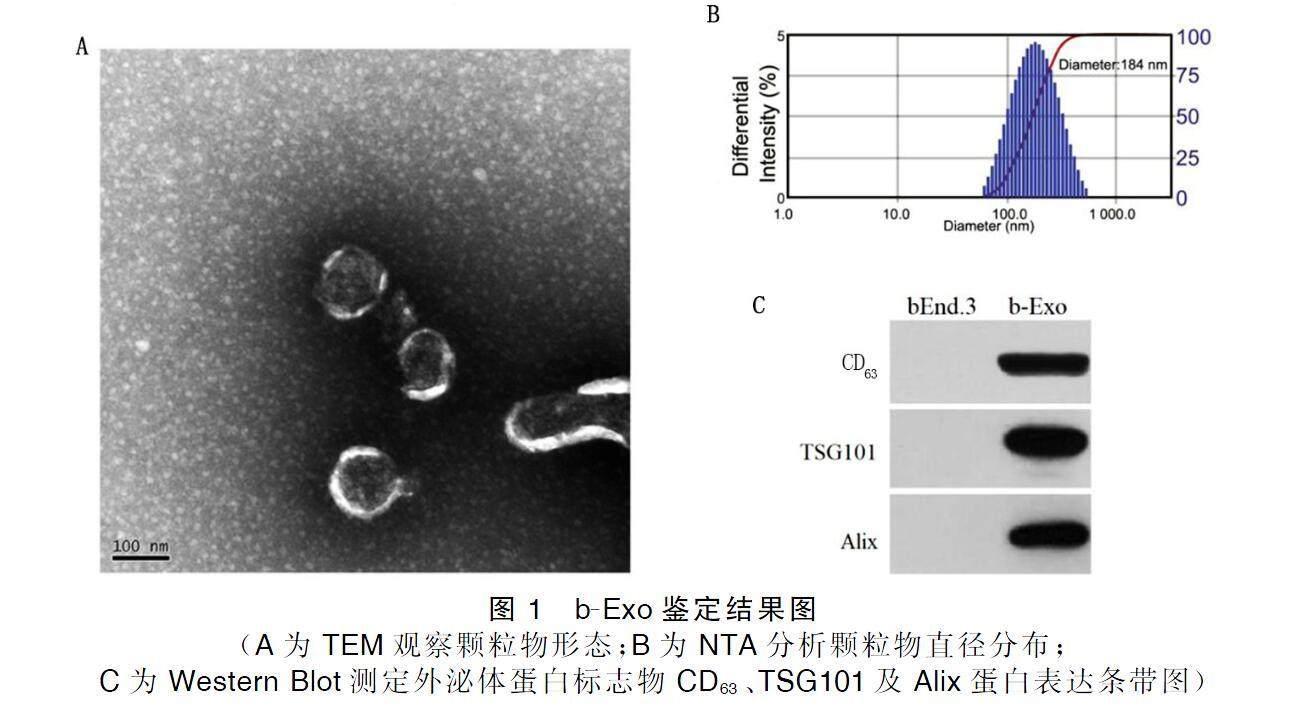
1)提取:采用超高速离心法提取bEnd.3细胞的外泌体,收集细胞条件培养基,以1 000 r/min低温4 ℃离心5 min,取上清转移至干净离心管。以3 000 r/min低温4 ℃离心15 min,取上清转移至干净离心管。所得上清以10 000 r/min低温4 ℃离心60 min。将获得的上清液分装于超高速离心管,以28 000 r/min低温4 ℃離心80 min,弃掉上清,留沉淀,用无菌磷酸缓冲盐溶液(PBS)级清洗沉淀后重悬,得到bEnd.3细胞来源的外泌体,记为b-Exo。2)鉴定:利用透射电子显微镜(transmission electron microscope,TEM)观察外泌体形态,将10 μL外泌体悬液滴入铜网,待其沉淀2 min,2%醋酸双氧乙铀液复染,清洗后滤纸吸水,室温干燥,在TEM上成像,观察外泌体形态并采集图像,纳米颗粒追踪分析(nanoparticle tracking analysis,NTA)测定外泌体径粒分布情况。
1.3.2蛋白质免疫印迹法(Western Blot)测定外泌体蛋白标志物表达
取外泌体或细胞,加入RIPA裂解液放于冰上裂解,提取总蛋白,BCA法测定蛋白浓度。制备10%为十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),待其完全凝固后,固定电泳装置,将等量蛋白样品加入凝胶孔,进行电泳分离,电转至PVDF膜。将膜浸入5%脱脂奶粉室温封闭2 h,TBST漂洗,加入稀释的一抗(1∶1 000),4 ℃孵育;次日,TBST漂洗,加入对应稀释的二抗(1∶5 000),室温孵育1 h, TBST再次漂洗。加入ECL显色,凝胶成像系统扫描拍照,观察外泌体表面标记蛋白CD63、TSG101、Aix表达。以GAPDH作为内参蛋白,Image-pro Plus软件分析蛋白表达条带灰度值。
1.3.3VD小鼠模型构建与分组给药
将40只小鼠按照随机数字表法分为4组,包括假手术组、模型组、外泌体(b-Exo)组、阳性对照(DP)组,每组10只。除假手术组外,其余3组小鼠均制备VD模型,参考文献[10]方法进行,利用10%水合氯醛腹腔注射麻醉小鼠,将其四肢固定在动物手术台上,备皮、消毒,以镊子钝性分离颈部组织和迷走神经,暴露两侧颈总动脉,利用动脉夹夹闭双侧颈总动脉20 min后再灌注10 min,重复该操作3次。假手术组小鼠仅分离颈部组织和迷走神经,术后缝合切口,并消毒,将小鼠放入保暖箱中,单笼饲养,流质饮食,注意观察生命体征。术后第1天即用药,b-Exo组小鼠腹腔注射100 μL的b-Exo(100 μg/mL),DP组小鼠腹腔注射盐酸多奈哌齐(1 mg/kg),假手术组和模型组小鼠腹腔注射等体积生理盐水,每日1次,持续28 d。
1.3.4Morris水迷宫行为学实验
给药结束后,检测各组小鼠空间记忆能力,对小鼠进行5 d的Morris水迷宫训练,然后进行测试。1)定位航行试验:将第1象限作为小鼠入点处,记录小鼠在60 s内寻找并达到平台的时间,即逃避潜伏期,若未能到达,则将其引导至平台停留30 s,记录逃避潜伏期平均值。2)空间探索试验:训练后撤去平台,在第1 象限入点处,将小鼠面向池壁放入水中,记录小鼠在60 s内通过目标象限的次数以及其在原平台象限停留时间。
1.3.5HE染色法
处死各组小鼠,无菌环境下解剖获得海马组织,将标本清洗干净,4%多聚甲醛常规固定,脱水至透明,浸蜡包埋,制备石蜡切片,厚度为5 μm。切片再脱蜡,并进行水化,加入苏木素染色5 min,自来水冲洗,盐酸乙醇分化,再次清洗,加入伊红染色2 min,常规脱水与透明,室温干燥,封片,光学显微镜下观察海马组织学变化。
1.3.6免疫荧光染色
取制备的各组小鼠海马组织切片,脱蜡水化,PBS洗涤,浸于抗原修复液中,置于微波炉高温煮沸进行抗原修复,取出室温冷却后,磷酸缓冲盐溶液(PBS)洗涤,在切片上滴加山羊血清封闭液,室温震荡10 min。分别滴加稀释的兔抗大鼠CD31(1∶200)、NeuN(1∶200)多克隆抗体,4 ℃孵育,次日,PBS洗涤,滴加稀释的Alexa Fluor 488标记的山羊抗兔IgG抗体(1∶500),室温避光孵育1 h,PBS再次洗涤,滴加DAPI工作液,室温避光孵育15 min,洗涤切片,常规脱水与透明,抗荧光淬灭封片剂封片,荧光显微镜下观察组织染色情况并采集图像。
1.3.7酶联免疫吸附法(ELISA)测定
给药结束后,对各组小鼠进行眼球取血,室温静置2 h后,2 000 r/min常温离心15 min,取上清并保存于-80 ℃冰箱备用。采用ELISA测定血清S-100β与NSE含量,严格按照各试剂盒说明书操作,运用酶标仪读数。
1.4统计学处理
实验数据应用SPSS 23.0统计软件进行分析,符合正态分布的定量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;GraphPad Prism 8.30绘制结果统计图。以P<0.05 为差异有统计学意义。
2结果
2.1b-Exo鉴定结果
在TEM下观察到分离的颗粒物呈圆形囊泡状,具有经典的“茶托”样形状,直径为184 nm,并且包含外泌体标志蛋白CD63、TSG101及Alix,且均呈高表达,以上结果证明所分离到的沉淀颗粒物为外泌体,记为b-Exo。详见图1。
2.2b-Exo对VD小鼠行为学的影响
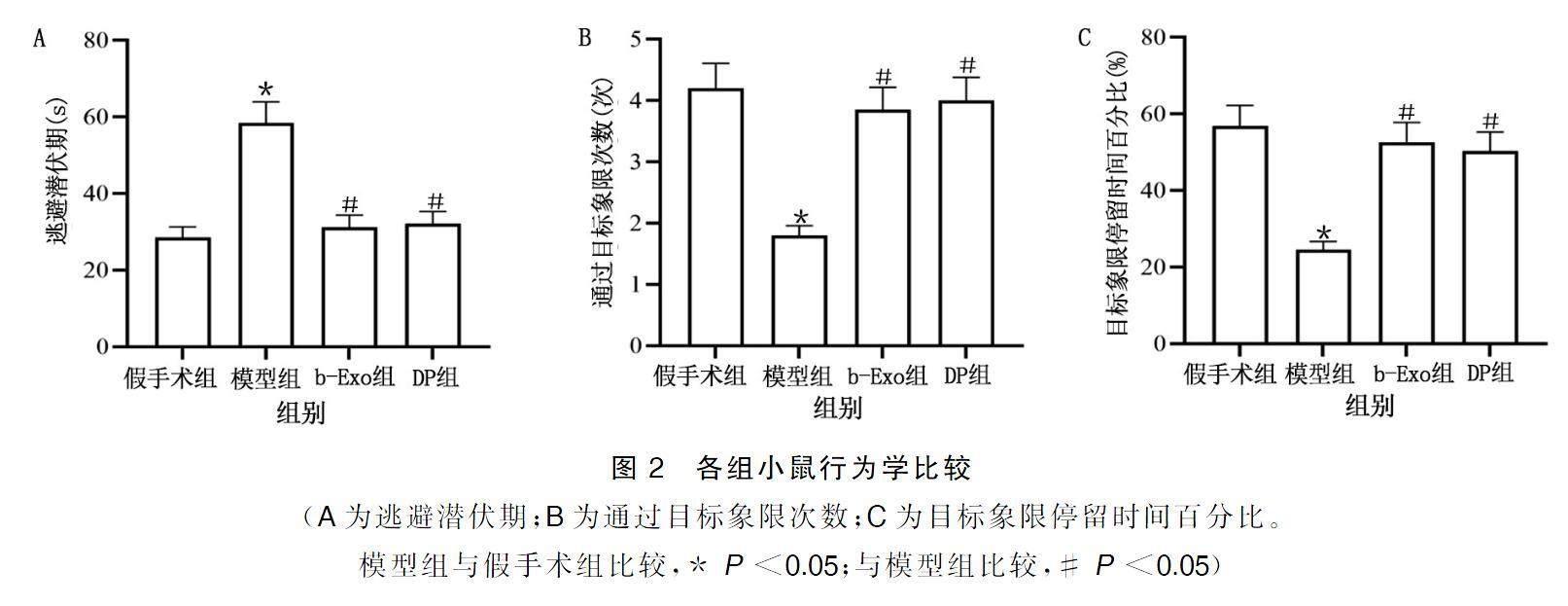
Morris水迷宫测定结果显示,与假手术组比较,模型组小鼠逃避潜伏期延长(P<0.05),通过目标象限次数和在目标象限停留时间百分比显著减少(P<0.05);与模型组比较,b-Exo组和DP组小鼠逃避潜伏期则缩短(P<0.05),通过目标象限次数和在目标象限停留时间百分比也均增加(P<0.05)。详见图2。
2.3b-Exo对VD小鼠海马区病理组织学的影响
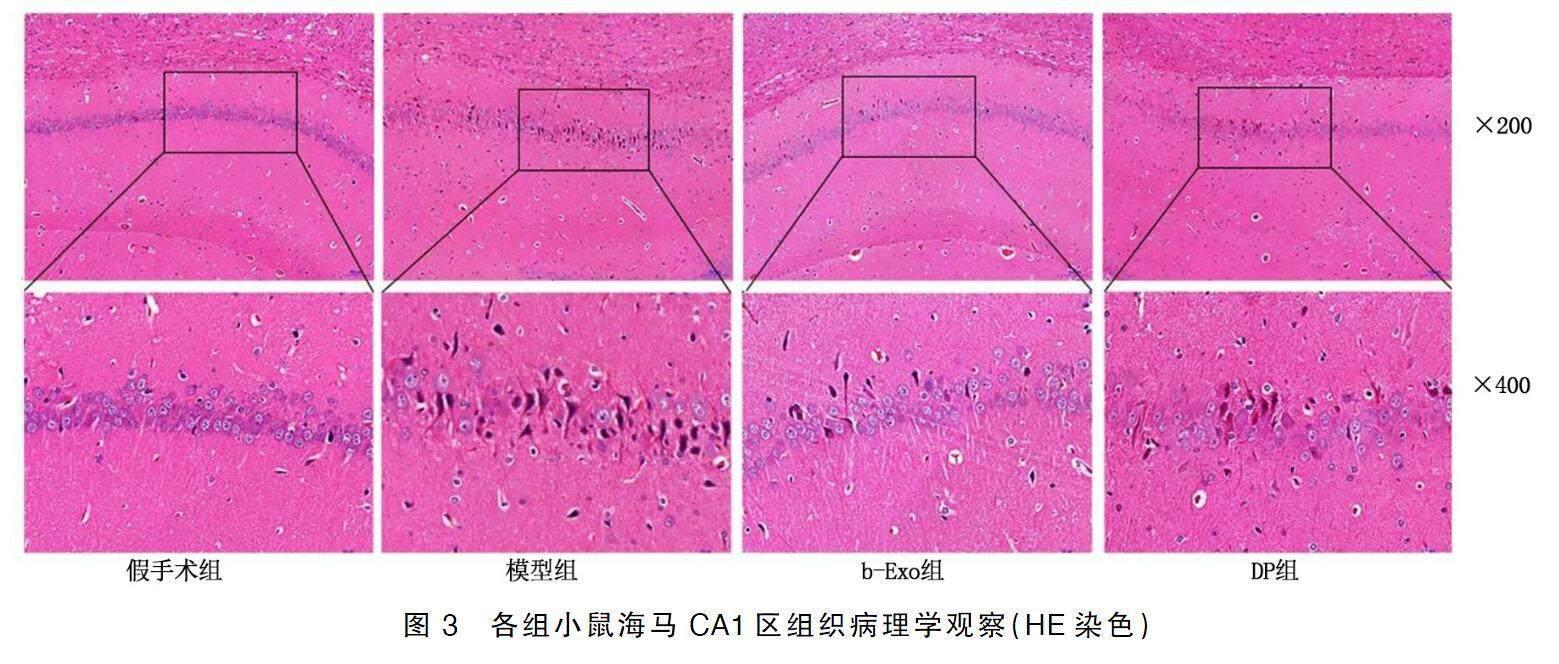
HE染色观察到假手术组小鼠海马CA1区结构清晰,海马神经元排列整齐,未见损伤;与假手术组比较,模型组海马CA1区神经元细胞数量减少,排列紊乱,部分出现坏死、核固缩的现象,结构不清晰;相较于模型组,b-Exo组和DP组海马CA1区病理损伤明显减轻,海马神经元排列较为整齐,数量也明顯增加。详见图3。
2.4b-Exo对VD小鼠海马区血管形成的影响
通过免疫荧光染色观察各组小鼠海马组织血管形成情况,绿色荧光为血管形成标志物CD31表达。相较于假手术组,模型组海马组织CD31的荧光强度明显减弱,说明血管形成减少;b-Exo组和DP组海马组织CD31的荧光强度则明显要强于模型组,说明血管形成增加。详见图4。
2.5b-Exo对VD小鼠海马区NeuN表达的影响
经免疫荧光染色观察各组小鼠海马组织NeuN表达,与假手术组比较,模型组海马组织NeuN的荧光强度明显减弱,说明NeuN表达减少;与模型组比较,b-Exo组和DP组海马组织NeuN的荧光强度明显增加,说明NeuN表达增加。详见图5。
2.6b-Exo对VD小鼠海马区VEGF表达的影响
Western Blot检测结果显示,模型组海马组织中VEGF蛋白相对表达量低于假手术组(P<0.05),而b-Exo组和DP组海马组织中VEGF蛋白相对表达量均高于模型组(P<0.05)。详见图6。
2.7b-Exo对VD小鼠血清S-100β与NSE水平的影响
ELISA测定结果显示,与假手术组比较,模型组小鼠血清S-100β与NSE水平显著升高(P<0.05);与模型组比较,b-Exo组和DP组小鼠血清S-100β、NSE水平显著降低(P<0.05)。详见图7。
3讨论
VD是随着年龄的增长而发展的常见疾病之一,由于其发生发展与心脑血管疾病密切相关,VD病人的平均生存时间仅为3~5年[11]。脑卒中、动脉粥样硬化、糖尿病、肥胖和高血压是VD的常见危险因素,这些疾病使身体处于慢性炎症状态下,从而使皮层下血管功能恶化,引起神经炎症,进而导致弥漫性白质病变,最终导致痴呆[2]。与其他神经退行性疾病相比,VD病人的认知障碍更加多变,除了以痴呆为主要临床表现外,还伴有意识浑浊、哭泣或爆发性大笑,部分病人还会出现淡漠、抑郁或偏执等人格改变。这些症状不仅会降低病人的生活质量,还会给病人家属带来巨大痛苦,并给社会经济带来沉重负担。
细胞间通讯有多种类型,外泌体是其中的重要形式之一。来自中枢神经系统的外泌体存在于脑脊液和外周体液中,其含量会随着疾病的发生而改变。由于外泌体可以穿透血脑屏障并且在外周循环中高度稳定,因此,其不仅是生理和病理状态下理想的生物标志物,也是药物递送载体[12]。大量研究表明,中枢神经系统中许多类型的细胞都能够分泌外泌体,包括少突胶质细胞、神经元、星形胶质细胞以及内皮细胞等,这些外泌体可以启动并参与调节神经系统炎症反应,改善神经损伤和神经源性定位,对一些神经系统疾病的治疗具有潜在意义。例如,少突胶质细胞来源的外泌体通过改善代谢状态和促进营养剥夺神经元的轴突运输来维持神经元活性[13];神经元来源的外泌体通过抑制小胶质细胞和星形胶质细胞的活化来促进神经功能行为的恢复,在小鼠脊髓损伤中发挥保护作用[14];星形胶质细胞来源的外泌体通过调节自噬抑制神经元凋亡,从而改善实验性缺血性脑卒中小鼠的神经功能[15]。血管内皮细胞是血脑屏障的重要组成部分,对于维持正常脑内环境与形态结构具有重要作用。目前,关于微血管内皮细胞来源的外泌体的作用研究报道也逐渐增多。崔永志等[16]研究表明脑微血管内皮细胞bEnd.3来源的外泌体能够促进骨髓间充质干细胞的成骨分化,这对骨再生和骨质疏松症的无细胞治疗提供了思路;Gao等[17]研究指出脑微血管内皮细胞bEnd.3来源的外泌体能够促进大脑动脉闭塞/再灌注模型大鼠的运动功能恢复,并对于缺血性脑损伤中突触功能的重建至关重要。本研究结果显示,经过脑微血管内皮细胞bEnd.3来源的外泌体作用的VD小鼠表现为逃避潜伏期缩短,通过目标象限次数和在目标象限停留时间百分比均增加,结合病理学结果观察到海马CA1区病理损伤明显减轻,且神经元数目增加。由此说明,脑微血管内皮细胞bEnd.3来源的外泌体能够对VD小鼠起到较好的治疗作用。
在VD中脑缺血会导致局部毛细血管和神经元受损,最终导致神经功能损伤。因此,立即恢复脑缺血区的血液供应对于神经功能的恢复至关重要。而脑缺血区血流的恢复取决于侧支循环的建立和毛细血管的形成,因此,促进脑血管形成可能是治疗VD的有效策略之一[18]。VEGF属于一种内皮细胞特异性有丝分裂原和趋化因子,通过与其受体(VEGFR)结合促进内皮细胞增殖、存活、血管生成以及突触的形成和成熟[19]。本研究结果显示,经过脑微血管内皮细胞bEnd.3来源的外泌体作用的VD小鼠海马组织内血管形成标志蛋白CD31的荧光强度明显增加,VEGF蛋白相对表达量也表现为上调,提示脑微血管内皮细胞bEnd.3来源的外泌体能够促进VD小鼠脑血管形成,从而改善脑损伤。
本研究结果还显示,VD模型小鼠海马组织内NeuN表达减少,血清中S-100β与NSE水平均升高。NeuN存在于多种神经细胞中,是成熟神经元的标志物,其表达减少表示神经元发生损伤或死亡,这一现象常出现在包括VD在内的脑血管疾病中,促进其表达能够减轻或缓解疾病的发生发展[20]。S-100β与NSE为2种重要的反映脑损伤程度的细胞因子,现已被用作VD中神经损伤的生物标志物[21]。在本研究中,经过脑微血管内皮细胞bEnd.3来源的外泌体作用的VD小鼠海马组织内NeuN表达增加,而血清中S-100β与NSE水平均降低,由此推测,脑微血管内皮细胞bEnd.3来源的外泌体能够通过提高海马组织NeuN表达并抑制血清S-100β、NSE水平来减轻VD小鼠的神经损伤,发挥神经保护作用。
4小结
综上所述,脑微血管内皮细胞bEnd.3来源的外泌体可以改善VD小鼠行为学,促进脑血管生成,并减轻神经损伤,较为全面检测了脑微血管内皮细胞bEnd.3来源的外泌体对VD小鼠的改善效果。从分子生物学层面表明,脑微血管内皮细胞bEnd.3来源的外泌体能够促进VD小鼠海马组织CD31、VEGF及NeuN表达,并抑制血清S-100β与NSE水平,从而发挥治疗作用。
参考文献:
[1]AKHTER F,PERSAUD A,ZAOKARI Y,et al.Vascular dementia and underlying sex differences[J].Front Aging Neurosci,2021,13:720715.
[2]KALARIA R N.The pathology and pathophysiology of vascular dementia[J].Neuropharmacology,2018,134(Pt B):226-239.
[3]BIR S C,KHAN M W,JAVALKAR V,et al.Emerging concepts in vascular dementia:a review[J].J Stroke Cerebrovasc Dis,2021,30(8):105864.
[4]KALLURI R V,LEBLEU V S.The biology,function,and biomedical applications of exosomes[J].Science,2020,367(6478):eaau6977.
[5]LIZARRAGA-VALDERRAMA L R,SHERIDAN G K.Extracellular vesicles and intercellular communication in the central nervous system[J].FEBS Lett,2021,595(10):1391-1410.
[6]GAO Y N,MA H,LV C Y,et al.Exosomes and exosomal microRNA in non-targeted radiation bystander and abscopal effects in the central nervous system[J].Cancer Letters,2021,499:73-84.
[7]ZHANG Z G,BULLER B,CHOPP M.Exosomes-beyond stem cells for restorative therapy in stroke and neurological injury[J].Nat Rev Neurol,2019,15(4):193-203.
[8]UPADHYA R,ZINGG W,SHETTY S,et al.Astrocyte-derived extracellular vesicles:neuroreparative properties and role in the pathogenesis of neurodegenerative disorders[J].Journal of Controlled Release,2020,323:225-239.
[9]周少婷,趙静.内皮细胞外泌体对神经干细胞活力的影响研究[J].老年医学与保健,2018,24(4):420-422;430.
[10]刘伟,胡鹏,冯波.血管性痴呆大鼠模型的研究进展[J].中国实验动物学报,2019,27(6):805-809.
[11]于骄洋,王鑫淼,王明阳,等.血管性痴呆发病机制与中西医治疗研究概况[J].辽宁中医药大学学报,2022,24(2):71-75.
[12]LIANG Y,DUAN L,LU J,et al.Engineering exosomes for targeted drug delivery[J].Theranostics,2021,11(7):3183-3195.
[13]FRHBEIS C,KUO-ELSNER W P,MLLER C,et al.Oligodendrocytes support axonal transport and maintenance via exosome secretion[J].PLoS Biol,2020,18(12):e3000621.
[14]JIANG D D,GONG F Y,GE X H,et al.Neuron-derived exosomes-transmitted miR-124-3p protect traumatically injured spinal cord by suppressing the activation of neurotoxic microglia and astrocytes[J].Journal of Nanobiotechnology,2020,18(1):105.
[15]PEI X,LI Y,ZHU L,et al.Astrocyte-derived exosomes suppress autophagy and ameliorate neuronal damage in experimental ischemic stroke[J].Exp Cell Res,2019,382(2):111474.
[16]崔永志,刘平,梁涛,等.bEnd.3细胞来源外泌体促成骨效应的体外研究[J].中华实验外科杂志,2021,38(3):507-510.
[17]GAO B,ZHOU S,SUN C,et al.Brain endothelial cell-derived exosomes induce neuroplasticity in rats with ischemia/reperfusion injury[J].ACS Chem Neurosci,2020,11(15):2201-2213.
[18]SALEHI A,ZHANG J H,OBENAUS A.Response of the cerebral vasculature following traumatic brain injury[J].J Cereb Blood Flow Metab,2017,37(7):2320-2339.
[19]ZHANG L,LIU X,LI T,et al.Fluoxetine may enhance VEGF,BDNF and cognition in patients with vascular cognitive impairment no dementia:an open-label randomized clinical study[J].Neuropsychiatric Disease and Treatment,2021,17:3819-3825.
[20]DUAN W,ZHANG Y P,HOU Z,et al.Novel insights into NeuN:from neuronal marker to splicing regulator[J].Mol Neurobiol,2016,53(3):1637-1647.
[21]FRIIS T,WIKSTRM A K,ACURIO J,et al.Cerebral biomarkers and blood-brain barrier integrity in preeclampsia[J].Cells,2022,11(5):789.
(收稿日期:2022-09-29)
(本文編辑王雅洁)

