针刀干预对膝骨关节炎模型兔膝关节软骨应力变化的影响
杜 玫 邢龙飞 胡庭尧 朱文婷 马薇薇 郭长青
(北京中医药大学,北京,100029)
膝骨关节炎(Knee Osteoarthritis,KOA)是以膝关节疼痛、活动受限、肿胀、僵硬等为主要临床症状的骨关节疾病[1]。关节软骨是维持膝关节功能的重要因素,其正常的力学环境对维持关节的稳定性具有重要意义[2]。KOA发病机制复杂,生物力学因素是诱发KOA及其形成过程中的关键因素,膝关节力学的失衡导致局部关节软骨承受的应力异常,加剧软骨的磨损、疼痛,导致软骨退变诱发KOA[3]。在此过程中,软骨的化学成分、结构以及其他力学特征都发生显著变化,使得其液体承载能力和纤维的抗拉伸能力受到严重削弱,从而引起软骨变形、细胞凋亡以及纤维衰减[4-5]。由于关节软骨出现破坏,滑膜细胞、软骨细胞产生的炎症介质作用于神经元,引发疼痛[6]。研究表明,白细胞介素-1β(Interleukin-1β,IL-1β)和肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)在膝关节骨性关节炎疾病的发生发展中起着关键作用,作为炎症介质二者协同激活炎症信号通路后迅速传递信号,导致大量相关基因表达,增加炎症介质、趋化因子、黏附因子以及酶分泌,加重关节炎症和疼痛,导致关节软骨破坏程度加剧,加速KOA进程,最终对关节的功能产生不利影响[7]。因此,恢复膝关节软骨正常应力、抑制炎症介质释放是延缓软骨退变从而治疗KOA的有效方法。
前期研究已证实,针刀“调筋”可有效调节肌肉-肌腱力学特性进而恢复关节良性应力环境,改善软骨组织合成和分解以缓解软骨退变,发挥针刀“治骨”的作用[8]。但针刀对膝关节软骨力学方面以及滑膜液炎症介质的直接影响尚不清楚。本研究意在通过观察针刀干预后膝关节、关节软骨应力变化、软骨形态学变化及炎症介质表达的变化,分析针刀干预对软骨受力、退变的影响,进一步探讨针刀治疗KOA的作用机制。
1 材料与方法
1.1 材料
1.1.1 动物 健康24周龄的清洁级新西兰雄性兔28只,体质量2.0~2.5 kg,分笼饲养,室温保持(20±2)℃,湿度为40%~60%,自然光线充足照射,标准饮食供给,自由摄食饮水,实验室定期进行紫外线消毒。实验场地由北京富龙腾飞实验动物研究院有限公司提供,合格证号:SYXK(京)2018-0041。本研究通过实验动物伦理委员会审批(伦理审批号:BUCM-4-2022010101-1097)。
1.1.2 试剂与仪器 3%戊巴比妥钠溶液(Sigma,德国,货号:P1110);乙二胺四乙酸(Ethylenediaminetetraacetic Acid,EDTA)脱钙液(塞维尔公司,货号:G1105);苏木精-伊红(Hematoxylin-eosin,HE)染液套装(塞维尔公司,货号:G1003);磷酸盐缓冲液(Phosphate Buffered Saline,PBS)(塞维尔公司,货号:G0002);酶联免疫吸附试验(Enzyme Linked Immunosorbent Assay,ELISA)试剂盒(南京建成生物工程研究有限公司,货号:CB10058-Rb、CB10011-Hs);一次性无菌针灸(苏州针灸用品有限公司,规格:0.2 mm×13 mm);韩氏穴位神经刺激仪(北京华卫,型号:LH202);一次性针刀(北京卓越华友医疗器械有限公司,规格:0.3 mm×30 mm);台式高速冷冻离心机[大龙兴创实验仪器(北京)股份公司,型号:D3024];酶标检测仪(BioTeK,美国,型号:Epoch);磁共振成像系统(飞利浦,日本,型号:Achieva3.0T)。
1.2 方法
1.2.1 分组与模型制备 选取健康清洁级24周龄雄性新西兰兔28只,适应性饲养7 d后,将实验动物按照随机数字表法随机分为空白组、模型组、针刀组、电针组4组,每组7只。空白组正常饲养,对模型组、电针组、针刀组进行兔左下肢制动。造模前对兔禁食,持续10~16 h,禁食结束后对耳缘静脉进行消毒,以30 mg/kg的标准确定剂量后进行麻醉。麻醉后,将兔仰卧位固定,将其左后肢牵拉至伸直位,保证膝关节处于180°伸直位、踝关节则保持背屈60°。将高分子绷带软化后,从腹股沟缠绕至足踝部进行固定;留出兔足趾部分以便观察其供血情况。为防止兔啃咬破坏模型,使用透明胶纸在外部进行缠绕,保护高分子绷带[9]。定期观察模型损坏、松动情况以及兔左下肢供血情况,有效制动持续6周。
1.2.2 干预方法 拆除各组固定后开始进行干预。1)空白组:正常饲养,不作任何处理,每天正常抓取。2)模型组:造模后每天正常抓取。3)电针组:造模成功后,根据《实验针灸学》动物穴位定位,取以下四穴进行干预:梁丘、血海、内膝眼、外膝眼。采用0.2 mm×13 mm一次性无菌针灸对上述腧穴进行治疗,选用波形疏密波行电针治疗,强度3 mA,频率2/100 Hz,20 min/次,隔天治疗1次,治疗3周。4)针刀组:造模成功后,选取兔膝关节股内外侧肌肌腱止点、股直肌肌腱止点、股二头肌肌腱止点及鹅足滑囊处为治疗点。常规备皮、消毒后,选用规格0.3 mm×30 mm一次性针刀刺入,针刀刀刃平行于肌腱,刀体与皮肤切面垂直,刺入后沿肌腱与骨连接方向进行松解,出针刀后进行按压止血。治疗频率为1次/周,治疗3周。
1.2.3 检测指标与方法
1.2.3.1 取材 各组动物于KOA模型制备前、造模后、治疗结束后分别以3%戊巴比妥麻醉,采用3.0T MRI对兔患侧膝关节进行活体扫描,获取相关MRI图像数据。治疗结束后将各组动物以3%戊巴比妥麻醉过量致死后提取家兔左后肢关节液。切开、分离皮下组织后,暴露髌骨韧带。膝关节弯曲45°,选取髌骨韧带中部和股骨下缘进入针头,在膝关节充分弯曲和拉伸后将关节液收集到冻干管中,在4 ℃下以1 000 r/min,离心半径15 cm,离心15 min,去除细胞和关节碎片,于-80 ℃下保存。打开关节腔,在无菌环境中使用直径4 mm的环钻对关节软骨面进行操作。从兔膝关节胫骨和股骨软骨面的中心负重区垂直切割出圆柱状的软骨-软骨下骨结合体组织块,钻取深度为3 mm。
1.2.3.2 光镜HE染色观察软骨组织 对组织块进行冲洗,使用生理盐水清洁其附着的血液、黏液及污物等,浸入4%多聚甲醛溶液中固定72 h。将软骨标本进行脱钙、脱水、透明、透蜡后进行石蜡包埋,切片4 μm,进行HE染色,在光镜下观察兔膝关节软骨,并参照Mankin评分标准进行评估。
1.2.3.3 ELISA检测 采用ELISA法测定滑膜液中IL-1β和TNF-α的含量。取出冷冻的滑膜液,恢复至室温后离心取上清液。样品按照ELISA试剂盒程序进行检测,用酶标记仪器在450 nm处测量吸光度值。通过与标准物质比较,计算IL-1β和TNF-α的含量。
1.2.3.4 关节软骨接触面间压力分布测试 导入核磁扫描文件Dicom,可以得到3种方位视图,一是轴向视图,第二、三为矢状面、冠状面,由切层数据获得。调节阈值范围使得模型各断层面达到最高清晰度后生成3D模型,点击Smooth调整模型表面光滑度、完整度,实现各部分整体表面尽可能符合实体,如此便可获得较为逼真的兔膝关节3D模型。见图1。将处理好的3D模型保存为Stl文件,导入到Ansa软件中进行有限元前处理。进入软件点击表面化处理(To surface)功能生成几何模型,根据不同部位进行拆分、定义,生成壳网格。网格单元多位四边形、少数三角形,即定义其为混合单元。将壳模型定义为实体模型,并将其划分为四面体网格模型。对各部分赋予相应的材料弹性模量及泊松比[9](表1)。建立接触面集合(Set),根据实际情况将紧密连接的面设定为绑定(Tie)关系。

表1 兔膝关节有限元模型中各组成部分材料参数

图1 兔膝关节3D模型

2 结果
2.1 各组兔软骨HE光镜观察结果比较 在空白组兔的膝关节软骨中,可以清晰观察到表浅层、移行层、辐射层以及钙化层。这4部分从浅至深的结构完整且明确,潮线清晰可见;细胞核、细胞质均清晰可见,分别呈蓝紫色、紫红色;未观察到软骨细胞聚集及血管通过。钙化层软骨可观察到少量血管。模型组兔膝关节软骨结构混乱,4层结构模糊不清,表层和移形层软骨出现分层剥落,部分区域剥离到辐射层;潮线扭曲且不规则,可观察到有血管延伸至非钙化层软骨。电针组兔膝关节软骨组织结构尚清晰,软骨表面可见不规则及部分剥脱,部分细胞出现凋亡,潮线模糊不清,未观察到血管翳的产生。针刀组兔膝关节软骨结构明显,但是软骨表面并不完全平滑。同时,软骨细胞的层次分布也比较均匀,潮线呈现出规则且清晰的特点,偶有重复的潮线出现。此外,有少数血管穿过至非钙化层软骨,但是未观察到血管翳形成。见图3。
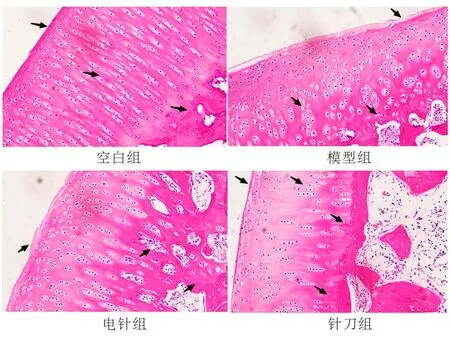
图3 各组兔膝关节软骨组织病理观察(HE染色,×200)
2.2 各组兔软骨Mankin评分 造模后,与空白组比较,模型组兔软骨Mankin评分升高(P<0.05)。进行干预后,电针组、针刀组兔软骨Mankin评分较模型组降低(P<0.05);针刀组较电针组兔软骨Mankin评分降低更为明显(P<0.05)。见表2。
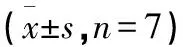
表2 各组兔关节软骨Mankin评分比较
2.3 各组兔膝关节滑液中炎症介质水平比较 与空白组比较,模型组TNF-α、IL-1β水平均显著升高(P<0.01);与模型组比较,电针组、针刀组TNF-α、IL-1β水平均显著降低(P<0.01),且针刀组明显低于电针组(P<0.01)。见表3。
表3 各组兔膝关节滑液中TNF-α、IL-1β水平比较
2.4 各组兔有限元结果分析 与空白组比较,模型组膝关节整体应力显著降低(P<0.01)、关节软骨最大应力显著降低,差异有统计学意义(P<0.01);与模型组比较,电针组和针刀组膝关节整体应力、关节软骨最大应力均升高,差异有统计学意义(P<0.01);针刀组与电针组比较,膝关节整体应力和关节软骨最大应力均增加,差异有统计学意义(P<0.05)。各组兔膝关节整体应力及关节软骨最大应力数据见表4。与空白组比较,模型组膝关节整体应力、关节软骨最大应力均显著降低(P<0.01),对比空白组与模型组应力云图可以观察到,关节软骨表面存在明显的应力集中区域,主要出现在膝关节内侧,且模型组应力集中趋势较空白组更加明显,应力分布出现明显的不均匀分布;与模型组比较,电针组和针刀组膝关节整体应力、关节软骨最大应力均升高,差异有统计学意义(P<0.01);针刀组与电针组比较,膝关节整体应力和关节软骨最大应力均增加,差异有统计学意义(P<0.05);观察电针组、针刀组应力云图可发现,针刀组较电针组应力分布更加均匀、应力集中区域减少。各组兔关节软骨应力云图见图4。
表4 各组兔膝关节整体应力及关节软骨最大应力比较

图4 KOA兔膝关节屈曲60°关节软骨最大应力
3 讨论
KOA属于中医学“骨痹”“痹病”“膝痹”等范畴[10]。正常膝关节运动依赖于骨骼和韧带提供的静态稳定性以及由肌肉产生的动态稳定性来确保膝盖部位良性压力分布,以维持其健康状态下软骨合成与分解过程的平衡,并保护其功能正常[11]。若膝部周围的软组织出现力学异常或者膝关节的动静态失衡,《素问·痿论篇》曰“宗筋主束骨而利机关”的生理功能受到严重损害,关节软骨会出现退变、磨损,削弱软骨的抗拉伸能力,进而导致关节对位匹配不良、关节稳定性下降,使应力集中更加明显逐渐引发疼痛[12]。关节失稳后异常应力环境加速软骨退变,最终导致膝关节的骨骼受损,从而引发筋骨共病,恶性循环发展为KOA[13-14]。本团队前期研究表明,针刀根据“以痛为输”原则对软组织损伤点即压痛点进行松解,并在现代膝关节“力学平衡理论”指导下对膝周韧带、肌肉-肌腱等高应力点进行松解,“调筋”可以有效地改善韧带和肌腱的生物力学特性,同时能够调节软骨细胞的合成代谢过程,从而使得针刀发挥“治骨”作用[15-17]。
在正常的关节软骨中,其基质内液会通过物理压力的作用而与滑液互相转换,从而为软骨细胞提供必要的养分以保持其健康的形态、功能以及新陈代谢[18]。关节及软骨受到的应力大小能够在一定程度上调控细胞合成、分泌基质等正常生理活动。当软骨受压过大或关节负荷失衡,那么软骨细胞和基质的构造就会遭受损害并导致软骨的退化[19]。本团队在前期研究中发现,针刀能够通过松解膝周高应力点改善软骨弹性模量,但对整体膝关节及软骨的应力变化研究还未涉及。因此,本实验选择有限元模拟进行膝关节整体及软骨的应力分析。有限元分析法是一种理论型的模拟生物力学变化的研究方法,利用现代仿真技术建立逼真的兔膝关节模型,通过变化参数来模拟模型的力学变化情况,解决了传统生物力学检测中无法兼顾的全关节动态力学变化[20]。实验结果显示,与空白组比较,模型组膝关节整体应力及关节软骨最大应力均明显下降,同时HE染色观察到,关节软骨组织层次紊乱、出现分层剥脱、潮线扭曲并有血管通过,且到达非钙化层软骨,Mankin评分降低。当软骨处于较低的应力环境时,由于缺乏充足的、生理性的应力刺激,使得软骨细胞的功能受到抑制、软骨基质的生成量减少。与此同时,软骨细胞的病变也会促使其异常产生能够引发基质金属蛋白酶产生的细胞因子,该蛋白酶的增加会引起软骨基质降解,这进一步增加了软骨基质的损伤程度,同时也削弱了其形成能力。二者相互影响,最终导致软骨损伤逐渐加重[21]。在实验中我们发现,有限元模拟检测表明电针组、针刀组兔膝关节整体应力及软骨最大应力均有提升;HE染色观察到软骨组织结构均有所改善,Mankin评分均有所升高,且针刀组较电针组更为显著。因此可以推测针刀干预能够恢复膝关节及软骨应力,进而改善膝关节软骨损伤程度。
IL-1β和TNF-α是参与骨关节炎的常见炎症介质[22]。通过实验结果可以观察到,与空白组比较,模型组IL-1β和TNF-α表达明显增高,这可能是由于模型组膝关节受力能力降低、加剧软骨磨损引发炎症反应而发生的变化。研究发现,当关节软骨组织遭受非正常的机械应力时,会生成一种一氧化氮(Nitric Oxide,NO)分子。这种小分子在软骨内迅速扩散后会在其内部快速传播,并且刺激软骨细胞产生大量的IL-1β,基质金属蛋白酶出现持续高水平表达。这些细胞因子的过量产生会导致基质中的大分子物质遭到破坏而引发软骨病变的发生[23]。IL-1β等物质会由于软骨变性后基质纤维片段及其他分子产物的产生而持续高水平表达,使基质金属蛋白酶的释放和活性持续处于高水平状态。其中,IL-1β、TNF-α的过量表达与骨关节炎病理变化密切相关。IL-1β是一种重要的炎症介质,是引起KOA产生并逐渐加重的关键因素,它可以独立诱导炎症反应和软骨分解,也能够与其他介质一同作用,其表达水平可以有效体现骨性关节炎发展过程中软骨基质降解、滑膜破坏的程度。IL-1β水平与骨关节受损程度成正相关,它能够影响滑膜细胞的生长、分化,使滑膜细胞、软骨细胞协同合成并释放前列腺素E2(Prostaglandin E2,PGE2)和胶原酶,抑制蛋白多糖的合成及软骨细胞的增殖,从而加快了软骨基质的降解[24]。TNF-α是由软骨细胞、成纤维细胞和巨噬细胞产生的肽类激素,通过炎症反应抑制蛋白聚糖的合成以及骨胶原的产生,进而干扰软骨的合成加速关节软骨破坏。有研究表明,TNF-α能够通过诱导骨母细胞产生一种能够促使骨吸收的破骨因子,并可与IL-1β、单核粒细胞刺激因子细胞等共同构成炎症介质参与软骨的吸收,介导骨关节组织的炎症反应和破坏[25]。本研究结果表明,在经过电针、针刀的干预后,2组兔IL-1β和TNF-α表达水平均有所下降,且针刀组优于电针组。由此可以认为,针刀能够通过干预肌肉-肌腱生物力学特性以恢复关节异常应力环境,降低KOA关节软骨中炎症介质的含量,改善软骨细胞的生长和代谢。
因此,通过以上实验结果可以认为,针刀干预能够恢复关节及软骨良性应力环境,有效抑制KOA软骨破坏,促进炎症的吸收和消散,延缓软骨退变,从而发挥“治骨”的重要作用。本实验中仅选取单一角度对兔膝关节及软骨力学环境进行分析,对针刀干预膝关节实时力学的动态变化还有待进一步研究。
利益冲突声明:所有作者声明无利益冲突。

