山药多糖延缓秀丽隐杆线虫衰老的药效评价及作用机制研究
刘泽坤 贺小芳 洪 颖 盛丽莉 李后开
(上海中医药大学中药学院,上海,201203)
衰老是随着时间进行的整体功能的退行性变化,具有累积性、普遍性、渐进性的特点。在衰老过程中,机体功能和代谢会发生衰退,与人类疾病息息相关。衰老是大多数慢性疾病,包括心脑血管疾病、骨质疏松症、癌症及神经退行性疾病等的主要危险因素[1-4]。由于衰老是一个极其复杂的全面性变化,涉及多器官多系统,并且存在个体差异和脏器特异性[5],已成为当今社会严峻的医学问题。随着人口老龄化的进一步加剧,衰老相关疾病涌现为社会以及经济发展带来了很大负担。因此,减缓衰老或者促进“健康老龄化”成为当今社会亟待解决的问题。
中医药历史源远流长,中药在抗衰老方面也积累了大量实践经验,其所应用的抗衰老方剂以及用药规律也为我们现代抗衰老中药的药理研究奠定了基础。衰老常表现为脾肾不足、气血亏虚、阴阳虚损等身体虚亏的现象,在《医门法律》也有云:“老衰久病,补益为先。”山药作为具有代表性的补气类药食同源中药,其性温味甘,归脾、胃、肺经,具有补脾养胃,生津益肺,补肾涩精的功效[6],在《神农本草经》上就记载其具有“补虚赢,益气力,久服耳目聪明,轻身延年”的作用。现代药理学研究表明,山药具有多种活性成分,而多糖是其主要的活性成分。目前已有研究表明山药多糖(Chinese Yam Polysaccharides,CYP)具有抗氧化[7]、降血脂[8]、抗肿瘤[9]、调节免疫[10-11]等多种药理活性。然而山药多糖延缓自然衰老的药理活性尚无研究报道。
秀丽隐杆线虫因其虫体小、世代和生命周期较短、基因组完全测序以及与人类基因的同源性高等优点,已逐渐成为衰老和药物筛选研究的中的重要动物模型[12-14]。因此,本研究将基于秀丽隐杆线虫模型对山药多糖的抗衰老药理活性及其作用机制进行探究,为中药抗衰老药理作用机制研究提供思路和示范。
1 材料与方法
1.1 材料
1.1.1 虫株及菌株 野生型秀丽隐杆线虫N2(CaenorhabditiselegansBristol N2)批号:3190712、大肠杆菌OP50(E.coli)批号:29021,购自福建上源生物科技有限公司。
1.1.2 药物 山药多糖(上海源叶生物有限公司,批号:S24912)。
1.1.3 试剂与仪器 琼脂粉(OXOID公司,英国,批号:LP0011);蛋白胨(BBI公司,以色列,批号:A100636-0100);氢氧化钠(分析纯)、氯化钠(分析纯)、无水氯化钙(分析纯)、七水合硫酸镁(分析纯)、磷酸二氢钾(分析纯)、磷酸氢二钾(分析纯)、胆固醇(分析纯)(国药集团化学试剂有限公司,批号分别为:10019718、10019318、10005861、10013018、10017618、20032118、69008214);总超氧化物歧化酶测定试剂盒、过氧化氢酶测定试剂盒(南京建成生物工程研究所,批号分别为A001-3-2、A007-1-1);2′,7′-二氯荧光素二乙酸酯(H2DCFDA)(SIGMA公司,德国,批号:D6683);琼脂糖(Amresco公司,美国,批号:N605)生化培养箱(上海一恒科学仪器有限公司,型号:LRH-70);酶标仪(瑞士TECAN,瑞士,型号:SPARK 10M);磁力搅拌仪(上海思乐仪器,型号:S10-2);体视显微镜(麦克迪奥科技有限公司,型号:SMZ171TLED);恒温摇床(HASUC,型号:HS-200B);低温高速离心机(Eppendorf公司,德国,型号:5810R);倒置荧光显微镜系统(Leica,德国,型号:DMi8 M/C/A)。
1.2 方法
1.2.1 培养基及相关溶液配制 1)NGM培养基配制:蛋白胨(Peptone)2 g,琼脂16 g,氯化钠2.4 g,置于洁净1 000 mL烧瓶,加入1 mol/L磷酸缓冲液20 mL,蒸馏水定容至800 mL,121 ℃高压蒸汽灭菌30 min,之后置于55 ℃水浴锅中冷却,加入5 mg/mL胆固醇0.8 mL,高压灭菌的1 mol/L MgSO4,1 mol/L CaCl2各0.8 mL,摇匀即得到完全培养基。2)M9缓冲液:3 g KH2PO4,6 g Na2HPO4,5 g NaCl,0.25 g MgSO4·7H2O,溶于1 000 mL双重去离子水(Double Distilled Water,dd H2O)中,121 ℃,30 min高压蒸汽灭菌。3)1 mol/L磷酸缓冲液:称取108.3 g KH2PO4和35.6 g K2HPO4溶于1 000 mL蒸馏水中,调节pH值到6.0即可。
1.2.2 NGM平板制备 制备菌液:使用接种环沾取OP50菌液在无抗LB平板上划单菌落,37 ℃培养12 h,取出含OP50的单菌落平板,用无菌枪尖挑取一个单菌落到50 mL LB培养基中,于37 ℃摇床12 h振荡培养。含OP50菌液及药物NGM平板制作:1)在超净工作台内取2 mL制备好的菌液,15 000×g,离心2 min,弃去上清。2)沉淀用160 μL dd H2O复溶,用移液枪吸取40 μL菌液加于空白的NGM平板的中央,轻轻将菌液均匀涂布成菌斑。将布好菌液的NGM平板置于封闭的超清工作台下晾干,紫外照射1 h灭菌。3)含CYP培养平板制作:药液使用0.22 μm微孔滤膜过滤除菌,用移液枪吸取40 μL制备好的药液,均匀涂布于空白的NGM平板上,覆盖住菌液。
1.2.3 线虫培养及线虫同期化 线虫的培养:利用挑虫针挑取线虫至含大肠杆菌的NGM平板,于20 ℃培养箱恒温培养,NGM中涂有0.2 mL OP50作为线虫的食物。线虫的同期化:1)在超净工作台内使用无菌M9缓冲液冲洗NGM平板若干次,洗下线虫和虫卵;2)将裂解液按与虫液2∶1的比例加入装有线虫的离心管;3)涡旋至虫体裂解,时间不超过5 min;4)将试管在台式离心机中以1 300×g,离心半径:10 cm,20 ℃离心2 min,以沉淀虫卵;5)弃去上清至0.1 mL后,添加无菌水至5 mL,摇匀,重复步骤4)和5),使用移液枪将剩余0.1 mL液体中的虫卵转移到接种有大肠杆菌OP50菌苔的干净NGM平板边缘,20 ℃培养孵化48 h,获得L4期线虫。
1.2.4 药物干预 CYP给药剂量为0.05、0.1、0.2 mg/mL,对照组使用dd H2O作为溶剂对照。
1.2.5 检测指标与方法
1.2.5.1 寿命观察 按照步骤1.2.2中方法,将L4期线虫挑至含有药物以及OP50的NGM平板上,进行给药处理,从给药当天,线虫年龄标记为0 d。实验过程中每隔2 d将给药线虫挑至新平板上,避免子代的干扰。每天观察线虫的状态,记录存活、死亡数量,观察线虫生长状态,线虫死亡判定标准为经触碰后不弯曲身体或头部不摆动,身体僵直。记录线虫的死亡数目,并制作生长曲线。
1.2.5.2 咽泵频率和身体活动观察 按照步骤1.2.2中方法,将同期化线虫在20 ℃恒温条件下培养至L4期,实验过程中每隔2 d将给药线虫挑至新平板上,避免子代的干扰。在给药处理的第0、3、6、9、12天,在显微镜下记录30 s内单条线虫吞咽次数和身体弯曲次数。
1.2.5.3 脂褐素荧光观察 将同期化线虫在20 ℃恒温条件下培养至L4期,将L4期线虫挑至含有CYP以及OP50的NGM平板上,CYP给药剂量为0.05、0.1、0.2 mg/mL,对照组使用dd H2O作为溶剂对照,给药5 d,中间每隔2 d,将给药线虫挑至新平板上,避免子代的干扰;在给药5 d后,将给药线虫移至含有M9缓冲液的离心管中;将装有线虫的离心管离心,100×g,离心2 min,以沉淀线虫。弃去上清后,添加2 mmol/L盐酸左旋咪唑麻醉;麻醉后,将线虫置于2%琼脂糖平板上。用荧光显微镜分别在明场和暗场观察其形态,然后拍照;使用ImageJ统计荧光强度,并使用Graphpad Pism 8进行统计分析。
1.2.5.4 热应激实验 将同期化线虫在20 ℃恒温条件下培养至L4期,将L4期线虫挑至含有CYP以及OP50的NGM平板上,CYP给药剂量为0.05、0.1、0.2 mg/mL,对照组使用dd H2O作为溶剂对照,给药3 d,中间每隔2 d,将给药线虫挑至新平板上,避免子代的干扰;在给药3 d后,将给药线虫移至不含药的NGM平板中,在35 ℃下孵育,每2 h计数1次,统计线虫的存活率,直至全部僵直死亡。
1.2.5.5 氧化应激实验 将同期化线虫在20 ℃恒温条件下培养至L4期,将L4期线虫挑至含有CYP以及OP50的NGM平板上,CYP给药剂量为0.05、0.1、0.2 mg/mL,对照组使用dd H2O作为溶剂对照,给药5 d,中间每隔2 d,将给药线虫挑至新平板上,避免子代的干扰;在给药5 d后,将给药线虫移至不含药的NGM平板中,在H2O2下培养,每天记录线虫的存活和死亡只数1次,统计线虫的存活率,直至全部死亡。
1.2.5.6 活性氧荧光检测 将同期化线虫在20 ℃恒温条件下培养至L4期。给药处理:将L4期线虫挑至含有CYP以及OP50的NGM平板上,CYP给药剂量为0.05、0.1、0.2 mg/mL,空白对照组使用dd H2O作为溶剂对照,给药6 d,中间每隔2 d,将给药线虫挑至新平板上,避免子代的干扰;在给药第0、3、6天时,将线虫移至含有50 μL的H2DCFDA的M9缓冲液中,在20 ℃黑暗环境中孵育30 min;弃去上清后,添加2 mmol/L盐酸左旋咪唑麻醉,后将活虫置于2%琼脂糖载玻片上。用荧光显微镜分别在明场和暗场观察其形态以及ROS水平,然后拍照;使用ImageJ统计荧光强度,并使用Graphpad Pism 8进行统计分析。
1.2.5.7 超氧化物歧化酶(Superoxide Dismutase,SOD)以及过氧化氢酶(Catalase,CAT)活性检测 将同期化的线虫卵进行给药处理:将裂解的线虫卵添加至含有CYP以及OP50的NGM平板上,CYP给药剂量为0.05、0.1、0.2 mg/mL,对照组使用dd H2O作为溶剂对照,每组线虫在2 000条左右,给药48 h;使用无菌生理盐水冲洗NGM平板若干次,洗下线虫至离心管中;将试管在离心机中离心,100×g,离心半径:10 cm,20 ℃离心2 min,以沉淀线虫,弃去上清;使用无菌生理盐水以100×g,20 ℃离心2 min洗涤线虫,重复2~3次;后续实验操作根据生化试剂盒说明书进行。
1.2.6 转录组测序
1.2.6.1 RNA提取与测序 同期化处理的线虫培养48 h后,Trizol法提取空白组和0.2 mg/Ml CYP组线虫组织总RNA,并使用DNase I去除基因组DNA。采用2100 Bioanalyser(Agilent)检测RNA样品的质量。(每组3个样本,每个样本的RNA来源于500只以上的线虫)。
1.2.6.2 测序数据处理与分析 文库使用Illumina HiSeq xten/NovaSeq 6000测序平台进行高通量测序,对原始测序数据进行过滤,得到高质量的测序数据(Clean Data)以保证后续分析的顺利进行,使用HiSat2(http://ccb.jhu.edu/software/hisat2/index.shtml)将Clean Data(Reads)与参考基因组进行比对,获得用于后续转录本组装、表达量计算等的Mapped Data(Reads),同时从测序饱和度、基因覆盖度、Reads在参考基因组不同区域分布及Reads在不同染色体分布对该次转录本测序的比对结果进行质量评估。通过定位到基因组区域的序列(Clean Reads)的数量(Reads Counts)来计算基因的表达水平。使用软件RSEM(http://deweylab.github.io/RSEM/)分别对基因和转录本的表达水平进行定量分析。
1.2.6.3 差异基因的筛选 使用DESeq2(Bioconductor-DESeq2),根据比对到基因的Read Count数据进行差异表达计算,筛选标准为:FDR<0.01&|log2FC|≥3。
1.2.6.4 差异基因京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析 使用KOBAS(http://kobas.cbi.pku.edu.cn/)进行KEGG PATHWAY富集分析,使用Fisher精确检验进行计算。为控制计算假阳性率,采用BH(FDR)方法进行多重检验,经过校正的P值(CorrectedP-Value)以0.05为阈值,满足此条件的KEGG通路定义为在差异表达基因中显著富集的KEGG通路。

2 结果
2.1 CYP对线虫寿命、咽泵频率及身体活动频率的影响 实验结果显示,不同浓度的CYP均可以延长线虫寿命,对照组、0.05、0.1、0.2 mg/mL CYP的线虫的最终死亡时间分别是19、20、23、23天,其中0.1、0.2 mg/mL CYP作用更为显著(图1A)。在实验终点时,0.1、0.2 mg/mL的CYP显著增加线虫咽泵频率(图1B,P<0.05)。0.2 mg/mL CYP显著增加线虫身体活动频率(图1C,P<0.05)。因此,CYP具有延长线虫寿命,增加咽泵频率和身体活动频率的作用。

图1 CYP对线虫寿命、咽泵频率及身体活动的影响
2.2 CYP对线虫脂褐素积累的影响 线虫的脂褐素是一种自发荧光色素,作为线虫衰老的指示剂,是检测药物对于线虫是否抗衰老作用的重要指标之一。脂褐素荧光积累分析发现,对照组脂褐素荧光强度明显高于CYP组。不同浓度的CYP均可以降低线虫衰老过程中的脂褐素积累,其中,低、中浓度CYP差异有统计学意义(P<0.05)。见图2。
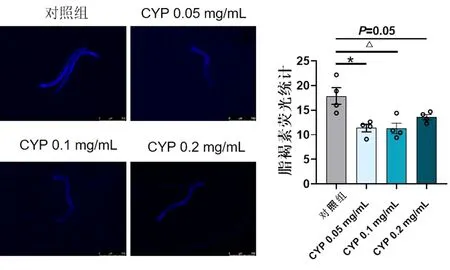
图2 CYP对线虫衰老过程中脂褐素积累的影响
2.3 CYP对线虫抗压能力的影响 本研究采取了耐热性实验以及急性氧化应激实验2个抗压性实验来探究CYP对线虫抗压能力的影响。实验结果如图3A所示,0.05、0.1、0.2 mg/mL CYP均增加线虫在35 ℃下的耐热性(P<0.05),其中0.1 mg/mL CYP改善效果更为明显。不同浓度CYP均显著增加了线虫在强氧化环境下的寿命,并且呈现剂量依赖性。
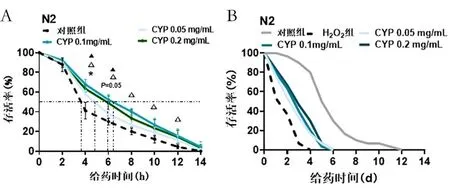
图3 CYP对线虫抗压性的影响
2.4 CYP对线虫抗氧化能力的影响 利用活性氧探针2′,7′-二氯荧光素二乙酸酯(H2DCFDA)来检测在线虫衰老过程中活性氧。在荧光显微镜下观察对照组以及CYP组线虫的活性氧荧光强度积累情况,结果如图4A所示,相比于第3天时,对照组在第6天时的活性氧荧光显著增强,而0.05、0.1、0.2 mg/mL CYP均显著减少了活性氧荧光其强度。因此,CYP可以降低线虫衰老过程中的活性氧积累,提高线虫的抗氧化能力。抗氧化酶活性实验结果如图4B所示,0.1、0.2 mg/mL CYP显著增加了线虫衰老过程中的SOD活性(P<0.05);不同浓度CYP均显著提高衰老过程中CAT酶活性(P<0.05)。

图4 CYP对线虫活抗氧化能力的影响
2.5 转录组测序结果
2.5.1 原始序列质量控制 对照组(Con)和0.2 mg/mL CYP组样本的总RNA量为(98.90±32.33)μg/μL和(296.90±48.87)μg/μL。原始测序序列统计结果如表1所示。

表1 测序数据统计
2.5.2 差异基因筛选 本次测序检测到Con组和CYP组的共有基因12 713个,Con组特有基因2 509个,CYP组特有基因587个。主成分分析(Principal Components Analysis,PCA)显示,Con和CYP组在PC1层面呈现显著明显分离(贡献度84.20%)。见图5A。结果显示共有5 513个差异表达基因,其中3 584个基因表达被CYP干预下调,1 929个基因表达被CYP干预上调。见图5 B。
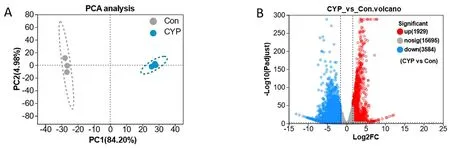
图5 对照组(Con)和0.2 mg/mL CYP组的差异基因表达基因的PCA分析(A)及火山图(B)
2.5.3 差异表达基因的KEGG分析 在Level 1水平的生物体系统(Organismal Systems)相关通路中,差异基因主要被聚类到内分泌系统(Endocrine System)、免疫系统(Immune System)、神经系统(Nervous System)和衰老(Aging)等;在代谢(Metabolism)相关通路中差异基因主要被聚类到脂代谢(Lipid Metabolism),碳水化合物代谢(Carbohydrate Metabolism)和氨基酸代谢(Amino acid Metabolism);在细胞过程(Cellular Processes)相关通路中,差异基因主要被聚类到细胞的生长和死亡(Cell Growth and Death)相关通路;在遗传信息加工(Genetic Information Processing)相关通路中,差异基因主要被聚类到遗传信息的转录(Transcription)相关通路。见图6。
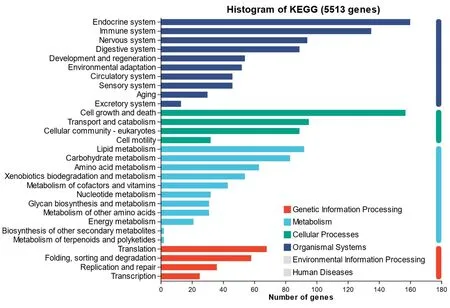
图6 对照组与CYP组的差异基因表达基因KEGG富集分析
2.5.4 衰老相关差异表达基因分析 KEGG功能分析中出现衰老(Aging)通路的富集,包含30个差异表达基因,其中20个基因在CYP干预后显著下调,10个基因显著上调。见图7A。与衰老相关的差异表达基因集的KEGG功能富集分析的TOP20如图7B所示,其中前10条通路分别是:Longevity regulating pathway-worm,Longevity regulating pathway-multiple species,Chemical carcinogenesis-reactive oxygen species,Pathways in cancer,Fluid shear stress and atherosclerosis,Longevity regulating pathway,Autophagy-animal,Hepatocellular carcinoma,FOXO signaling pathway和Insulin signaling pathway。其中,衰老差异表达基因显著富集于自噬、哺乳动物雷帕霉素靶蛋白(Mammalian Target of Rapamycin,mTOR)及胰岛素信号通路。

图7 对照组和0.2 mg/mL CYP组的与衰老相关的差异基因热谱图(A)和KEGG富集分析(B)
3 讨论
模型是疾病研究及药物筛选最重要的基础。在衰老研究中,常用的衰老模型分为自发性衰老动物模型和诱发性衰老动物模型,相较诱发性衰老动物模型,自然衰老动物模型是现在最接近人类衰老特点的动物模型。秀丽隐杆线虫因其生命周期短、基因序列清楚、成本低廉等特点,是近年来常被应用于衰老及其相关疾病研究优良自然模型[15]。
我们采用寿命、咽泵频率和身体活动情况这3个线虫衰老研究中的经典指标考察CYP对线虫寿命及健康状况的直接影响,发现CYP可以延长线虫寿命并提高线虫衰老过程中下降的咽泵频率和身体活动频率。脂褐素又称老年素,是溶酶体作用后剩下不再能被消化的物质而形成的残余体,其积累随生物体年龄增长而增多,是衰老的重要指征之一[16-18],我们发现CYP可以降低线虫衰老过程中的脂褐素积累。抗压性是评价衰老过程中线虫对于外界刺激的承受能力的重要指标,包括耐高温及抗急性氧化应激等[19],我们的结果表明在高温压力及强氧化应激条件下,CYP能够保护线虫抗热激损伤并提高抗氧化应激能力。在衰老的自由基理论中,随着时间的推移,细胞产生自由基未被及时清除,会造成细胞损伤,进而引发衰老乃至死亡[20-22]。活性氧(Reactive Oxygen Species,ROS)作为氧来源的自由基也是指征线虫衰老的重要指标,我们的实验表明CYP能够降低线虫衰老过程中活性氧积累。SOD以及CAT是清除体内的活性氧,限制活性氧引起的细胞损伤的关键抗氧化剂[23-26]。我们的检测结果发现CYP可以提高机体内的抗氧化酶活性,与前期活性氧荧光检测实验结果一致,表明CYP具有抗衰老药理活性。已有文献表明,CYP可以提高D-半乳糖诱导衰老小鼠模型以及黑腹果蝇的SOD以及CAT活性[27-28],我们的实验结果与其类似。
胰岛素/IGF-1信号通路(IIS)是研究最多的长寿通路之一,在线虫生长发育、代谢、行为、寿命方面起到重要的调控作用,也是第一个被报道影响线虫衰老的信号通路。多个研究发现,胰岛素信号通路是调控线虫寿命的重要通路[29-32]。mTOR信号通路和自噬通路也是线虫延长寿命并改善的健康寿命的有效通路之一,与线虫的生长和生殖息息相关[33-34]。我们通过RNA-seq检测技术分析了CYP组和对照组的差异基因表达,研究发现sip-1、daf-18、gst-26、hsp-60等基因显著上调,sip-1是编码线虫小热休克蛋白的基因,受胰岛素/IGF-1信号转导(IIS)通路调节,它的表达能够提高线虫的耐热性并在胚胎发育以及成年寿命的调节中起正向作用;而daf-18参与线虫发育的多个过程,包括确定成年寿命,对dauer幼虫发育的积极调节;hsp-60也参与多个线虫生理过程,包括线粒体未折叠蛋白反应和线虫幼虫发育。当线虫去hsp-60活性时,会在胚胎和幼虫发育的早期阶段停滞;gst-26则参与谷胱甘肽代谢过程,是编码抗氧化系统中谷胱甘肽S-转移酶亚群的重要基因,与线虫的抗氧化能力息息相关。对于差异基因,并进行了通路富集分析,发现与线虫衰老相关的差异基因显著富集于胰岛素通路、mTOR信号通路和自噬通路。这说明CYP可以通过调控衰老相关基因表达发挥延缓衰老作用,可能与多个通路的协同作用有关,具体调控机制有待进一步验证。
利益冲突声明:作者声明没有经济利益冲突。

