地红方通过miR-133b/DUSP1/JNK通路干预糖尿病肾病氧化应激损伤
林姿 何卫东 杜思哲

*基金项目:福建省自然科学基金(2021J01896);福建省卫生健康青年科研课题(2021QNA054)
第一作者简介:林姿(1987-),女,主治医师,研究方向:糖尿病及其并发症中医药防治。
摘要:目的 研究地红方对糖尿病肾病细胞模型氧化应激损伤的影响。方法 地红方含药血清制备,小鼠肾小球系膜细胞常规培养、传代。按以下分组:对照组(5.5mmol/L葡萄糖+正常血清)、高糖组(30mmol/L葡萄糖+正常血清)、地红方低剂量组(30mmol/L葡萄糖+5%地红方含药血清)、地红方中剂量组(30mmol/L葡萄糖+10%地红方含药血清)、地红方高剂量组(30mmol/L葡萄糖+20%地红方含药血清)。采用实时荧光定量PCR检测miR-133b、DUSP1 mRNA表达。Western blotting检测DUSP1、p-JNK、Drp1、Fis1蛋白表达。Elisa检测SOD、MDA表达。结果 与高糖组比较,地红方组miR-133b、MDA、p-JNK、Drp1、Fis1表达明显下降(P<0.05),而DUSP1、SOD表达显著升高(P<0.05)。结论 地红方可通过miR-133b/DUSP1/JNK通路调控线粒体分裂改善糖尿病肾病氧化应激损伤。
关键词:地红方;糖尿病肾病;miR-133b;DUSP1;JNK;氧化应激
中图分类号:R587.1 文献标志码:A 文章编号:1007-2349(2024)05-0080-05
Study on the Intervention of Didong Decoction on Oxidative Stress Injuryof Diabetic Nephropathy through miR-133b/DUSP1/JNK Pathway
LIN Zi, HE Wei-dong, DU Si-zhe
(The Peoples Hospital Affiliated to Fujian University of Traditional Chinese Medicine, Fuzhou 350004, China)
【Abstract】Objective: To study the effect of Dihong Decoction on oxidative stress injury of diabetic nephropathy cell model. Methods: The serum containing Dihong Decoction was prepared, and mouse mesangial cells were cultured and passed through routine. Groups were divided as follows, control group (5.5mmol/L glucose+normal serum), high glucose group (30mmol/L glucose+normal serum), low dose Dihong Decoction group (30mmol/L glucose+5% Dihong Decoction containing serum), medium dose Dihong Decoction group (30mmol/L glucose+10% Dihong Decoction containing serum), and high dose Dihong Decoction group (30mm ol/L glucose +20% Dihong Decoction containing serum). Real-time fluorescent quantitative PCR was used to detect the mRNA expression of miR-133b and DUSP1. Western blotting to detect the expression of DUSP1, p-JNK, Drp1 and Fis1 proteins. The expressions of SOD and MDA were detected by Elisa. Results: Compared with that of the high glucose group, the expressions of miR-133b, MDA, P-JNK, Drp1 and Fis1 in Dihong Decoction groups were significantly decreased (P<0.05), while the expressions of DUSP1 and SOD were significantly increased (P<0.05). Conclusion: Dihong Decoction can regulate mitochondrial division through miR-133b/DUSP1/JNK pathway to improve oxidative stress injury in diabetic nephropathy.
【Key words】Dihong Decoction; Diabetic Nephropathy; miR-133b; DUSP1; JNK; Oxidative Stress
糖尿病腎病(diabetic nephropathy,DN)是由糖尿病(diabetes mellitus,DM)所致的慢性肾脏病(chronic kidney disease,CKD),已成为 CKD 和终末期肾病的主要病因,增加了 DM 的死亡率[1-2],因此及时防治对于延缓 DN具有极其重大意义。地红方(滋阴活血调糖饮)是我院多年来用于防治 DN 验方,临床效果显著。地红方由六味地黄汤、桃红四物汤化裁而来,滋阴活血之力强,可作为 DN 滋阴活血的代表方。我们团队在前期临床研究中表明地红方可改善DM患者氧化应激指标及炎症因子[3],发现地红方能够改善DM血管内皮细胞氧化应激损伤[4]。在前期研究的基础上,本研究探讨地红方基于miR-133b/双特异性磷酸酶1(dual specificity phosphatase 1,DUSP1)/c-Jun氨基端激酶(c-Jun N-terminal kinase,JNK)通路调控线粒体分裂改善DN氧化应激损伤的机制。
1 材料与方法
1.1 实验动物 SPF 级雄性SD大鼠14只,体质量(180±20)g,适应性喂养1周后,分笼饲养。自由摄食进水,使用基础饲料喂养。实验过程符合国家《实验动物管理条例》。
1.2 实验细胞 小鼠肾小球系膜细胞(SV40 MES 13)购自武汉普诺赛,37℃水浴中进行快速融化,加入含10 mL DMEM培养基中,900 rpm/min,离心5min,加入5 mL DMEM培养基吹打均匀,置入T25培养瓶中培养。待细胞长满80%融合时,进行传代处理,用0.25%胰酶消化2min,收集细胞放入15mL离心管中,1000 rpm/min,离心5min,按1∶3进行传代,细胞传2代待用。
1.3 实验药物 熟地黄24 g,山茱萸12 g,山药10 g,泽泻9 g,茯苓9 g,牡丹皮9 g,葛根20 g,天花粉15 g,桃仁6 g,红花9 g,当归9 g,白芍9 g,川芎9 g,丹参9 g。配齐药材,先以5倍量清洁自来水在5 min内清洗两次。加10倍量的蒸馏水浸泡半小时,以700瓦的火力加热煎煮1 h,过滤取药液;第二次加6倍量水,以同等火力加热煎煮40 min,过滤。合并滤液,再以700瓦火力浓缩至每1mL药液相当于1 g生药材的药液(即1∶1药液),无菌包装,备实验使用。
1.4 主要药品与试剂 DUSP1抗体(武汉博士德生物工程有限公司,批号:A30451),磷酸化c-Jun氨基端激酶(p-JNK)抗体、线粒体动力相关蛋白1(dynamin-related protein 1,Drp1)抗体、线粒体分裂蛋白1(fission protein 1,Fis1)抗体、GAPDH抗体(美国proteintech公司,批号:80024-1-RR、12957-1-AP、10956-1-AP、60004-1-Ig)。增强型RIPA裂解液、BCA蛋白定量试剂盒、SDS-PAGE凝胶制备试剂盒、Western专用一抗二抗稀释液、Western Blotting增强型蛋白印迹再生液(武汉博士德生物工程有限公司,批号:AR0102、AR0198、AR0138、AR1017、AR0196)。
1.5 主要实验仪器 漩涡混合器[VORTEX-6](福州康和尔生物科技有限公司);超净工作台Opticlean-1300(力康生物医疗公司);冷冻离心机[JID-17R](广州吉迪仪器有限公司);琼脂糖水平电泳仪[DYCP-31DN](北京六一生物科技有限公司);漩涡混合器[VORTEX-6](福州康和尔生物科技有限公司);梯度PCR仪[MV-C155-ov71](杭州米欧仪器有限公司);QPCR仪[Archimed X6](鲲鹏基因(北京)科技有限责任公司);超微量紫外可见分光光度计[ND-100c](杭州米欧仪器有限公司)。
1.6 实验方法
1.6.1 地红方含药血清的制备 健康雄性SD大鼠14只,体质量(180±20)g,适应性喂养1周后。按随机数字表法分为正常血清组和地红方血清组,每组各7只。正常对照组予以等体积蒸馏水灌胃;地红方组以16.695 g/(kg·d)(臨床等效剂量)进行灌胃。连续1周,于末次给药2h后,颈动脉取血,离心取血清,56℃水浴30min灭活补体,除菌过滤后,分装冻存。将收集到的地红方含药血清配制成含药 血清浓度分别为5%、10%、20%的培养液备用。
1.6.2 实验分组 SV40 MES 13常规培养、传代。按以下分组:对照组(N组,5.5mmol/L葡萄糖+正常血清)、高糖组(H组,30mmol/L葡萄糖+正常血清)、地红方低剂量组(30mmol/L葡萄糖+5%地红方含药血清)、地红方中剂量组(30mmol/L葡萄糖+10%地红方含药血清)、地红方高剂量组(30mmol/L葡萄糖+20%地红方含药血清)。于37℃ 5%CO2培养箱中干预培养72h。
1.6.3 实时荧光定量PCR(qPCR)检测miR-133b、DUSP1 mRNA表达 收集各组细胞,按Trizol说明书进行,提取总RNA,将RNA反转录为cDNA,依据荧光定量试剂盒说明。将PCR薄壁管混匀、离心,放入PCR仪,反应条件:95℃ 预变性 30 s;95℃ 30 s;55℃ 1 min;扩增40个循环;95℃ 30s反应终止。反应结束后于-20℃保存。扩增片段大小:DUSP1(165bp);引物序列如下(按5′-3′排列):DUSP1-F(Rat):TACTGGCCCCTCACTGTTCT;DUSP1-R(Rat):AGCTCGGAGAGGTTGTGATG; rno-miR-133b-3p- F:TCGCGTTTGGTCCCCTTCAAC; rno-miR-133b-3p-R: AGTGCAGGGTCCGAGGTATT; rno-miR-133b-3p-RT: GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTAGCTG;GAPDH-F(Rat):ACGGCAAGTTCAACGGCACAG;GAPDH-R(Rat):GAAGACGCCAGTAGACTCCACGAC;U6-F(Rat):CTCGCTTCGGCAGCACATATACT;U6-R(Rat):ACGCTTCACGAATTTGCGTGTC。每组10个样本。
1.6.4 Elisa检测超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)表达 收集按以上分组的系膜细胞,根据Elisa试剂盒说明书操作,在酶标仪下读取吸光度值,测定各组细胞内SOD活性及MDA的含量。每组10个样本。
1.6.5 Western blotting(WB)检测DUSP1、p-JNK、Drp1、Fis1蛋白表达 收集各组细胞。用冷的PBS液洗涤细胞2次,提取总蛋白质。配制适量BCA工作液进行蛋白质定量,转膜,进行膜的染色。5%脱脂奶粉封闭,4℃孵育过夜。将一抗4℃孵育过夜。加入二抗室温孵育1h。之后进行胶片显影。每组10个样本。
1.7 统计学方法 采用 SPSS 24.0进行数据分析统计,计量资料数据服从正态分布者以(x±s)表示,服从非正态分布以中位数(四分位间距)即 M(IQR)表示,多组定量资料数据均符合正态分布采用单因素方差分析,否则采用非参数检验。
2 结果
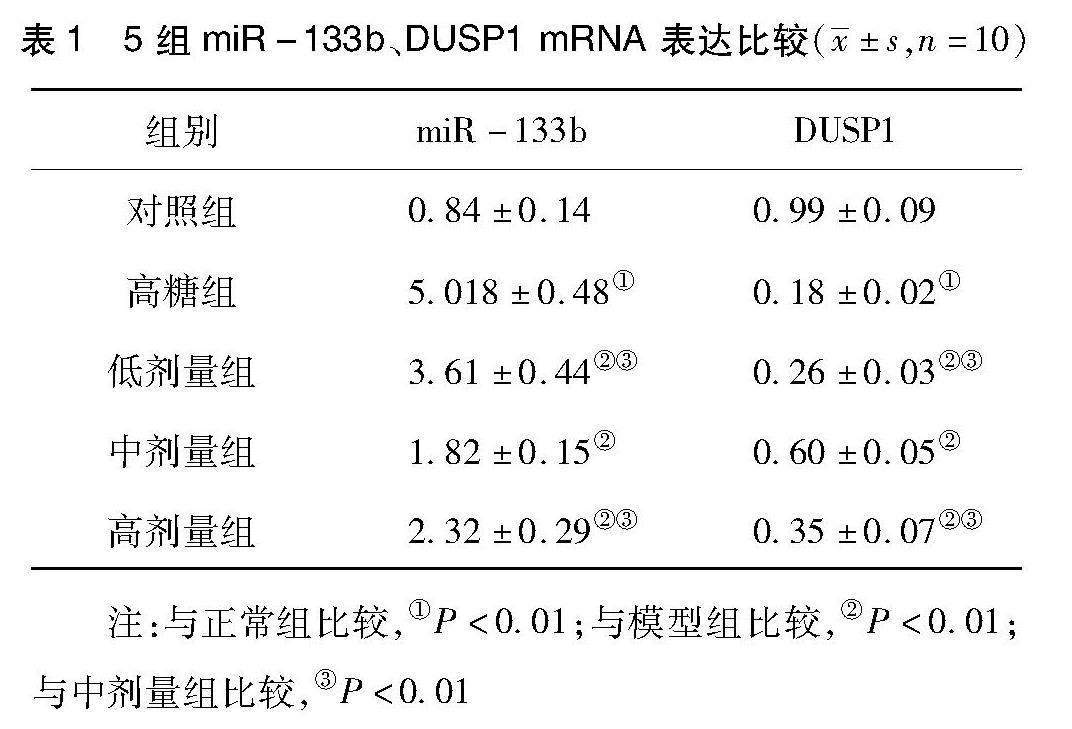
2.1 各组miR-133b、DUSP1 mRNA 表达比较 见表1。与对照组比较,高糖组miR-133b mRNA表达明显升高(P<0.01),而DUSP1 mRNA表达显著下降(P<0.01);与高糖组比较,地红方低、中、高剂量组miR-133b mRNA表达显著降低(P<0.01),而DUSP1 mRNA表达显著升高(P<0.01)。与地红方低、高剂量组,地红方中剂量miR-133b mRNA表达明显下降(P<0.01),而DUSP1 mRNA表达显著升高(P<0.01)。
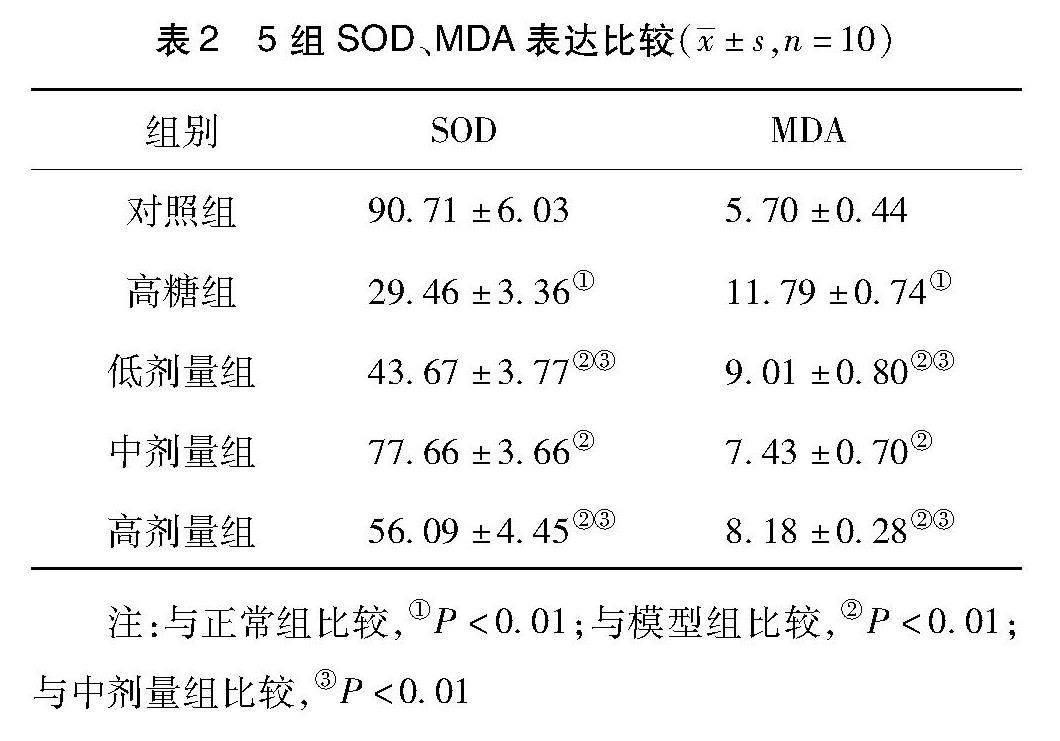
2.2 各组SOD、MDA表达比较,见表2。与对照组比较,高糖组SOD表达显著降低(P<0.01),而MDA表达显著升高(P<0.01);与高糖组比较,地红方低、中、高剂量组SOD 表达显著增加(P<0.01),而MDA表达显著减少(P<0.01)。与地红方低、高剂量组,地红方中剂量SOD表达明显增加(P<0.01),而DUSP1 mRNA表达显著减少(P<0.01)。
2.3 各组DUSP1、p-JNK、Drp1、Fis1蛋白表达比较,见表3。与对照组比较,高糖组DUSP1蛋白表达显著降低(P<0.01),而p-JNK、Drp1、Fis1蛋白表达显著升高(P<0.01);与高糖组比较,地红方低、中、高剂量组DUSP1蛋白表达显著增加(P<0.01),而p-JNK、Drp1、Fis1蛋白表達显著减少(P<0.01)。与地红方低、高剂量组,地红方中剂量DUSP1蛋白表达明显增加(P<0.01),而p-JNK、Drp1、Fis1蛋白表达显著减少(P<0.01)。
3 讨论
DN是DM最严重的微血管并发症之一,是终末期肾病的主要原因[1],其发病机制目前尚未完全阐明。人们越来越认识到,高血糖引起的氧化应激是DN发生和进展的主要触发因素[5]。本研究采用高糖培养SV40 MES 13建立DN细胞模型,探讨地红方在DN发生及发展过程中,改善机体氧化应激损伤的机制。本研究发现,高糖组抗氧化酶SOD表达下降(P<0.01),脂质过氧化的产物MDA表达上升(P<0.01),提示高糖引起肾小球系膜细胞氧化应激损伤。经过地红方低、中、高剂量干预后,高糖诱导的肾小球系膜细胞SOD表达显著升高(P<0.01),MDA表达明显下降(P<0.01),提示地红方可改善DN氧化应激损伤,对DN具有一定的疗效。
高血糖介导的线粒体分裂引起活性氧(reactive oxygen species,ROS)过度产生,迫使细胞承受氧化应激损伤[6]。由过量的ROS产生或抗氧化能力降低引起的氧化应激,对DN发生发展起关键作用,是近期DN机制研究的热点。本研究重点围绕miR-133b/DUSP1/JNK通路调节线粒体分裂在DN氧化应激损伤的作用。
微RNA(miR)是一系列小分子非编码RNA,参与几乎所有的生物过程,如分化、增殖、凋亡、细胞周期等,在糖脂代谢中起重要作用[7-8]。一般来说,miRNAs通过与下游mRNAs的3非翻译区(3UTR)相互作用,在基因表达调控中起作用[9]。miR-133家族包含miR-133a和miR-133b的2个成员[10],刘敏等[11]研究表明联合检测人体尿液中miR-133b、miR-30a和miR-342可作为DN诊断的潜在标志物,并探讨其灵敏度、特异性和准确度。X S等[12]发现miR-133可能与DN的发生和发展有关;建立大鼠DN模型,沉默的miR-133通过丝裂原活化蛋白激酶/蛋白激酶(MAPK/ERK)信号通路抑制DN的肾损伤,因而表明miR-133可能是治疗DN的有效靶点。Junqin S等[13]研究发现慢性高血糖刺激下调了DUSP1。有缺陷的DUSP1表达激活了JNK途径,后者通过调节线粒体裂变因子(mitochondrial fission factor,Mff)磷酸化来选择性地打开线粒体裂变。Mff相关的线粒体裂变引起线粒体氧化应激,最终促进线粒体功能障碍、肾小球凋亡和DN的发展。X-L Z等[9]发现LncRNA CASC2上调通过miR-133b/FOXP1调节轴抑制高糖诱导的肾小球系膜细胞增殖、细胞外基质积累和氧化应激。越来越多证据表明,过表达miR-133b,发挥抗氧化能力,将成为DN防治的热点。本研究探讨miR-133b/DUSP1/JNK通路调节线粒体分裂在DN氧化应激损伤的机制。本研究结果表明,高糖组miR-133b、p-JNK、Drp1、Fis1表达明显升高(P<0.01),而DUSP1表达显著下降(P<0.01);与高糖组比较,地红方低、中、高剂量组miR-133b、p-JNK、Drp1、Fis1表达显著降低(P<0.01),而DUSP1表达显著升高(P<0.01)。本研究提示miR-133b/DUSP1/JNK通路调节线粒体分裂在DN氧化应激损伤起重要作用。
地红方由六味地黄汤、桃红四物汤加天花粉、葛根、丹参组成,具有滋阴活血的功效。众所周知,六味地黄汤是滋阴的代表方,桃红四物汤是活血养血的经典方。六味地黄汤为阴虚型消渴的经典方剂,全方六药合用,三补与三泻相伍,而以三补为主,肝脾肾三阴并治,尤以补肾阴为重;桃红四物汤中六药相伍,补中寓行,使补血而不滞血,行血而不伤血,共成补血调血之功;配伍丹参活血化瘀,天花粉清热泻火,葛根生津止渴,在六味地黄汤合桃红四物汤的基础上增强滋阴泻火、活血化瘀之功。
临床实践和实验研究方面均有多个六味地黄汤和桃红四物汤单独使用治疗DN的报道。陶鹏宇[14]研究表明六味地黄丸治疗DN大鼠,能够控制血糖及延缓肾功能下降,改善氧化应激指标,SOD表达上升,MDA表达下降,起到抗氧化应激的作用。多个临床研究表明桃红四物汤能一定程度上减少尿蛋白,保护肾功能。侯君等[15]观察桃仁红花煎能够改善2型糖尿病(type 2 diabetes mellitus,T2DM)大鼠肾小球和肾小囊病变,降低DM大鼠血糖、血脂水平,抑制肾脏Wnt/β-catenin信号通路,发挥对肾脏的保护作用。地红方可作为DN滋阴活血的代表方。课题组在长期的临床实践中观察地红方可改善DN患者的临床症状,控制血糖及改善肾功能。
中药汤剂地红方可作为DN滋阴活血的代表方。我们课题组在长期的临床实践及前期的临床研究中观察地红方可改善DN患者的临床症状,具有控制血糖及改善肾功能的功效。现代研究表明地红方中多味中药及其活性成分具有保护线粒体功能及抗氧化应激的作用。本课题可望通过微观实验角度验证标本兼治的滋阴活血法防治DN的有效性,并科学的阐释滋阴活血法,丰富DN中医治疗的科学内涵。因而,笔者团队基于miR-133b/DUSP1/JNK通路探讨地红方调控线粒体分裂改善DN氧化应激损伤的机制。本课题组也将在今后的研究中进一步验证地红方改善DN动物模型的机制研究。这样有助于中药复方地红方在治疗DN的应用和推广,有助于治疗DN的新药开发。
参考文献:
[1]Tsai Y,Kuo M,Hung W,et al.High Glucose Induces Mesangial Cell Apoptosis through miR-15b-5p and Promotes Diabetic Nephropathy by Extracellular Vesicle Delivery[J].Molecular Therapy,2020,28(3):963-974.
[2]Hui Z,ChengE Y,Tian L,et al.The roles of gut microbiota and its metabolites in diabetic nephropathy[J].Frontiers in microbiology,2023,14:7132.
[3]林姿,何卫东,张富,等.地红方治疗阴虚血瘀型老年2型糖尿病43例[J].福建中医药,2023,54(4):62-64.
[4]何卫东,杨柳清,林姿,等.地红方调控Keap1/Nrf2信号通路干预糖尿病血管内皮细胞氧化应激损伤的研究[J].福建中医药,2022,53(3):42-45.
[5]Xing L,Guo H,Meng S,et al.Klotho ameliorates diabetic nephropathy by activating Nrf2 signaling pathway in podocytes.Biochem Biophys Res Commun[J].Molecular Therapy,2020,28(3):963-974.
[6]H F R,A A S E,Mohamed M A,et al.Ulinastatin ameliorated streptozotocin-induced diabetic nephropathy:Potential effects via modulating the components of gut-kidney axis and restoring mitochondrial homeostasis[J].Pflugers Archiv:European journal of physiology,2023,475(8):1161-1176.
[7]焦婷婷,韩秋霞,张冬,等.微小RNA在糖尿病肾病中的作用机制研究进展[J].中华肾病研究电子杂志,2019,8(3):138-141.
[8]万淑君,孔祥,吕坤.非编码RNA与糖尿病血管病变的关系[J].上海交通大学学报(医学版),2021,41(5):665-670.
[9]X-L Z,H-Q Z,Y Z,et al.LncRNA CASC2 regulates high glucose-induced proliferation,extracellular matrix accumulation and oxidative stress of human mesangial cells via miR-133b/FOXP1 axis[J].European review for medical and pharmacological sciences,2020,24(2):802-812.
[10]彭兴,林玲,周祥群,等.miR-133b靶向YES1抑制心肌缺血再灌注引起的心肌細胞凋亡和活性氧簇的积累[J].南方医科大学学报,2020,40(10):1390-1398.
[11]刘敏,马芬.尿液中miR-133b,miR-342和miR-30a联合检测在糖尿病肾病中的诊断价值分析[J].实验与检验医学,2020,38(6):1135-1138.
[12]X S,W-X K,Y-T L.MiR-133 inhibits kidney injury in rats with diabetic nephropathy via MAPK/ERK pathway[J].European review for medical and pharmacological sciences,2019,23(24):10957-10963.
[13]Junqin S,Hongyan L,Qin D,et al.DUSP1 recuses diabetic nephropathy via repressing JNK-Mff-mitochondrial fission pathways[J].Journal of cellular physiology,2019,234(3):3043-3057.
[14]陶鹏宇.六味地黄丸通过PI3k/mTOR/AKt通路防治糖尿病肾病的研究[D].上海:上海中医药大学,2019.
[15]侯君,李枚聪,魏莱,等.桃仁红花煎对2型糖尿病大鼠血糖和血脂代谢及肾损伤的影响[J].中国临床研究,2020,33(11):1473-1477.
(收稿日期:2023-10-23)

