盐酸布比卡因注射液中基因毒性杂质含量测定与来源分析*
周冰捷,王非梦,2,李 超,罗立骏,徐 登,冯 琴,梁 静△
(1.重庆市食品药品检验检测研究院·国家药品监督管理局麻醉精神药品质量监测重点实验室,重庆 401121;2.西南大学药学院,重庆 400716)
盐酸布比卡因注射液是一种长效酰胺类局部麻醉药,用于局部浸润麻醉、外周神经阻滞和椎管内阻滞,麻醉和镇痛作用强烈,药效持续时间较长,能有效改善患者的预后,可避免阿片类药物造成的过度镇静及呼吸抑制等不良反应[1-3],临床应用范围较广[4]。但制备过程中部分杂质的引入会影响制剂的安全性,其中2,6-二甲基苯胺(杂质F)是制备布比卡因等酰苯胺类局部麻醉药的关键起始物料[5-6]。杂质F 是一种基因毒性杂质,可直接或间接损伤细胞DNA,具有基因毒性和致癌作用,已被世界卫生组织国际癌症研究机构列为2B 类致癌物,必须严格控制含量[7-13]。盐酸布比卡因注射液现行质量标准中均未对杂质F 进行有效控制[14]。药品标准能否准确控制有关物质直接关系到药品的质量可控性与安全性[15-16],其中基因毒性杂质的研究至关重要[7]。本研究中建立了测定盐酸布比卡因注射液中基因毒性杂质F含量的高效液相色谱法,并从原料药合成工艺、辅料、制剂生产工艺、制剂所用原料药4 个方面对5 家生产企业提供的样品进行杂质F 的检测和分析,以更好地控制和评价药品质量,并为后续药品标准的修订提供参考。现报道如下。
1 仪器与试药
1.1 仪器
Agilent 1260 型高效液相色谱仪(美国Agilent 公司);Waters 2695 型高效液相色谱仪(美国Waters 公司);XSE204 型电子天平(精度为0.1 mg),Quintix 224-1CN型电子天平(精度为0.01 mg),均购自瑞士Mettler Toledo公司;SB25-12DT型新芝超声波清洗机(宁波新芝生物科技股份有限公司,功率为600 W,频率为50 kHz)。
1.2 试药
盐酸布比卡因原料药(生产企业A-C,共9批);盐酸布比卡因注射液(生产企业B,D-G,共94 批);盐酸布比卡因对照品(中国食品药品检定研究院,批号为101034-202103,含量为94.6%);杂质F 对照品(美国Sinco Pharmachem,批号为18-10-1501,含量为99.48%);乙腈为色谱纯,水为二次纯化水,其他试剂均为分析纯。
2 方法与结果
2.1 色谱条件与系统适用性试验
色谱柱:Xbridge Shield RP18柱(250 mm×4.6 mm,5µm);流动相:A 为0.05 mol/L 磷酸盐缓冲液(取磷酸二氢钾6.8 g 与氢氧化钠1.87 g,加水至1 000 mL,调pH 至8.0)-乙腈(65∶35,V/V),B 为乙腈,梯度洗脱(程序见表1);流速:1.0 mL/min;检测波长:240 nm;柱温:30 ℃;进样量:10µL。在此色谱条件下,系统适用性溶液色谱图中,出峰顺序依次为杂质F 和布比卡因,且两峰间的分离度符合要求;对照品溶液色谱图中,理论板数按布比卡因峰计大于3 000,且杂质F 峰高的信噪比(S/N)大于10。色谱图见图1。
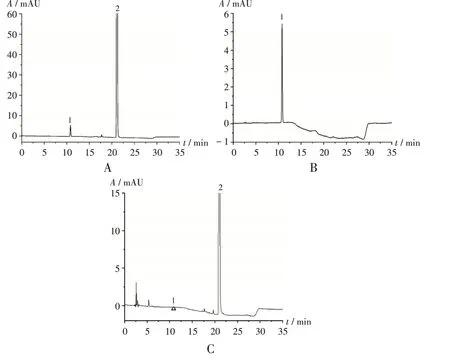
图1 系统适用性试验高效液相色谱图1.杂质F 2.布比卡因A.系统适用性溶液 B.对照品溶液 C.供试品溶液Fig.1 HPLC chromatograms of the system suitability test1.Impurity F 2.BupivacaineA.System suitability solution B.Reference solution C.Test solution
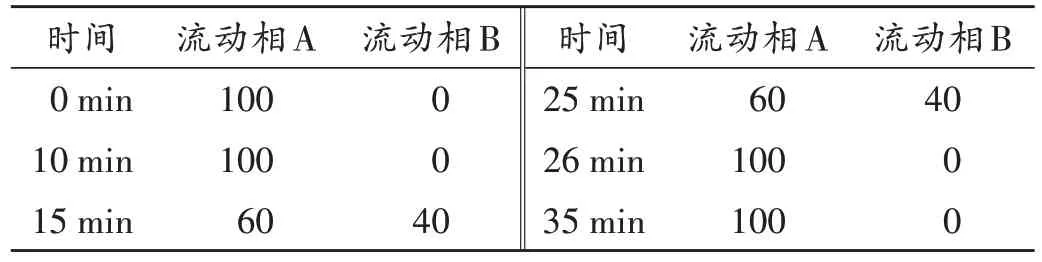
表1 流动相梯度洗脱程序(%)Tab.1 Gradient elution program of the mobile phase(%)
2.2 溶液制备
供试品溶液:取样品,即得。
对照品溶液:取杂质F对照品适量,精密称定,用流动相A稀释成每1 mL约含杂质F 1.5µg的溶液,摇匀,即得。
系统适用性溶液:取盐酸布比卡因和杂质F对照品各适量,精密称定,用流动相A 稀释成每1 mL 约含盐酸布比卡因5 mg和杂质F 1.5µg的混合溶液,摇匀,即得。
空白辅料溶液:取除主药的辅料2.0 g,精密称定,置50 mL容量瓶中,加70%容量瓶体积的流动相A,振摇至完全崩散,超声并不时强烈振摇,冷却至室温,用流动相A稀释并定容,摇匀,离心,滤过,取续滤液,即得。
2.3 方法学考察
专属性试验:取2.2 项下空白辅料溶剂,按2.1 项下色谱条件进样测定,结果表明空白辅料溶液无干扰。
线性关系考察:取杂质F对照品适量,精密称定,用流动相A 定量稀释成每1 mL 分别含杂质F 0.15,0.75,1.5,2.25,3.00µg 的溶液,摇匀,精密量取上述溶液各10 µL,按2.1 项下色谱条件进样测定,记录色谱图,以杂质F 的质量浓度(C,µg/mL)为横坐标、峰面积(A)为纵坐标进行线性回归,得回归方程A=25 224C-343.45(r=1.000 0,n=5)。结果表明,杂质F 的质量浓度在0.15~3µg/mL范围内与峰面积线性关系良好。
精密度试验:精密量取2.2 项下对照品溶液适量,按2.1 项下色谱条件进样测定6 次,记录峰面积。结果峰面积的RSD为0.42%(n=6),表明仪器精密度良好。
重复性试验:取样品6 瓶,按2.1 项下色谱条件进样测定,记录峰面积,并计算含量。结果的RSD为9.27%(n=6),表明方法重复性良好。
加样回收试验:取杂质F对照品适量,精密称定,共9 份,用供试品溶液稀释成每1 mL 含杂质F 0.75,1.5,2.25 µg 的溶液,各3 份,按2.1 项下色谱条件进样测定,记录峰面积,并计算回收率。结果平均回收率为99.41%,RSD为2.06%(n=9),表明方法准确度良好。
2.4 杂质F 含量测定
取生产企业B,D,E,F,G 的94 批样品,按2.1 项下色谱条件进样测定。结果生产企业B,D,F,G 的85 批样品中均未检出杂质F;企业E的9批样品中均检出杂质F,含量分别为0.000 4%,0.000 4%,0.000 4%,0.000 6%,0.000 5%,0.000 5%,0.000 4%,0.000 4%,0.000 3%。
3 讨论
3.1 杂质F 来源
3.1.1 原料药合成工艺
盐酸布比卡因原料药的国内生产企业有3家,分别为生产企业A、生产企业B和生产企业C。本次国家药品抽验样品所用原料药上述3家生产企业均有涉及,调研发现,原料药的合成路线基本一致,起始物均由N-(2',6'-二甲苯基)-2-哌啶甲酰胺(杂质B)和溴代正丁烷通过缩合反应生成布比卡因碱基,再经脱碱基生成盐酸布比卡因。
通过分析原料药的合成工艺认为,在原料药合成过程中有2个风险点可能会引入杂质F。风险点1,杂质F为起始反应物料盐酸布比卡因杂质B的副产物,有可能由杂质B 引入;风险点2,根据强降解试验结果,在强酸条件下,布比卡因会降解产生杂质F,在合成路线中,布比卡因碱基酸化得到布比卡因,盐酸与布比卡因会结合成盐酸盐的形式,从而引入杂质F。本研究中按2.1项下色谱条件测定原料药生产企业A,B,C的9批样品,结果均未检出杂质F,表明各原料药生产企业对该基因毒性杂质的风险控制良好。
3.1.2 辅料
盐酸布比卡因注射液的辅料单一,抽检的5家生产企业均仅以0.9%氯化钠溶液作为等渗调节剂。按2.1项下有关物质检查方法,对生产企业B,D,E,G 提供的样品进行杂质F 检查(企业F 未能提供原辅料),结果均未检出杂质F。
3.1.3 制剂生产工艺
制剂生产工艺:根据影响因素试验和强降解试验结果,在强酸条件下,布比卡因会降解产生杂质F,而在强碱、光照、高温和氧化的强破坏条件下均未产生杂质F。对比各制剂生产企业的生产工艺发现,其生产工艺步骤基本一致,且整个生产过程不会用到强酸和浓酸,均以氢氧化钠溶液调节pH。可见,制剂的生产及储存过程中均不会降解产生杂质F。
模拟活性炭生产工艺:在盐酸布比卡因注射液的生产过程中,生产企业B,E,F 均以活性炭作吸附剂进行热源吸附、除杂、脱色。其中,生产企业B 和E 在浓配步骤中加入0.1%活性炭,煮沸,保温搅拌20 min。通过模拟生产企业B 和E 的实际工艺条件,按各处方的用量,分别配制原料药溶液、原料药+氯化钠溶液、原料药+氯化钠+活性炭溶液,煮沸,保温搅拌30 min,考察活性炭的引入对杂质谱的影响。结果生产企业B 和E的样品中均未检出杂质F,表明活性炭的使用并不会引入杂质F。但生产企业B 和E 的产品在生产过程中引入活性炭后,杂质谱的数量和含量均出现增长。对比不同企业的杂质检测结果可知,未使用活性炭的生产企业D和G的样品杂质谱的数量和含量均较低,而使用了活性炭的生产企业B,E,F 的样品杂质谱的数量和含量均较高,表明活性炭的使用存在引入其他未知杂质的风险。
模拟高压灭菌试验:生产企业E 的灭菌温度为100 ℃,灭菌时间为30 min。通过模拟灭菌工艺条件,考察灭菌工艺对生产企业E 和F 的样品中杂质F 含量的影响。结果表明,灭菌工艺并未引起生产企业E 和F 的样品中杂质F的含量变化,表明灭菌工艺不会使盐酸布比卡因降解产生杂质F。
3.1.4 制剂所用原料药
经调研和追溯发现,在抽检的生产企业E 的产品中,有部分批次产品的原料药供货商及批号与生产企业F的部分批次产品所用原料药一致。生产企业A 提供了2批(批号分别为C053-210402,C053-211002)原料药的留样,2批原料药中均未检出杂质F;采用相同批次原料药的生产企业F的注射剂产品中也均未检出杂质F。
3.2 结语
所建立的方法专属性强、重复性好、精密度高,可为杂质F 的定量检测和制剂的质量控制提供参考。此外,从原料药及合成工艺、辅料、制剂生产工艺、制剂所用原料药4 个方面探讨了杂质F 的来源,认为杂质F 不会在盐酸布比卡因注射液的生产过程中降解产生,但通过原料药引入的可能性较大。因此,建议制剂生产企业重视对基因毒性杂质F的控制,加强原料药的入库质控,从源头控制引入风险。

