青黛对炎症性肠病TGF-β1/Smad 3信号通路相关分子表达的临床研究
胡招兵 潘华 贾志红

【摘要】 目的:探讨青黛对炎症性肠病转化生长因子β1/信号传导蛋白3(TGF-β1/Smad 3)信号通路相关分子表达的临床效果。方法:选取2021年1月—2023年1月在景德镇市第二人民医院被确诊为溃疡性结肠炎或克罗恩病的患者共80例,根据随机抽签方式对其进行分组,包括观察组和对照组,两组各40例,对照组采取常规治疗,观察组则在此基础上采取青黛口服治疗,连续治疗2个月。比较两组临床疗效、TGF-β1/Smad 3表达、免疫功能及不良反应。结果:观察组治疗总有效率为90.00%,明显高于对照组的60.00%,差异有统计学意义(P<0.05)。治疗前,两组TGF-β1/Smad 3表达差异无统计学意义(P>0.05);治疗后两组TGF-β1/Smad 3 protein及mRNA表达均高于治疗前,且观察组均高于对照组,差异均有统计学意义(P<0.05)。治疗后,两组CD3+、CD4+水平均高于治疗前,CD8+水平均低于治疗前,且观察组CD3+、CD4+水平均高于对照组,CD8+水平低于对照组,差异均有统计学意义(P<0.05)。观察组和对照组治疗不良反应总发生率分别为10.00%、20.00%,差异无统计学意义(P>0.05)。结论:青黛可通过修复炎症性肠病患者TGF-β1/Smad 3信号通路,改善临床疗效,具有较高临床价值。
【关键词】 青黛 炎症性肠病 TGF-β1/Smad 3信号通路
炎症性肠病(inflammatory bowel disease,IBD)指的溃疡性结肠炎和克罗恩病集合,目前临床对于其发生原因尚不十分明确,并且症状缺乏特异性[1]。当前全球发病人数约2 800万例,且有逐渐升高的趋势。IBD发病率在不同地区差异显著,但总体上与当地经济发展水平和城市化水平呈正相关。欧洲和北美发达国家的发病率明显高于亚洲、非洲和南美洲的发展中国家。然而近年来,溃疡性结肠炎的发病率和流行率在发展中国家呈现上升趋势,且在南美和东亚地区最为明显[2]。目前我国国内报道以溃疡性结肠炎为主,其发病率最高的区域为广东省,为3.14/10万,其次为湖北省,为1.96/10万[3]。另外,溃疡性结肠炎在男女之中的发病率并无明显差异,发病高峰年龄是20~49岁[4];克罗恩病发病高峰年龄为18~35岁,男性略多于女性[3]。据2014年中国疾病预防控制中心数据预计到2025年,中国IBD患者将达到150万例[5]。IBD具有复杂的发病机制,目前大多认为其发病与多种因素相关,包括慢性炎症状态下的异常免疫反应和以炎症因子为主的细胞因子失衡,包括自身免疫反应和抗炎途径的损伤,以及脑肠轴的紊乱[6]。中医在我国的发展有近千年的历史,在长时间对于炎症性肠病的诊治中总结出相应的诊疗体系,并有利于当前临床对于此类疾病的治疗[7]。中医虽无炎症性肠病这一病名,但是可根据患者病情表现以“肠癖”“泄泻”“滞下”等症对其进行概括,主要因外感湿热邪气、脾气运化不足使得湿浊之气阻滞下注大肠,导致脏腑失调,湿热内蕴,久则伤肠,化以腹泻,对其治疗应以清热除燥除湿为主,中药材青黛属于一味清热药,可清解热毒、凉血消斑,在以往的动物实验中证实其能有效改善溃疡性结肠炎大鼠肠道损伤,转化生长因子/信号传导蛋白(TGF-β/Smad)被认为是该药发挥效果的重要通路[8]。本文对青黛用于IBD的治疗机制及效果进行探讨,从而为其未来治疗方向提供新思路。
1 资料与方法
1.1 一般资料
选取2021年1月—2023年1月在景德镇市第二人民医院被确诊为溃疡性结肠炎或克罗恩病的患者共80例,纳入标准:(1)接受影像学检查且术后经病理诊断为炎症性肠病,符合文献[9]有关标准的描述;中医辨证中主次症均符合热毒炽盛型的相应表现。(2)30~50岁。排除标准:(1)合并其他自身免疫性疾病;(2)存在其他类型肠炎或是因明确的细菌感染所致肠道症状;(3)已导致肠穿孔等可能危及生命的并发症;(4)身体多器官功能不能正常运转,或已合并癌症,预计生存期不足1个月;(5)意识状态异常或者明确精神病史;(6)处于特殊生理期的女性。根据随机抽签方式分为观察组和对照组,两组各40例,本次试验的开展是建立在景德镇市第二人民醫院医学伦理委员会批准的基础上进行的,患者和家属均知晓本次研究,且同意参与。
1.2 方法
(1)对照组:采取炎症性肠病基础治疗及干预,包括饮食控制、作息调节、血压及体温控制等,口服美沙拉嗪肠溶片(生产厂家:葵花药业集团佳木斯鹿灵制药有限公司,批准文号:国药准字H19980148,规格:0.25 g)进行治疗,1片/次,3次/d,连续服用2个月。(2)观察组:在对照组基础上加用青黛一方(方剂:青黛)颗粒口服(1.5~3 g)或灌肠(灌肠30 g),1剂/次,2次/d,连续使用2个月。
1.3 观察指标及评价标准
(1)临床疗效:根据当前有关炎症性肠病治疗评价标准,均通过体征、肠镜检查进行判断,患者症状消失,肠镜检查未发现肠黏膜异常时表示显效;临床症状较治疗前改善,结肠镜仅显示轻微炎症为有效;病情无变化或加重则表示无效[10]。总有效率=(显效+有效)例数/总例数×100%。(2)TGF-β1/Smad 3表达:分别于治疗前后留取患者肠镜活检组织,将其置于10%聚乙烯醇中,在-80 ℃的冷冻室中保存,分别采用Western blot及实时荧光定量法(RT-PCR)检测TGF-β1、Smad 3蛋白及信使核糖核酸(mRNA),采用Western blot法时加入裂解液裂解,提取总蛋白,通过BCA法对蛋白浓度进行测定,同时在进行蛋白变性之后,用等量的蛋白上样,再经聚丙烯酰胺凝胶电泳(SDS-PAGE)、转膜,在5%脱脂奶粉在室温封闭1 h之后,顺序加入一抗、二抗,用Image J图像分析软件来测量其蛋白灰度值;用RT-PCR法测定在液氮中研磨的TGF-β1、Smad 3 mRNA的表达量,加入适量裂解液,在超低温匀浆器中匀浆,在离心之后,将上清液提取出来,用RNA试剂盒来提取总RNA,用超微量分光光度计来提取RNA,反转录后采取PCR,同时对20 μL反应体系进行配置,并根据试剂盒说明书扩增,以β-action为内参,通过2-ΔΔCt法,对比两组TGF-β1/Smad 3表达情况。(3)免疫功能:于治疗前后采集患者空腹静脉血5 mL,离心后采取流式细胞仪法检测T淋巴亚群(CD3+、CD4+、CD8+)水平。(4)对患者治疗期间出现的不良反应进行观察。
1.4 统计学处理
数据分析通过软件SPSS 22.0来运行,计数资料、计量资料分别以率(%)、(x±s)表示,并通过字2检验、独立样本t检验或配对t检验进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 两组基线资料比较
观察组男24例,女16例,年龄30~50岁,平均(38.72±5.34)岁;溃疡性结肠炎28例,克罗恩病12例;病程2~5年,平均(3.65±1.22)年;对照组包括男20例,女20例;年龄30~45岁,平均(38.09±4.14)岁;溃疡性结肠炎24例,克罗恩病16例;病程2~5年,平均(3.65±1.22)年;两组性别、年龄、病程、病变类型等基线资料比较,差异均无统计学意义(P>0.05),具有可比性。
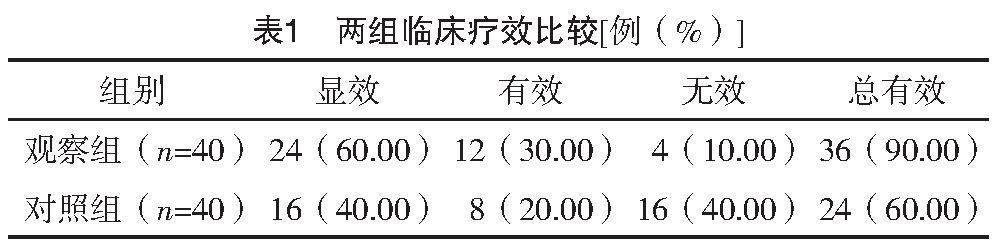
2.2 两组临床疗效比较
观察组治疗总有效率为90.00%,明显高于对照组的60.00%,差异有统计学意义(字2=9.600,P=0.002),见表1。
2.3 两组治疗前后TGF-β1/Smad 3表达比较
治疗前,两组TGF-β1/Smad 3表达差异均无统计学意义(P>0.05);治疗后,两组TGF-β1/Smad 3 protein及mRNA表达均高于治疗前,且观察组均高于对照组,差异均有统计学意义(P<0.05)。见表2。
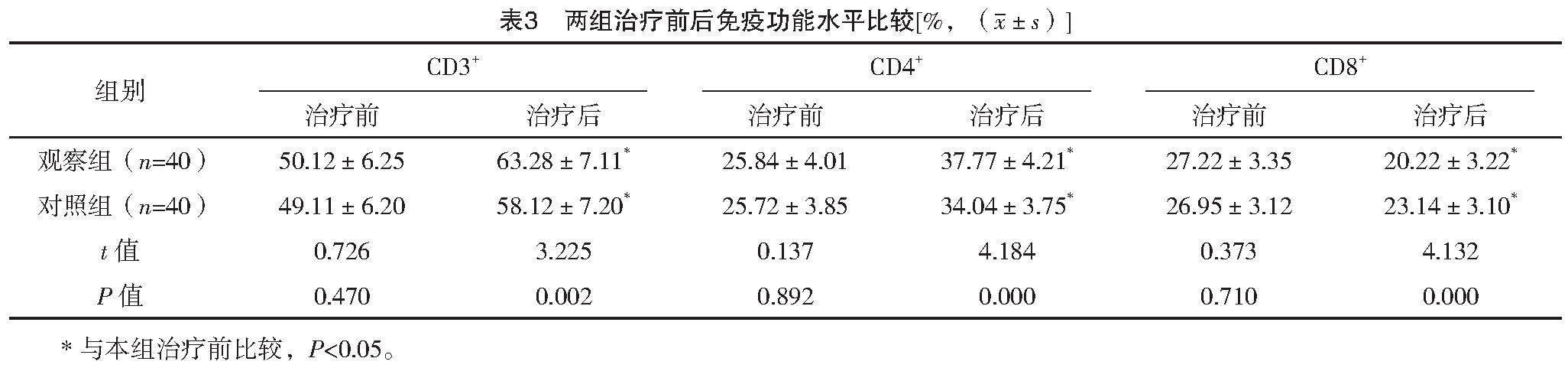
2.4 两组治疗前后免疫功能水平比较
治疗前,两组CD3+、CD4+、CD8+比较差异均无统计学意义(P>0.05);治疗后,两组CD3+、CD4+水平均高于治疗前,CD8+水平均低于治疗前,且观察组CD3+、CD4+水平均高于对照组,CD8+水平低于对照组,差异均有统计学意义(P<0.05)。见表3。
2.5 两组治疗不良反应比较
观察组和对照组治疗不良反应总发生率分别为10.00%、20.00%,差异无统计学意义(字2=1.569,P=0.210),见表4。
3 讨论
IBD虽然不是肿瘤,但属癌前病变,不仅会出现终身复发趋势,还会对患者造成永久性的身心伤害,除了需要长期吃药之外,还要承受消化道的各种不适,如便血、腹痛、腹泻等,这对患者的工作和生活都会产生很大的影响。特别是由于反复的炎症反应,会导致肠道的纤维化,从而引发肠腔狭窄、梗阻和癌变等严重的并发症。临床上常用的药物有氨基水杨酸类、皮质类固醇类和免疫抑制剂等,但只能改善症状,疗效和预后并不理想[11]。目前已有的微生态制剂及与奥沙拉嗪联用等手段为IBD的治疗提供了新思路,但仍需要进一步的研究。上海市名医马贵同教授认为“湿热瘀结”是IBD的核心病机,以“清热化湿、活血止血”为治法,故而将青黛、三七等中药制成直肠给药制剂,结果发现青黛在其中起了重要作用[12]。
本研究结果显示,观察组治疗总有效率为90.00%,明显高于对照组的60.00%,提示青黛用于IBD可获取良好的疗效。青黛味道咸,性凉,归肝肺胃经,具有清热、凉血、解毒的功效。现代医药的药理学研究显示,青黛有抗炎、调节免疫、促进黏膜愈合的功效,而青黛则通过作用于肠道菌群,促使肠道黏膜实现不同程度的修复,促使肠内细菌的发生发展受到抑制,进而降低其病情进一步恶化风险[13]。另外,本研究也经不良反应观察证实两组不良反应未见统计学差异,经现代病理学证实,青黛具有抑制炎性反应、改善免疫细胞水平的作用,通过青黛对多种细胞功能进行调节能使得受损的TGF-β1/Smad 3信号通路得到恢复,从而使得患者病情得到改善,这个过程并不会明显增加患者不良反应,因而具有良好安全性[14]。
本试验研究發现,治疗后两组TGF-β1、Smad 3protein及mRNA表达均高于治疗前,且观察组均高于对照组,提示青黛可能通过调节TGF-β1/Smad 3信号通路来实现IBD的治疗。目前研究认为TGF-β1可以在调节细胞生长分化和迁移过程中促进炎症细胞浸润的改善,从而降低炎症性肠病的恶性病变风险。TGF-β1/Smad 3信号通路则被认为是介导上皮间质细胞转化的重要路径,当TGF-β1受损后经由信号传导可能使得Smad表达改变,从而使得该信号通路的正常运转受到影响,通过服用青黛能促进TGF-β1/Smad 3信号通路的修复和完善,同时使得炎症反应受到抑制,并促进黏膜的修复,具有较高的应用意义[15-17]。此外,本研究也发现观察组CD3+、CD4+水平均高于对照组,CD8+水平低于对照组,提示青黛可以通过改善TGF-β1/Smad 3信号通路实现患者体内免疫因子水平的改善。服用青黛后可能对炎症细胞产生明显破坏作用,从而使得患者免疫能力明显增强,更好地发挥对于残余炎症细胞的扩散、转移的抑制作用,故而具有良好的应用价值[18-21]。
综上所述,青黛用于炎症性肠病患者可以获得良好的临床效果,且可能通过修复TGF-β1/Smad 3信号通路促使患者免疫水平提升,进而使得病情症状得到改善,且安全性良好,具有一定的应用价值。
参考文献
[1]孟欢,侯晓婷,张华敏,等.中药天然产物治疗炎症性肠病的研究进展[J].中草药,2023,54(10):3349-3369.
[2] KAPLAN G G,NG S C.Understanding and preventing the global increase of inflammatory bowel disease[J].Gastroenterology,2017,152(2):313-321.
[3]何琼,李建栋.炎症性肠病流行病学研究进展[J].实用医学杂志,2019,35(18):2962-2966.
[4] CHOW D K,LEONG R W,TSOI K K,et al.Long-term follow- up of ulcerative colitis in the Chinese population[J].Am J Gastroenterol,2009,104(3):647-654.
[5] KAPLAN G G.The global burden of IBD:from 2015 to 2025[J].Nat Rev Gastroenterol Hepatol,2015,12(12):720-727.
[6]張北平,程怡,赵喜颖.炎症性肠病中医药疗效与机制研究进展[J].北京中医药,2020,39(3):216-219.
[7]苏晓兰,国嵩,张涛,等.炎症性肠病诊治现状及中医药治疗特色与优势[J].北京中医药,2020,39(3):211-215.
[8]刘雪珂,赵海梅,吴甜甜,等.巨噬细胞在炎症性肠病发病中的作用及中医药干预研究进展[J].中华中医药学刊,2020,38(10):141-145.
[9]中华医学会病理学分会消化病理学组筹备组,中华医学会消化病学分会炎症性肠病学组.中国炎症性肠病组织病理诊断共识意见[J].中华病理学杂志,2014,43(4):268-274.
[10]张玉洁,梁洁,吴开春.炎症性肠病诊断与治疗的共识意见(2018年,北京)溃疡性结肠炎部分解读[J].中华消化杂志,2018,38(5):312-314.
[11]黄荣伟,吕冠华.中药对溃疡性结肠炎相关炎性因子和信号通路的影响探析[J].内蒙古中医药,2019,38(3):98-100.
[12]胡鸿毅,马贵同,朱凌云,等.三七、青黛等对溃疡牲结肠炎组织中核因子NF—κB活性的影响[J].上海中医药大学学报,2007,21(5):44-48.
[13]凌海慧,梁棻,刘蓉,等.中医药保护肠黏膜屏障治疗炎症性肠病的研究进展[J].天津中医药,2018,35(9):718-720.
[14]谢妲.涩肠青黛散联合美沙拉嗪对溃疡性结肠炎患者炎症因子及氧化应激的影响[J].中医学报,2017,32(6):1063-1066.
[15]戴玲颖.青黛散治疗肛肠疾病术后肛周湿疹的临床观察[J].光明中医,2018,33(11):1590-1592.
[16]苏玉清,王烜.atRA对大鼠结肠炎中TGF-β1/Smad3通路的作用研究[J].实用药物与临床,2018,21(5):491-497.
[17]黄胜杰,钟婧娉,谢锦,等.青黛表面改性对口腔溃疡双层膜质量与药效的影响[J].中草药,2023,54(13):4118-4127.
[18]王博,丁晓坤,权沛沛,等.青黛通过ERK/p38 MAPK/MEK信号通路对湿热内蕴型溃疡性结肠炎大鼠抗炎修复和免疫功能的影响[J].现代药物与临床,2023,38(6):1297-1303.
[19]刘金萍,吕冠华,王丽丹,等.青黛苦参配伍治疗溃疡性结肠炎大鼠的疗效及潜在机制的探究[J].时珍国医国药,2023,34(2):328-332.
[20]马玉景,郎晓猛,康欣,等.青黛制剂治疗溃疡性结肠炎疗效与安全性的系统评价[J].中国民间疗法,2022,30(20):52-59.
[21]姚松领,闫小宁,蔡宛灵.复方青黛胶囊治疗银屑病的Meta分析及试验序贯分析[J].湖北中医杂志,2022,44(10):54-59.

