国产依托红霉素片和颗粒质量分析
邹宇 姚兰 刘杨 傅蓉


摘要:目的 对国内上市的依托红霉素片和颗粒的质量进行评价。方法 依据现行法定质量标准,对市场中的依托红霉素片、颗粒进行检验,统计分析依托红霉素片、颗粒的质量总体水平,比较不同企业产品的质量。根据专题调研和标准检验结果,结合文献分析,针对依托红霉素标准中组分及有关物质、溶出度、含量测定等的不足开展探索性研究。结果 本次抽检涉及的4个生产企业的23批依托红霉素片和16个生产企业的154批依托红霉素颗粒按法定标准检验,有176批次符合规定,合格率为99.4%。探索性研究采用新建的组分和有关物质测定方法,对依托红霉素原料和制剂的组分和有关物质进行了考察;按新增和修订的溶出度检查法,对20家企业的样品的溶出曲线进行了考察;含量测定时,应根据产品的处方工艺情况选择水解条件,才能保证含量测定结果的准确性。结论 依托红霉素片和颗粒质量状况较好,现行质量标准中项目和方法有待进一步完善。
关键词:依托红霉素片;依托红霉素颗粒;质量分析;抽检
中图分类号:R917 文献标志码:A
Quality analysis of domestic erythromycin estolate tablets and granules
Zou Yu1,2, Yao Lan 1,2, Liu Yang1,2, and Fu Rong1,2
(1 Liaoning Province Inspection and Testing Certification Center, Shenyang 110036;
2 Liaoning Institute for Drug Control, Shenyang 110036)
Abstract Objective This study assessed the quality of erythromycin estolate tablets and granules in China. Methods The nationwide erythromycin estolate tablets and granules were tested according to the official specification. The overall quality was analyzed using statistical methods. The products from different manufacturers were compared. Based on the special survey and the determination results, some methods of erythromycin estolate in specification, i.e., components and related substances, dissolution, and assay were optimized. Results A total of 23 batches of erythromycin estolate tablets from 4 manufacturers and 154 batches of erythromycin estolate granules from 16 manufacturers underwent testing. A total of 176 batches met the specified requirements, resulting in a pass rate of 99.4%. The optimal HPLC method was used to detect the components and related substances of erythromycin estolate raw materials and preparations. The revised dissolution method was used to test the dissolution curves of samples from 20 companies. The hydrolysis conditions should be selected in the assay according to the formulation and technology, which could ensure the accuracy of the content determination. Conclusion The quality of erythromycin estolate tablets and granules was with acceptable in general. The official specification of erythromycin estolate tablets and granules needs to be further improved.
Key words Erythromycin estolate tablets; Erythromycin estolate granules; Quality analysis; Sampling test
依托紅霉素又名无味红霉素,为红霉素丙酸酯的十二烷基硫酸盐,其在肠道中以酯化物的形式被吸收,在体内水解成活性成分红霉素。临床中主要用于治疗对青霉素耐药的球菌类感染以及支原体肺炎、白喉感染等 [1-2]。依托红霉素由红霉素经化学合成生产:硫氰酸红霉素与三乙胺在丙酮水溶液中发生游离反应,生成红霉素碱,红霉素碱与丙酸酐反应生成红霉素酯,再和十二烷基硫酸钠反应生成依托红霉素 [3]。《中国药典》1977年版开始收载依托红霉素及制剂。依托红霉素片、颗粒目前国内均属于非基本药物。作为2022年国家药品抽检品种,本文通过对依托红霉素片、颗粒的标准检验和探索性研究,从安全性、有效性及质量可控性等方面对其质量进行全面地分析评价。
1 材料与方法
1.1 仪器、试药与样品
1.1.1 仪器
Waters e2695系列高效液相色谱仪;Agilent 1200高效液相色谱仪;Waters XTERRA RP18色谱柱(250 mm ×4.6 mm, 3.5 μm);资生堂CAPCELL PAK MGⅡ C18色谱柱(250 mm×4.6 mm,5 μm);Agilent 708-850DS全自动溶出仪;天大天发公司ZKT18真空脱气仪; ALC-1100.2型和R225D型电子天平(Sartorius公司);ZY-300IV抑菌圈测量仪(北京先驱威锋技术有限公司);GNP-9270隔水式恒温培养箱(上海精宏试验设备有限公司);SX-700灭菌锅(日本Tomy公司)。
1.1.2 试药
乙腈(色谱纯,美国天地公司);磷酸二氢钾、磷酸氢二钾、磷酸、盐酸、十二烷基硫酸钠(分析纯,国药集团化学试剂有限公司);抗生素检定培养基Ⅰ(北京陆桥技术股份有限公司);纯化水(实验室自制)。
红霉素对照品(红霉素A组分含量93.3%,批号130307-201417),红霉素系统适用性试验对照品(批號130670-201902)均来自中国食品药品检定研究院。
标准菌株短小芽孢杆菌[CMCC(B)63202]来自中国食品药品检定研究院。
1.1.3 样品
本次抽检共抽取到23批次的依托红霉素片,规格为125 mg(以红霉素计);154批次的依托红霉素颗粒,规格为50和75 mg(以红霉素计);另获得1家依托红霉素原料企业的5批原料药。
1.2 方法
1.2.1 法定检验方法
按照《中国药典》2020年版依托红霉素片剂和颗粒剂标准进行法定检验。
1.2.2 组分及有关物质
参考欧洲药典(EP)10.0版依托红霉素项下[4]有关物质和含量测定的方法以及中国药典(ChP)2020年版二部红霉素项下[5]组分和有关物质的限度,通过考察水解对测定结果的影响,建立了HPLC测定依托红霉素组分和有关物质的检测方法。
色谱条件:以XTerra RP C18柱(4.6 mm×250 mm,3.5 μm)为色谱柱;以乙腈-0.2 mol/L磷酸氢二钾溶液(用磷酸调节pH值至7.0)-水(35:5:60, V/V/V)为流动相A,以乙腈-0.2 mol/L磷酸氢二钾溶液(用磷酸调节pH 值至7.0)-水(50:5:45, V/V/V)为流动相B进行梯度洗脱;流速为1.0 mL/min;柱温为65 ℃;检测波长为210 nm;进样体积100 μL。
供试品溶液制备:精密称取本品适量(相当于红霉素200 mg),置50 mL量瓶中,加甲醇25 mL使溶解,加入pH 8.0磷酸盐溶液近刻度,摇匀,室温放置18 h,以pH 8.0磷酸盐溶液稀释至刻度。
1.2.3 溶出度
方法:桨法;溶出介质为含0.2%的十二烷基硫酸钠的盐酸溶液;转速为75 r/min;溶出时间为45 min(片剂)、30 min(颗粒)。采用HPLC法测定样品的溶出量:利用依托红霉素配制对照品溶液;以十八烷基键合硅胶为填充剂;以磷酸盐缓冲液(取磷酸氢二钾8.7 g,加水1000 mL,用20%磷酸溶液调节pH值至8.2)-乙腈(40: 60)为流动相;流速为1.5 mL/min;柱温40 ℃;检测波长215 nm;进样体积100 μL。
20家企业的产品各取一批样品,按上述方法进行溶出曲线的测定,比较片剂与颗粒剂溶出曲线的差异。
1.2.4 含量测定
依托红霉素在进行含量测定时,首先需将样品水解成红霉素,通过测定红霉素的含量确定依托红霉素的含量。《中国药典》2020年版(ChP)采用乙醇-pH7.8磷酸盐缓冲液(1:1)60 ℃水解样品4 h后,按抗生素微生物检定法测定红霉素的含量;EP10.0采用甲醇-pH8.0磷酸盐缓冲液(1:1)室温水解12 h以上,按HPLC法测定红霉素的含量。考察EP10.0[4]与ChP2020[5]含量测定中水解条件对含量结果的影响。20家生产企业各取一批样品,分别按EP和ChP的条件水解,按抗生素微生物检定法测定含量,对测定结果进行比较。
2 结果与讨论
国家市场监督管理总局数据库显示,截止到2022年9月,国内依托红霉素片生产企业有127家,批准文号132个;依托红霉素颗粒生产企业50家,批准文号68个。本次抽检涉及29个省市自治区,共抽到177批次样品,其中片剂23批,涉及4个生产企业,占该品种国内生产企业总数的3.1%;颗粒剂154批,涉及16个生产企业,占该品种国内生产企业总数的32.0%。177批次样品的分布率分别为生产企业19%,经营企业80%,医疗机构1%。抽检结果基本可以反映出目前该品种国内的生产和使用情况。
2.1 法定检验结果及分析
按《中国药典》2020年版标准,依托红霉素片剂检验项目包括性状、鉴别、溶出度、重量差异和含量测定;颗粒剂检验项目包括性状、鉴别、酸碱度、水分、粒度、装量差异和含量测定。177批样品依据法定标准进行全检,176批符合规定,合格率为99.4%;1批依托红霉素颗粒含量测定不符合规定。对与产品质量密切相关的主要检查项目包括溶出度、酸碱度、水分、重(装)量差异和含量测定等结果进行统计分析。
溶出度:23批依托红霉素片的平均溶出量分布在85%~98%之间,平均溶出量的均值为92%;有87%的样品结果为85%~97%,提示依托红霉素片总体溶出情况较好。
酸碱度:154批依托红霉素颗粒的pH值分布在5.2~6.8之间;pH均值为6.1,接近酸碱度规定中间值6.0,94%的样品pH值为5.4~6.6,结果呈正态分布。
水分:154批依托红霉素颗粒的水分值分布在0.1%~1.2%之间;水分均值为0.2%,93%的样品水分值在0.4%以下,主要集中在0.2%以内,远低于限度2.0%。
费休氏试液的滴定度一般在4 mg/mL左右,如按依托红霉素颗粒标准中的规定取0.2 g供试品进行检验,当含水分为2.0%(限度值)时,费休氏试液的使用量约为1 mL,而实际样品中的水分含量基本在0.4%以下,费休氏试液的实际使用量小于0.2 mL,不满足《中国药典》2020年版通则0832水分测定法[6]中,费休氏试液消耗量应为1~5 mL的要求,因而易造成测定结果的不准确。建议将依托红霉素颗粒水分检查项中,“取本品0.2 g”修订为“取本品适量”,以根据样品的实际含水量称取样品。
重(装)量差异:以每批样品20片片重的RSD为指标,考察依托红霉素片压片工艺稳定性。23批次样品的片重服从正态分布,片重RSD的均值为0.96%,最小值为0.20%,最大值为2.17%,90%以上的批次片重RSD小于1.4%,提示依托红霉素片的压片工艺稳定性较理想。
以每批样品10袋的装量RSD为考察指标,考察制粒工艺的稳定性。154批次样品的装量服从正态分布,装量RSD均值为1.4%,最小值为0.4%,最大值为4.4%,95.5%以上的批次装量RSD小于2.4%,提示依托红霉素颗粒的工艺稳定性较理想。
含量测定:23批依托红霉素片的含量分布在92.2%~102.7%之间;含量均值为97.5%,有82.3%的样品测定结果在94.0%~102.0%之间。
153批含量符合规定的依托红霉素颗粒的含量分布在90.1%~108.5%之间,均值为98.0%;有16批(约占样品总量10.4%)样品的含量在93.0%以下,8批(约占样品总量5.2%)样品的含量在105.0%以上,含量分布较离散。1批不符合规定的样品含量为113.5%,超过标准上限。通过对企业提供的处方和实际装量检测结果的分析,认为其是制剂分剂量包装时投料量控制出现问题导致装量偏大所致。
2.2 探索性研究结果及分析
根据专题调研和标准检验结果,结合文献分析,针对依托红霉素标准中组分及有关物质、溶出度、含量测定等的不足开展探索性研究。
2.2.1 组分和有关物质
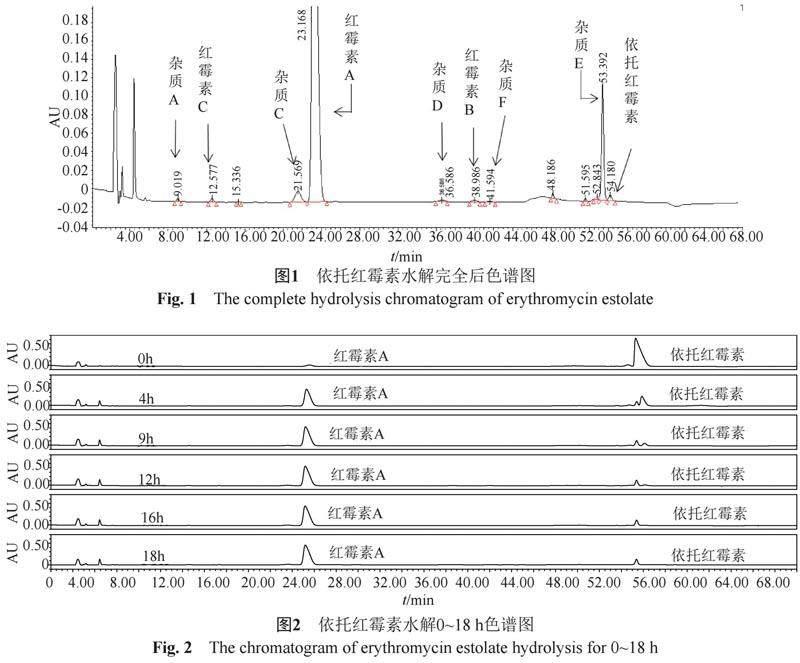
利用HPLC法测定红霉素酯化物的组分及有关物质时,需首先对酯化物进行水解,使其水解成红霉素诸组分及杂质后再进行测定。依托红霉素水解完全后的HPLC色谱图见图1。
参考EP10.0方法[4]建立依托红霉素组分和有关物质检测方法。EP方法要求本品配制成溶液后需室温水解12 h以上再测定。对依托红霉素0~21 h的水解情况进行考察(图2):不经水解,色谱图中只有未水解的依托红霉素峰及少量红霉素A峰,检测不到B、C组分和其他红霉素的已知杂质;随着水解时间的增加,各组分和杂质逐渐出现,12 h后趋于稳定,但未水解的依托红霉素仍有约2.7%;继续水解至18 h时,未水解的依托红霉素降低至0.5%以下,未发现有其他杂质峰产生。红霉素A、B、C组分和杂质A、F、E在12至21 h无变化,但杂质C和D,会随着水解时间的增加缓慢增加。因此,新建立的依托红霉素组分和有关物质检测方法的水解条件和液相條件与EP10.0方法[4]一致,但规定水解时间为18 h。
在限度设定上,考虑到依托红霉素水解后的杂质均为红霉素原料引入的杂质,因而各杂质的限度应与ChP2020红霉素项下有关物质的限度一致。依托红霉素现行质量标准规定每1 mg的效价不得少于610红霉素单位,因此,拟定原料药红霉素A组分的限度为不少于61.0%;红霉素B、C组分参考EP10.0[4]和ChP2020[5],设定为不得过3.0%。采用上述方法对5批依托红霉素原料进行检测(表1),可见,除杂质C外,各组分及杂质均可达到上述限度;而杂质C接近或超过限度。杂质C是红霉素发酵中的前体(红霉素E),其含量偏高,说明合成起始原料的质量欠佳。
由于依托红霉素制剂的辅料多且量大,仅对其红霉素A组分的含量进行了测定。20个生产企业各取一批样品进行检测,4批片剂中红霉素A组分的含量分布在98.6%~101.7%范围内;16批颗粒剂中红霉素A组分的含量分布在95.5%~119.9%之间,均值为103.3%;其中含量测定不合格样品的含量为最大值119.9%。
国内依托红霉素原料自上市以来对其中的有关物质情况一直未予以关注,本次抽检中发现部分批次的原料药中杂质C的含量偏高(表1)。由于质量标准中未设立红霉素组分和有关物质检查项,使得原料和制剂企业对该产品中的杂质情况均不十分了解。新建立的依托红霉素原料药组分、有关物质检查方法以及依托红霉素片、依托红霉素颗粒红霉素A组分检查方法,填补了依托红霉素质量标准的空白。
2.2.2 溶出度
依托红霉素片现行质量标准采用硫酸显色-紫外法对溶出度进行测定。试验中发现,溶出介质与浓硫酸溶液混合后易发生浑浊,干扰测定。依托红霉素颗粒未收载溶出度检查法。采用HPLC法替代硫酸显色法测定样品的溶出度,可提高方法的专属性;通过对溶出条件和检测方法的考察,对片剂溶出度的测定方法进行了修订,并新建立了颗粒剂溶出度测定方法。
采用新建立的颗粒剂和片剂的溶出度测定方法测定其溶出曲线(图3),16批依托红霉素颗粒样品20 min时的溶出量为82%~115%;30 min时主成分基本溶出(92%~121%)。片剂样品30 min时,3家企业的样品溶出量为91%~107%;45 min时主成分基本溶出(98%~107%);但一家企业的样品60 min的溶出量仍未到70%的限度。比较片剂和颗粒的溶出曲线,片剂的溶出较颗粒剂滞后,其系片剂的崩解分散速度相对颗粒剂较慢所致。
2.2.3 含量测定
检验中发现部分企业的产品含量测定结果批间差异大,个别企业产品的含量值接近限度的低限;调研中有2家企业反馈,成品的含量测定结果较投料量约低5%~6%。因而考察水解条件对依托红霉素含量测定的影响。
15家企业的样品,按EP或ChP条件水解,含量测定结果无明显差异;5家企业的样品按EP条件水解,含量测定值较按ChP条件水解约高出5%。提示制剂的处方、工艺影响产品的水解速率,这5家企业的产品更适宜采用EP的条件水解。上述结果显示,ChP的含量测定方法仅可满足约75%的抽样企业样品的准确测定,而EP的含量测定方法能适用于全部的抽样企业样品。建议中国药典对依托红霉素含量测定中的水解条件进行修订。
3 结论
本次国家药品抽检采取法定检验结合探索性研究模式对国产依托红霉素片和依托红霉素颗粒进行了较全面的分析评价。由法定检验情况可知,177批次样品中有1批检验结果不符合规定,合格率为99.4%,2016年安徽省食品药品检验研究院曾对依托红霉素片进行国家药品抽检,14家生产企业130批样品按法定检验合格率为100%(未发表资料),综合两次抽检结果,可以认为目前国内生产的依托红霉素片和颗粒总体质量较好。
质量标准方面,依托红霉原料和制剂均缺少对其组分和有关物质的控制;制剂的溶出度和含量测定方法亦可进一步改进。
参 考 文 献
陈桂珍, 孙成城. 无味红霉素半合成法[J]. 中国现代应用药学, 1996, 27(4): 13.
万兴平. 依托红霉素片制备工艺优化的研究[J]. 海峡药学, 2014, 26(6): 24-25.
卢元东, 汪寅华. 依托红霉素的一种合成方法: CN, ZL201310333261.0[P]. 2015-06-24.
Erythromycin estolate. EDQM, European Pharmacopoeia 10.0[S]. 2020: 2527-2531.
國家药典委员会.中华人民共和国药典2020年版(二部)[S]. 北京: 中国医药科技出版社, 2020: 520-521.
国家药典委员会. 中华人民共和国药典2020年版(四部)通则0832[S]. 北京: 中国医药科技出版社, 2020: 114-115.
作者简介:邹宇,女,1981年,硕士,副主任药师,主要从事抗生素药品质量标准研究, E-mail: zoe0921cn@163.com
*通信作者,E-mail: furonger25@126.com
第一作者:邹宇,2007年获沈阳药科大学药物分析专业硕士学位,副主任药师。现就职于辽宁省药品检验检测院微生物与抗生素室。主要从事药品检验、分析及质量标准研究工作,多次参与完成中国药典标准起草及复核、国家药品抽检、国家标准物质协作标定等工作,发表论文多篇。
通信作者:傅蓉,2006年毕业于沈阳药科大学微生物与生化药学专业,硕士学位,主任药师。毕业至今就职于辽宁省药品检验检测院微生物与抗生素室,从事抗生素药品检验及质量标准研究工作,以及药品、保健食品和化妆品的微生物检验和方法研究工作。多次参与中国药典质量标准起草及复核工作;多次承担或参与国家药品抽检工作。

